Introducción
El crecimiento de la población en las últimas décadas del siglo XX y las primeras del nuevo milenio, por una parte, y el deterioro del medioambiente por otra, han planteado la necesidad de desarrollar nuevas estrategias para tratar los problemas de salud y, en general, las enfermedades que aquejan a la población.
Entre los “Objetivos del Desarrollo del Milenio” (ODM, agenda 2000-2015) del año 2000 (Naciones Unidas, 2000), se planteó como objetivo número seis: “Combatir el VIH /SIDA, el paludismo y otras enfermedades”, mientras que en los nuevos “Objetivos de Desarrollo Sostenible” (ODS, agenda 2015-2030) (Naciones Unidas, 2016), se estableció como objetivo número tres: “Garantizar una vida sana y promover el bienestar para todos en todas las edades”.
Entre las enfermedades que más afectan a la población mundial, y sobre las cuales se piden acciones concretas a la comunidad internacional, se encuentra el cáncer. De acuerdo a la Organización Mundial de la Salud (WHO, por sus siglas en ingles), el cáncer es la segunda causa de muerte en el ámbito mundial, con 8.8 millones de defunciones en el año 2015. De hecho, una de cada seis defunciones en el mundo se debe a esta enfermedad (WHO, 2018).
Desde el ámbito de la química, y especialmente desde la química inorgánica, se han aprovechado todas las nuevas herramientas tecnológicas para desarrollar la síntesis de nuevos compuestos con aplicaciones terapéuticas específicas, comenzando por los agentes anticancerígenos.
Dentro de la química inorgánica, la química de coordinación (Lawrance, 2010) ocupa un papel preponderante, en virtud de que estudia los compuestos complejos o de coordinación, en los cuales los metales de transición ofrecen muchas ventajas ya comprobadas en áreas como la catálisis (Bochmann, 2015), la química industrial (Buchel et al., 2003), la química medicinal (Patrick, 2017), química de alimentos (Contreras, 2012), entre otras.
Así mismo, dentro de la química de coordinación, merecen especial atención los compuestos organometálicos (Crabtree, 2014), que se caracterizan por poseer en su estructura un enlace carbono-metal, y que ofrecen muchas ventajas por su notable reactividad química. En tal sentido, el campo de la bioorganometálica (Jaouen, 2015) se ha concentrado en el estudio de las aplicaciones medicinales de los compuestos organometálicos.
También se deben señalar los avances que la química inorgánica y organometálica están teniendo en el campo de la nanotecnología, y especialmente en el área de la nanoquímica (Contreras, 2015), lo cual configura todo un nuevo espacio para el planteamiento de proyectos de investigación y desarrollo.
Tanto los compuestos de coordinación como los organometálicos, pueden ser vistos sobre la base de un efecto sinérgico entre el ligando y el metal de transición, luego, un ligando de comprobada acción terapéutica puede ser combinado con un metal de transición y formar un nuevo compuesto complejo que puede mejorar la acción farmacológica frente a una enfermedad en concreto. En tal sentido, el potencial a futuro que ofrecen los compuestos de coordinación y los organometálicos es muy prometedor.
En el presente artículo, se expone una breve revisión sobre los compuestos de coordinación y especialmente los compuestos organometálicos sintetizados en el último lustro, y su potencial terapéutico en el tratamiento del cáncer.
Metodología
Este artículo desarrolla una investigación cualitativa-documental sobre la actividad terapéutica reportada en el último lustro, referente a complejos compuestos de metales de transición y compuestos organometálicos, frente a una enfermedad de interés general como es el caso del cáncer.
Se utilizaron bases de datos reconocidas en el área de la química tales como: Chemical Abstracts (SciFinder), SCOPUS, Science Direct, Web of Science (ISI web), utilizando como entrada las siguientes palabras clave: organometallic, organometallic compounds, cancer, therapeutic compounds, ruthenium, platinum, osmium, iridium, entre otras, y combinaciones de ellas. El lapso escogido es el lustro 2013-2018.
Resultados y Discusión
Compuestos Organometálicos con actividad terapéutica
A finales del siglo XIX, el Salvarsán (Lloyd et al., 2005), una arsfenamina descubierta por Paul Ehrlich (1854-1915), fue uno de los primeros compuestos organometálicos en ser utilizado para el tratamiento de una enfermedad, en este caso de la sífilis. En la primera mitad del siglo XX, se puede decir que se exploró más bien poco la acción terapéutica de los compuestos organometálicos.
Obviamente, uno de los pocos ejemplos emblemáticos fueron los compuestos a base de ferroceno, que fueron administrados como un suplemento de hierro en pacientes anémicos (van Staveren, 2004). No obstante, en las primeras décadas del siglo XXI, el interés por investigar los compuestos organometálicos en lo que respecta a su acción terapéutica se ha visto renovado frente a enfermedades de interés estratégico como el cáncer, la malaria, el mal de Chagas o el VIH, entre otras, y se han desarrollado novedosas aproximaciones metodológicas, a fin de obtener estructuras nuevas y aprovechar toda la reactividad química de los compuestos organometálicos (Hillard et al., 2011).
Tradicionalmente, la investigación de los organometálicos y su acción terapéutica enfrenta un obstáculo en lo que se refiere a la reactividad de estos compuestos frente al agua, el aire y, en general, los compuestos oxigenados. A esto se suma los problemas de biodisponibilidad asociados con la poca solubilidad de los mismos. Sin embargo, estos problemas se han venido solucionando utilizando interesantes estrategias que se basan en el uso de ligantes hidrosolubles (Donzello et al., 2011) o la encapsulación en ciclodextrina (Valero et al., 2016). En tal sentido, una nueva generación de fármacos se ha desarrollado (Contreras et al., 2012), y las perceptivas que se abren son muy promisorias.
Compuestos Organometálicos contra el cáncer
Históricamente, el cisplatino (Fontal, 2005) y sus derivados son los agentes antineoplásicos por excelencia, y más del 50 % de las terapias contra el cáncer se basan en estos compuestos. Ahora bien, el alto costo del platino (II) y de sus compuestos de coordinación, genera una dificultad de acceso a este tratamiento, de allí el interés por estudiar nuevos compuestos que, utilizando metales de transición más asequibles y ligantes más económicos, puedan presentar una actividad comparable o superior frente a la enfermedad.
Otra de las limitantes de los compuestos tipo cisplatino se encuentra en su propia estructura, los compuestos de platino(II), d 8 , son plano cuadrados u octaédricos, lo cual no ofrece mayores posibilidades para racionalizar y diseñar nuevos fármacos. Por el contrario, los compuestos organometálicos ofrecen gran versatilidad, tanto como el número de coordinación y las diversas geometrías permitidas para los metales de transición, generalmente, dos (lineal), tres (triangular) cuatro (plano cuadrado, tetraédrico), cinco (bipirámide trigonal, pirámide de base cuadrada) y seis (octaédrica). Luego, los compuestos organometálicos ofrecen muchas posibilidades de investigación para el desarrollo de nuevos agentes antineoplásicos.
Por otro lado, se pueden aplicar diversas estrategias en el diseño de los ligantes, lo que vendría a ser diseño inteligente, racionalizando efectos estéricos, electrónicos, que permitan controlar su biodisponibilidad y la farmacocinética, lo cual es fundamental para mejorar la selectividad sobre las células dianas (target cells) y los efectos secundarios. Un aspecto a resaltar es que las grandes familias de compuestos organometálicos (Contreras, 2014), los carbonilos (Calderazzo, 1990) y carbenos (de Frémont et al., 2009), los metalocenos (Chirik, 2010) y los arenos (Muetterties et al., 1982), que se han utilizado extensivamente en la catálisis homogénea (Cornils & Herrmann, 2017) y bifásica (Cornils & Herrmann, 2004), tienen aplicaciones terapéuticas (22) (figura 1), especialmente contra el cáncer (Aranguren & Contreras, 2010).
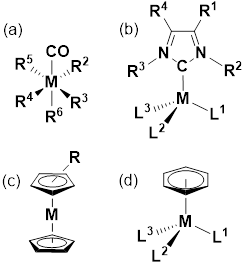
Figura 1: Compuestos organometálicos de importancia terapéutica. (a) Carbonilos metálicos con Rn = CO u otro ligando. (b) Carbenos N-heterocíclicos (NHC). (c) Metalocenos. (d) Arenos.
Para comenzar a hablar que los compuestos organometálicos utilizados en el campo terapéutico, debemos iniciar refiriéndonos a los metalocenos y, específicamente, al ferroceno. Los metalocenos constituyen una familia de compuestos con dos ligantes donadores-π ciclopentadienilo (Cp, C5H5 -) enlazados al centro metálico (figura 1c). El desarrollo de estos compuestos comenzó en 1952 con el descubrimiento del bis-ciclopentadienilo hierro(II) (Kauffman, 1983), denominado simplemente como ferroceno (Cp2Fe). La elucidación estructural, que le valdría el premio Nobel en 1973 a Geoffrey Wilkinson y Ernst Otto Fischer, determinó la presencia de dos anillos ciclopentadienilo equivalentes. El ferroceno, sus análogos rutenoceno y cobaltoceno, y muchos derivados estructurales (Kowalski, 2016), presentan propiedades terapéuticas muy importantes (Harry et al., 2014), y se ha reportado su actividad contra el cáncer (Lianga, 2017). La familia de metalocenos tipo Cp2MX2, titanoceno con M = Ti, circonoceno con M = Zr; vanadoceno con M = V; niobioceno con M = Nb y molibdoceno con M= Mo, y donde X es un halógeno, poseen comprobada actividad terapéutica (Zhang & Sadler, 2017) (figura 2a). En este sentido, el desarrollo de complejos ciclopentadienilo de titanio(IV) con ligandos quirales y hidrosolubles tipo amino-oximato (figura 2c), se perfilan como una excelente propuesta para generar agentes terapéuticos anticancerígena, pues poseen actividad contra el cáncer renal cuando se compara con una línea celular renal humana (HEK-293T) (de la Cueva-Alique et al., 2016).
La versatilidad del ferroceno como base estructural para la síntesis de nuevos fármacos (Braga & Silva, 2013) ha venido abriendo todo un nuevo campo de posibilidades, pues se puede aprovechar la reactividad del anillo ciclopentadienilo para hacer sustituciones y generar una gran familia de derivados. En este orden de ideas, una de las propuestas más significativas es incorporar sobre dicho anillo moléculas que posean comprobada actividad terapéutica. En 1996, Jaouen y colaboradores reportaron el primer ferroceno acoplado con el metabolito activo de tamoxifeno, el hidroxitamoxifeno (HOTAM) (Top et al., 1996), estos compuestos combinan el efecto anti-estrogénico del tamoxifeno y las propiedades citotóxicas del ferroceno. Estos ferrocenos funcionalizados, conocidos como “ferrocifenos (de Jaouen)”, constituyen una nueva generación de fármacos con actividad antiproliferativa (Meléndez, 2012) (figura 2b).
Varios compuestos de coordinación a base de rutenio han sido evaluados en aplicaciones terapéuticas contra el cáncer, presentando un intercambio de ligantes similar al observado en Pt(II) (Harry 2017), lo cual constituye un factor determinante en la actividad antitumoral. Estos compuestos presentan baja toxicidad, y se cree que la posibilidad de que el rutenio(II) pueda enlazarse a la albúmina o la transferrina sérica, tal y como lo hace el hierro, puede ser el responsable del efecto. Este tipo de unión es fundamental para el mecanismo de acción contra las células cancerosas, debido a que éstas requieren más abundancia de hierro para proliferar, en consecuencia, al sustituir el hierro por el rutenio, la velocidad de proliferación debería disminuir (Southam et al., 2017).
Los complejos de rutenio(III) pueden utilizarse también, pues ellos se reducen a rutenio(II) en el tejido canceroso. En el mecanismo de acción antitumoral también influye la afinidad del rutenio por las bases del ADN (Morris, 2001); sin embargo, la biodisponibilidad se ve afectada por los problemas de solubilidad que presentan estos compuestos. Esto se resolvió incorporando en la esfera de coordinación ligantes hidrosolubles, una primera alternativa serían las fosfinas sulfonas, pero ha resultado muy interesante el efecto de la fosfina cíclica conocida como PTA (1,3,4-triaza-7-fosfatriciclo-(3.3.1.1) decano) (Gasser et al., 2011). Otros compuestos organometálicos han sido investigados, y se ha encontrado que los arenos de rutenio(II) presentan resultados comparables al cisplatino en líneas celulares de, por ejemplo, cáncer de ovario A2780 (Palmucci et al., 2016; Auzias et al., 2008) (figura 3).
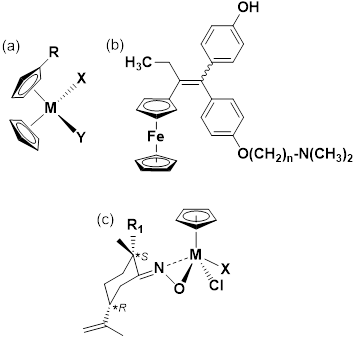
Figura 2: (a) Metalocenos tipo Cp2MX2, titanoceno con M = Ti, circonoceno con M = Zr; vanadoceno con M = V; niobioceno con M = Nb y molibdoceno con M= Mo; Cp = η5-C5H5, -R puede ser un profármaco y -X un halógeno. (b) Hidroxiferrocifeno n = 2, 3, 4, 5,8. (c) Ciclopentadienilo amino-oximato titanio(IV), (S,R)-((η5-C5H5)Ti{к2NO,(R1)Cl) con X = η5-C5H5 y R1 = NH(C6H5).
La afinidad del rutenio por los ligantes nitrogenados no puede ser omitida, y se han estudiado la actividad antitumoral de los emblemáticos complejos de rutenio(II) con los conocidos ligantes bidentados 2,2’-bipiridilo (bipy) y 1,10-fenantrolina (o-phen). Los complejos tipo Ru(bipy)3 y Ru(o-phen)3 tienen muchas aplicaciones en el campo de la ciencia de materiales, debido a que poseen excelentes propiedades electrónicas (p.e. fotolumiscencia: Noble & Peacock, 1996) y una alta reversibilidad electroquímica (Geiger, 2007). Estos compuestos eran considerados muy estables como para entrar en un equilibrio que pudiera facilitar una interacción biológica, no obstante, se probaron frente a células cancerosas, encontrando citotoxicidad y un mecanismo selectivo de acumulación por el sistema de transporte de hierro (Klajner et al., 2014).
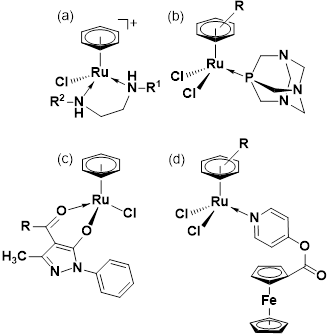
Figura 3: (a) Areno(etilendiamino)rutenio(II). (b) Areno(PTA)rutenio(II) (denominado RAPTA) con PTA = 1,3,4-triaza-7-fosfatriciclo-(3.3.1.1) decano. (c) Areno (acil-pirazolona) rutenio(II). (d) Areno (piridin-monoactilferroceno) rutenio(II).
Adicionalmente, complejos arenos de rutenio(II) y osmio(II) con ligados nitrógeno-sulfurados (figura 4a), presentaron buena actividad antiploriferativa in vivo frente a líneas celulares de cáncer de ovario, colon y pulmón (Meier et al., 2013). Complejos arenos de rutenio(II), osmio(II) y rodio(III) con el ligando bidentado-O,O’ y bioactivo conocido como lapachol (2-hydroxi-3-(3-metilbut-2-en-1-il)naftaleno-1,4-diona), presentaron actividad antiproliferativa; especialmente el complejo de rutenio(II) indujo mayor apoptosis en comparación al lapachol libre y respecto a los análogos de rodio y osmio, lo cual indica un efecto sinérgico del centro de rutenio(II) y del ligando bioactivo (Kandioller et al., 2013). En el área de la investigación de compuestos antitumorales de rutenio destacan dos compuestos de coordinación con ligantes nitrogenados, el NAMI-A (figura 4b) (Sava et al., 1999) y el KP1019 (figura 4c) (Galanski et al., 2003), que ya superaron con éxito la fase 1 de los ensayos clínicos y se perfilan como prometedores agentes terapéuticos (Lazarevic et al., 2017).
Por su parte, complejos organoiridio(III) con 2-fenilpiridina, metil-tiosemicarbazida, fenil-tiosemicarbazida y naftil-semicarbazida, presentaron actividad cinco veces mayor que el cisplatino frente a la línea celular T47D (cáncer de mama) (Ruiz et al., 2013).
Complejos planos cuadrados de paladio(II) con fenilpiridina y 4-hidroxiacridina como ligantes (figura 5a), también han demostrado actividad antiproliferativa frente a líneas celulares de cáncer de ovario (A2780, OVACR 5 y OVACR 8) resistentes al cisplatino (Pucci et al., 2006). Varios ciclometalatos a base de platino(II) también mostraron una buena actividad frente a células tumorales de leucemia promielocítica; algunos compuestos con ligantes como la acridina presentan una actividad hasta treinta veces mayor que el cisplatino (Cutillas et al., 2013). Metalatos de paladio(II) utilizando como base una N-bencildenanilina y como ligando soluble el 1,3,4-triaza-7-fosfatriciclo-(3.3.1.1) decano (PTA) (figura 5b) presentaron actividad contra líneas celulares de cáncer de mama (MCF7 y MDA-MB 231) y melanoma (ME1402) (Blanckenberg et al., 2017).
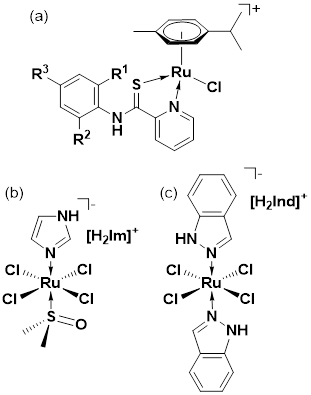
Figura 4: (a) Areno(piridino-carbotioamida)rutenio(II). (b) NAMI-A: (H2im)(trans-RuCl4(Him)(dmso)) (Him=imidazol, dmso=dimetilsulfóxido). (c) KP1019:(H2Ind)(trans-(tetraclorobis(HInd)rutenato(III)) (HInd=1H-indazol).
Complejos de oro(I) con trifenilfosfina y trietilfosfina y ligantes derivados de 5-(fenil)-1,3,4-oxadiazol-2-tiona han demostrado mayor actividad in vitro que el cisplatino frente a líneas celulares de cáncer de colon (CT26.WT) y melanoma cutáneo metastásico (B16F10) (Tunes et al., 2017).
Por otro lado, complejos de oro(III) con carbenos N-heterocíclicos (NHC) N-sustituidos por diferentes tipos de grupos alquilos, han suprimido el crecimiento de tumores in vivo con bajos efectos secundarios. Los complejos análogos de platino(II) y paladio(II) mostraron un comportamiento similar, lo cual indica que la geometría plana cuadrada y la presencia de los ligantes NHC son factores que contribuyen a la actividad observada (Zou et al., 2018)
Los complejos organometálicos de oro(III) con ligantes nitrogenados tetrahidroxiquinolina y una estructura plano cuadrada similar a la del cisplatino, presentaron menor toxicidad y una mejor actividad anticancerígena en tumores A549 (Huang et al., 2018). La capacidad del oro(III) para oxidarse a oro(I) es tan grande que reacciona con biomoléculas como la metionina y la glicina, provocando su reducción y afectando su estabilidad en condiciones fisiológicas. Utilizando las herramientas de la nanoquímica, se sintetizaron nanopartículas de oro con porfirinas solubles (sulfonadas, TPPS-AuNPs), las cuales arrojaron buenos resultados contra células de cáncer de cerebro (Bera et al, 2018).
Un complejo bimetálico de titanio(IV) y oro(I) con ciclopentadienilo y fosfinas ofrece un interesante efecto anticancerígeno in vitro contra líneas celulares de cáncer renal (A498, UO31, Caki-1) y de próstata (PC3, DU145) (Fernández-Gallardo et al., 2014) (figura 5c).
Carbenos N-heterocíclicos de oro(III), platino(II) y paladio(II), fueron sintetizados y evaluados in vitro e in vivo con prometedores resultados como agentes terapéuticos contra el cáncer (Zou et al., 2018), lo que abre prometedoras perspectivas.
Complejos metalocenos de iridio(III) con ligantes nitrogenados como la piridina y la 1,10-fenantrolina, han presentado actividad anticancerígena en varios tipos de cáncer (por ejemplo, línea A2780 de cáncer de ovarios; A549 de cáncer de pulmón y MCF-7 de cáncer de mama) (Liu et al. 2014) (figura 5d). Los resultados frente a la línea celular A2780 fueron cinco veces mayor que la de cisplatino.
Muchos complejos de osmio tienen una importante actividad antiproliferativa frente a células cancerosas humanas y con una actividad varias veces superior al cisplatino (Hanif et al., 2014). Recientemente, se ha reportado la actividad antiproliferativa (línea A2780 de cáncer de ovario) de nitruro complejos de osmio(VI) tipo OsN(N^N)Cl3, donde (N^N = 2,2′-bipiridilo 1,10-fenantrolina, 3,4,7,8-tetrametil-1,10-fenantrolina, u 4,7-difenil-1,10-fenantrolina (Suntharalingam et al., 2013). Los experimentos in vivo contra glioblastoma (Berger et al., 2018) mostraron un aumento significativo en la supervivencia después de una inyección quimioterapéutica intracraneal, lo cual justifican el desarrollo de mayores estudios con esta clase de compuestos.
Complejos carbonilos de renio(I) con ligantes ricos en electrones tipo piridina, 2,2’-bipiridilo o porfirinas, también se presentan como buenos candidatos en terapias contra el cáncer (Leonidova & Gasser, 2014) y se probaron frente a varias líneas celulares HT 29 (cáncer colorectal), MCF-7 (cáncer de mama), A549S (adenocarcinoma de pulmón), y HeLa (carcinoma uterino).
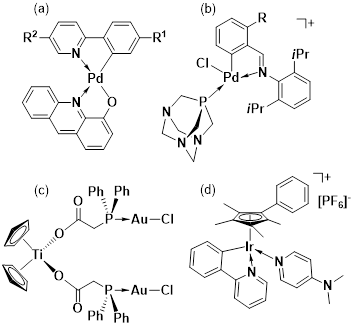
Figura 5: (a) 4-hidroxi-acridina{5-hexil-2-(4'-metoxi-fenill)pirimidina}paladio(II) (R1 = fenil; R2 = metoxi). (b) N-bencildenanilina(1,3,4-triaza-7-fosfatriciclo-(3.3.1.1)decano)cloropaladio(II) (R = H, Cl, Br, F, CH3,). (c) (η5-C5H5)2{Ti(IV){OC(O)RPPh2AuCl}2, (R= -CH2-). (d) ((η5-Cpxph)Ir(phpy)(4-NMe2-py))PF6, donde η5-Cpxph = tetrametil-(fenil)ciclopentadienyl, phpy = 2-fenilpiridina y 4-NMe2-py = N,N-dimetilpiridin-4-amina.
Finalmente, complejos de cobre(II) vienen siendo objeto de estudios como agentes quimioterapéuticos contra el cáncer. Aquí encontramos el uso de una gran variedad de ligantes nitrogenados, oxigenados y sulfurados, tipo base de Schiff, tipo Salen, quinolinas, entre otros (Santini et al., 2014), y, más recientemente, el uso de nanopartículas (CuNPs) (Zhou et al., 2016), como un campo de estudio de alto interés, tomando en cuenta una disminución de costos por el uso de cobre(II).
Conclusiones y perspectivas
En esta revisión, se han resumido algunos avances en el diseño de compuestos organometálicos con potencial actividad terapéutica contra el cáncer. Destaca el número de metales de transición que vienen siendo utilizados, el tipo de estado de oxidación y la naturaleza del entorno metálico en dichos complejos. La mayoría de los ligantes observados tienen como átomos donadores al nitrógeno, que es el más recurrente, el oxígeno, el azufre, el fósforo, y los halógenos. Obviamente los ligantes organometálicos propiamente dichos son característicos, especialmente el ciclopentadienilo (η5-C5H5), los arenos (η6-C6H6) y los carbenos N-heterocíclicos. Los mecanismos de acción contra las células cancerosas van desde el ataque al ADN, a proteínas y enzimas, pasando por la perturbación de los equilibrios energéticos o de óxido-reducción. En tal sentido, es crucial el establecimiento de la relación estructura/reactividad, especialmente para determinar la acción específica de muchos compuestos organometálicos. Se pone de manifiesto que pequeños cambios en la estructura de los compuestos puede traducirse en grandes cambios de la actividad anticancerígena. Las posibilidades de proyectos de investigación y desarrollo en esta área son muy grandes, en beneficio de quimioterapias más específicas, con menores efectos secundarios y económicamente más asequibles.















