Introducción
Hoy día se ha aceptado y reconocido el impacto de un amplio y variado grupo de compuestos químicos, naturales o sintéticos, que ponen en riesgo a diferentes especies que no fueron el objetivo de tratamientos contra enfermedades infecciosas o de cualquier otra índole farmacológica, incluyendo animales acuáticos, plantas, microorganismos y humanos, generando una interacción impredecible entre dichos individuos, el agua y el suelo (Sathishkumar et al., 2020). Los residuos de antibióticos también pueden matar a aquellas bacterias benéficas del suelo que ayudan a mantener su fertilidad, permitiendo así el crecimiento de otros microorganismos patógenos o bien disminuyendo la calidad biológica del suelo. A su vez, las plantas que se siembran en suelos contaminados por antibióticos u otros tipos de medicamentos pueden absorber de la tierra estos residuos, lo que según Zimmermann et al. (2012) puede ocasionar en los vegetales impactos fitotóxicos que producen raíces cortas y retardo en la germinación de cultivos.
Existen antibióticos que se emplean como promotores de crecimiento en la producción animal, mientras que otros se usan con fines terapéuticos, tal como el tratamiento de una infección. Se ha estimado que el uso global de antibióticos de uso veterinario sobrepasó, en 2017, las 93 toneladas, y se espera que en el 2030 sobrepase las 105 toneladas (Tiseo et al., 2020; Van Boeckel et al., 2015). Sin embargo, entre el 30 y 90% estos antibióticos son persistentes y excretados al medio ambiente a través de las heces, orina o leche sin ser completamente metabolizados por parte de los animales (Ahmad et al., 2019).
El ganado vacuno a lo largo de su etapa de crianza es susceptible de infecciones, como por ejemplo la mastitis, en cuyo momento el uso de antibióticos se ve necesario tanto para los pequeños como para los grandes ganaderos productores de leche. Sin embargo, el uso incorrecto de los mismos puede conllevar a graves problemas ambientales y de salud, con repercusiones económicas (Alsager et al., 2018; Bilal et al., 2022; Rama et al., 2017; Schewe y Brock, 2018). La principal preocupación de los contaminantes emergentes, y en particular de los antibióticos, recae en el hecho de que las bacterias generan mecanismos de resistencia, y estos medicamentos, si no se degradan antes de que la leche se elimine, pueden tener contacto con las bacterias que se localizan en el medio ambiente, con el riesgo subyacente. Es por ello por lo que, si se generan resistencias, los antibióticos disponibles para tratar infecciones bacterianas en humanos y otros animales van a resultar ineficaces (Alsager et al., 2018; Schewe y Brock, 2018). Si se tiene en cuenta, por ejemplo, que las tetraciclinas perduran meses en el suelo, la eliminación al medio ambiente de leche contaminada con residuos de antibióticos podría tener un impacto a largo plazo en los cultivos y en la salud humana.
Frente a la presencia de antibióticos en leche, los productores se pueden ver inmersos en sanciones, porque si este alimento es destinado al consumo humano puede producir resistencias antimicrobianas, alergias a nivel de la piel, enfermedades como el asma e incluso reacciones anafilácticas a la penicilina, por citar algunos ejemplos (Rama et al., 2017). La presencia de antibióticos en leche genera además pérdidas económicas, ya que puede interferir en la calidad de productos derivados como el yogurt, el queso o la mantequilla, pues se produce destrucción o baja eficiencia de los cultivos iniciadores o pérdida del sabor (Quintanilla et al., 2019; Quintanilla et al., 2020). A causa de estos problemas se debe desechar la leche contaminada con cualquier tipo de antibiótico que supere las cantidades permitidas (Rama et al., 2017). Cuando se aplica un tratamiento con antibióticos, la leche con residuos se elimina sin un previo tratamiento que elimine estas sustancias, por lo que su propagación ocasiona contaminación del entorno ambiental y puede provocar la aparición de los problemas antes mencionados.
Los estudios llevados a cabo hasta el momento para degradar antibióticos en leche se han efectuado con la ayuda de procesos de oxidación avanzada con ozono (Alsager et al., 2018), con el que se logró reducir entre un 70 a 95% de diferentes tipos de antibióticos en un tiempo de 10 minutos de contacto con ozono. Mediante radiación solar, ultravioleta y con fotocatalizadores químicos se pudo eliminar entre el 44 y 100% de trimetoprima y sulfametoxazol en un tiempo de 20 a 35 minutos de exposición (Martínez et al., 2018) o aplicando métodos electroquímicos con los que se degradó un 83% de oxitetraciclina en 6 horas (Kitazono et al., 2012). Abbasnia et al. (2022) también utilizaron procesos de adsorción y degradación por fotocatálisis en fase acuosa para degradar tetraciclinas, consiguiendo reducciones que fueron de 85 al 93% (según el tipo de tetraciclina utilizada en el estudio) en tan solo una hora. Sin embargo, estos métodos resultan costosos y complicados de implementar por parte del productor de leche, lo que deriva en malas prácticas de eliminación de la leche con residuos de antibióticos.
En otras investigaciones realizadas para eliminar antibióticos en leche se hizo uso de adsorbentes como carbón activado o resinas funcionales, pero los métodos no resultan factibles porque no se consigue una separación total del antibiótico de la leche según lo descrito en la publicación de Alsager et al. (2018). Además, sólo puede eliminarse cantidades de antibiótico pequeñas, entre 0.01 y 0.2 Unidades Internacionales en tiempos que van desde minutos a varias horas, ya que depende del tamaño de partícula del adsorbente.
Ciertos métodos como la filtración, coagulación, floculación o sedimentación se emplean en la separación de contaminantes del agua, pero para dar un tratamiento más eficaz pueden emplearse técnicas como microfiltración, ósmosis inversa o radiación UV. A pesar de ello, los residuos de antibióticos pueden persistir aún en grandes cantidades (Batt et al., 2006; Homem y Santos, 2011). Por lo tanto, no existe un proceso que permita a los ganaderos, de forma fácil y económica, para degradar los residuos de antibióticos presentes en la leche antes de que sea descartada, ya sea en el medio ambiente o alcantarillado.
Por otra parte, la distribución de los antibióticos en diferentes componentes de la leche permite que puedan volver a ser utilizados, como por ejemplo en la alimentación animal, siempre y cuando la concentración del antibiótico en la leche esté dentro del Límite Máximo de Residuos (LMR) según Ozdemir et al. (2018). De acuerdo con el Codex Alimentarius (2018), la oxitetraciclina tiene un LMR de 100 µg L-1. Esta fue la razón principal para que en el presente estudio se realizara un fraccionamiento de la leche.
Las enzimas que fabrican los hongos terrestres constituyen una alternativa para la degradación de diferentes químicos, entre estos los antibióticos, y ofrecen ventajas porque al emplear enzimas naturales se minimiza o elimina el uso de agentes químicos que en otros procesos de descontaminación son imprescindibles (Mata et al., 2017). Los antibióticos y otros medicamentos son moléculas constituidas por carbono y su estructura química es similar a las moléculas de lignina. En consecuencia, existen evidencias de que estas enzimas ligninolíticas provenientes de hongos (oxidasas y peroxidasas) pueden degradar antibióticos y otros medicamentos, así como otras moléculas orgánicas contaminantes que incluyen a los plaguicidas organofosforados, entre otros (Mata et al., 2017).
Se han realizado estudios de degradación de medicamentos y sustancias orgánicas presentes en agua residual aplicando un coctel de lacasas fúngicas de Pycnoporus sanguineus para eliminar diclofenaco, beta-naftol, 2,4 diclorofenol y 5,7-diyodo-8-hidroxiquinolina. Rodríguez et al. (2016), consiguieron porcentajes de reducción entre el 50% y 97% en un tiempo de reacción máximo de 8 horas para los tres primeros compuestos y 3.5 horas para el último. Además, la importancia del tratamiento biológico con enzimas para eliminar contaminantes emergentes como los antibióticos radica en que los subproductos de degradación son menos tóxicos o más susceptibles de biodegradación, de acuerdo con lo mencionado por Margot et al. (2013). Blair-González et al. (2021) probaron carbón activado con enzima lacasa inmovilizada en dicha matriz, de tal manera que la combinación de un proceso físico y otro químico pudiera tener mayor eficiencia de degradación de la oxitetraciclina presente en soluciones tampón. Observaron una mayor eficiencia de eliminación del antibiótico cuando se usó este proceso combinado, en comparación con la enzima lacasa libre. Sin embargo, concluyen que lo único que se consiguió fue separar la molécula de antibiótico más no degradarla.
Existe la necesidad de crear procedimientos fáciles y económicos para el productor de leche, en caso de necesitar desechar leche con residuos de oxitetraciclina, el principal y más usado antibiótico ante las infecciones de la ubre. Existen diferentes tratamientos de la leche que podrían ser una alternativa a los costosos métodos utilizados en la industria, y de fácil aplicación. Así mismo, tal y como se ha descrito anteriormente, la utilización de extractos o licuados de hongos de fácil acceso en el mercado también podrían ser una alternativa económica para el productor, y se sencilla aplicación a la leche contaminada. Es así que se propuso como objetivo de este estudio analizar el efecto de diferentes pretratamientos de la leche y el uso de lacasa sobre la degradación de residuos de oxitetraciclin.
Metodología
Selección de materias primas, reactivos y diseño experimental.
Se obtuvo leche cruda de una granja de vacas de raza Holstein, del cantón Chambo de la Provincia de Chimborazo (Ecuador). La granja sigue procedimientos de buenas prácticas de producción y ordeño. Los animales están en buen estado de salud, libre de enfermedades infecciosas y no han sido sujetos a tratamientos en los últimos 5 meses. Se tomó leche libre de antibióticos como materia prima, en la que se simuló la presencia de oxitetraciclina (Sigma-Aldrich, Estados Unidos) a una concentración de 200 µM, siguiendo el procedimiento descrito por Alsager et al. (2018). Se seleccionó la cantidad de enzima lacasa a ser utilizada en distintas concentraciones, según lo reportado en la literatura científica sobre la cinética de acción de esta enzima y las Unidades Internacionales de la actividad asociada a la lacasa comercial (Sigma-Aldrich, Estados Unidos).
Se partió de 8 L de leche, a la cual se añadió oxitetraciclina a una concentración de 200 µmol L-1, que es la cantidad aproximada más común encontrada en la leche de animales que han sido tratados para la mastitis con este antibiótico. Esta leche con antibiótico se subdividió en 3 porciones: una quedó como leche cruda con antibiótico, otra que fue tratada térmicamente a 90ºC por 20 minutos y la última se fraccionó en leche descremada y suero a través de los procesos de descremado y acidificación. Cada uno de estos subgrupos se subdividieron en 3 porciones, las cuales recibieron el tratamiento con lacasa a concentraciones de 0.1 mg L-1, 0.2 mg L-1 o 0.3 mg L-1. Se tomaron muestras cada 60 minutos durante 6 horas por triplicado, y el estudio experimental fue replicado tres veces en diferentes días.
Por lo tanto, el tamaño muestral fue: 4 pretratamientos (leche sin pretratamiento, pretratamiento térmico, leche descremada y suero) x 3 concentraciones de lacasa (0.1 mg L-1; 0.2 mg L-1 y 0.3 mg L-1) x 6 horas x 3 repeticiones, lo que da un total de 252 muestras que fueron analizadas.
Pretratamientos de la leche
La leche con inclusión de oxitetraciclina fue subdividida en 4 grupos. Uno de ellos se dejó como leche cruda, considerada control con relación al efecto pretratamiento. Los demás grupos se trataron tal como se describe a continuación. El grupo de leche tratada térmicamente o pasteurizada fue sometido a un proceso térmico de 90ºC por 20 minutos, simulando un proceso de pasteurización y desnaturalización de proteínas en la elaboración del yogurt. Luego se dejó enfriar rápidamente hasta temperatura ambiente.
Otra porción de leche sufrió un proceso de descremado para eliminar la grasa, de tal manera que se obtuvo la leche descremada, tercer grupo considerado para este estudio. Seguidamente, una porción de leche descremada fue sometida a un proceso de acidificación con HCl al 37,5% hasta un pH de 4.6. Esta leche acidificada se centrifugó a 3000 x g durante 30 min a 24ºC, según lo descrito por Ziv y Rasmussen (1975), para la obtención de las fracciones de caseína y suero. Se recuperó el suero, el cual se llevó de nuevo a un pH de 6.7 mediante la adición de una solución de NaOH al 37.7% con el propósito de trabajar al mismo pH de la leche. Este suero fue considerado como el cuarto grupo de estudio.
Previo a la adición de la lacasa, se tomaron muestras de leche o suero, las que fueron consideradas al tiempo 0 (t0) como control en comparación con las muestras que fueron analizadas a lo largo del tiempo tras la adición de la enzima.
Preparación de la lacasa, adición a la leche o suero y tiempo de análisis.
Se preparó una solución madre de lacasa a una concentración de 100 mg L-1. Cada uno de los grupos de leche cruda, pasteurizada, descremada o suero fueron divididos en 3 subgrupos, cada uno de los cuales recibieron lacasa de la solución madre hasta una concentración final en muestra de 0.1, 0.2 o 0.3 mg L-1. Una vez adicionada la lacasa, se tomaron muestras cada hora hasta las 6 horas. Cada una de estas muestras fueron congeladas a -86ºC hasta realizar la extracción y análisis cromatográfico.
Extracción de oxitetraciclina y análisis cromatográfico
Se mezcló 2 mL de cada muestra con 5 mL de acetonitrilo para posterior agitación durante 10 minutos en vórtex. Se centrifugó a 9500 rpm por 15 minutos y se tomaron 5 mL de sobrenadante que fueron depositados en un tubo de ensayo. Se evaporaron los 5 mL de sobrenadante al baño maría hasta sequedad y el residuo de antibiótico se reconstituyó con 2 mL de agua grado HPLC. Posteriormente, cada muestra se hizo pasar a través de un filtro de jeringa marca Phenex (Phenomenex) RC (celulosa regenerada) de 26 mm de diámetro y 0.2 µm de tamaño de poro.
Se inyectaron 20 µL de la muestra filtrada en un cromatógrafo líquido marca Perkin Elmer con detector UV/Visible, con columna analítica C18 de 5 µm de tamaño de partícula, 256 mm de longitud por 4.6 mm de diámetro interno, a una velocidad de flujo de 1 mL min-1. La fase móvil fue 20:80 (v/v) de acetonitrilo y solución de EDTA al 0.1% ajustado a pH 3.8 con ácido fosfórico concentrado.
Se mezcló 2 mL de cada muestra con 5 mL de acetonitrilo para posterior agitación durante 10 minutos en vórtex. Se centrifugó a 9500 rpm por 15 minutos y se tomaron 5 mL de sobrenadante que fueron depositados en un tubo de ensayo. Se evaporaron los 5 mL de sobrenadante al baño maría hasta sequedad y el residuo de antibiótico se reconstituyó con 2 mL de agua grado HPLC. Posteriormente, cada muestra se hizo pasar a través de un filtro de jeringa marca Phenex (Phenomenex) RC (celulosa regenerada) de 26 mm de diámetro y 0.2 µm de tamaño de poro.
Se inyectaron 20 µL de la muestra filtrada en un cromatógrafo líquido marca Perkin Elmer con detector UV/Visible, con columna analítica C18 de 5 µm de tamaño de partícula, 256 mm de longitud por 4.6 mm de diámetro interno, a una velocidad de flujo de 1 mL min-1. La fase móvil fue 20:80 (v/v) de acetonitrilo y solución de EDTA al 0.1% ajustado a pH 3.8 con ácido fosfórico concentrado.
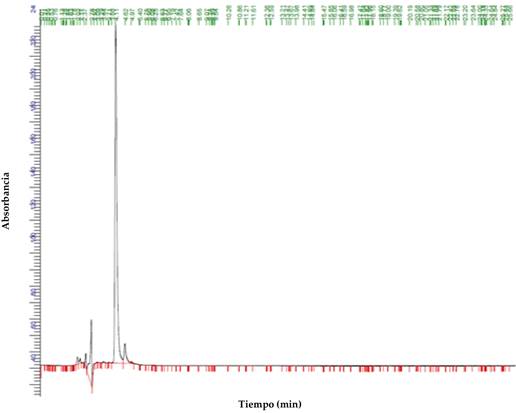
Figura 1: Cromatograma de una muestra de leche enriquecida con oxitetraciclina para detectar el tiempo de retención del antibiótico.
Se aplicó luego una elución isocrática siguiendo la técnica para doxiciclina y oxitetraciclina, como se indica en el estudio de Alsager et al. (2018) y Fletouris et al. (2008), respectivamente. Para el análisis cromatográfico se seleccionó una longitud de onda igual a 360 nm, previa la realización de un barrido espectral de una solución estándar. El estándar analítico tuvo una pureza de 98%. Los valores de la curva de calibración realizados en leche fueron de 200 µM, 150 µM, 100 µM, 50 µM y 10 µM.
Determinación del tiempo de retención de la oxitetraciclina.
Para determinar el tiempo de retención y localización exacta del pico de oxitetraciclina en los cromatogramas, se prepararon muestras con alta concentración del antibiótico y se analizaron en el cromatógrafo. En la Figura 1 se puede apreciar el cromatograma en estas muestras control positivo. El tiempo de retención para la oxitetraciclina fue de 4.11 minutos de acuerdo con el pico que se observa en ese instante de tiempo.
Análisis estadístico
Se aplicó un procedimiento de Análisis de Varianza de Medidas Repetidas (SAS, versión 9) para determinar la existencia o no de diferencia estadística significativa, a un nivel de confianza α=0,05, entre cada uno de los tiempos de muestreo, los pretratamientos y los tratamientos enzimáticos. La prueba estadística de Bonferroni permitió la comparación de pares.
Resultados
Efecto de la concentración de lacasa.
En la Tabla 1 se presentan los valores medios de oxitetraciclina presente en las muestras de leche o suero y su evolución a lo largo de 6 horas en presencia de diferentes concentraciones de lacasa. En esta tabla se compara, además, el efecto de la concentración de lacasa dentro de cada uno de los pretratamientos a los que fue sometida la leche.
Previo a añadir la lacasa a las muestras, se observó que los valores de concentración de oxitetraciclina se presentaron en valores aproximados de 200, 188, 198 y 49 µM en la leche cruda sin tratamiento, leche tratada térmicamente, leche descremada y suero, respectivamente.
Tanto en la leche cruda sin pretratamiento, como en la tratada térmicamente y la descremada, la presencia de lacasa, en cualquiera de sus concentraciones, redujo notablemente la concentración de oxitetraciclina presente en leche. Esta reducción significativa se produjo a cada hora en la que se tomó la muestra. Los niveles de oxitetraciclina encontrados a las 6 horas en estos tres tratamientos en presencia de lacasa varió entre 47.51 y 53.36 µM. Si se hubiese alargado en el tiempo, posiblemente los niveles de oxitetraciclina serían más bajos.
En el caso del suero, el uso de lacasa, en cualquiera de sus concentraciones, produjo una ligera disminución de los niveles de oxitetraciclina, y aunque después de 6 horas se redujo con diferencia respecto al t 0 , esta disminución no fue más de 5 µM.
Respecto al efecto de la concentración de lacasa en las muestras de leche cruda sin pretratamiento, tratada térmicamente o descremada, se observó una ligera disminución del nivel de oxitetraciclina presente en la muestra a medida que aumentó la concentración de lacasa. Sin embargo, no fueron evidentes ni proporcionales al aumento de la concentración de lacasa añadida.
En el caso del suero, no hubo diferencias en la cantidad de oxitetraciclina presente en la muestra a medida que aumentó la concentración de lacasa. Adicionalmente, en el suero no hubo diferencias significativas en la concentración el antibiótico a medida que aumentó la presencia de la enzima lacasa usada en este estudio durante las 6 horas de contacto.
Tabla 1. Valores medios de concentración de oxitetraciclina (µM) en muestras de leche1 cruda, tratada térmicamente, descremada y suero, con presencia de diferentes concentraciones de lacasa durante 6 horas de contacto.
Tabla 1 Valores medios de concentración de oxitetraciclina (µM) en muestras de leche1 cruda, tratada térmicamente, descremada y suero, con presencia de diferentes concentraciones de lacasa durante 6 horas de contacto.
| Tiempo (horas) | |||||||||||||||||
| Pretratamiento | Concentración de lacasa1 | 0 | 1 | 2 | 3 | 4 | 5 | 6 | EEM2 | ||||||||
| Leche cruda | Baja | 200.00 | a | 160.48 | bz | 128.77 | cz | 100.32 | dz | 82.91 | ez | 62.52 | fz | 53.36 | gz | 10.10 | |
| Media | 200.00 | a | 150.90 | by | 126.25 | cy | 98.30 | dy | 79.69 | ey | 63.31 | fz | 50.30 | gy | 9.75 | ||
| Alta | 200.00 | a | 148.64 | bx | 125.83 | cy | 95.81 | dx | 79.17 | ey | 60.80 | fy | 49.80 | gx | 9.76 | ||
| EEM | 0.00 | 1.82 | 0.58 | 0.69 | 0.62 | 0.44 | 0.56 | ||||||||||
| Leche tratada térmicamente | Baja | 188.28 | a | 157.12 | b | 126.60 | cz | 98.72 | dz | 80.13 | ez | 60.75 | fz | 50.71 | gz | 9.79 | |
| Media | 182.87 | a | 156.14 | b | 123.04 | cy | 96.87 | dzy | 76.18 | ey | 59.81 | fy | 48.89 | gy | 9.71 | ||
| Alta | 181.52 | a | 155.70 | b | 122.35 | cy | 96.05 | dy | 75.31 | ey | 58.96 | fy | 48.08 | gy | 9.72 | ||
| EEM | 2.06 | 0.38 | 0.68 | 0.50 | 0.77 | 0.30 | 0.41 | ||||||||||
| Leche descremada | Baja | 198.92 | a | 155.29 | b | 122.37 | cz | 96.34 | dz | 75.75 | ez | 59.48 | fz | 49.59 | gz | 10.08 | |
| Media | 199.35 | a | 154.55 | b | 121.51 | czy | 95.40 | dy | 74.76 | ezy | 59.46 | fz | 48.56 | gy | 10.11 | ||
| Alta | 199.11 | a | 153.82 | b | 120.51 | cy | 94.28 | dx | 73.62 | ey | 57.34 | fy | 47.51 | gx | 10.19 | ||
| EEM | 0.12 | 0.33 | 0.33 | 0.31 | 0.36 | 0.36 | 0.31 | ||||||||||
| Suero | Baja | 49.18 | a | 48.34 | ab | 47.31 | b | 46.50 | b | 46.03 | c | 45.60 | c | 44.91 | c | 0.32 | |
| Media | 49.29 | a | 48.41 | ab | 47.35 | bc | 46.48 | cd | 46.05 | de | 45.51 | ef | 44.90 | f | 0.32 | ||
| Alta | 49.37 | a | 48.49 | a | 47.42 | b | 46.78 | bc | 46.01 | cd | 45.35 | de | 44.82 | e | 0.34 | ||
| EEM | 0.05 | 0.21 | 0.18 | 0.10 | 0.22 | 0.13 | 0.19 | ||||||||||
1Concentración de lacasa en leche o suero: 0.1 mg L-1 (baja), 0.2 mg L-1 (media) y 0.3 mg L-1 (alta). 2EEM: error estándar de la media. a-gLetras diferentes en una misma fila indican diferencias estadísticas entre medias (P < 0.05). z-xLetras diferentes en una misma columna indican diferencias estadísticas entre medias (P < 0.05).
Efecto de los pretratamientos de la leche y tiempo de exposición a la lacasa.
En la Tabla 2 se presentan los valores medios de la concentración de oxitetraciclina en las muestras de leche y suero, comparando los pretratamientos de la leche dentro de cada grupo de las concentraciones de lacasa añadidas. El objetivo de esta agrupación y comparación fue determinar si los pretratamientos de la leche favorecen la degradación de residuos de oxitetraciclina, juntamente con el uso de la enzima lacasa a diferentes concentraciones. Si se observan los resultados previo a la adición de lacasa, es evidente que el descremado y tratamiento térmico redujeron sutilmente, en sí, la cantidad de oxitetraciclina en la muestra de leche (aproximadamente 0.5 y 6%, respectivamente).
El pretratamiento que produjo una mayor reducción de oxitetraciclina en la leche fue el desuerado, con una menor presencia del antibiótico en el suero (aprox. 49 µM, lo que significa una reducción del 75% del antibiótico de la muestra original), seguido del pretratamiento térmico, al t0. La reducción del 75% de oxitetraciclina en el suero fue debido a un reparto del antibiótico por el fraccionamiento, el cual migró a la fase caseínica de la leche. Es decir, no se redujo por una degradación de la molécula, tal y como sí sucedió con el pretratamiento térmico.
Tabla 2 Valores medios de concentración de oxitetraciclina (µM) en las diferentes muestras agrupadas en función de cada una de las tres concentraciones de lacasa para evidenciar la efectividad del pretratamiento1.
| Tiempo (horas) | |||||||||||||||
| Concentración de lacasa2 | Pretratamiento1 | 0 | 1 | 2 | 3 | 4 | 5 | 6 | |||||||
| Baja | Leche cruda | 200.00 | z | 160.48 | z | 128.77 | z | 100.32 | z | 82.91 | z | 62.52 | z | 53.36 | z |
| Leche tratada térmicamente | 188.28 | y | 157.12 | y | 126.60 | y | 98.72 | y | 80.13 | y | 60.75 | y | 50.71 | y | |
| Leche descremada | 198.92 | z | 155.29 | x | 122.37 | x | 96.34 | x | 75.75 | x | 59.48 | x | 49.59 | y | |
| Suero | 49.18 | x | 48.34 | w | 47.31 | w | 46.50 | w | 46.03 | w | 45.60 | w | 44.91 | x | |
| EEM2 | 36.73 | 14.28 | 10.29 | 6.80 | 4.45 | 2.03 | 0.93 | ||||||||
| Media | Leche cruda | 200.00 | z | 150.90 | y | 126.25 | z | 98.30 | z | 79.69 | z | 63.31 | z | 50.30 | z |
| Leche tratada térmicamente | 182.87 | y | 156.14 | z | 123.04 | y | 96.87 | zy | 76.18 | y | 59.81 | y | 48.89 | y | |
| Leche descremada | 199.35 | z | 154.55 | z | 121.51 | x | 95.40 | y | 74.76 | y | 59.46 | y | 48.56 | y | |
| Suero | 49.29 | x | 48.41 | x | 47.35 | w | 46.48 | x | 46.05 | x | 45.51 | x | 44.90 | x | |
| EEM | 36.41 | 13.78 | 9.97 | 6.59 | 4.07 | 2.06 | 0.61 | ||||||||
| Alta | Leche cruda | 200.00 | z | 148.64 | x | 125.83 | z | 95.81 | z | 79.17 | z | 60.80 | z | 49.80 | z |
| Leche tratada térmicamente | 181.52 | y | 155.70 | z | 122.35 | zy | 96.05 | z | 75.31 | y | 58.96 | y | 48.08 | y | |
| Leche descremada | 199.11 | z | 153.82 | y | 120.51 | y | 94.28 | y | 73.62 | x | 57.34 | x | 47.51 | x | |
| Suero | 49.37 | x | 48.49 | w | 47.42 | x | 46.78 | x | 46.01 | w | 45.35 | w | 44.82 | w | |
| EEM | 36.29 | 13.63 | 9.87 | 6.35 | 3.97 | 1.83 | 0.54 | ||||||||
1Concentración de lacasa en leche o suero: 0.1 mg L-1 (baja), 0.2 mg L-1 (media) y 0.3 mg L-1 (alta). 2EEM: error estándar de la media. z-xLetras diferentes en una misma columna indican diferencias estadísticas entre medias (P < 0.05).
En la Tabla 3 se aprecia el porcentaje de oxitetraciclina presente en leche con relación a la cantidad de antibiótico que había previo a la adición de lacasa. Esta presentación de los datos en porcentaje de concentración de oxitetraciclina presente en leche nos permite observar mejor el efecto sobre la cantidad de antibiótico residual en las muestras después del pretratamiento.
Se puede observar, por ejemplo, que la degradación del antibiótico a la primera hora en presencia de lacasa, respecto al t0, fue más rápida en la leche cruda (24% de reducción), seguida de la leche descremada (22 % de reducción), pasteurizada (16% de reducción), y finalmente en el suero, en el cual se redujo levemente la cantidad de antibiótico por efecto de la lacasa (menos del 2% de reducción).
A lo largo del tiempo de exposición de la leche contaminada a la lacasa, los análisis mostraron una reducción gradual y significativa de la concentración de antibiótico en las muestras de leche cruda, pasteurizadas y descremadas, de entre un 74 y 76% de reducción a las 6 horas de la aplicación de la enzima.
Sin embargo, en las muestras de suero, a pesar de que el pretratamiento redujo significativamente la cantidad de antibiótico, la lacasa en estas muestras degradó levemente la oxitetraciclina.
A pesar de ello, tal y como se observó en la Tabla 1, el simple hecho de obtener el suero fue suficiente para obtener valores residuales de oxitetraciclina similares a aquellos obtenidos combinando los otros pretratamientos con el uso de lacasa.
En todo caso, se puede concluir que los pretratamientos térmico y descremado, junto con el uso de la lacasa, influyen significativamente en la degradación de la oxitetraciclina.
Tabla 3 Valores medios de concentración de oxitetraciclina (%) en muestras de leche1 cruda, tratada térmicamente, descremada y desuerada (suero), con presencia de diferentes concentraciones de lacasa durante 6 horas de contacto.
| Tiempo (horas) | |||||||||||||||||
| Pretratamiento | Concentración de lacasa1 | 0 | 1 | 2 | 3 | 4 | 5 | 6 | EEM2 | ||||||||
| Leche cruda | Baja | 100.00 | a | 80.24 | b | 64.39 | c | 50.16 | d | 41.46 | e | 31.26 | f | 26.68 | g | 5.05 | |
| Media | 100.00 | a | 75.45 | b | 63.13 | c | 49.15 | d | 39.85 | e | 31.66 | f | 25.15 | g | 4.88 | ||
| Alta | 100.00 | a | 74.32 | b | 62.92 | c | 47.91 | d | 39.59 | e | 30.40 | f | 24.90 | g | 4.88 | ||
| Leche tratada térmicamente | Baja | 100.00 | a | 83.45 | b | 67.24 | c | 52.43 | d | 42.56 | e | 32.27 | f | 26.93 | g | 5.20 | |
| Media | 100.00 | a | 85.38 | b | 67.28 | c | 52.97 | d | 41.66 | e | 32.71 | f | 26.73 | g | 5.31 | ||
| Alta | 100.00 | a | 85.78 | b | 67.40 | c | 52.91 | d | 41.49 | e | 32.49 | f | 26.49 | g | 5.36 | ||
| Leche descremada | Baja | 100.00 | a | 78.07 | b | 61.52 | c | 48.43 | d | 38.08 | e | 29.90 | f | 24.93 | g | 5.07 | |
| Media | 100.00 | a | 77.53 | b | 60.95 | c | 47.86 | d | 37.50 | e | 29.83 | f | 24.36 | g | 5.07 | ||
| Alta | 100.00 | a | 77.25 | b | 60.52 | c | 47.35 | d | 36.97 | e | 28.80 | f | 23.86 | g | 5.12 | ||
| Suero | Baja | 100.00 | a | 98.29 | ab | 96.20 | bc | 94.55 | cd | 93.60 | de | 92.72 | ef | 91.32 | f | 0.66 | |
| Media | 100.00 | a | 98.21 | ab | 96.06 | bc | 94.30 | cd | 93.43 | de | 92.33 | ef | 91.09 | e | 0.66 | ||
| Alta | 100.00 | a | 98.22 | a | 96.05 | b | 94.75 | bc | 93.19 | cd | 91.86 | de | 90.78 | e | 0.68 | ||
1Concentración de lacasa en leche o suero: 0.1 mg L-1 (baja), 0.2 mg L-1 (media) y 0.3 mg L-1 (alta). 2EEM: error estándar de la media. a-gLetras diferentes en una misma fila indican diferencias estadísticas entre medias (P < 0.05).
Discusión
Tal y como se observó en los resultados, alrededor de un 25% de oxitetraciclina permaneció en suero luego del desuerado. Un resultado similar a esto lo obtuvo Cabizza et al. (2017), quien reportó la permanencia de un 23% de oxitetraciclina en suero y un 60% en caseína luego de realizar el fraccionamiento de la leche con residuos de este antibiótico. Estos autores, aunque en su discusión no explican que el resto de antibiótico faltante se pudo haber repartido en la fracción de grasa, atribuyen el resultado a la imprecisión del método. En nuestro estudio, observamos que, al realizar el pretratamiento de descremado, la presencia de oxitetraciclina en la leche descremada fue prácticamente igual a la presencia de esta en la leche cruda, lo que nos indica que el antibiótico no migra a la fracción grasa. Por tanto, es plausible la conclusión de Cabizza et al. (2017) de haber usado métodos o procedimientos imprecisos.
La enzima lacasa actúa degradando las moléculas de oxitetraciclina que no están fijas a las proteínas lactoséricas (es decir, las proteínas que miran al suero de la leche). Según Shappell et al. (2017), la afinidad de antibióticos como la oxitetraciclina por las lactoproteínas séricas disminuye en presencia de la caseína; es así que, cuando los antibióticos están en la leche, una menor cantidad de estas moléculas permanecen unidas a las proteínas del lactosuero, en contraposición a cuando están exclusivamente en suero, aisladas de la caseína. En la investigación desarrollada por Alseger et al. (2018), se mencionó que los antibióticos disponibles en forma libre tienden a direccionarse a la caseína durante la fragmentación de la leche. Esto puede explicar que la degradación de la oxitetraciclina fue más eficiente en leche que en suero, ya que es posible que la enzima lacasa actúe sólo con las moléculas de antibiótico libres o no asociadas a otras proteínas.
En nuestro estudio, la lacasa y sus diferentes concentraciones redujeron sutilmente la concentración de oxitetraciclina en el suero, lo cual concuerda con lo mencionado anteriormente. La razón de este fenómeno en el suero puede explicarse porque la cantidad de oxitetraciclina libre en esta fracción de la leche es escasa (Shappell et al., 2017) y, por lo tanto, si no existe más cantidad de antibiótico libre, de nada servirá adicionar más cantidad de lacasa, ni esperar más tiempo en presencia de esta.
El pretratamiento de descremado usado en este estudio tenía como objetivo analizar si éste es capaz de ejercer un efecto en la mejora del desempeño de la lacasa para degradar la oxitetraciclina. Al igual que en nuestro estudio, en el estudio de Hakk et al. (2016) se reportó que la oxitetraciclina se distribuyó en un porcentaje mayor al 99% en la leche descremada.
Conclusiones
Los pretratamientos térmico y descremado no disminuyen sustancialmente la presencia de oxitetraciclina en la leche, mientras que el desuerado resulta en un suero con una reducción de más del 75% la concentración del antibiótico. Duplicar o triplicar la concentración de lacasa a lo largo de las 6 horas de estudio no aumenta la velocidad de degradación de la oxitetraciclina en las muestras de leche o suero. Los pretratamientos térmico y descremado de la leche no favorecen la degradación de la oxitetraciclina por parte de la lacasa, en comparación con la leche cruda. Así mismo, la lacasa, en cualquiera sus concentraciones, reduce levemente la concentración de oxitetraciclina en el suero.
Se evaluó como efecto positivo la degradación de oxitetraciclina en leche gracias a la acción de la lacasa en todas sus concentraciones tras las 6 horas de ensayo o por el pretratamiento desuerado sin adición de lacasa, consiguiéndose una máxima remoción de aproximadamente el 75% de antibiótico a las 6 horas. Con esto se consigue residuos del antibiótico por debajo del LMR establecido por el Codex Alimentarius, de tal manera que la leche o el suero ya pueden ser desechados directamente al medio ambiente o usarse como alimentación animal.
Se consiguió así establecer procedimientos simples y económicos para el productor en caso de necesitar manejar leche de animales tratados con oxitetraciclina, ya sea usando un extracto de hongos ricos en lacasa en leche cruda, o bien acidificando la leche para obtener el suero con baja cantidad de antibiótico, y que puede llegar a representar hasta el 90% del total de la leche. Como trabajo futuro se plantea investigar y definir procedimientos de reducción de oxitetraciclina en la fracción caseína de la leche después del desuerado, que bien también podría probarse con enzimas como la lacasa u otros métodos fisicoquímicos.
Fuente de financiamiento
Esta investigación ha sido financiada por una parte por el proyecto “Uso potencial del calostro para mejorar los quesos bajos en grasa”, así como también mediante fondos propios.
Agradecimiento
Los autores quisieran agradecer especialmente a Alicia Zabala, Sandra López y Patricio Guevara, docentes de la Facultad de Ciencias Pecuarias de la Escuela Superior Politécnica de Chimborazo.