Introducción
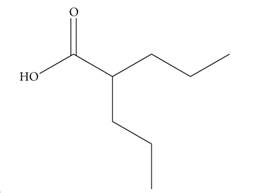
El ácido valproico (ácido 2-propilvalérico, ácido 2-propilpentanoico o ácido n-dipropilacético) es un ácido graso de cadena corta ramificada (Figura 1) derivado del ácido valérico extraído de la valeriana (Valeriana officinalis). Fue sintetizado por primera vez en 1882 por el químico Beverly S. Burton, en Estados Unidos.
En 1963, durante un estudio centrado en moléculas con potencial actividad anticonvulsiva, en el que se utilizó el ácido valproico (AVP) como vehículo molecular, fue cuando se demostró la actividad farmacológica del AVP, ya que previno las convulsiones inducidas por pentilenetetrazol en roedores. Posteriormente, se ha utilizado como anticonvulsivante para el tratamiento de un amplio espectro de epilepsias focales y generalizadas; así como estabilizador del estado de ánimo (Chateauvieux, Morceau, Dicato, & Diederich, 2010). Además, ha demostrado beneficio para múltiples patologías neurológicas, para el tratamiento de la dependencia a sustancias psicoactivas, enfermedades psiquiátricas, cáncer y asma, entre otras (Koenig et al., 2008; Luna-Palencia, Correa-Basurto, & Vásquez-Moctezuma, 2019; Manohar, Avitsian, Lozano, Gonzalez-Martinez, & Cata, 2011; Martínez-Lazcano et al., 2015). Su mecanismo de acción consiste en potenciar la actividad inhibitoria del ácido gamma-aminobutírico, atenuar la excitación mediada por N-metil D-aspartato y bloquear los canales de sodio, calcio y potasio dependientes de voltaje; propiedades que serían las responsables de la disminución de la actividad cerebral (acción depresora sobre el sistema nervioso central). El AVP se clasificó recientemente entre los inhibidores de histona desacetilasa, actuando directamente a nivel de transcripción de genes al inhibir la desacetilación de histonas y hacer que los sitios de transcripción sean más accesibles. En años resientes el aumento de la prescripción de AVP como consecuencia de su amplio uso terapéutico, se ha asociado a un incremento significativo de los casos de intoxicación en pacientes tratados con este fármaco. Afortunadamente, la mayoría de los casos suelen ser leves, requiriendo sólo tratamiento de sostén, sin embargo, cuando la ingesta supera los 200 mg/kg, se debe pensar en un compromiso grave del paciente, que obliga a actuar en consecuencia, en donde, además de instaurarse las medidas de rescate habituales, debe tenerse presente la implementación de prácticas extracorpóreas (hemodiálisis o hemofiltración) (Docampo et al., 2014). Por otra parte, el uso crónico del AVP se encuentra relacionado con alteraciones hematológicas, hepáticas, endocrinas y cambios morfológicos en los capilares cerebrales y de las células gliales, y más recientemente se ha señalado como sensibilizador a los tratamientos anticáncer al modificar epigenéticamente la expresión de genes (Chateauvieux et al., 2010; Fajardo, Olmos, & Sarmiento, 2013; Luna-Palencia et al., 2019)
El hígado es el principal responsable del metabolismo de los fármacos, nutrientes y otras sustancias. La medicación no controlada clínicamente puede inducir hepatotoxicidad provocando lesiones de diversa magnitud incluso insuficiencia hepática aguda (Higuera-de la Tijera, Servín-Caamaño, & Alexanderson-Rosas, 2012). Sin embargo, la susceptibilidad individual al daño hepático farmacológico depende de factores tanto genéticos como adquiridos. Dichos factores actuarían presumiblemente mediante la inducción o inhibición del sistema microsomal oxidativo de función mixta, o mediante la interferencia con los sistemas enzimáticos detoxificadores. Los factores de riesgo comúnmente relacionados con las reacciones hepáticas adversas son los factores genéticos, la edad, el sexo, los factores metabólicos, hormonales, el consumo de alcohol, el uso concomitante de medicamentos y la presencia de determinadas enfermedades asociadas a un mayor riesgo de afección hepática (Tejada, 2010).
La hepatotoxicidad secundaria debido al consumo de fármacos tiene una incidencia relativamente alta, entre 1/10000 y 1/100000 medicamentos prescriptos. Sin embargo, la incidencia real de hepatotoxicidad por medicamentos es difícil de establecer; debido a que existen subregistros de los casos que no permiten precisar la magnitud del problema. La inducción de una lesión hepática es una complicación potencial ante cualquier tratamiento farmacológico. (Cruz, 2015). En la mayoría de los casos, no existe un tratamiento o antidoto para revertir la hepatotoxicidad, ante una reacción adversa de este tipo, por lo que se sugiere suspender el tratamiento (Fernández, 2015) y la información epidemiológica sobre el efecto tóxico de los fármacos en el hígado es escasa. No obstante, se conoce que la incidencia está aumentando de forma paralela a la introducción de nuevos fármacos en el mercado, al incremento de la esperanza de vida, la polimedicación y al uso cada vez más extendido de productos herbales. En años recientes, mediante revisiones sistemáticas, se identificaron 181 medicamentos y 17 formas farmacéuticas combinadas o regímenes terapéuticos con probabilidad de causar hepatotoxicidad; entre ellos el AVP. Mientras que, 6 de estos medicamentos presentan una muy alta probabilidad de producir hetapotoxicidad (metotrexato, minociclina, vancomicina, everolimus, isoniazida y tamoxifeno). Por otra parte, más del 50% de estos medicamentos se asocian con hepatotoxicidad de tipo idiosincrásico y al sexo femenino con un amplio rango de edad como principales factores de riesgo. La elevación de las enzimas hepáticas, la ictericia y la fiebre hacen parte de los síntomas que más se presentan, generándose lesiones principalmente de tipo hepatocelular. En la mayoría de los casos, se presenta una adecuada evolución al identificar y suspender el agente causante. La consolidación de la información sobre hepatotoxicidad demostró que diversos grupos de medicamentos tienen mayor evidencia de ser sustancias causantes de toxicidad hepática, aunque para algunas sea escasa la información precisa del mecanismo que explica el desarrollo y aparición del evento (Cano, Cifuentes, & Amariles, 2017).
Sin embargo, el diagnóstico de hepatotoxicidad es difícil y puede demandar un largo tiempo de estudios y de exclusión de otras enfermedades (Cavalieri & D’Agostino, 2017). Las pruebas de la función hepática (PFH) son determinaciones de componentes sanguíneos que proporcionan información sobre la existencia, la magnitud y el tipo de una lesión hepática; pero no sirven para valorar cuantitativamente la capacidad del hígado para llevar a cabo sus funciones. Generalmente, en las PFH se realizan las determinaciones en suero de bilirrubina, fosfatasas alcalinas y aminotransferasas. Estas pruebas bioquímicas sirven para diferenciar entre: Obstrucción del tracto biliar, lesiones hepatocelulares agudas y enfermedad hepática crónica (Gaw, Murphy, Srivastava, R, & O´Reilly, 2013). La lesión hepática puede ser hepatocelular cuando existe una elevación inicial predominante de los niveles de alanino aminotransferasa o puede ser colestásica cuando se presenta una la elevación inicial predominante de fosfatasa alcalina. El reconocer las características de la lesión hepática puede ayudar a categorizarlas. Según el tipo de medicamento, algunos podrían mostrar un patrón hepatocelular o colestásico. Estas categorías de lesión hepática no son mutualmente excluyentes e inclusive podrían encontrarse en un patrón mixto. La lesión hepática generalmente se establece cuando existe una elevación en los niveles de aminotransferasas séricas; aun cuando, aumentos de más de tres veces el límite superior normal, podrían no generar daño hepático, debido a la gran capacidad que tiene el hígado para remediar esa lesión y el subsecuente desarrollo de tolerancia adaptativa, como se ha logrado observar con la exposición inicial de medicamentos como la isoniazida. (Fernández, 2015). Por tanto, el objetivo de este trabajo fue analizar los niveles de las aminotransferasas séricas como marcadores del metabolismo hepático en pacientes con trastornos neurológicos tratados con AVP que asistieron a la consulta de neurología del Instituto Autónomo Hospital Universitario de Los Andes, Mérida-Venezuela desde febrero hasta abril de 2018.
Materiales y Métodos
Tipo y diseño de la investigación
Este estudio se enmarca en una investigación exploratoria de tipo analítico y diseño transeccional, ya que se pretende analizar cuáles son los niveles de las aminotransferasas o aminotransferesas como marcadores del metabolismo hepático en pacientes con trastornos neurológicos tratados con AVP en un periodo determinado.
Recolección de la información
Una vez obtenido el consentimiento informado por escrito de los integrantes de los grupos de pacientes tratados con AVP e individuos no tratados con AVP (grupo control) a participar en el estudio; se les realizó individualmente un cuestionario de tipo mixto como instrumento, para la obtención de información relevante a través de preguntas abiertas y cerradas que conjuntamente con información suministrada por el médico especialista basada en las historias clínicas de los pacientes, permitieron la selección definitiva de la población a participar en el estudio, teniendo en cuenta los criterios de inclusión preestablecidos.
Población y muestra
La población objetivo fue un conjunto finito (48 participantes) con características comunes y accesibilidad. Como criterio de inclusión se estableció una población representada por pacientes diagnosticados clínicamente con diversos trastornos neurológicos, fácilmente manejables y tratados solo con AVP como fármaco anticrisis que acudieron a la consulta de neurología del Instituto Autónomo Hospital Universitario de Los Andes, Mérida-Venezuela. Estos criterios redujeron significativamente el número de participantes a 38 pacientes. Adicionalmente, se contó con un grupo control representado por 10 individuos de ambos géneros, diferentes edades y no tratados con AVP.
Metodología
El procedimiento analítico para la determinación de las concentraciones séricas in vitro de la alanina aminotransferasa (ALT) y aspartato aminotransferasa (AST); tanto en el grupo pacientes tratados con AVP como en el grupo control (sin tratamiento), se realizó mediante Espectrofotometría de Absorción Molecular utilizando y ajustados al manual de indicaciones y procedimiento analítico del kit de reactivos (Enzimático-UV) para determinación de aminotransferasas de Laboratorios Bioscience C.A., Caracas, Venezuela. A la población de ambos grupos en estudio se les realizó una punción venosa, para obtener 15 mL de sangre total, y luego suero mediante centrifugación a 4000 rpm por 5 minutos (centrifuga Gemmy PLC-05, Taiwan). A partir de suero libre de hemólisis obtenido de cada paciente tratado con AVP; así como de los individuos del grupo control, se tomó 100 µL y se añadieron a 1000 µL de reactivo para la determinación de cada una de las aminotransferasas ALT y AST, respectivamente. Luego de mezclar mediante agitación suave por inversión y dejar reposar 30 segundos a temperatura ambiente (25oC +/ - 2) se procedió a leer la absorbancia a 340 nm, previa calibración del espectrofotómetro (Rayto Rt 1904c Medsinglong Co., Ltd. Guangdong, República Popular China) a cero de densidad óptica con agua destilada. Posteriormente, se realizaron los cálculos individuales de los niveles (U/L) para cada enzima analizada de cada integrante de los grupos en estudio.
Análisis estadístico
Luego de obtener las determinaciones de los niveles de ambas aminotransferasas se procedió a realizar el análisis de los resultados, mediante métodos estadísticos, que dependen del número de muestras tomadas. Los datos cuantitativos se representaron a través de gráficos de puntos o de cajas y bigotes; las frecuencias de los datos cualitativos se mostraron con gráficos de barras o de sectores. Las diferencias entre los datos cuantitativos se evaluaron con medidas de tendencia central y dispersión, comparándolos con las pruebas de Mann Whitney, método de Dunnett y-ANOVA, la significancia estadística se consideró para valores de p < 0.05. Estos análisis estadísticos se realizaron con el programa SPSS versión 21 (IBM Corporation, New York, EE.UU) y el Software estadístico Minita® 20.4, State College, PA, EE.UU., los gráficos con el programa Excel 2010 (Microsoft Corporation, Redmond, CA, EE.UU) y GraphPad Prism versión 5 (GraphPad Software, Inc, La Jolla, CA, EE.UU).
Previo a realizar el análisis one-way ANOVA se ejecutó la prueba de igualdad de variancia o desviaciones estándar para determinar si las poblaciones de dos o más grupos diferentes tienen o no varianzas similares. Se adoptó un nivel de confidencia de los intervalos de confianza simultáneo de Benferroni de 95% para cada grupo. La realización de la prueba se basó en que la distribución de los datos es normal. La hipótesis nula fue que todas las variancias son iguales, la hipótesis alternativa fue que al menos una de las variancias es diferente y se calcularon los valores de p para la prueba de hipótesis. Si el valor p es > 0.05, las diferencias entre las desviaciones estándar no son estadísticamente significativas. Si el valor p es ≤ 0.05, las diferencias entre algunas de las desviaciones estándar son estadísticamente significativas.
Para los análisis estadísticos se agruparon los datos como se muestra en la tabla 1. Con la etiqueta C1 y C2 (Grupos Controles) se agruparon los valores de AST y ALT medidos en 10 individuos no tratados con AVP, con la etiqueta D1 se agruparon pacientes cuyas dosis de AVP recibidas fueron menores a 400 mg y a los cuales se les midió los niveles de AST y ALT, con la etiqueta D2 se agruparon pacientes cuyas dosis de AVP recibidas fueron entre 400-800 mg y a los cuales se les midió los niveles de AST y ALT, con la etiqueta D3 se agruparon pacientes cuyas dosis de AVP recibidas fueron entre 800-2000 mg y a los cuales se les midió los niveles de AST y ALT.
Con la etiqueta C1 y C2 (Grupos Controles) se agruparon los valores de AST y ALT medidos en 10 individuos no tratados con AVP, respectivamente. Con la etiqueta A1 se agruparon pacientes tratados con AVP durante menos de 5 años y a los cuales se les midió los niveles de AST y ALT. Con la etiqueta A2 se agruparon pacientes tratados con AVP durante 5 y 10 años y a los cuales se les midió los niveles de AST y ALT, con la etiqueta A3 se agruparon pacientes tratados con AVP durante 10 y 50 años y a los cuales se les midió los niveles de AST y ALT. Con la etiqueta C2 (Grupo Control) se agruparon los valores de ALT medidos en diez individuos (individuos no tratados con AVP
Con la etiqueta E1 se agruparon pacientes tratados con AVP con edades menores de 5 años y a los cuales se les midió los niveles de AST y ALT, con la etiqueta E2 se agruparon pacientes tratados con AVP con edades entre 5 y 10 años y a los cuales se les midió los niveles de AST y ALT, con la etiqueta E3 se agruparon pacientes tratados con AVP con edades entre 10 y 50 años y a los cuales se les midió los niveles de AST y ALT.
Tabla 1: Variables y parámetros de estudios agrupados e identificados mediante etiquetas específicas
| Factor - Tratamiento | Respuesta | Niveles | Etiquetas |
| Dosis | AST | 4 | C1, D1, D2, D3 |
| ALT | 4 | C2, D1, D2, D3 | |
| Años de tratamiento | AST | 4 | C1, A1, A2, A3 |
| ALT | 4 | C2, A1, A2, A3 | |
| Edad | AST | 4 | C1, E1, E2, E3 |
| ALT | 4 | C2, E1, E2, E3 |
Para determinar cuando los valores medios de grupo son iguales o diferentes del valor medio de otro grupo de datos se realizó la prueba ANOVA de un solo factor a grupos con variancias iguales. La hipótesis nula fue que las medias son iguales, la hipótesis alternativa fue que las medias no son iguales y se calcularon los valores de p para la prueba de hipótesis. Si el valor p es > 0.05, las diferencias entre los valores medios no son estadísticamente significativas. Si el valor p es ≤ 0.05, las diferencias entre los valores medios son estadísticamente significativas. Se asumió un intervalo de confianza bilateral de 95%. Se adoptó el método de Dunnett como procedimiento para comparar los grupos con diferente tratamiento con el grupo de control, mientras que se controla el nivel de confianza simultáneo.
Aspectos Bioéticos
Se siguió la normativa de ética y bioseguridad del Fondo Nacional de Ciencia, Tecnología e Innovación para inclusión de pacientes en investigaciones científicas, siguiendo así los principios éticos para las investigaciones médicas en seres humanos concordantes con la Declaración de Helsinki (Comisión de Bioética y Bioseguridad, 2002). Todos los individuos participantes en el estudio o sus representantes legales otorgaron el consentimiento informado.
Resultados
Fueron analizados y determinados los niveles de AST y ALT de una población total de 48 individuos, 38 del grupo de pacientes tratados con AVP y 10 individuos correspondientes al grupo control (sin tratamiento con AVP). En la figura 2, los puntos muestran los niveles individuales obtenidos para ambas enzimas y las líneas corresponden a la mediana y el rango intercuartílico para cada grupo en estudio.
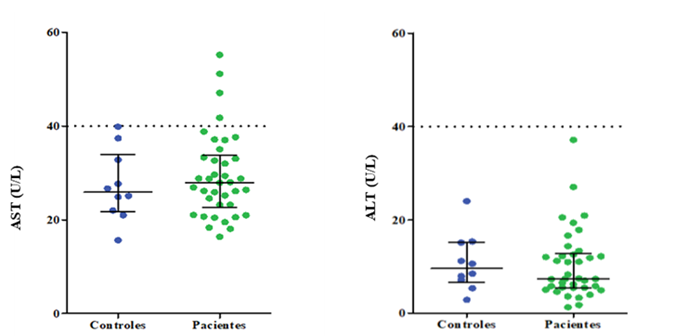
Figura 2: Concentraciones de AST (a) y ALT (b) del grupo control y grupo de pacientes tratados con AVP
Las diferencias entre las medianas se avaluaron con la prueba de Mann Whitney, se obtuvo un valor p = 0.603 para la AST; mientras que para la ALT el valor de p fue de 0.639. La significancia estadística se consideró para valores de p < 0.05. Mientras que la tabla 2 recoge los valores netos obtenidos para las medianas y los rangos intercuartílicos de los niveles enzimáticas en cada grupo en estudio.
Tabla 2: Valores de las medianas y rangos intercuartílicos de los niveles de AST y ALT obtenidos para cada uno de los grupos de estudio.
| Indicador | Controles | Pacientes tratados con AVP | ||
|---|---|---|---|---|
| Mediana | Rango intercuartílico | Mediana | Rango intercuartílico | |
| AST | 26 | 11 | 28 | 12 |
| ALT | 10 | 8 | 7 | 8 |
La tabla 3 muestra los resultados del análisis estadístico ANOVA de un solo factor usando la prueba de Dunnett cuando se contrastan los valores medios de AST y ALT del grupo de control con los valores medios de AST y ALT de los pacientes agrupados según la dosis que han recibido de AVP.
Tabla 3: Contraste entre los valores medidos de AST y ALT del Grupo de control C1 y C2, respectivamente, con los valores medios de AST y ALT de grupos que han recibido diferentes dosis de AVP.
| Contraste entre los valores medidos de AST del Grupo de control C1 y los valores medios de AST de grupos que han recibido diferentes dosis de AVP Agrupamiento de la información usando el método de Dunnett y 95% de confidencia Dosis N Media Agrupamiento* C1 (control) 10 27.16 A D1 16 31.63 A D2 13 31.35 A D3 9 23.82 A |
|---|
| *Los valores medios no etiquetados con la letra A son significativamente diferentes de la media del grupo de control. |
| Pruebas de contraste simultáneo de Dunnett entre los valores medios de AST del grupo de control C1 y los valores medios de AST de grupos que han recibido diferentes dosis de AVP Deferencia de niveles Diferencia de medias Error estándar de las diferencias 95% CI Valor T Valor p ajustado D1 - C1 4.46 3.52 (-4.05, 12.98) 1.27 0.437 D2 - C1 4.19 3.67 (-4.69, 13.08) 1.14 0.518 D3 - C1 -3.34 4.01 (-13.05, 6.36) -0.83 0.729 Nivel de confianza individual = 98.04% |
| Contraste entre los valores medidos de ALT del Grupo de control C2 y los valores medios de AST de grupos que han recibido diferentes dosis de AVP Agrupamiento de la información usando el método de Dunnett y 95% de confidencia Dosis N Media Agrupamiento* C2 (control) 10 10.89 A D1 10 11.38 A D2 14 10.02 A D3 14 9.60 A |
| (Los valores medios no etiquetados con la letra A son significativamente diferentes de la media del grupo de control. |
| Pruebas de contraste simultáneo de Dunnett entre los valore medios de ALT del grupo de control C2 y valores medios de ALT de grupos que han recibido diferentes dosis de AV P Deferencia de niveles Diferencia de medias Error estándar de las diferencias 95% CI Valor T Valor p ajustado D1 - C2 -1.29 3.03 (-8.61, 6.04) -0.43 0.947 D2 - C2 -0.87 3.03 (-8.19, 6.46) -0.29 0.982 D3 - C2 0.49 3.27 (-7.43, 8.40) 0.15 0.997 Nivel de confianza individual = 98.03% |
La figura 3, muestra los resultados del ANOVA mediante pruebas simultáneas de Dunnett para media de nivel - media de control de la AST con un nivel de confianza individual de 98.04% y valor de p = ˃ 0.05; mientras que para la ALT con un nivel de confianza individual de 98.03% y valor de p = ˃ 0.050. La significancia estadística se consideró para valores de p < 0.05.
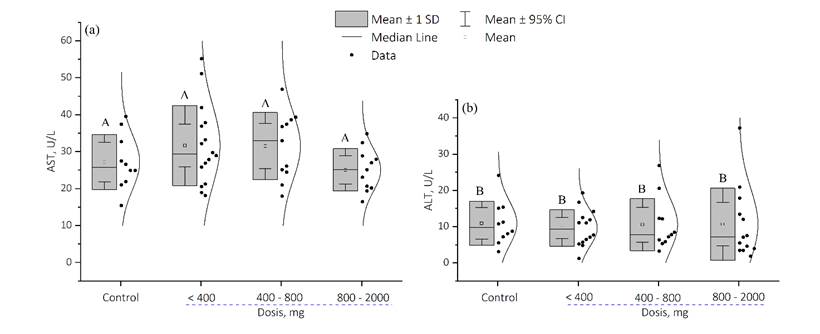
Figura 3: Análisis estadístico de los valores de concentraciones de AST (a) y ALT (b) medidos en el grupo de control y en grupos con diferentes dosis de AVP establecidas clínicamente e individualmente a cada paciente en estudio.
La tabla 4 recoge los resultados de la prueba de ANOVA de un solo factor contrastando los valores medidos de AST y ALT del grupo de control y de los grupos definidos según los años de tratamiento.
Tabla 4: Contraste entre los valores medidos de AST y ALT del Grupo de control C1 y C2, respectivamente, con los valores medios de AST y ALT de grupos con diferentes años de tratamiento con AVP.
Tabla 4: Continuación
| Contraste entre los valores medidos de AST del Grupo de control C1 y los valores medios de AST de grupos con diferentes años de tratamiento con AVP Agrupamiento de la información usando el método de Dunnett y 95% de confidencia Años de tratamiento N Media Agrupamiento C1 (control) 10 27.16 A A1 24 29.86 A A3 8 29.73 A A2 6 27.65 A |
|---|
| * Los valores medios no etiquetados con la letra A son significativamente diferentes de la media del grupo de control Pruebas de contraste simultáneo de Dunnett entre los valores medios de AST del grupo de control C1 y los valores medios de AST de grupos con diferentes años de tratamiento con AVP |
| Deferencia de niveles Diferencia de medias Diferencia de SE 95% CI Valor T Valor P ajustado A1 - C1 2.70 3.36 (-5.46, 10.86) 0.80 0.760 A2 - C1 0.49 4.60 (-10.71, 11.69) 0.11 0.999 A3 - C1 2.57 4.23 (-7.72, 12.85) 0.61 0.875 Nivel de confianza individual = 98.09% |
| Contraste entre los valores medidos de ALT del Grupo de control C2 y los valores medios de ALT de grupos con diferentes años de tratamiento con AVP Años de tratamiento N Media Agrupamiento* C2 (control) 10 10.89 A A2 6 12.86 A A3 8 11.97 A A1 24 9.807 A *Letras iguales indican que no existen diferencias significativas entre las medias de los grupos. |
| Continuación Tabla 4: Contraste entre los valores medidos de AST y ALT del Grupo de control C1 y C2, respectivamente, con los valores medios de AST y ALT de grupos con diferentes años de tratamiento con AVP. Pruebas de contraste simultáneo de Dunnett entre los valore medios de ALT del grupo de control C2 y valores medios de ALT de grupos con diferentes años de tratamiento con AVP Deferencia de niveles Diferencia de medias Diferencia de SE 95% CI Valor T Valor p ajustado A1 - C2 -1.08 2.71 (-7.68, 5.51) -0.40 0.958 A2 - C2 1.97 3.72 (-7.08, 11.02) 0.53 0.912 A3 - C2 1.08 3.42 (-7.23, 9.39) 0.32 0.979 Nivel de confianza individual = 98.09% |
La figura 4, muestra los resultados del ANOVA mediante pruebas simultáneas de Dunnett para el contraste de media de nivel - media de control de la AST con un nivel de confianza individual de 98.09% y valor de p = ˃ 0.05; mientras que para la ALT con un nivel de confianza individual de 98.09% y valor de p = ˃ 0.05. La significancia estadística se consideró para valores de p < 0.05.
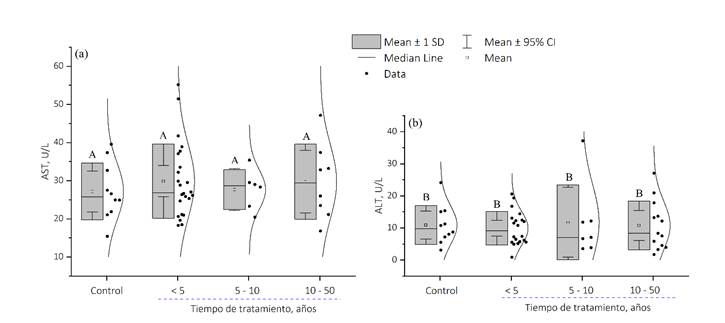
Figura 4: Análisis estadístico de los valores medidos de AST (a) y ALT (b) del Grupo de control C1 y C2, respectivamente, con los valores medios de AST y ALT de grupos con diferentes años de tratamiento con AVP.
La tabla 5 muestra los resultados de la prueba de ANOVA de un solo factor y de Dunnett contrastando los valores medidos de AST y ALT del grupo de control y de los grupos definidos según la edad de los pacientes tratados con AVP.
Tabla 5: Contraste entre los valores medidos de AST y ALT del Grupo de control C1 y C2, respectivamente, con los valores medios de AST y ALT de grupos definidos según la edad de los pacientes tratados con AVP
| Contraste entre los valores medidos de AST del Grupo de control C1 y los valores medios de AST de grupos definidos según la edad de los pacientes tratados con AVP Agrupamiento de la información usando el método de Dunnett y 95% de confidencia Edad N Media Agrupamiento C1 (control) 10 27.16 A E1 10 37.30 B E2 8 30.55 A E3 20 24.72 A |
|---|
| * Los valores medios no etiquetados con la letra A son significativamente diferentes de la media del grupo de control. Continuación Tabla 5: Contraste entre los valores medidos de AST y ALT del Grupo de control C1 y C2, respectivamente, con los valores medios de AST y ALT de grupos definidos según la edad de los pacientes tratados con AVP Pruebas de contraste simultáneo de Dunnett entre los valores medios de AST del grupo de control C1 y los valores medios de AST de grupos definidos según la edad de los pacientes tratados con AVP |
| Deferencia de niveles Diferencia de medias Diferencia de SE 95% CI Valor T Valor P ajustado E1 - C1 10.14 3.35 (2.02, 18.25) 3.03 0.011 E2 - C1 3.39 3.55 (-5.22, 12.00) 0.96 0.650 E3 - C1 -2.44 2.90 (-9.47, 4.58) -0.84 0.727 Nivel de confianza individual = 98.05% |
| Contraste entre los valores medidos de ALT del Grupo de control C2 y los valores medios de AST de grupos definidos según la edad de los pacientes tratados con AVP Edad N Media Agrupamiento C2 (control) 10 10.89 A E2 8 16.86 A E3 20 8.61 A E1 10 8.39 A * Los valores medios no etiquetados con la letra A son significativamente diferentes de la media del grupo de control. |
| Deferencia de niveles Diferencia de medias Diferencia de SE 95% CI Valor T Valor p ajustado E1 - C2 -2.50 2.95 (-9.66, 4.66) -0.85 0.725 E2 - C2 5.97 3.13 (-1.62, 13.57) 1.91 0.151 E3 - C2 -2.29 2.56 (-8.49, 3.92) -0.89 0.693 Nivel de confianza individual = 98.05% |
La figura 5, muestra los resultados del estudio estadístico ANOVA mediante pruebas simultáneas de Dunnett para media de nivel - media de control de la AST con un nivel de confianza individual de 98.05% y valor de p = ˃ 0.05; mientras que para la ALT con un nivel de confianza individual de 98.09% y valor de p = ˃ 0.05. La significancia estadística se consideró para valores de p < 0.05.
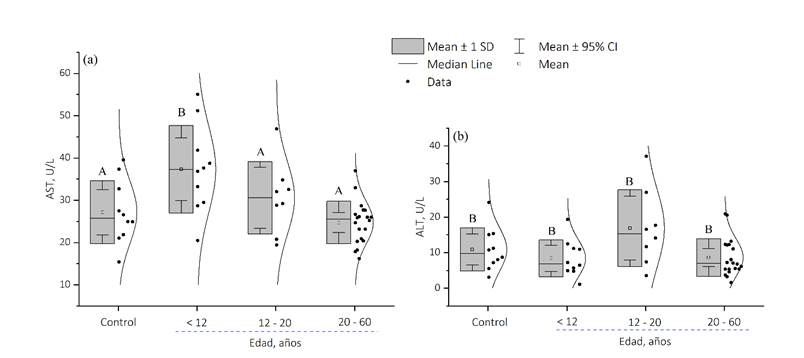
Figura 5: Análisis estadístico de los valores medidos de AST (a) y ALT (b) del grupo de control C1 y C2, respectivamente, con los valores medios de AST y ALT de grupos definidos según la edad de los pacientes tratados con AVP.
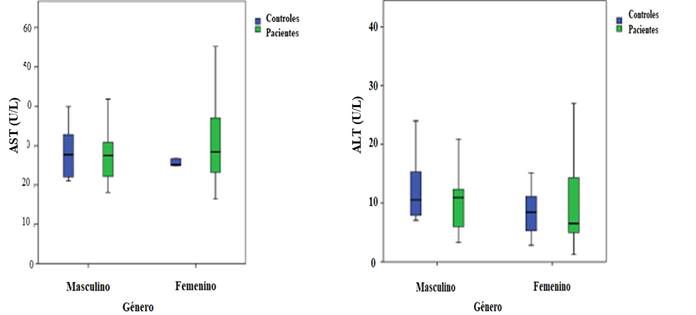
La figura 6 muestra las diferencias entre las medianas de los niveles de las enzimas AST y ALT las cuales se avaluaron mediante la prueba ANOVA de dos vías: Los resultados permitieron determinar para la AST un valor de p = 0.942 entre los géneros de ambos grupos en estudio, y de p = 0.499 entre los géneros de cada grupo en estudio (tanto en el grupo control, como para el grupo de pacientes tratados con AVP). Mientras que las diferencias entre las medianas de los niveles de las enzimas ALT reflejaron un valor de p = 0.269 entre los géneros de ambos grupos en estudio y de p = 0.864 entre los géneros de cada grupo en estudio. La significancia estadística se consideró para valores de p < 0.05.
Discusión
Los resultados obtenidos (figura 2) indican que tanto los individuos del grupo control como el grupo de pacientes tratados con AVP, muestran niveles de AST y ALT dentro del rango de referencia establecido por el método analítico utilizado (hasta 40 U/L). Con excepción de cuatro pacientes tratados con AVP en edades comprendidas entre 1-14 años, donde se evidencia un ligero aumento de la AST alcanzando concentraciones máximas de 60 U/L. Este incremento en los niveles séricos de la AST se explica debido a que en recién nacidos y niños hay mayor permeabilidad del hepatocito, por lo que aumenta la liberación al torrente sanguíneo de las diferentes sustancias producidas por estas células, entre ellas las aminotransferasas que llegan a alcanzar concentraciones de hasta 65 U/L y también debido al uso de medicamentos asociados con toxicidad (Costaguta & Álvarez, 2014; Mejías & Ramelli, 2006). Sin embargo, los niveles de la ALT en ambos grupos en estudio se encuentran dentro del rango de referencia establecido para el método analítico; aun cuando las ALT son producidas específicamente por las células hepáticas a diferencia de la AST (Costaguta & Álvarez, 2014). Los valores de las medianas y los rangos intercuartílicos de los niveles de enzimáticas obtenidos para cada uno de los grupos de estudio (Tabla 2) y el análisis estadístico sugieren que no existen diferencias estadísticamente significativas entre las medianas de los niveles de las AST y ALT de los grupos en estudios ya que arrojaron valores de p > 0.05. Resultados que parecen indicar la ausencia de inducción por AVP de algún tipo de reacción sobre el metabolismo enzimático hepático dependiente de las aminotransferasas; aun cuando, se ha descrito ampliamente su efecto hepatotóxico (Cano et al., 2017) y por tanto, sus consecuencias sobre el metabolismo enzimático hepático.
Por otra parte, en la figura 3 se evidenció como los niveles de la AST en los pacientes tratados con AVP disminuyen ligeramente en la medida que las dosis del medicamento aumentan; tendencia contraria a la descrita para medicamentos considerados tóxicos o hepatotóxicos (Cano et al., 2017; Costaguta & Álvarez, 2014); sin embargo, esta tendencia en los niveles de la AST no presentaron significancia estadística y los niveles se mantuvieron dentro del rango establecido como referencia para este analito. Mientras que, los niveles de la ALT fluctúan dentro de los valores de referencia independientemente de las dosis de AVP con la cual son tratados clínicamente los pacientes, y por tanto sin presentar diferencias estadísticas significativas que sugieran alguna relación estadística con las diferentes dosis de AVP sobre los niveles séricos establecidos para las enzimas AST y ALT en los pacientes en estudio.
Así mismo, al contrastar el tiempo de tratamiento (expresado en años) con AVP y los niveles enzimáticos de AST y ALT (Figura 4); se observa como los niveles de ambas enzimas se mantienen dentro los rangos de referencia pero con una tendencia a disminuir cuanto mayor es el tiempo de tratamiento con AVP; exceptuando cuatro pacientes en edades comprendidas entre 1-14 años, los cuales mostraron concentraciones de AST que sobrepasan los valores de referencia; mientras que los niveles de ALT se mantienen dentro de los parámetros considerados normales. Así mismo, en el análisis estadístico con la prueba de Dudannett sugiere que no existen diferencias significativas entre el tiempo de tratamiento con AVP y los niveles enzimáticos, ya que los valores de p son > 0,05 para ambas enzimas. Por otra parte, el estudio evidencia que en tres pacientes, cuyo tiempo de tratamiento con ácido valproico es de entre 15 y 90 días, se determinaron concentraciones de ambas enzimas dentro de los valores referencia; en contradicción con reportes previos que señalan que el tiempo desde el inicio de la terapia con una droga hasta la aparición del daño hepático agudo, está en el rango entre 5 y 90 días (Cavalieri & D’Agostino, 2017); sobre todo, sí se tiene en consideración la hepatotoxicidad atribuida al AVP (Cano et al., 2017).
Paralelamente, el análisis estadístico de los niveles de las enzimas en estudio y la edad de los pacientes tratados con AVP (Figura 5), sugiere que los niveles de la enzima AST disminuyen progresivamente y con significancia estadística a medida que la edad de los pacientes aumenta. Esto se explica debido a que el hígado experimenta una reducción del peso y del volumen del 24 al 37%, debido a la disminución del número de hepatocitos, a pesar de que, para compensar esta pérdida, los hepatocitos aumentan su tamaño. Este fenómeno se ha denominado atrofia senil y se atribuye a una disminución de la capacidad regenerativa de las células que mueren al finalizar su ciclo vital. Este proceso se inicia alrededor de los 50 años y se intensifica a medida que progresa la edad (Bruguera, 2014). Mientras que, los niveles de la ALT se observan distribuidas dentro de sus valores de referencia, pero con tendencia a disminuir ligeramente conforme aumenta la edad de los pacientes estudiados.
Las diferencias entre las medianas de los niveles enzimáticos de la AST y la ALT en relación al género de la población en estudio (Figura 6), mostraron que los niveles de las enzimas en ambos géneros están dentro del rango de referencia, con las excepciones de los cuatro pacientes (niños de ambos géneros entre 1-14 años), donde determinaron concentraciones elevadas de AST hecho justificado previamente. A su vez, se puede determinar que las medianas de ambos géneros en el grupo de pacientes tratados con AVP y las medianas de ambos géneros en el grupo control son similares entre sí. Tendencia que se corroboró mediante la prueba ANOVA de dos vías, permitiendo establecer que no existen diferencias estadísticamente significativas en los niveles enzimáticos entre en los géneros tanto intra grupo como entre grupos de la población estudiada. Estos resultados difieren de estudios previos (Cano et al., 2017), donde se reporta al género femenino (con un amplio rango de edad) como principal factor de riesgo de sufrir hepatotoxicidad por fármacos. No obstante, los resultados concuerdan con el estudio previo en el que se establece que no observaron diferencias entre géneros, con respecto al desarrollo de reacciones adversas como respuesta al tratamiento con AVP(Gómez-Oliván, Martínez, Chamorro, & Téllez, 2005).
Finalmente, los resultados obtenidos en este estudio exploratorio permiten señalar que no se determinaron diferencias estadísticamente significativas entre los niveles de ninguna de las aminotransferasas (AST y ALT) del grupo de pacientes tratados con AVP y del grupo control. Datos que permiten indicar que la acción farmacológica del AVP no reveló la inducción de alguna reacción intrínseca o idiosincrática sobre el metabolismo enzimático hepático dependiente de las aminotransferasas; poniendo en evidencia la dificultad descrita para establecer el diagnóstico y la incidencia real de hepatotoxicidad por medicamentos (Fernández, 2015); incluso para aquellos previamente descritos o relacionados con este y otros tipos de alteraciones metabólicas, entre ellos el AVP (Cano et al., 2017; Fajardo et al., 2013).
Conclusión
Los niveles de ALT y ASP en los pacientes tratados con AVP no mostraron diferencias estadísticamente significativas con respecto a los niveles determinados en el grupo control (individuos no tratados con AVP) y en ambos grupos los niveles enzimáticos permanecieron dentro de los niveles de referencia para el método analítico. Por tanto, es pertinente realizar nuevos y más amplios estudios que permitan corroborar o no la hepatotóxicidad atribuida al AVP y su influencia directa sobre el resto de los marcadores de funcionamiento hepático.
Contribución de los autores
En concordancia con la taxonomía establecida internacionalmente para la asignación de créditos a autores de artículos científicos (https://casrai.org/credit/). Los autores declaran sus contribuciones en la siguiente matriz: