Introducción
La química organometálica constituye, dentro del área de la química inorgánica, un campo muy fértil para la investigación y el desarrollo, especialmente si se toma en cuenta que la catálisis homogénea (Crabtree, 2019; Cotton, Wilkinson, Murillo, & Bochmann, 1999; Parshall, 1992), tanto la tradicional como sus modificaciones (catálisis asimétrica (Jacobsen, 2011), catálisis híbrida o por transferencia de fase (Sharma, 2020), basan sus procedimientos en la utilización de catalizadores que, en su gran mayoría, son compuestos organometálicos. Luego, la industria farmacéutica, de los agroquímicos, y la importante industria de los polímeros o los surfactantes, que entran en el área de lo que se conoce como química fina (Beller & Blaser, 2012), utilizan compuestos organometálicos en alguno o varios de sus procesos.
En tal sentido, muy temprano en la década de 1950, pero especialmente a partir de la década de 1960, se vienen realizando pruebas catalíticas sobre la inmensa mayoría de los compuestos organometálicos que eran el resultado de la investigación básica en los laboratorios de química inorgánica. Es así como se empezaron a estudiar compuestos de iridio(I), que comenzaron a presentar excelentes propiedades catalíticas. Entre los compuestos que llamaron la atención se encontraban los organoiridio del tipo [IrH2Cl2(PPh3)3] (Vaska, 1961), que tenían además del hidruro y el cloruro, ligandos fosfinados tipo trifenilfosfina (PPh3). En esta familia de organometálicos aparece el trans-[IrCl(CO)(PPh3)2], sintetizado hace sesenta años por el químico estonio-estadounidense Lauri Vaska en estrecha colaboración con el químico ítalo-estadounidense John W. DiLuzio, en el Instituto Mellon de Investigación (Universidad Carnegie Mellon) de Pittsburg, Pensilvania, EE.UU.
Lauri Vaska (1925-2015), nació en Estonia y, finalizada la Segunda Guerra Mundial, realizó estudios de pregrado en Alemania, primero en Hamburgo y finalmente en la Universidad de Göttingen, donde obtuvo el Bachelor of Science en 1949 (Kirss, 2013). Una vez que emigró a los Estados Unidos, comenzó sus estudios de doctorado en la Universidad de Texas entre 1952 y 1956, bajo la supervisión del Prof. George W. Watt, en el área de química inorgánica. En 1957 ingresó a la planta profesoral del Instituto Mellon, que se transformaría más tarde en la Universidad Carnegie Mellon de Pittsburg, donde desarrolló una línea de investigación en la química de coordinación de los metales de transición de los grupos 8 y 9 de la tabla periódica. En el marco de esta línea de investigación, Lauri Vaska sintetizó varios complejos de iridio(I) que, para ese momento, comenzaban a tener especial interés académico y, a comienzos de la década de 1960, Vaska y DiLuzio publicaron en la prestigiosa revista de la Sociedad Americana de Química, la síntesis del trans-clorocarbonilbis(trifenilfosfina-κP)iridio(I), trans-[IrCl(CO)(PPh3)], un complejo organoiridio diamagnético, no electrolito y estable al aire (Vaska y DiLuzio, 1961), figura 1, que, a finales de 1967, ya era conocido simplemente como el “complejo de Vaska” (Bellucco, Croatto, Uguagliati, & Pietropaolo, 1967).
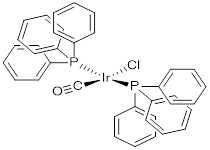
Figura 1 : Estructura del complejo de Vaska trans-clorocarbonilbis(trifenilfosfina-κP)iridio(I), trans-[IrCl(CO)(PPh3)2] (Vaska y DiLuzio, 1961), disponible comercialmente según la referencia Chemical Abstracts [CAS]: 14871-41-1, Sigma-Aldrich: 20,348-3 y Strem: 77-0300.
En el campo de los compuestos organoiridio, ocupa un destacado lugar el catalizador de Crabtree (Contreras, Urbina-Gutiérrez, & Rodríguez-Sulbarán, 2020), (η4-cicloocta-1.5-dieno)(piridina-κN) (triciclohexilfosfina-κP)iridio(I), y, en general, en el área de la catálisis homogénea con metales de transición (Contreras, 2020), varios complejos plano cuadrados de iridio(I) o de rodio(I), entre los cuales destaca el catalizador de Wilkinson, clorotris(trifenilfosfina-κP)rodio(I) (Contreras, Cardozo, & García-Molina, 2017). Todos estos catalizadores tienen una comprobada actividad catalítica en la hidrogenación selectiva de olefinas (Dickson, 1985), una reacción que tiene un alto interés en el área de la química fina.
En el presente artículo, se ha hecho un esfuerzo por ordenar, de manera sistemática y simplificada, la información más relevante reportada en las principales revistas del área de la química inorgánica, de coordinación, organometálica y afines, entorno al complejo de Vaska, en marco del sexagésimo aniversario de su descubrimiento. Esta revisión confirma la importancia de este compuesto, cuyas aplicaciones superan el ámbito de la química organometálica, y se extienden a otras áreas de la química e incluso a la nanotecnología (Schmid, Waser, & Krug, 2012), lo que indica con claridad que este compuesto organoiridio, y sus análogos del tipo trans-[IrX(CO)L2], seguirán ocupando un lugar significativo en la investigación y el desarrollo, tanto en el campo de la química inorgánica, así como en bioorganometálica (Contreras, Aranguren, Bellandi, & Gutiérrez, 2012) y la nanoquímica (Contreras & Cardozo, 2015).
Metodología
Este artículo desarrolla una investigación cualitativa-documental sobre la importancia de los complejos organoiridio, especialmente el “complejo de Vaska” y algunas de sus aplicaciones, en el campo de la catálisis y en otras áreas emergentes. Se utilizaron bases de datos reconocidas en el área de la investigación y el desarrollo (I+D), tales como: ScienceDirect, ACS Publications, Chemical Abstracts (SciFinder), SCOPUS, Web of Science (ISI web) y los catálogos digitales de Strem Chemicals y Sigma-Aldrich (Merck KGaA), usando como entrada (palabra clave): “Vaska´s complex”, “Vaska´s compound” “metallic complexes”, “organoiridium complexes”, “coordination chemistry”, “catalysis”, y otros términos relacionados con el área de la catálisis homogénea con compuestos organoiridio. Se empleó como rango el período 1961-2019, tomando como referencia inicial el trabajo publicado en 1961 por Lauri Vaska y John W. DiLuzio en la revista de la Sociedad Americana de Química, que es citado como punto de partida para el complejo de Vaska (Vaska & DiLuzio, 1961). Haciendo un muestreo en Chemical Abstracts (SciFinder), y luego de aplicar los criterios, se encontraron 284 artículos relacionados directamente con el complejo de Vaska, su síntesis, caracterización y aplicaciones.
Resultados y Discusión
Síntesis del complejo de Vaska
Inicialmente, el complejo se reportó como el resultado de la reacción entre el hexacloroiridiato(IV) de amonio, [IrCl6](NH4)2, o en su defecto, el tricloruro de iridio(III) trihidratado [IrCl3•3H2O], en un exceso de trifenilfosfina (10 a 20 mol). La mezcla de reactantes, en atmósfera inerte de nitrógeno, fue disuelta en diferentes alcoholes de alto peso molecular, agitada y mantenida en reflujo hasta obtener un sólido de color amarillo-verdoso. Las temperaturas y el rendimiento reportados fueron las siguientes: solución acuosa de 2-(2-metoxietoxi)etanol, 190 °C, 2 h, 86%; etilenglicol, 190 °C, 7 h, 75%; dietilenglicol, 240 °C, 2 h, 76%; trietilenglicol, 270 °C, 4 h, 83%; figura 2a, (Vaska & DiLuzio, 1961).
Más adelante, se realizaron modificaciones al procedimiento original cambiando el disolvente por dimetilformamida (DMF), que es una conveniente fuente de monóxido de carbono (Serp, Hernández, & Kalck, 1999), aportando un nuevo método para síntesis del complejo de Vaska, ver figura 2b (Collman & Kang, 1967). En las nuevas condiciones de reacción se vuelve a utilizar un ligero exceso de trifenilfosfina (1:3, hasta 1:5) y, si bien es cierto aumenta el tiempo del reflujo hasta 12 h, disminuye la temperatura por debajo de los 160 °C y aumenta el rendimiento hasta el 90%.
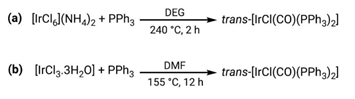
Figura 2 : Métodos clásicos de síntesis del complejo de Vaska. (a) Método por Vaska & DiLuzio (1961), DEG = dietilenglicol. (b) Método por Collman & Kang (1967), DMF = dimetilformamida. Ambos métodos fueron estandarizados y están reportados en el Inorganic Syntheses (Vrieze et al., 2007).
El monóxido de carbono como ligando y el enlace por retrodonación
El monóxido de carbono es uno de los ligandos organometálicos por excelencia, y conforma una importante familia de compuestos conocida como “carbonilos metálicos”, donde existe uno o más enlaces metal-carbono (M‒CO) (Contreras, 2014). A pesar de que la gran mayoría de los carbonilos metálicos están descritos para metales de transición, existen carbonilos de cationes de lantánidos y de actínidos (Cotton, 2006), que poseen una configuración electrónica con electrones 4f o 5f, respectivamente y, de elementos del Grupo 13, por ejemplo, carbonilos de boro(III) (Skancke & Liebman, 1994). Los carbonilos mononucleares pueden ser octaédricos, tipo M(CO)6, cuando M = Ti, V, Cr, Mo, W, o bipirámide trigonal, tipo M(CO)5, con simetría D3h, especialmente con M = Fe, Ru, Os. También pueden ser tetraédricos como en el caso del Ni(CO)4, cuya historia es citada recurrentemente en la literatura, debido a la toxicidad observada durante el procesamiento industrial del níquel (Fochi, 1999). En los carbonilos polinucleares, de fórmula general M2(CO)n, y sobre la base de la regla de los 18 electrones, se pueden postular dos tipos de arreglos (Mitchell & Parish, 1969): 1) que los metales se encuentren enlazados entre sí, razón por la cual solamente se observan carbonilos terminales, o, 2) que tengan los carbonilos en puente, μ n -CO, en cuyo caso no es necesario un enlace metal‒metal. Se puede inferir que, mientras mayor sea el radio del metal de transición, menos probable es que se produzca la situación con carbonilos en puente. En tal sentido, a medida que nos movemos en la primera serie de transición, el Mn2(CO)10 (Coville, Stolzenberg & Muetterties, 1983) no posee carbonilos en puente, mientras que el Co2(CO)8 (Absi-Halabi, Atwood, Forbus, & Brown, 1980) los tiene en estado sólido. Por su parte, el Fe2(CO)9 (Cotton & Troup, 1974) cumple con la regla de los 18 electrones, y tiene tres carbonilos en puente, además de un enlace Fe‒Fe. En el caso de los carbonilos polinucleares más complejos, donde los metales de transición forman arreglos denominados cúmulos o “clusters” metálicos (Calderazzo, 2005), se observa la formación de arreglos geométricos en los cuales el átomo metálico casi siempre cumple con la regla de los 18 electrones, con la excepción del Rh6(CO)16, el cual tiene un carbonilo en triple puente (μ3-CO) (Dyson & McIndoe, 2000). Los compuestos M3(CO)12 son comunes para los elementos del Grupo 8 (Ellis, 2003), tanto los homometálicos, como los mixtos o heterometálicos tipo FeRu2(CO)12 o Fe2Os(CO)12, y los compuestos tipo M4(CO)12 son comunes para los elementos del Grupo 9 y donde se incluyen los carbonilos binarios más estables, que se forman preferencialmente con rodio e iridio. También se conocen carbonilos M5(CO)12 como el [Ni5(CO)9(μ-CO)3] (Beattie, Masters, & Meyer, 1995) con un arreglo de bipirámide trigonal y el carburo carbonilo de hierro Fe5(C)(CO)15, que posee un carbono intersticial μ5-C. Los cúmulos mayores tipo M6(CO)16 se forman también con metales del Grupo 9 (Wender & Pino, 1968), cuyo ejemplo más representativo es el Rh6(CO)16, que adquiere un arreglo octaédrico de átomos metálicos, con dos carbonilos terminales en cada átomo metálico, y cuatro carbonilos en triple puente, μ3-CO, ocupando cuatro caras del octaedro.
La primera interacción conducente a un enlace químico entre el monóxido de carbono y un metal de transición, M-CO, se produce cuando el monóxido de carbono (CO) coordina al metal utilizando el orbital σ-HOMO centrado en el átomo de carbono, y los orbitales de simetría adecuada dσ (dz 2 o dx 2 -y 2) del metal de transición. Si embargo, no se puede perder de vista que el metal de transición dispone, al mismo tiempo, de los orbitales dπ ocupados (dxy, dxz o dyz), que también pueden solaparse con el orbital de baja energía π-LUMO del CO, una interacción que conduce a la formación de lo que se conoce como “enlace por retrodonación” (Montgomery, 2007), tal como se muestra en la figura 3.
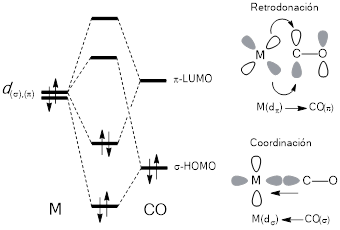
Figura 3 : Diagrama de orbitales moleculares del enlace sigma metal‒carbonilo y el enlace por retrodonación.
El sistema de enlace en los carbonilos metálicos, implica que el monóxido de carbono no sólo dona dos electrones por coordinación, sino que también, y al mismo tiempo, recibe dos electrones del metal, estabilizando así el enlace M‒CO y debilitando la fuerza del triple enlace, en comparación con el monóxido de carbono libre (-)꞉C≡O(+). Se puede llegar a decir que, debido al mecanismo de retrodonación, el enlace metal-carbonilo posee un carácter de “doble enlace parcial” y, por lo tanto, se ve fortalecido en comparación a un simple enlace de coordinación (Yves, 2005). Así mismo, el mecanismo de retrodonación aumenta la energía de enlace metal-ligando, cuando el metal (rico en electrones) tiene un orbital HOMO alto en energía, y cuando el ligando posee un orbital LUMO bajo en energía que, adicionalmente, posee una simetría adecuada para retrodonar. La posibilidad de que ocurra una retrodonación en un carbonilo metálico es altamente dependiente del estado de oxidación del metal de transición, y del tipo o naturaleza del ligando. Por ejemplo, la frecuencia a la cual ocurre el estiramiento v(CO) en los espectros de infrarrojo de los carbonilos metálicos decrece de la siguiente manera: [Ni(CO)4] (2060 cm-1) > [Co(CO)4]1- (1890 cm-1) > [Fe(CO)4]2- (1790 cm-1) (Nakamoto, 2009), lo cual indica que decrece la fuerza del enlace a medida que disminuye el estado de oxidación.
Estructura de rayos x del complejo de Vaska y análogos
Uno de los mejores estudios dirigidos a la determinación de la estructura de rayos X del complejo de Vaska fue realizado por Melvyn Rowen Churchill en la Universidad del Estado de Nueva York, Buffalo, EE.UU., quien en 1988 alcanzó a resolver varios problemas en el análisis estructural, y presentar la estructura del trans-[IrCl(CO)(PPh3)2], que cristalizó en un grupo espacial centrosimétrico triclínico P1, con parámetros de celda a: 9.2076(10); b: 9.6458(16); c: 10.4601(11); α: 72,290(11)°; β: 89.597(10)°; γ: 69.568(11)°; V: 824.17 Å3 y Z = 1 (Churchill, Fettinger, Buttrey, Barkan, & Thompson, 1988). En esta estructura, que se puede observar en la figura 4, la posición de los ligandos no fosfinados, es decir, el cloruro y el monóxido de carbono, fue determinada con suficiente precisión, y las distancias metal ligando observadas fueron las siguientes: Ir-P: 2,330(1) Å; Ir-Cl: 2,382(3) Å; Ir-CO: 1.791(13) Å, con un típico C-O: 1.161(18) Å. Los ángulos observados para la esfera de coordinación del iridio(I) fueron: P-Ir-Cl: 87.75°; P-Ir-CO: 90.81° y Cl-Ir-CO: 178.08°.
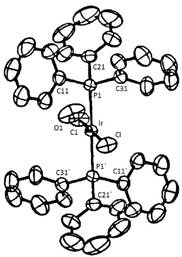
Figura 4 : Estructura molecular (diagrama ORTEP) del complejo de Vaska trans-clorocarbonil-bis(trifenilfosfina-κP)iridio(I), determinada a partir de datos de difracción de rayos X por Churchill et al., 1988.
Para efectos de este trabajo, se realizó el modelaje de la estructura del complejo de Vaska, ver figura 5, a partir de herramientas de la química computacional, optimizando mediante la teoría del funcional de la densidad (DFT por sus siglas en inglés) (Harvey, 2018). En este caso se utilizó el funcional EDF2, con el conjunto base 6-31G**, y el pseudopotencial LANL2DZ para el átomo de iridio (utilizando el software Wavefunction Spartan 14’). Los parámetros energéticos se obtuvieron realizando el cálculo de un punto singular de energía con el método semiempírico PM7 (empleando MOPAC2016). Los parámetros energéticos obtenidos fueron los siguientes: ΔHf° = 355.35888 kcal/mol; energía del orbital HOMO: -4.931 eV; energía del orbital LUMO: -0.545 eV. Las distancias de enlace calculadas obtenidas fueron: Ir-P: 2,358 Å (iguales para P(1) y P(2)); Ir-Cl: 2,425 Å; Ir-C(1)O: 1.827 Å. Los ángulos obtenidos para la esfera de coordinación del iridio(I) fueron: P-Ir-Cl: 87.9°; P-Ir-C(1)O: 92,3° y Cl-Ir-C(1)O: 175.0°; P(1)-Ir-P(2): 174.7. El ángulo cónico de Tolman (TAng) se calculó como el promedio de los ángulos formados entre el hidrógeno perteneciente al carbono para- (de los sustituyentes fenilo) respecto a P(1) o P(2), y el átomo de iridio(I), el valor calculado fue de 113.7°.
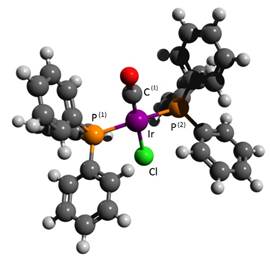
Figura 5 : Estructura de mínima energía optimizada para el complejo de Vaska utilizando química computacional (EDF2/6-31G**/LANL2DZ).
Como puede observarse, existe una muy buena correlación en cuanto a las distancias y ángulos de enlace calculados, respecto a los reportados por Churchill et al., 1988. La diferencia energética en los orbitales de frontera (HOMO/LUMO), ubica al complejo de Vaska, y especialmente a su centro metálico, dentro de la categoría de los ácidos blandos, de acuerdo a la escala de ácidos duros y blandos de Pearson (Pearson, 1997), razón por la cual se justifica que el iridio(I), con esa esfera de coordinación, sea susceptible de experimentar reacciones de inserciones de olefinas o ligandos que sean buenos donadores-σ y mejores aceptores-π por retrodonación.
Es menester señalar que, previo al estudio de Churchill et al., 1988, el propio Vaska comenzó a realizar estudios en compuesto análogos al trans-[IrCl(CO)(PPh3)2], cuya principal estrategia consistía en utilizar fosfinas modificadas con diferentes grupos funcionales o análogos de rodio(I). En tal sentido, se ha reportado la estructura del trans-clorocarbonilbis(tri-o-tolilfosfina-κP)iridio(I), ver figura 6a (Brady et al., 1975). Más recientemente, se determinó la estructura del trans-[Ir(1-2,5-η2-CH2(CH)3SO2-κS) (CO)(PPh3)], donde el cloro fue sustituido por el ligando soluble dihapto butanodienosulfonil 1-2,5-CH2(CH)3SO2, figura 6b (Sánchez-Sánchez, Castillo-García, Cervantes-Vásquez, Ortiz-Pastrana, & Paz-Sandoval, 2019). En este extenso trabajo, se realizó la sustitución de las trifenilfosfinas por PMe3 o PMePh2 (Me = -CH3), y se determinaron, por difracción de rayos X, todas las correspondientes estructuras de los compuestos análogos. La introducción del ligando butanodienosulfonil introduce un cambio en la solubilidad del compuesto, lo cual es especialmente importante para la catálisis por transferencia de fase, y, por otro lado, el cambio del tipo de fosfina introduce modificaciones en el ángulo de cono Tolman (Müller & Mingos, 1995), y, en consecuencia, induce modificaciones de naturaleza estérica que, generalmente, modifican la selectividad cuando estos compuestos organoiridio son utilizados como catalizadores. En este orden de ideas, se reportó un complejo donde se utiliza el ligando triciclohexilfosfina (referencia Chemical Abstracts [CAS]: 2622-14-2, Sigma-Aldrich: 26.197-1 y STREM: 15-6150), PCy3, una de las fosfinas con mayor ángulo de cono, que aparece formando parte del catalizador de Crabtree, figura 6c, (Grobbelaar, Lötter, Visser, Conradie, & Purcell, 2009). La estructura fue determinada por rayos X, encontrando que las distancias Ir-CO, Ir-Cl y Ir-P son, respectivamente, 1.778(10) Å, 2,374(3) Å y 2,3486(8) Å, En este caso, la triciclohexilfosfina puede aportar un efecto no solo estérico sino electrónico (Moers, De Jong, & Beaumont, 1973), muy adecuado para dirigir la selectividad en reacciones catalíticas de hidrogenación.
Adicionalmente, se ha determinado por rayos X la estructura del aducto dioxigenado del complejo de Vaska, [IrCl(CO)(O2)(PPh3)2], figura 6d, (Weininger, Griffith, Sears, & Amma, 1982), una especie que es muy importante a los efectos de realizar estudios mecanísticos en reacciones catalíticas, por ejemplo, en la reacción de olefinación o reducción de aldehídos (Lebel & Ladjel, 2008). La longitud del enlace O-O se determinó en 1.47(1) Å, y las distancia del enlace Ir(η2-O2) son, respectivamente, Ir-O(3): 2,04(3) Å, e Ir-O(4): 2,09(3) Å (Lebel, Ladjel, Bélanger-Gariépy, & Schaper, 2008).
Un caso interesante es el complejo de Vaska sintetizado utilizando la ferrocenil-trifenilfosfina, una fosfina que, conteniendo en su estructura como sustituyente una molécula de ferroceno, aporta al complejo estabilidad, además de un interesante efecto estérico y electrónico, produciendo un novedoso organoridio carbonilcloro(ferrocenil-trifenilfosfina-κP)iridio(I), figura 6e (Muller & Otto, 2011). Este complejo cristaliza en un sistema triclínico, P1, con los siguientes parámetros de celda: a = 9.436(5) Å, b = 12,978(5) Å, c = 18.091(5) Å, α = 107.903(5)°, β = 96.269(5)°, γ = 95.225(5)°, y un V = 2077.3(15) Å3, que es 2,5 veces superior al volumen del propio complejo de Vaska.
Siguiendo la metodología de hacer cambios en la esfera de coordinación de los complejos tipo Vaska, especialmente en relación al tipo de ligandos organofosforados, se reportó la caracterización por rayos X de los compuestos trans-[IrCl(CO)(PH t Bu2)2] y [IrCl(PH t Bu2)3] (Böttcher, Graf, & Merzweiler, 1997), donde But 2PH es la fosfina secundaria di-ter-butilfosfina. Así mismo, la reacción del complejo de Vaska con el ligando nitrogenado bidentado bencildiimina (H2BID), C6H5-(HN=)C-C(=NH)-C6H5, genera el complejo pentacoordinado [Ir(CO)(H2BID)(PPh3)2]Cl, con una geometría tipo pirámide de base cuadrada, cuya estructura de rayos X indica las siguientes distancias de enlace: Ir-N(1): 1.994(2) Å; Ir-N(2): 2,032(2) Å; Ir-C(15)O: 1.872(3) Å; Ir-P(1): 2,350(9) Å y Ir-P(2): 2,327(10) Å (Haque, Neumann, Roedel, & Lorenz, 2010). El ligando H2BID, de manera similar al 2,2´-bipiridilo y al 1.10-fenantrolina, aporta en la esfera de coordinación del iridio(I) un efecto electrónico muy característico que modifica sus propiedades frente a reacciones que involucran procesos de oxidorreducción.
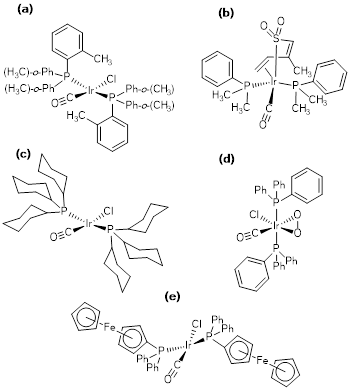
Figura 6 : Complejos de iridio(I) análogos al complejo de Vaska con estructuras determinadas utilizando rayos X de monocristal. (a) Trans-clorocarbonilbis(tri-o-tolilfosfina-κP)iridio(I) (Brady et al., 1975). (b) Trans-[Ir(1-2,5-η2-CH2(CH)3SO2-κS)(CO)(PPh3)] (Sánchez-Sánchez et al., 2019). (c) Trans-clorocarbonilbis(triciclohexilfosfina-κP)iridio(I) (Grobbelaar et al., 2009). (d) Clorocarbonil(η2-dioxo)(trifenilfosfina-κP)iridio(I) (Weininger et al., 1982). (e) Carbonilcloro(ferrocenil-trifenilfosfina-κP)iridio(I) (Muller & Otto, 2011).
Con la finalidad de obtener complejos análogos al complejo de Vaska, pero introduciendo ligandos que aportan efectos dirigidos a controlar la selectividad en reacciones catalíticas homogéneas, se ha hecho reaccionar el trans-clorocarbonil-bis(trifenilfosfina-κP)iridio(I) con aniones alquil-pirazolato, alquil-pz-, figura 7, y, por ejemplo, se obtuvo el complejo trans-carbonil(3.5-(CF3)2-pz-κN)bis(trifenilfosfina-κP)iridio(I), con distancia de enlace: Ir-N(1): 2,079 Å; Ir-CO: 1.811(7) Å; Ir-P(1): 2,328(2) Å; Ir-P(2): 2,336(2) Å (Bandini et al., 1984).

Figura 7 : El anión alquil-pirazolil (3.5-R2-pz-) y tres de las posibles formas de coordinar un metal de transición (M). R = grupo alquilo (-CH3 o CF3).
Un extenso grupo de complejos de la familia del clorobis(trifenilfosfina-κP)iridio(I) ha sido sintetizada y suficientemente caracterizada y, dentro de este grupo, se han reportado varias estructuras plano cuadradas, entre ellas la estructura de rayos X del trans-[IrCl(η2-C2H2)(PPh3)2] (Restivo, Ferguson, Kelly, & Senoff, 1975), donde un etileno coordinado le confiere importancia a los efectos de realizar estudios cinéticos y catalíticos. Moléculas más complejas, que tienen como punto de partida al complejo de Vaska, también han sido objeto de varios estudios estructurales. En tal sentido, se determinó la estructura de un complejo hierro(0)-iridio(I) con carbonilos y fosfinas en puente, el [FeIr(μ-CO)(CO)4(μ-P t Bu2)(PH t Bu2)], con un enlace Fe-Ir de 2,624 Å (Böttcher, Graf & Merzweiler, 1996), un interesante ejemplo de la capacidad de los metales de transición para formar compuesto heterobimetálicos.
Adicionalmente, en la literatura científica se encuentra reportada la estructura de rayos X de muchos otros compuestos análogos al complejo de Vaska. En ellas se observa la sustitución de los ligandos, empezando por el cloruro, o incorporando nuevos ligandos tales como: el ligando dihapto tiocarboxamida (η2-SCN(CH3)2) (Gal, Ambrosius, van der Ploeg, & Bosman, 1978; Dean, 1980); el metoxilo (-OCH3-κO) y el diapto tetracianoetileno, TCNE, (η2-(CN)2C=C(CN)2) (Janik, Bernard, Churchill, & Atwood, 1987); la tris(2,4,6-trimetoxifenil)fosfina-κP (Dunbar, Haefner, Uzelmeier, & Howard, 1995), el ligando bidentado 2-(difenilfosfino)piridina-κ 2 N,P, PPh2py (Franciò et al., 1998); una tris(o-dimetilarsinofenil)arsina-κAs (Hill, Levason, Preece, & Frampton, 1997); el fluorobencenotiolato-κS (SRF, con RF = -C6F5, -C6HF4 y -C6H4F) (Antiñolo et al., 1999); un derivado estánnico del ion dodecaborato, (B12H12)2-, el estaño-closo-dodecaborano-κSn (SnB11H11)2-, con un enlace Ir-Sn(1) de 2,6620(5) Å (Kirchmann, Fleischhauer, & Wesemann, 2008). Finalmente, ya en el campo de la nanotecnología, se han utilizado ligandos derivados del fullereno, como el óxido C60O, para coordinar al iridio(I) en un complejo seudo-Vaska del tipo [IrCl(CO)(η2-C60O)(PPh3)2], ver figura 8 (Balch, Costa, Lee, Noll, & Olmstead, 1994) y [IrCl(CO)(η2-C60O)(AsPh3)2] (Balch, Costa, Noll, & Olmstead, 1996).
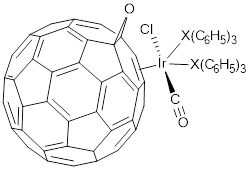
Figura 8 : Representación de la estructura del [IrCl(CO)(η2-C60O)(PPh3)2], si X = P (Balch et al., 1994), y, [IrCl(CO)(η2-C60O)(AsPh3)2], si X = As (Balch et al., 1996).
Se han reportado muchas otras estructuras de rayos X de compuestos análogos al complejo de Vaska o que siguen una reacción de Vaska, sin embargo, destacan los compuestos donde el iridio(I) ha sido sustituido por rodio(I). En tal sentido, solo en las revistas de la Unión Internacional de Cristalografía (IUCr Journals), se han reportado veinticuatro compuestos y, adicionalmente, se determinó la estructura del análogo estricto de Vaska, el trans-[RhCl(CO)(PPh3)2], con distancia de enlace: Rh-Cl: 2,382(1) Å; Rh-CO: 1.77(1) Å; Rh-P: 2,322(1) Å (promedio para los P de las PPh3); (Dunbar & Haefner, 1992).
Algunas aplicaciones catalíticas del complejo de Vaska
Como se puede esperar, las aplicaciones catalíticas del complejo de Vaska son obvias, tomando en cuenta que el iridio(I), dentro de los metales de transición, es un elemento cuyos compuestos complejos poseen una extensa y comprobada actividad en el área de la catálisis, que pasa del campo puramente académico, hasta llegar al ámbito comercial e industrial (Haynes, 2007).
Las reacciones catalíticas homogéneas constituyen el campo más natural para el complejo de Vaska, y las reacciones de adición oxidativa y eliminación reductiva han sido extensamente estudiadas utilizando este complejo como catalizador (Burk, McGrath, Wheeler, & Crabtree,1988), un aspecto resaltante, especialmente tomando en cuenta que este tipo de estudios vienen a aclarar y definir aspectos mecanísticos muy relevantes para las catálisis homogéneas con iridio y, en general, con metales de transición (Taylor, 1974).
En este orden de ideas, el número de investigaciones y los resultados obtenidos a partir de las reacciones químicas que involucran el complejo de Vaska, se puede inferir a partir del número de artículos de investigación, comunicaciones o capítulos de libros que se basan en este complejo organoiridio. En el histograma de la figura 9, se puede apreciar un sostenido crecimiento en el número de publicaciones sobre el complejo de Vaska, en el período 1961-2019; y en la década de 1990 se observa una aceleración en el número de investigaciones, que muy probablemente toma en cuenta el interés por desarrollar métodos con aplicaciones comerciales, y el apoyo a los proyectos en el área de la catálisis homogénea, y los grupos o laboratorio que hacían investigación y desarrollo (I+D) en este campo, tanto a nivel mundial, como en el ámbito iberoamericano (Domínguez, 2004).
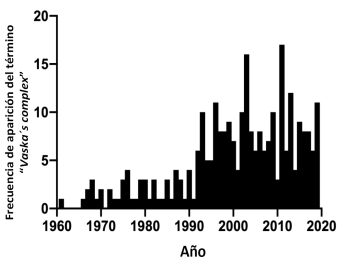
Figura 9 : Histograma correspondiente a la frecuencia de aparición del término “Vaska’s complex” en el período 1961-2019. La investigación se llevó a cabo utilizando la plataforma de Chemical Abstracts (SciFinder). La búsqueda fue refinada excluyendo los resultados duplicados y aquellos en las cuales se hace referencia al complejo de Vaska, pero no se utiliza en su sentido estricto, o no tiene aplicaciones en el área objeto de la investigación. El total encontrado fue de 284.
Históricamente, se ha reportado que el complejo de Vaska es mucho más activo, en reacciones de hidrogenación catalítica de olefinas y acetilenos, que otros complejos de iridio, por ejemplo, presenta mayor actividad que el trans-[IrH(CO)(PPh3)3] (Vaska, 1965), posiblemente como consecuencia de la diferencia en la reactividad del enlace Ir-Cl versus el enlace Ir-H, y la inestabilidad del aducto que se forma con la molécula de dihidrógeno. La reacción de isomerización de olefinas, una reacción colateral a la hidrogenación se ve igualmente favorecida con el complejo de Vaska (James & Memon, 1968), y puede eventualmente ser utilizada para modificar sustratos que poseen largas cadenas carbonadas poliinsaturadas.
El complejo de Vaska es catalíticamente activo en reacciones de olefinación de aldehídos y cetonas, utilizando compuestos diazo como el adiazoacetato de etilo o el trimetilsilildiazometano. En tal sentido, ha sido posible la olefinación (reducción) del 3-fenilpropanaldehido, con porcentajes de conversión hacia el 3-butenilbenceno del 98% figura 10a (Lebel & Ladjel, 2008).
Una reacción de interés para la síntesis orgánica es la aza-espirociclización, y aquí el complejo de Vaska ha presentado buenos resultados como precursor catalítico. Por ejemplo, la triptamina, cuya estructura se encuentra presente en varios neurotransmisores (Voet & Voet, 2011), puede ser convertida en una aza-espiroindolina, hasta con un 93% de conversión, a temperatura ambiente, y utilizando tolueno o diclorometano como disolvente, figura 10b (Gabriel, Gregory, & Dixon, 2019).
La reacción catalítica de ciclización, vía radical libre por transferencia de hidrógeno (HAT) (por sus siglas en inglés) (Rowlands, 2010), se desarrolló utilizando un complejo de Vaska. Esta reacción tiene especial interés para la síntesis de moléculas altamente sustituidas, y se obtienen, por ejemplo, pirrolidinas sustituidas con olefinas o grupos oxo, figura 10c (Gansäuer, Otte, & Shi, 2011). Este tipo de moléculas pueden servir de punto de partida para la síntesis de fármacos (Ahluwalia & Chopra 2008).
La síntesis de ciclopentadionas, a partir de dialquinos, se ha realizado mediante una reacción catalítica utilizando el complejo de Vaska disuelto en xileno y a una temperatura de 120 °C. El porcentaje de conversión es superior al 90% dependiendo del tipo de grupo o heteroátomo que sirve de puente entre los alquinos, figura 10d (Shibata, Yamashita, Ishida, & Takagi, 2001).
El complejo de Vaska cataliza la reacción de descarboxilación de ésteres, especialmente los formiatos. En tal sentido, el n-octilformiato, CH3(CH2)7OC(=O)H, puede transformarse en el n-octanol, CH3(CH2)7OH, hasta con un 64% de conversión, figura 10e (Zahalka, Alper & Sasson, 1986). Así mismo, la descarboxilación de N,N´-dialquilamidas se produce exitosamente a temperatura ambiente, obteniendo la correspondiente enamina, en condiciones fotoquímicas, con la presencia de TMDS ((CH3)2HSiOSiH(CH3)2), y con porcentajes de conversión del 99%, ver figura 10f (Une, Tahara, Miyamoto, Sunada, & Nagashima, 2019). En esta misma línea de investigación, se ha reportado que el complejo de Vaska cataliza la síntesis de una gran variedad de enaminas conjugadas, alcanzando conversiones superiores al 90% y en condiciones de reacción suaves (Tahara et al., 2015).
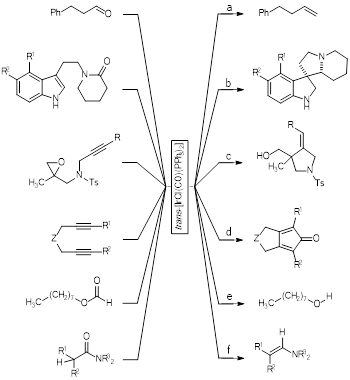
Figura 10 : Algunas reacciones químicas de interés donde se utiliza el complejo de Vaska como precursor catalítico. Rn = grupos alquilo; Ph = fenilo (-C6H5), Et = etilo, Bn = bencilo, t Bu = ter-butilo; Ts = tosilato o grupo p-toluenosulfonato (p-CH3C6H4SO3 -); Z = O, CH2, C(CO2Et)2, C(CO2Bn)2, C(CO2 t Bu)2.
La funcionalización de alcanos (hidrocarburos) es una reacción de interés para la industria química y petroquímica. En tal sentido, mediante catalizadores de rodio(I) tipo Vaska, es posible desarrollar una metodología que permite la activación del enlace C-H. Por ejemplo, la carbonilación de benceno, pentano o 2-metilpentano, para formar los correspondientes alcoholes, aldehídos y cetonas se puede llevar a cabo con buenos porcentajes de conversión y, adicionalmente, controlando la regioselectividad (Tanaka & Sakakura, 1992).
El complejo Vaska ha sido modificado a fin de ser utilizado en la catálisis por transferencia de fase. En este orden de ideas, se utiliza la sal sódica del tris(m-sulfonatofenil)fosfina (TPPMS), para sintetizar el trans-[IrCl(CO)(TPPMS)2], un complejo hidrosoluble, que se utilizó en la hidrogenación e isomerización del doble enlace presente en la estructura de ácidos grasos insaturados de cadena corta como el ácido oleico (Kovács, Todd, Reibenspies, & Darensbourg, 2000). Este tipo de reacciones es especialmente útil en la modificación de sistemas a base de membranas lipídicas, una metodología que puede llegar a ser importante en el campo de los surfactantes y áreas afines.
Nuevas aplicaciones del complejo de Vaska
Si bien es cierto que las aplicaciones más conocidas del complejo de Vaska son de naturaleza catalítica, merece la pena recalcar que este compuesto promueve la adición oxidativa de un gran número de sustancias, no solo moléculas diatómicas como el H2 o el O2, o las olefinas, sino muchos otros sustratos, incluyendo glicósidos (Pelczar, Munro-Leighton & Gagné, 2009), moléculas de interés por su hidrosolubilidad. En este sentido, el complejo de Vaska guarda una estrecha relación con el catalizador de Wilkinson (Contreras et al., 2017) y especialmente con el catalizador de Crabtree (Contreras et al., 2020), haciendo que sea capaz de transformar una gran variedad de sustratos de interés para la química fina (Margarita & Andersson, 2017). Dentro de estas transformaciones, merece la pena mencionar la síntesis de aminas terciarias, hidrosilanos y nitronas (Tahara et al., 2015), estas últimas tienen un amplio interés en el campo de la biomedicina como precursores de una gran cantidad de compuestos biológicamente activos (Feuer, 2008). La síntesis de nitronas involucra normalmente varias etapas, pero utilizando el complejo de Vaska o sus análogos, es posible obtenerlas en un solo paso.
Por otro lado, se ha observado que el complejo de Vaska induce la interconversión de espines nucleares en la molécula de dihidrógeno, donde el ortohidrógeno (o-H2), H(↑)-H(↑) (αα/ββ), pasa a parahidrógeno (p-H2) H(↑)-H(↓)(αβ/βα) (Matthes, Gründemann, Buntkowsky, Chaudret, & Limbach, 2013). La polarización inducida por parahidrógeno (PHIP por sus siglas en inglés) (Eisenberg, 1991) es una reacción que tiene gran interés, en virtud de que las moléculas que experimentan una hiperpolarización por medio de una reacción con parahidrógeno, tienen una mayor respuesta en estudios por resonancia magnética nuclear (RMN). Dicho de otra forma, una reacción de hidrogenación de un sustrato con parahidrógeno (con espín cero), induce la polarización neta del producto hidrogenado, ver figura 11a. Esta hiperpolarización puede extenderse no sólo a partes de la molécula que reaccionan directamente con el parahidrógeno, sino incluso a lugares más alejados, especialmente en grandes moléculas, lo que significa que esta sustancia, ahora “enriquecida” en parahidrógeno, puede aportar mucha más información que una molécula ordinaria, especialmente a la hora de realizar estudios por RMN, y el complejo de Vaska puede ser muy útil en este tipo de experimentos, al inducir la reacción de intercorvención de o-H2 en p-H2,figura 11b. La metodología PHIP crea todo un campo de nuevas aplicaciones en la ciencia de los materiales y, adicionalmente, en un área de mucho interés como la imagenología biomédica.
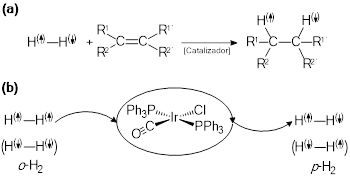
Figura 11 : Polarización inducida por parahidrógeno (PHIP). (a) Esquema de la reacción típica de una molécula insaturada con uno de los isómeros del parahidrógeno; el producto de la reacción se encuentra hiperpolarizado. (b) Reacción del complejo de Vaska con ortohidrógeno para producir parahidrógeno. El complejo de Vaska disuelto en d 6 -benceno (1 x 10-3 M), se enfrió hasta los 77 K, a fin de obtener el correspondiente sólido (vítreo), que entra en contacto con una presión parcial de H2/D2, según las condiciones descritas por Matthes et al., 2013, a fin de proceder con el estudio por RMN.
En el campo de la nanotecnología, el complejo de de Vaska y sus análogos tipo trans-[IrX(CO)L2] (Roodt, Otto & Steyl, 2003), también han sido empleados. Es así como se ha desarrollado una “máquina molecular” (Schliwa, 2003) a partir del análogo de rodio(I) del complejo de Vaska y una ferrocenodifenilfosfina, la 1.1´-bis-(p-metoxifenil)-3,3´-bis-(trifenilfosfina)ferroceno, figura 12a (Tanaka & Kinbara, 2008). El funcionamiento de esta máquina molecular se basa en la posibilidad de que la ferrocenodifosfina (bis-PPh2Fc), induzca dos tipos de configuraciones para el complejo [RhCl(CO)L2], una cisoide y otra transoide, figura 12b, que, como consecuencia de la fluxionalidad presente en esta estructura, intercambian constantemente. La fluxionalidad observada, se basa en la posibilidad de que los grupos p-metoxifenil puedan experimentar un “tijereteo” o torsión en el plano, que implica un cambio en el ángulo P-Rh-P´, que va de 180°, en el cis-complejo, hasta 90°, en el trans-complejo. La dinámica observada en esta máquina molecular se refleja en la actividad catalítica, por ejemplo, la reacción de descarboxilación de 3-fenilpropapanal que pasa a etilbenceno, en presencia de difenilfosforil azida (DPPA) figura 12b. En el ciclo catalítico propuesto, el paso del trans-complejo a cis-complejo, ocurre con pérdida del grupo carbonilo, que es aceptado por el DPPA y, a continuación, el cis-complejo actuando sobre el 3-fenilpropapanal, induce la descarboxilación de éste, para general el etilbenceno, y regenerar el trans-complejo que recupera su grupo carbonilo.
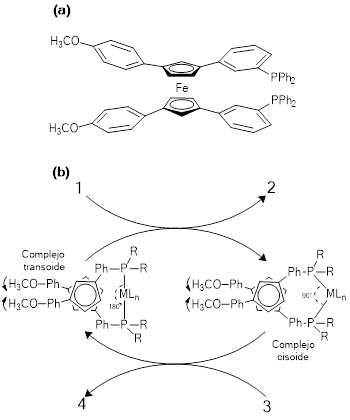
Figura 12 : Máquina molecular basada en un análogo del compuesto de Vaska, trans-[RhCl(CO)L2]. (a) Ligando 1.1´-bis-(p-metoxibenceno)-3,3´-bis-(trifenilfosfina) ferroceno. (b) Esquema de funcionamiento del sistema. En la reacción de descarboxilación del 3-fenilpropapanal en presencia de difenilfosforil azida (DPPA), cuando el trans-complejo pasa a cis-complejo, la DPPA (1) acepta el grupo carbonilo (2); a continuación, el cis-complejo, con el 3-fenilpropanal (3), produce la descarboxilación hasta generar el etilbenceno (4) y regenerar el trans-complejo (Tanaka & Kinbara, 2008).
Este tipo de máquinas moleculares que, por analogía, tienen como motor el complejo de rodio(I), y como combustible a las moléculas de aldehído, pueden ser empleadas para producir movimiento, dinámica molecular, un aspecto que tiene interés en el estudio de sistemas biológicos y nanotecnológicos (Wang, 2013).
Siguiendo en el campo de la nanotecnología, el complejo de Vaska ha sido utilizado para funcionalizar nanotubos de carbono, con la finalidad de hacerlos más solubles en disolventes como la DMF (Banerjee & Wong, 2002). Los nanotubos de carbono tienen propiedades de altísimo interés en el área de la ciencia de los materiales, especialmente por su conductividad eléctrica y resistencia mecánica. El procedimiento tradicional para la oxidación de nanotubos de carbono de pared única (SWNT por sus siglas en inglés), consiste en tratar el material con una solución 1.5 M de KMnO4 en una mezcla fuertemente ácida (H2SO4/HCl), en un reflujo de 5 h, ver figura 13. Ahora bien, la funcionalización por carboxilación de la capa externa de los nanotubos, no le confiere la solubilidad adecuada en DMF, sin embargo, haciendo reaccionar el nuevo material con el complejo de Vaska, el iridio se enlaza a la pared del nanotubo, y se produce un cambio en sus propiedades fisicoquímicas, mejorando la solubilidad, lo cual permite su utilización en reacciones posteriores.
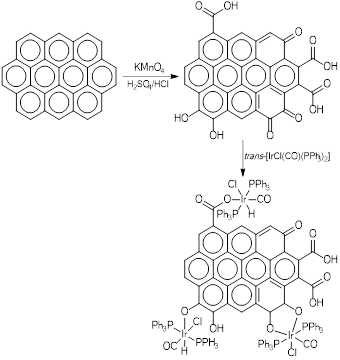
Figura 13 : Esquema de reacción propuesta para la funcionalización de nanotubos de carbono con el complejo de Vaska (Banerjee & Wong, 2002).
Ahora bien, los nanotubos de carbono (CNTs por sus siglas en inglés) pueden interaccionar directamente con el complejo de Vaska, sin necesidad de una funcionalización previa. Para comprender como sucede esta interacción se han realizado estudios teóricos utilizando descripciones híbridas QM/MM (mecánica cuántica/mecánica molecular), y DFT utilizando funcionales de Becke y Perdew (BP) (Mercuri & Sgamellotti, 2006). Los resultados indican que las interacciones η2-C2-Ir más fuertes se observan cuando el átomo de carbono con carácter olefínico pertenece a un anillo de cinco miembros, que se origina como defecto en el nanotubo. De esta forma se concluyó que la reactividad de los nanotubos frente al complejo de Vaska, estaba determinada por la cantidad de defectos estructurales presentes. Una novedosa aplicación del complejo de Vaska se basa justamente en la posibilidad de que exista una interacción η2-C2-Ir con los grupos olefínicos en fullerenos. La coordinación de estos grupos al complejo de Vaska le permite ser utilizado como un quimiosensor en la detección de fullerenos por voltamperometría cíclica (Igartúa-Nieves, Rivera-Pagán, & Cortés-Figueroa, 2012). La metodología planteada en este caso es bastante selectiva, y permite diferenciar distintos tipos de fullerenos.
Finalmente, no se puede omitir la posibilidad de estudiar compuestos derivados del complejo de Vaska en el campo de la bioorganometálica (Aranguren & Contreras, 2010) y, especialmente, en aplicaciones dirigidas a la biomedicina. Existe suficiente evidencia de las propiedades antitumorales de los compuestos organoiridio (Contreras, Urbina-Gutiérrez, Aranguren, 2018), específicamente aquellas familias de compuestos que puede estabilizar el par Ir(I)/Ir(III). La actividad anticancerígena de los organoiridio se basa en la conocida interacción directa con la molécula de ADN y, en otros casos, se debe a una perturbación del balance de las reacciones de oxidorreducción al interior de las células tumorales (Liu & Sadler, 2014). En consecuencia, se abren muchas posibilidades, especialmente tomando en cuenta las poderosas metodologías que se vienen desarrollando en el campo de la síntesis de nuevos ligandos, y la gran cantidad de nuevas fosfinas que se pueden obtener en la actualidad, y que eventualmente podrían ser utilizadas para sintetizar nuevos compuestos análogos al complejo de Vaska.
Conclusiones
Como puede observarse, desde la publicación de su síntesis de 1961, el complejo de Vaska ha suscitado gran interés, en principio de naturaleza académica, por los estudios en química de coordinación de compuestos organoiridio, y, posteriormente, por las posibilidades que se abrían en el campo de la catálisis homogénea, de cara a los procesos industriales que podían ser abordados. El establecimiento de mejores métodos de síntesis y caracterización del complejo de Vaska y de grandes series de compuestos análogos de iridio(I) y rodio(I), ha abierto una puerta hacia el desarrollo de potenciales aplicaciones, no solo en el campo de la catálisis homogénea, asimétrica, bifásica o por transferencia de fase, sino al estudio de nanomateriales y aplicaciones en el campo de la bioorganometálica y la biomedicina. Todavía, a sesenta años del descubrimiento del trans-[IrCl(CO)(PPh3)2], a manos de Lauri Vaska y John W. DiLuzio, quedan muchas posibilidades por explorar, y se generan todavía expectativas en la investigación y desarrollo de compuestos organoiridio.















