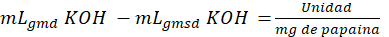Introducción
La papaya es una planta originaria de la América tropical (McGee, 2004), su cultivo se ha extendido a lo largo del mundo, especialmente en regiones geográficas con clima tropical. Según datos del tercer censo nacional agropecuario realizado en el año 2002, en Ecuador se siembran 1608 hectáreas de papaya en unidades de producción agropecuaria, con una estimación de ventas de 12090 toneladas métricas. La papaya por ser un cultivo natural de los trópicos y subtrópicos se adapta a una amplia variedad de climas y zonas, de preferencia zonas cálidas con alta irradiación solar.
La papaína es una proteína que se encuentra en toda la planta de papaya, se compone de aminoácidos con un peso molecular de 23000 daltons. La papaína además de hidrolizar proteínas, también lo hace con pequeños péptidos, aminas, esteres, carbohidratos y grasas (Osuna, Aguilar y Tapia, 2005).
En los últimos años, las proteasas han surgido como biocatalizadores estándar en muchos procesos industriales en diferentes campos, como la farmacéutica, la medicina, la fabricación de detergentes y la ciencia de los alimentos (Fernández-Lucas, Castañeda & Hormigo, 2017). Las enzimas son biocatalizadores, agentes de origen biológico que aceleran la velocidad a la cual ocurren las reacciones químicas al disminuir los requerimientos de energía de activación necesaria para dichas reacciones (Cornish-Bowden, 1995). La aplicación de las enzimas a la industria se constituye en uno de los primeros procesos biotecnológicos de la química moderna (Roberts et al., 1995).
La terneza es conocida como uno de los atributos más importantes de la carne que influye mucho su aceptabilidad del consumidor (Istrati, 2008). Los procesos de pre y post sacrificio del ganado bovino influyen en gran medida en la terneza o dureza de la misma. La aplicación de enzimas como papaína, bromelina y ficina han sido ampliamente observada como ablandadores de carne (Gerelt, Ikeuchi & Suzuki, 2000).
En la investigación se presenta el proceso integral de obtención de papaína liofilizada, su análisis químico y sensorial, lo que involucra la recolección de muestras, su tratamiento, preparación de reactivos, actividad proteolítica, liofilización y degustación, para lo cual se hace uso de carne bovina.
Metodología
La metodología de investigación que se aplicó en el presente trabajo consta de los siguientes pasos:
Recolección y transporte del material vegetal
Homogenización de las muestras
Preparación de Reactivos
Determinación actividad enzimática
Liofilización
Degustación
Recolección y transporte del material vegetal
La recolección de la materia vegetal se realizó en una plantación representativa de papayas de la población de Rio Negro, cantón Baños. Se recolectaron los frutos y las hojas en tres estados, madura, pintona, y verde. La recolección fue al azar observando que se cumplan los requisitos requeridos para el análisis, en cuanto a estados de maduración, ausencia de hongos, tipo de plaga, o fungicidas que pudiesen afectar a los experimentos.Para el análisis de la fruta verde se recolectó el látex de la misma, realizando unas pequeñas incisiones al fruto y obteniendo el material lechoso en tubos de ensayo provistos de corchos. Para su transporte, las muestras fueron envueltas en papel con la finalidad de evitar la transpiración y pérdida de enzimas, sin exposición solar; los tubos de ensayo fueron inmediatamente refrigerados a 1°C.
Homogenización de las muestras
En el tratamiento de las muestras se realizó la obtención de un homogenato, que implica la destrucción del tejido vegetal (de las hojas) y el pasaje de las enzimas a solución o suspensión, por medio de homogenización mecánica.
El procedimiento se llevó a cabo utilizando una licuadora con la ayuda de abrasivos como arena de mar en una mínima proporción (1 g), la hoja de la fruta fue mezclada con una solución de NaCl en una proporción de 0.9%, se trituró hasta lograr la rotura total del tejido vegetal, luego fue filtrado y obtenido el homogenato (en estado líquido).
Para la corteza de las frutas se utilizó el mortero, lo que permitió la ruptura de la pared vegetal. En tanto que para el látex no se requirió realizar ningún proceso de homogenización mecánica por encontrase en estado líquido.
Preparación de Reactivos
Para la posterior determinación de la actividad enzimática de la papaína se aplicó el método AOAC (Latimer, 2016), el que está basado en cuatro reactivos, el proceso de preparación se explica a continuación:
- Solución de caseína al 6%, en una cantidad de 60g, fue triturada en un mortero usando poca cantidad de agua. Gradualmente fueron añadidos 60mL de hidróxido de sodio (𝑁𝑎𝑂𝐻 1N), trasvasados cuantitativamente a un balón de 1000 mL y aforado con agua destilada. Se obtuvo una solución viscosa, la que fue calentada durante 30 minutos en baño maría. Luego de enfriar la solución se realizó el filtrado por medio de lana de vidrio.
- Solución buffer de citrato, basada en una solución 0.2M de citrato monosódico por neutralización parcial de ácido cítrico con 𝑁𝑎𝑂𝐻.
- Solución titulante correspondiente a una solución estandarizada de hidróxido de potasio (𝐾𝑂𝐻 0.1N) alcohólica.
- Un Indicador, correspondiente a una Solución de timolftaleína al 1% en alcohol.
Determinación de la actividad enzimática
La actividad enzimática es la función de una enzima, la que puede ser determinada por medio de la medición de la cantidad de sustrato que desaparece o la cantidad del producto formado por unidad de tiempo (Grajales, 2005).
La actividad enzimática existente en las hojas, corteza y látex de la papaya fue determinada por medio de la aplicación de los reactivos obtenidos en la sección 2.3 sobre el homogenato obtenido en la sección 2.2. El proceso aplicado para la identificación de la actividad enzimática se describe a continuación:
- Fueron colocados 10mL de la solución de caseína y una pequeña cantidad de esferas de cristal de 4mm de diámetro en un erlemeyer de 125mL, luego encubados en baño maría a 40°C.
- Se añadió un volumen de la solución de enzima de la papaya, no mayor a 4Ml, y 3 mL de solución buffer de citrato.
- Se agitó vigorosamente el erlenmeyer por 5 segundos en un baño termostatado a 40°C.
- Se incubó 20 minutos a 40°C, contando el tiempo desde la adición del buffer. Se añadió 1mL del indicador y se tituló con la solución alcohólica de 𝐾𝑂𝐻 hasta obtener la presencia de color azul pálido persistente en la solución.
- A la par, se preparó una titulación en blanco, a la que le fue adicionado el buffer sin incubación.
La diferencia entre las dos titulaciones de los mL de 𝐾𝑂𝐻 gastados de la muestra sin digerir y los mL de 𝐾𝑂𝐻 gastados de la muestra digerida, es la medida de la actividad enzimática.
Para medir la actividad enzimática se aplicó la siguiente fórmula (1):
donde, 𝑚 𝐿 𝑔𝑚𝑑 𝐾𝑂𝐻 son los mililitros gastados 𝐾𝑂𝐻 de muestra digerida, y 𝑚 𝐿 𝑔𝑚𝑠𝑑 𝐾𝑂𝐻 son los mililitros gastados 𝐾𝑂𝐻 de la muestra sin digerir.
Liofilización
El proceso de liofilización consiste básicamente en la deshidratación del homogenato obtenido desde las muestras de papaya, por medio de refrigeración, eliminación de hielo, y un ligero calentamiento al vacío. El liofilizador consta de una bomba de vacío conectada por una tubería flexible a la parte superior de un balón de condensación, el cual está provisto de un serpentín de cobre, donde circula la solución refrigerante, impulsada por un zorrino (Bertoluzzo et al., 2007).
Luego de un periodo de 7 días, por medio del proceso de liofilización se obtuvo un producto en forma de un polvo fino de color verde con un olor característico a papaya, en este caso la papaína que sería utilizada como ablandador de carne bovina.
Degustación
La degustación fue realizada por medio de un panel de jueces que verificaría si el liofilizado obtenido logró ablandar la carne bovina. La degustación estuvo acompañada de bebida. Se cortaron trozos uniformes de carne, de 10 cm2 y 1 gramo de material vegetal liofilizado, el que se dejó actuar por 20 minutos (tiempo promedio revisado en trabajos citados), luego se procedió a la cocción.
El mismo procedimiento fue realizado con carne libre de liofilizado, con la intención de que los jueces definan cuál de las 2 muestras tenía mayor terneza para su paladar, para ello, se utilizaron fichas de recolección de datos.
Para el análisis de resultados fue aplicado un test pareado, con la finalidad de detectar pequeñas diferencias entre las dos muestras.
Resultados y Discusión
Como se muestra en la tabla 1, el proceso experimental fue realizado por medio de tres repeticiones basadas en las muestras de hoja de papaya en sus tres estados de maduración.
El pH inicial para cada repetición es ligeramente ácido, en un rango de 5.2 a 6.2, lo que se explica por la presencia de iones de hidrógeno en la estructura de la papaína, en su estado puro sin la adición del buffer ni activación previa.
Al finalizar la titulación, el pH está en el rango de 7 a 8.8, tal incremento se debe a que al adicionar el buffer que contiene una mezcla de ácido cítrico y 𝑁𝑎𝑂𝐻 se produce una disminución en la concentración de iones de hidrógeno; el ácido se disocia en su totalidad, tornándose básica la muestra.
Tabla 1: Parámetros iniciales para la determinación enzimática de la papaína frente los reactivos usando la hoja de la fruta verde, pintona y madura.
| Factores de control | Repeticiones - hoja de fruta verde | Repeticiones - hoja de fruta pintona | Repeticiones - hoja de fruta madura | ||||||
|---|---|---|---|---|---|---|---|---|---|
| I | II | III | I | II | III | I | II | III | |
| pH Inicial | 5.4 | 5.4 | 5.2 | 5.4 | 5.2 | 5.2 | 6 | 5.8 | 6.2 |
| Volumen consumido x factor de dilución ¼ | 42 mL | 38.8 mL | 40.4 mL | 11 mL | 12 Ml | 11.5 mL | 7 mL | 7.7 mL | 7.1 mL |
| pH Final | 8.6 | 8 | 8.4 | 7 | 8.8 | 8 | 7 | 7.6 | 8 |
Tabla 2: Parámetros iniciales para la determinación enzimática de la papaína frente a los reactivos usando el látex del fruto verde, la corteza de la fruta pintona y la corteza de la fruta madura.
| Factores de control | Repeticiones - látex de la fruta verde | Repeticiones - corteza de la fruta pintona | Repeticiones - corteza de la fruta madura | ||||||
|---|---|---|---|---|---|---|---|---|---|
| I | II | III | I | II | III | I | II | III | |
| pH Inicial | 5 | 5.2 | 5 | 6.4 | 6.4 | 6.2 | 5.8 | 5.6 | 5.8 |
| Volumen consumido x factor de dilución ¼ | 22.4 mL | 22.7 mL | 22.55 mL | 11.1 mL | 13.25 Ml | 12.15 mL | 8.2 mL | 8.35 mL | 9 mL |
| pH Final | 9.8 | 9.5 | 10 | 9 | 10 | 9.8 | 8 | 8.4 | 9 |
Dada la intensa coloración verde de las hojas del fruto verde, el homogenato obtenido también tenía esa tonalidad, por lo que fue necesario realizar una dilución ¼ para lograr visualizar el viraje de color y poder obtener el volumen gastado final.
Con respecto al volumen 𝐾𝑂𝐻 consumido por factor de dilución, en el caso de la hoja de la fruta verde está en un rango de 38.8 a 42 mL, para la hoja de fruta pintona está entre 11 y 12 mL, y para las hojas de fruta madura está en está en un rango de 7 a 7.7 mL. El mayor o menor consumo de 𝐾𝑂𝐻 se explica por los diferentes procesos fisiológicos que ocurren en las hojas durante el proceso de maduración de la fruta, tales como, transpiración, pérdida de turgencia, estrés hídrico por radiaciones solares, nutrición mineral, entre otras (Casierra-Posada, 2012).
Mediante las titulaciones realizadas con la muestra de la hoja de la fruta totalmente madura se obtuvo un mayor consumo de 𝐾𝑂𝐻, en tanto que en las hojas de la fruta madura hubo un menor consumo. La clorofila por ser un pigmento se decolora y deja al descubierto otros pigmentos como es el amarillo, ya que la hoja en este estado de maduración ya no es totalmente verde, se encuentra decolorada con tonalidades amarillas. La clorofila es un actor central en la recolección de energía de la luz para la fotosíntesis, sin embargo, los pasos limitantes de la tasa del catabolismo de la clorofila y la regulación de las enzimas catabólicas no ha podido ser comprobado (Harpaz-Saad et al., 2007).
La concentración enzimática disminuye en frutos maduros debido a que el fruto al que alimenta la hoja ya se encuentra en su completo estado de maduración.
Los resultados reportados en la tabla 2, corresponden a los parámetros iniciales para la determinación enzimática de la papaína frente a los reactivos usando el látex del fruto verde, la corteza de la fruta pintona y la corteza de la fruta madura. El pH inicial de la muestra de látex del fruto verde está en el rango 5 a 5.2, mientras que el pH final está entre 9.8 a 10. Los valores finales de pH son indicativos de que la acidez de la fruta es elevada, ya que se encuentra en un estado de maduración verde y los ácidos orgánicos se encuentran en mayores concentraciones en etapas iniciales de maduración (Flores, 2012).
El volumen consumido de 𝐾𝑂𝐻 está en un rango de 22 a 22.5 mL lo que indica que la concentración enzimática es elevada; durante este periodo de maduración de la fruta en el látex no solo está contenida la papaína, se encuentran también otras enzimas tales como papaya peptidasa A, lipasa y lisozima (Calzada et al., 2004). También, los taninos y fenoles se encuentran en grandes cantidades, con la finalidad de proteger a la planta de insectos y hongos, ya que en este estado de maduración la planta necesita tener gran cantidad de defensas para llegar a su punto de madurez fisiológica final.
Los resultados de la corteza de la fruta pintona, muestran que el pH inicial está en un rango de 6.2 a 6.4, indicativo de que la muestra está ligeramente ácida, al finalizar la titulación el pH aumenta a un máximo de 10 (totalmente básica), atribuible a la perdida de acidez de la fruta. El volumen consumido de KOH está entre 11 a 13.25 mL lo que indica que la actividad enzimática disminuye debido a que durante este periodo de desarrollo existe acumulación de agua en los tejidos, y desaparecen algunas de las enzimas antes mencionadas, además el proceso de maduración se inicia con el etileno endógeno producido por la fruta que es un proceso natural y propio de la misma, donde el etileno es una hormona gaseosa que inicia los procesos de maduración. La actividad enzimática es menor en comparación a los valores obtenidos en los experimentos basados en frutas verdes.
Los resultados obtenidos con la fruta madura presentan valores iniciales de pH en el rango 5.6 a 5.8 y final en el rango 8 a 9. El volumen consumido de 𝐾𝑂𝐻 es en un rango de 8.2 a 9 mL, este mínimo volumen indica que ya la concentración enzimática es pequeña.
En la tabla 3 se muestran los resultados de las muestras sin digerir (con enzima inactivada). El pH inicial de la muestra de hoja verde es de 5, valor óptimo para el mantenimiento de las enzimas, cuyo pH final es 9, dada la acidez elevada de la fruta verde. El volumen gastado de 𝐾𝑂𝐻 es de 19 mL, lo que indica que la concentración enzimática está presente. Con relación a la fruta pintona, el pH inicial es de 5.2 y el final es de 8 lo que indica que va de ácido a ligeramente básico, el volumen gastado es de 10 mL. Para la fruta madura, el pH inicial es de 5.6 y pH final de 7, lo que indica que la muestra pasa de ligeramente ácida a neutra, el volumen consumido de 𝐾𝑂𝐻 es de 8 mL.
Tabla 3: Parámetros iniciales para la determinación enzimática de la papaína en blanco presente en el látex y la hoja del fruto verde, en la corteza y hoja de la fruta pintona, y en la corteza y hoja de la fruta madura.
| Papaína en blanco | |||
|---|---|---|---|
| Factores de control | fruta verde | fruta pintona | fruta madura |
| pH Inicial | 5 | 5.2 | 5.6 |
| Volumen consumido x factor de dilución ¼ | 19mL | 10Ml | 8mL |
| pH Final | 9 | 8 | 7 |
La unidad de papaína es la cantidad de enzima producida en condiciones establecidas, la verificación se realiza entre titulaciones de 1mL de 𝐾𝑂𝐻 0.1N. El valor de la preparación original se expresa en Unidades/mg de papaína, o como mg de papaína necesaria para hacer una unidad. El cálculo se realiza por medio de la fórmula (1), definida en la sección 2.4. Los valores obtenidos se presentan en la tabla 4.
Tabla 4: Unidades de papaína/mg presentes en las muestras de estudio.
| Unidades/mg papaína | ||||
| Repetición I | Repetición II | Repetición III | Promedio | |
| Hoja Verde | 23 | 19.8 | 21.4 | 21.4 |
| Hoja Pintona | 1 | 2 | 1.5 | 1.5 |
| Hoja Madura | 1 | 0.3 | 0.9 | 0.7 |
| Látex de Fruta Verde | 3.4 | 3.7 | 3.5 | 3.5 |
| Corteza de Fruta Pintona | 1.1 | 3.2 | 2.1 | 2.1 |
| Corteza de Fruta Madura | 0.2 | 0.35 | 1 | 0.5 |
Tabla 5: Valores correspondientes al volumen gastado en la muestra digerida y en la muestra sin digerir, para el liofilizado.
Los resultados presentados en la tabla 4, indican que la mayor concentración enzimática está en la hoja del fruto verde, seguido de los valores que reportan el látex del fruto verde. La menor concentración enzimática se reporta en la corteza de la fruta madura. La concentración enzimática elevada en las hojas puede ser debido a que además de la papaína, existen otro tipo de enzimas que podrían estar interactuando en el proceso de verificación de la papaína.
La muestra que mayor concentración enzimática reporta es la obtenida de la hoja verde con 21.4 Unidades/mg papaína, mientras que la que presenta la menor concentración enzimática es la que se localiza en la corteza de la fruta madura con 0.51 Unidades/mg papaína.
Mediante la prueba de varianza se comprobó que existen diferencias significativas entre los tratamientos, y que en las repeticiones no existen diferencias significativas. Debido a la existencia de diferencias significativas entre tratamientos, se realizó la separación de medias según Duncan, el tratamiento que mayor concentración enzimática arrojó fue el de la hoja del fruto verde que se diferencia estadísticamente de las demás muestras.
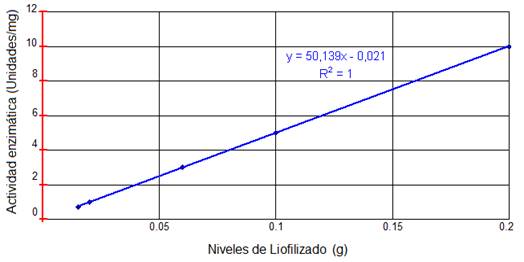
En la tabla 5, se muestran los resultados obtenidos con la muestra digerida para el liofilizado, con un valor de 25.7 mL de 𝐾𝑂𝐻 0.1N para un peso de 0.015g, hasta llegar a un volumen gastado de 258 mL con un peso de 0.200g de papaína liofilizada. En la figura 1, se ilustra la actividad enzimática para cada nivel de liofilizado, observándose que a mayor peso mayor actividad enzimática.
En la tabla 6, se presentan los resultados del proceso de análisis sensorial, los que se realizaron por medio de estadísticas no paramétricas con 10 jueces (catadores) por tratamiento. La muestra A corresponde a aquella que contiene papaína liofilizada, mientras que la muestra B corresponde a la muestra sin papaína liofilizada.
Se observa que, al identificar el sabor, la muestra A gustó más a los jueces en comparación con la muestra B.
Con respecto a la textura 6 de 10 jueces definieron a la muestra A como muy suave, en tanto que 2 jueces calificaron a la muestra B como dura.
En la aceptabilidad para la muestra A, 5 jueces la califican como buena, mientras que para la muestra B, 3 jueces la califican como poco desagradable.
Con relación al color, todos los jueces califican a la muestra A entre bueno y muy bueno, mientras que para la muestra B, 4 jueces la califican como ni agradable ni desagradable.
Tabla 6: Resultados del análisis sensorial.
| Características | Alternativas | Muestra A (con papaína liofilizada) | Muestra B (sin papaína liofilizada) |
|---|---|---|---|
| Sabor | Muy desagradable | 0 | 0 |
| Desagradable | 0 | 1 | |
| Ni agrada ni desagrada | 2 | 5 | |
| Bueno | 5 | 4 | |
| Muy bueno | 3 | 0 | |
| Total | 10 | 10 | |
| Textura | Muy dura | 0 | 0 |
| Dura | 0 | 2 | |
| Ni suave ni dura | 1 | 4 | |
| Suave | 3 | 4 | |
| Muy suave | 6 | 0 | |
| Total | 10 | 10 | |
| Aceptabilidad | Muy desagradable | 0 | 0 |
| Poco desagradable | 0 | 3 | |
| Ni agrada ni desagrada | 1 | 3 | |
| Bueno | 5 | 3 | |
| Muy bueno | 4 | 1 | |
| Total | 10 | 10 | |
| Color | Desagrada mucho | 0 | 0 |
| Desagradable | 0 | 0 | |
| Ni agrada ni desagrada | 0 | 4 | |
| Bueno | 5 | 6 | |
| Muy bueno | 5 | 0 | |
| Total | 10 | 10 |
Esto nos indica que, en relación a los valores de los cuadros subsiguientes, las hojas del fruto verde tienen la mayor concentración enzimática, observada durante la realización de las titulaciones posteriores.
Conclusiones
Se evaluó la actividad enzimática de la papaína extraída de la corteza, las hojas y látex de la fruta en sus tres estados, madura, pintona y verde. Se determina que la concentración enzimática promedio de las hojas, cuando la fruta está verde es de 21.4 Unidades/mg de papaína. Para un estado de maduración pintona fue de 1.5 Unidades/mg, y cuando la fruta presenta su madurez total se obtuvo 0.7 Unidades/mg papaína. Para el látex fue de 3.5 Unidades/mg papaína, para la corteza cuando la fruta esta pintona fue de 2.1 Unidades/mg papaína, y finalmente para la corteza cuando la fruta está totalmente madura de 0.51 Unidades/mg papaína. Determinando que, cuando la fruta se encuentra verde, existe mayor concentración enzimática.
El procesamiento estadístico de la actividad enzimática de las muestras de papaya en sus tres estados de maduración, mediante el análisis de varianza demostró que existen diferencias significativas entre tratamientos y que no existen diferencias significativas entre repeticiones. Se comparó además la actividad enzimática de la papaína mediante una curva de liofilizado, en la que se determinó que el liofilizado de papaína tiene actividad enzimática que va de 0.17, 1, 3, 4, 10 Unidades/mg papaína, para muestras de 0.015 g a 0.2 g, observándose que a mayor peso mayor actividad enzimática.
Finalmente se comprobó la actividad enzimática del liofilizado de papaína mediante un panel de degustación. La carne con papaína liofilizada la que obtuvo valoraciones positivas superiores en sabor, textura, aceptabilidad y color, en comparación con la valoración de la carne sometida a ablandador comercial.
Como trabajo futuro se realizará el análisis de los procesos físico-químicos que ayudarían a mantener estable la actividad enzimática de la papaína sin que ésta se pierda a través del tiempo.
Conflicto de Intereses
Los autores declaran que los procesos experimentales están basados en la tesis de grado desarrollada por uno de los autores de este manuscrito, en la Escuela Superior Politécnica de Chimborazo, titulada “Evaluación de la Actividad Enzimática de la Papaína y su Aplicación en Carne Bovina”.