INTRODUCCIÓN
Funciones cognitivas
Las funciones cognitivas (FC) son procesos cerebrales necesarios para conocer e interactuar con el entorno, y son una importante fuente de autonomía diaria (1)(2), por ejemplo para comunicarse, resolver tareas domésticas u orientarse en la vía pública. Es un constructo integrado por múltiples dominios tales como la atención, memoria y funciones ejecutivas (FE) (3)(4). Al envejecer habría un declive de las FC, particularmente de la memoria (episódica), FE y velocidad de procesamiento (VP) (4)(5)(6)(7) . Se considera que dicho declive es uno de los principales cambios negativos asociados a la vejez (8). Sin embargo la magnitud del declive presenta una importante variabilidad entre individuos, siendo que algunas personas logran un envejecimiento cognitivo exitoso, mientras que otras sufren significativos déficits (9). La evidencia actual respalda la idea de que la educación (10), el estrés psicosocial (11)(12), el sueño (13), el ejercicio físico (10)(13), el estado nutricional (10), el genotipo APOE (14)(15) y el alcoholismo (16)(17), pueden aportar una explicación parcial a las diferencias cognitivas interindividuales. Sin embargo estas variables no explican todas las diferencias, y se necesita investigar otras. Una de las variables de mayor interés actual por sus efectos sobre la cognición es la inflamación.
Inflamación y neuroinflamación
La inflamación es un mecanismo de defensa asociado a un complejo sistema de señalización química en el que intervienen varios mediadores como la interleuquina 6 (IL-6), el factor de necrosis tumoral (TNF-α) y la proteína C-reactiva (PCR) (18)(19). También intervienen múltiples tipos celulares (ej. macrófagos, neutrófilos y microglías) (18)(19). Cuando la respuesta inflamatoria se prolonga deviene en inflamación crónica. Aunque no se ha terminado de dilucidar con exactitud, parecería ser que la inflamación crónica se instala cuando mecanismos homeostáticos que normalmente desactivan dicha respuesta no funcionan de manera adecuada (18)(19). Existe a su vez creciente entusiasmo por investigar las respuestas inflamatorias localizadas en el sistema nervioso central (SNC), lo que comúnmente se conoce como neuroinflamación (20)(21). Estas son respuestas mediadas por citoquinas, quimiocinas, especies reactivas de oxígeno y otros mensajeros como el óxido nítrico. Las microglías son las células desencadenantes de la neuroinflamación, con participación activa en la vigilancia inmunológica en el SNC, producción de citoquinas y quimiocinas, y con semejanzas a los macrófagos (21)(22). Se les atribuye a las microglías la propagación central de señales inflamatorias que se inician en la periferia (por ejemplo a raíz de una infección), favoreciendo la comunicación del eje cerebro-inmunidad. DiSabato et al. (21) proponen que la activación microglial y el aumento de la expresión de citoquinas tiene como propósito proteger al cerebro pero, sin embargo, la activación microglial exagerada o crónica puede conducir a alteraciones del tejido nervioso. En líneas generales, la neuroinflamación es favorable o perjudicial según su intensidad y duración; así las respuestas neuroinflamatorias breves y reguladas son adaptativas, por ejemplo, promoviendo la reparación del tejido nervioso tras una lesión traumática cerebral, favoreciendo procesos de plasticidad neuronal durante el desarrollo, o bien, activando la conducta de enfermedad (sickness behaviors) en contextos de infección y enfermedad. Mientras que por el contrario, la neuroinflamación crónica y desregulada es perjudicial para el SNC (21)(23). Se ha demostrado que durante el envejecimiento normal las células microgliales y astrocitos se vuelven más reactivas, y hay menor producción de proteínas antiinflamatorias, lo que conduce a un perfil proinflamatorio en el cerebro (24)(25).
Relación entre inflamación y desempeño cognitivo
En las últimas décadas creció el interés por determinar si la inflamación afecta la cognición y en qué magnitud (25)(26)(27). La idea que sustenta dicha asociación es que al envejecer aumenta la inflamación central, y al mismo tiempo hay disminución de las capacidades cognitivas (25,26), como si se tratase de dos fenómenos que se acompañan y profundizan con el correr de la vida adulta. A partir de la investigación en animales, fueron propuestos mecanismos que ayudarían a explicar ese nexo, y que otorgan plausibilidad biológica. Se evidenció que la neuroinflamación crónica de bajo grado, señalizada por IL-1 e IL-6, y asociada al envejecimiento normal es capaz de reducir la plasticidad neuronal, y por su intermedio, aumentar la vulnerabilidad cognitiva (21). Asimismo, la neuroinflamación crónica de mayor intensidad, mediada principalmente por IL-1 y TNF-α, induce muerte neuronal y procesos neurodegenerativos (21)(28), por lo que podría ser un elemento más de la compleja fisiopatología de la enfermedad de Alzheimer (EA) (21)(28).
Otra vía de investigación del nexo inflamación-cognición es la exploración del desempeño cognitivo en personas con desórdenes médicos que suponen algún claro componente proinflamatorio, como por ejemplo el síndrome metabólico (SM) o la obesidad. Al respecto fueron realizadas revisiones sistemáticas y metaanálisis (29)(30)(31)(32)(33)(34) y en líneas generales se advierte asociación negativa entre el SM y el desempeño cognitivo, aunque un metaanálisis de estudios prospectivos señaló efectos cognitivos pequeños (33), y una revisión sistemática (34) advirtió la ausencia de resultados significativos para la mayoría de los dominios cognitivos investigados. El sobrepeso y obesidad conllevan efecto negativo, aunque selectivamente sobre procesos ejecutivos, mientras que la evidencia de sus efectos negativos en memoria y VP es menos consistente (34).
Una tercera vía de estudio está sujeta a trabajos que examinan el nivel de inflamación en la EA y en el Deterioro Cognitivo Leve (DCL). Un metaanálisis (35) demostró que la neuroinflamación, en base a la medición de la proteína traslocadora (TSPO), aumenta al progresar el DCL y la EA en comparación con los controles. En el metanálisis de Lai et al. (36), personas con EA presentaron niveles elevados de inflamación periférica (IL-6, IL-1β, TNF-α y PCR, entre otros mediadores) respecto a controles. Sin embargo, otro metaanálisis (34) no señaló diferencias periféricas de IL-6, TNFα y PCR entre EA y controles. Estas discrepancias abren el interrogante acerca de si los biomarcadores de inflamación periféricos reflejan cabalmente los niveles de inflamación central.(37)
Una vía aún más directa para estudiar el nexo inflamación-cognición consiste en analizar la asociación entre la inflamación (por biomarcadores) y las medidas cognitivas objetivas (mediante test cognitivos o neuropsicológicos). Al respecto anteceden una serie de revisiones que merecen atención (25)(38)(39). En la revisión no sistemática de Sartori et al. (25) se examinaron cinco estudios prospectivos y tres transversales, revelando una asociación negativa entre la inflamación periférica, en particular IL-6 y PCR, y el desempeño cognitivo. Otra revisión también no sistemática (37) analizó resultados de siete estudios epidemiológicos, concluyendo que niveles elevados de inflamación periférica aumentan el riesgo de deterioro cognitivo. Los biomarcadores más sensibles por su relación con el desempeño cognitivo fueron IL-6, PCR y TNF-α. Por su parte, un metaanálisis (35) reportó asociación negativa entre el marcador de neuroinflamación TSPO y las puntuaciones del test Mini Mental (MMSE) en sujetos con EA; mientras que otro metanálisis (36) para esa misma población y en base a estudios que utilizaron también el test MMSE, indicó asociación negativa entre la IL-6 periférica y el desempeño cognitivo. Recientemente, una revisión sistemática (39) en adultos mayores sanos sugirió una relación inversa entre la inflamación periférica (IL-6, PCR, TNF-α) y la cognición. Otra revisión sistemática y metaanálisis (40) analizó la relación entre la disfunción inmunológica y cognición en trastornos del ánimo y psicosis, hallándose asociación débil entre los marcadores inmunológicos séricos y la cognición. Los autores argumentan que la ausencia de asociación robusta entre las medidas inmunológicas y cognitivas podría explicarse por la transversalidad de los datos y porque las concentraciones de biomarcadores inmunológicos en sangre periférica podrían no reflejar con exactitud la actividad inmunitaria central.
En resumen, existe considerable evidencia básica, clínica y epidemiológica sobre los efectos cognitivos adversos provocados por la inflamación. Sin embargo la mayoría de las revisiones de asociación entre inflamación y medidas cognitivas objetivas se han focalizado hasta aquí en el desempeño cognitivo global y en personas adultas mayores, motivo por el cual, es necesaria una nueva revisión dirigida a estudios que hayan evaluado la cognición en dominios específicos como atención, memoria o lenguaje, y en personas adultas de todas las edades. En consecuencia, el objetivo del presente trabajo fue revisar de forma sistemática artículos que en los últimos cinco años investigaron la asociación entre la inflamación (mediante biomarcadores) y el desempeño en dominios cognitivos específicos para adultos desde los 18 años.
METODOLOGÍA
Se realizó una revisión sistemática conforme a la declaración PRISMA (41).
Estrategias de búsqueda
Fue consultada la base de datos PubMed el 3 de octubre de 2022. Todos los términos de búsqueda fueron definidos según el tesauro de Medline (MeSH). Todos los investigadores del equipo discutieron los términos y sus combinaciones, hasta llegar a un consenso. Se resolvió utilizar el algoritmo ("Inflammation"[Majr] OR "Neuroinflammatory Diseases”[Majr] OR “Inflammation Mediators”[Majr] OR "Cytokines"[Majr] OR "C-Reactive Protein"[Majr] OR "Leukocytes"[Majr] OR "TSPO protein, human" [Supplementary Concept]) AND ("Cognition" [Majr] OR "Cognition Disorders"[Majr] OR "Memory"[Majr] OR "Attention"[Majr] OR "Language"[Majr] OR "Executive Function"[Majr] OR "Spatial Navigation"[Majr]). Para mayor especificidad, cada descriptor ingresado se acompañó de la función Restrict to MeSH Major Topic (Majr). Se obtuvo un total de 3933 registros. Al aplicar los filtros “publicaciones 2017-2022”, “investigación humana” e “investigación adulta”, la cantidad de hallazgos se redujo a 421 registros.
Selección de los artículos
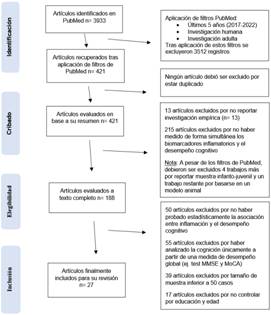
Tal como indica la Figura 1 (diagrama de flujo) de los 421 artículos recuperados, no hubo exclusión por duplicado. Posteriormente se realizó el cribado en base a la lectura del abstract, excluyendo investigaciones no empíricas e investigaciones que no recolectaron de manera conjunta medidas inflamatorias y cognitivas. Cabe aclarar que si los artículos recuperados no explicaban que los biomarcadores fuesen inflamatorios, estos eran aceptados como tales solo cuando al menos otro artículo del área de inmunología de PubMed le atribuía a dicho marcador un papel relevante en la respuesta inflamatoria. Por su parte se aceptaron únicamente estudios de medidas cognitivas objetivas, es decir, mediciones a través de pruebas cognitivas o neuropsicológicas. Tras la aplicación del cribado, el total de artículos se redujo a 188. Luego, en función de la lectura full text se excluyeron los artículos que: a) no aplicaron pruebas estadísticas para contrastar el grado de asociación entre inflamación y desempeño cognitivo, b) evaluaron la cognición global (ej. mediante test MMSE y MoCA), sin proporcionar, cuanto menos, una medida de dominio cognitivo específico, c) analizaron muestras con N <50 sujetos o d) efectuaron análisis estadísticos sin ajustar por edad y educación, ya que es ampliamente conocido que ambas variables demográficas influyen en el desempeño cognitivo. Los dos últimos criterios de exclusión (c y d) estuvieron dirigidos a ofrecer, respectivamente, mayores garantías de validez externa e interna. Finalmente 27 artículos fueron escogidos para la revisión. Cada integrante del equipo corroboró cada fase del proceso de selección para subsanar potenciales errores.
Análisis de los artículos
Se realizó una descripción y síntesis de los 27 artículos recuperados en base a siete grandes ejes: tipo de diseño, muestra, medidas inflamatorias, medidas cognitivas, métodos de evaluación cognitiva, métodos estadísticos y principales hallazgos.
RESULTADOS
La Tabla 1 resume y describe los 27 estudios seleccionados. 26 de los 27 estudios recuperados advirtieron que mayor inflamación se asocia a peor desempeño en dominios cognitivos específicos, con evidencias para las áreas de la atención, memoria, FE, lenguaje y VP. La evidencia a favor de una asociación negativa entre la inflamación y las medidas cognitivas aplicó a adultos de distintas edades tanto en muestras clínicas como no clínicas. Asimismo, ocho estudios longitudinales señalaron que la inflamación es buen predictor del declive cognitivo.
El 60% de los trabajos adoptó diseño transversal, mientras que el resto utilizó diseño longitudinal con dirección prospectiva, a excepción de dos trabajos retrospectivos (ambos, casos y controles).
El 52% de los estudios investigaron muestras no clínicas. De los estudios con muestras clínicas, siete se focalizaron en desórdenes psiquiátricos (mayoritariamente esquizofrenia), tres en HIV positivo, dos en enfermedades neurodegenerativas, y otros dos en pacientes oncológicos y enfermedades críticas, respectivamente. Por otra parte, tres trabajos obtuvieron muestras con N >10000, cuatro con N entre 1000 y 10000, y los estudios restantes oscilaron entre los 50 y 905 participantes. Desde el punto de vista etario, 18 artículos informaron muestras con M de edad inferior a 60 años, y 9 artículos restantes una M de edad mayor a 60 años.
En su conjunto todos los trabajos revisados suman hasta más de 50 biomarcadores inflamatorios distintos y exhiben entre sí una escasa homogeneidad de mediciones, con excepción de la PCR e IL-6, presentes respectivamente en el 48 % y 41 % de los trabajos. A su vez, la mayoría de los estudios recuperados procedieron con mediciones periféricas, y tan solo dos trabajos realizaron mediciones de neuroinflamación.
En cuanto a los dominios cognitivos explorados, estos pueden agruparse en ocho áreas, más específicamente memoria/aprendizaje, atención, lenguaje, FE, habilidades visuoespaciales, visuoconstrucción, VP e inteligencia fluida. La memoria, FE, lenguaje y atención fueron evaluadas en más de la mitad de los trabajos recuperados (77 % de los trabajos evaluó memoria, 70% FE, 66% lenguaje, y 55 % atención). En lo que respecta a los métodos de evaluación de las funciones cognitivas, impresiona la variabilidad de instrumentos utilizados cuando se evalúa un mismo dominio cognitivo.
Los métodos estadísticos se han centrado en la regresión múltiple, regresión logística, correlaciones parciales y ANCOVA. También se realizaron procedimientos de mayor complejidad como el análisis de modelos lineales generalizados, ecuaciones estructurales y curvas de crecimiento latente. Todos los métodos mencionados fueron utilizados para contrastar el grado de asociación entre las mediciones inflamatorias y cognitivas, controlando por educación y edad. (Tabla 1)
Tabla 1 Resumen de 27 estudios de asociación entre inflamación y desempeño cognitivo (PubMed 2017-2022)
| Autores | Diseño | Muestra | Medidas de inflamación | Dominios cognitivos | Test cognitivos | Métodos estadísticos | ¿Se obtuvo asociación negativa entre la inflamación y el desempeño cognitivo en dominios específicos? (✓ Si X No) | ||||
| ¿Clínica o General? | N | Edad | Marcador | P | C | ||||||
| Al-Dujaili et al. (42) | Transversal | Ez | 115 | M 36.3 (10.9) | CCL11 HMGB1 DKK1 IL-6, IL-10 | Si | No | Atención Memoria FE Lenguaje | BACS | Regresión múltiple | ✓ Mayor CCL11, HMGB1, DKK1 e IL-6 fueron predictores de menor desempeño en tareas de atención, memoria y FE. |
| Arce-Rentería et al. (43) | Longitudinal (prospectivo, 12 años de seguimiento) | General | 21782 | M 64.1 (9.1) | PCR | Si | No | Memoria Lenguaje | Recuerdo de lista de palabras; FV | Modelos de curva de crecimiento latente | ✓ Mayor PCR al inicio se asoció con peor lenguaje. x No hubo asociación entre PCR y dominios cognitivos longitudinalmente. |
| Ashraf-Ganjoeui et al. (44) | Transversal | General | 216 | 39.1 (20.2) | PCR | Si | No | Atención Memoria FE Lenguaje IntFluida | TAP; TMT A y B; CVLT; Test Vocabulario; PTS; FV | Modelos lineales generales | ✓ Niveles más altos de PCR se asociaron con peor rendimiento de memoria verbal y atencional. |
| Beydoun et al. (45) | Longitudinal (prospectivo, 4.6 ±0.9 años de seguimiento) | General | 222 | 46.9 (1) (edad al inicio) | IL-1β IL-6 IL-18 | Si | No | Atención Memoria FE, VP Lenguaje HVC HVE | CVLT; Dígitos; BVRT; FS; BTA; TMT A y B; Test del Reloj | Modelos de regresión de efectos mixtos | ✓ Mayor IL-1β se asoció con declive más rápido de FE en >50 años, mientras que en población total, la IL-6 se asoció con declive más rápido de memoria verbal. En ≤ 50 años, la IL-18 se asoció con peor atención al inicio del estudio. |
| Bradburn et al. (46) | Transversal | General | 361 | Jóvenes 23.4(2.7) Mayores 74.4(3.3) | CXCL10 | Si | Si | Memoria FE | CNTABS | Correlación parcial | ✓ CXCL10 en plasma se asoció negativamente con la memoria de trabajo en adultos mayores. |
| Brummel et al. (47) | Longitudinal (prospectivo, medición a 3 y 12 meses) | Enfermedades críticas (IR y shock) | 548 | Mediana 61 (52-70) | IFN-γ,IL-1β, IL-6, IL-8, IL- 10, IL-12 TNF-α, PCR, MMP-9 | Si | No | FE | TMT B | Regresión multivariable | x Los biomarcadores de inflamación no alcanzaron asociación con mediciones cognitivas. |
| Butcher et al. (48) | Transversal | General | 318 rural, 515 urbana | Rural 82.2(4.3) Urbana 76(6,7) | CCL11 | Si | No | Memoria Lenguaje | FCSRT; Isaacs Set Test | Regresión multivariable | ✓ Mayor CCL11 se asoció con peor desempeño en memoria episódica en el grupo de habitantes de áreas rurales. |
| Calice-Silva et al. (49) | Transversal | General | 4327 | M 51.5 (± 9) | GlycA | Si | No | Atención Memoria FE Lenguaje | TMT, Recuerdo de lista de palabra, FV | Regresión múltiple | ✓ Niveles más altos de GlycA se asociaron con un rendimiento más bajo en FE y lenguaje. |
| Chai et al. (50) | Transversal | Demencia y DCL | 378 | Demencia 75.7(7.8), DCL 72 (8.2), GC 68.8 (6.3) | OPN | Si | No | Memoria Atención FE Lenguaje VP HVC | FAB; Dígitos; SpVi; AudD; DígSim; Porteus; TestCanc; Boston; FV; VRCT; Test del Reloj; DisB; PRRT; VRRRT; WLR;SRT | Regresión multivariable | ✓ Una concentración más alta de OPN se asoció con peor desempeño en todos los dominios cognitivos evaluados. |
| Chen et al. (51) | Transversal | Trastornos del ánimo | 110 | TB1 37.2 (9.5) TDM 37.1(12) | IL-6, TNF-α, PCR | Si | No | FE | WCST; Go/no-go task | Modelos lineales generales | ✓ Mayor TNF-α se asoció con disfunción ejecutiva por peor desempeño en WCST. |
| Corey-Bloom et al. (52) | Transversal | Huntington y población general | 73 Hunt 52 sanos | Sanos 54.4, Hunt 56.9, PreHunt 43.4 | IL-6, IL-1β, PCR | Si | No | VP | DígSim | Correlación parcial | ✓En sujetos sanos, la IL-6 (en saliva, pero no en plasma) se asoció negativamente con la VP. x No hubo hallazgos en el grupo con Huntington |
| Dalkner et al. (53) | Transversal | Trastornos psiquiátricos | 364 | 52.4 (7.5) | PCRas | Si | No | Atención FE VP | Stroop; TMT | Regresión múltiple | ✓ La PCR se asoció negativamente con FE (flexibilidad cognitiva) |
| Fard et al. (54) | Transversal | General | 286 | 65.9(4) | TNF-α, IL-6, IL-1β, INF-γ,IL-2IL-4,IL-10 PCRas | Si | No | Atención Memoria VP | Cognitive Drug Research test battery | Regresión múltiple | ✓ Mayor concentración de INF-γ se relacionó con peor atención, y en sujetos con alto IMC, una mayor inflamación se asoció con peor memoria episódica y VP. |
| Fathian et al. (55) | Longitudinal (mediciones al inicio, a 1 mes, a 3 meses y a 6 meses) | Psicosis | 208 | 33.5 (13) | PCR | Si | No | Atención Memoria Lenguaje HVE HVC | RBANS; WAIS III, COWAT; TMT, Stroop; WMS-R; Rey Figure | Modelos de curva de crecimiento latente | ✓ Una reducción en el nivel de PCR predijo una mejora posterior en tareas de lenguaje y atención |
| Henneghan et al. (56) | Transversal | Pacientes oncológicos | 66 | 49 (8.7) | TNF-α, INF-γ GM-CSF, IL-1β, IL-2, IL-4, IL-5, IL-6. IL-7, IL-8 IL-10, IL-12, IL-13 | Si | No | Atención Memoria FE VP Lenguaje | HVLT-R; TMT; COWA | Modelos de regresión aleatoria | ✓ Niveles más bajos de IL-1β, IL-4 y TNF-α se asociaron con mejor memoria verbal. Asimismo, niveles más bajos de GM-CSF, IL-2, IL-1β y más altos de IL-8 se asociaron a mejor desempeño ejecutivo, mientras que niveles más bajos de IL-10, IL-7 e IL-4 se asociaron con mejor lenguaje (fluidez). |
| John et al. (57) | Longitudinal (prospectivo, >40 años de seguimiento) | General | 6276 | 44 años (al iniciar el estudio) | PCR | Si | No | Memoria VP Lenguaje | Recuerdo de lista de palabras; FV y TestCanc | Modelos de ecuaciones estructurales | ✓ Mayor concentración de PCR a los 44 años fue predictor de peor memoria inmediata y tardía a los 50 años. |
| Li et al. (58) | Transversal | Trastorno depresivo mayor (TDM) | 50 TDM sin tto, 30 sanos | TDM: 28.7(9), Sanos: 27.4(9) | TSPO (proteína traslocadora) | No | Si | Atención Memoria Lenguaje HVE,HVC | RBANS | Regresión múltiple | ✓ El aumento de TSPO (en CPF) se asoció a puntajes más bajos en el dominio de atención de RBANS |
| Ruhanya et al. (59) | Transversal | Pacientes con HIV | 139 | entre 21 y 46 años | 14 interleucinas, GCSF, GM-CSF, TNF-α, IFN-γ, y quimiocinas | Si | No | Memoria FE VP | HVLT-R.\ BVMT-R Figura Rey WAIS (dígitos) WMS (span espacial y CM) | Regresión múltiple | ✓ La IL-2 fue predictor negativo de memoria, VP y FE. Asimismo la IL-6 se asoció en forma negativa a VP, memoria, y en forma positiva a tareas de memoria. |
| Saloner et al. (60) | Longitudinal (prospectivo, hasta 5 años de seguimiento) | Pacientes con HIV | 143 | 50.7 (9.6) | PCR | Si | No | Atención Memoria FE, VP Lenguaje | WAIS III (DígSim, BúsqSim,LetNum), TMT, Pasat, WCST, Stroop, FV, HVLT-R, BVMT-R, COWAT,Grooved | Modelos multinivel | ✓ La atención, memoria de trabajo y VP empeoraron a medida que la PCR aumentó, aunque en pacientes con síntomas depresivos de moderados a severos |
| Swanta et al. (61) | Transversal | Pacientes con HIV | 121 | 50 (10) | 26 CTQ inflamatorias, TNF-α, IFN-γ, quimiocinas | Si | No | Atención Memoria FE VP | Software Central Nervous Systems Vital Signs | Regresión multivariable | ✓ CCL8, TIMP1 e IL-23 se asociaron con peor desempeño en los distintos dominios cognitivos evaluados. |
| Vintimilla et al. (62) | Transversal | General | 328 | entre 50 y 85 años | PCR | Si | No | Atención Memoria FE Lenguaje | WMS (memoria lógica),WAIS III (dígitos);FV | Regresión múltiple y regresión logística | ✓ Niveles más altos de PCR predijeron peor desempeño en FE y lenguaje. Participantes con niveles altos de PCR tuvieron 1.7 veces más probabilidades de obtener una puntuación más baja en las tareas de FV. |
| Walker et al. (63) | Longitudinal (20 años de seguimiento) | General | 12336 | 56.8 (5.7) (al iniciar el estudio) | fibrinógeno, glóbulos blancos, VW, factor VIII, PCR | Si | No | Memoria FE VP Lenguaje | DWRT, DSST; FV | Ecuaciones de estimación generalizada | ✓ Concentraciones más altas de inflamación en la mediana edad predijeron un declive más pronunciado de la memoria episódica. |
| Wennberg et al. (64) | Transversal y Longitudinal (prospectivo, hasta 15 meses de seguimiento) | General | 1602 | ≥ 50 años (M 72.8) | IL-6, IL-10 y TNFα | Si | No | Atención Memoria FE Lenguaje HVE HVC | ReyAV,WMS-R (memoria lógica-visual II),TMT B, Boston; FV; DigSim; DisB; FigInc | Regresión logística y modelos multivariable | ✓ Niveles más altos de IL-6 se asociaron transversalmente con peor memoria y lenguaje. Mayor TNF-α se asoció transversalmente a peor lenguaje. x No hubo hallazgos longitudinales. |
| Xiu et al. (65) | Longitudinal (retrospectivo) | Ez | 905 Ez, 571 sanos | Ez 48.4(9.6,sanos 45.8 (12.8) | Alelos de TNF-α 1031T/C | Si | No | Atención Memoria Lenguaje HVE HVC | RBANS | Análisis de covarianza (ANCOVA) | ✓ El desempeño en memoria inmediata y en el índice visoespacial/constructivo varió según el alelo de TNF-α 1031T/C (en pacientes con Ez). |
| Xiu et al. (66) | Longitudinal (retrospectivo) | Ez | 112 Ez, 44 sanos | Ez 51.1(8.8) sanos 47.7(4.5) | TNF-α, IL-2, IL-6 e IL-8. | Si | No | FE Lenguaje | FV; Stroop y WCST | Regresión múltiple | ✓ Interacciones entre IL-8 y BDNF, y TNF-α y BDNF, predijeron la fluidez verbal y la flexibilidad en Ez. |
| Yang et al. (67) | Transversal | General | 10715 | 29.1 (1.8) | PCR | Si | No | FE | Test de dígitos hacia atrás | Regresión múltiple | ✓ Niveles altos de PCR predicen peor memoria de trabajo. |
| Zheng et al. (68) | Longitudinal (prospectivo, 10 años de seguimiento) | General | 5257 | 65.4 (9.4) | PCRas | Si | No | Memoria FE Lenguaje | Recuerdo de lista de palabras; FV | Regresión múltiple y modelos lineales mixtos | ✓ Niveles altos de PCR predijeron un declive más rápido de la memoria y FE. |
*Notas: P: periférica o sistémica; C: central; EZ: esquizofrenia; VP: velocidad de procesamiento; FE: funciones ejecutivas; FV: tareas de fluidez verbal, IntFluida: inteligencia fluida, HVE: habilidades visuoespaciales; HVC: habilidades visuoconstructivas; CCL11: eotaxina; HMGB1: grupo de proteínas de alta movilidad; DKK1: proteínas Dickkopf 1; GLyCA: es una señal de resonancia magnética nuclear que refleja el nivel de proteínas inflamatorias en la sangre; BACS: Evaluación breve de la cognición en esquizofrenia, compuesta por tarea de dígitos, codificación de símbolos, torre de Londres, tareas de memoria verbal, tareas de FV y tarea motora; TAP: Test of attentional performance; CVLT: Test de Aprendizaje Verbal de California; PTS: Performance Testing System; CNTABS: Cambridge Neuropsychological Test Automated Battery System; BVRT: Test de retención visual de Benton; FS: fluidez semántica; BTA: Brief Test of Attention; CXCL10: ligando de quimiocina 10; IR: insuficiencia respiratoria; FCSRT: The Free and Cued Selective Reminding Test; OPN: osteopontina; FAB: Frontal Assessment Battery; SpVi: span visual de la Wechsler Memory Scale-Revised (WMS-R); AudD: Auditory Detection; DígSim: dígitos-símbolos: TestCanc: test de cancelación; FV: fluidez verbal; VRCT: Visual Reproduction Copy Task de la WMS-R; DisB: diseño de bloques de la WAIS; PRRT: Picture Recall & Recognition Tasks WMS-R; VRRRT: Visual Reproduction Recall & Recognition Task WMS-R; WLR: Word List Recall; SRT: Story Recall Task; GC: grupo control; TB1: Trastorno Bipolar tipo 1; TDM: Trastorno Depresivo Mayor; WCST: Wisconsin Card Sorting Test; PCRas: proteína C-reactiva de alta sensibilidad; RBANS: Repeatable Battery for the Assessment of Neuropsychological Status; COWAT: Controlled Oral Word Association Test; WAIS: Wechsler Adult Intelligence Scale; Rey Figure: Rey Osterrieth Figure Test; HVLT-R: Hopkins Verbal Learning Test Revised; CM: control mental WMS-R; tto: tratamiento; GCSF: factor estimulante de granulocitos; GMCSF; factor estimulante de macrófagos y granulocitos; BVMT-R: Brief Visuospatial Memory Test; BusqSim: Búsqueda Símbolos WAIS; LetNum: Letra-números WAIS; VW: factor de von Willebrand; DWRT: Delayed Word Recall Test; DSST: Digit Symbol Substitution Test; Rey AV: Prueba de Aprendizaje Auditivo Verbal de Rey; FigInc: Figuras incompletas WAIS-R.
DISCUSIÓN
Existe interés por determinar si la inflamación afecta la cognición y en que magnitud (25)(26)(27). La presente revisión estuvo dirigida a artículos que investigaron la relación entre inflamación y desempeño cognitivo en mayores de 18 años. Se seleccionaron 27 trabajos publicados entre 2017 y 2022 en la base PubMed. Entre los hallazgos más relevantes, cabe advertir en primer lugar que la mayoría de los estudios, 26 de 27, ofrecieron evidencias a favor de una relación negativa entre biomarcadores de inflamación y el desempeño cognitivo en varios dominios, en especial para atención, memoria, FE, lenguaje y VP. Por lo que en principio la inflamación no parecería estar vinculada al desempeño en un dominio cognitivo en particular, sino a múltiples dominios. Asimismo varios estudios longitudinales (45)(55)(57)(60)(63)(65)(66)(68) señalaron que la inflamación es un importante predictor del declive cognitivo. Esta revisión expone además que la asociación negativa entre las medidas inflamatorias y las cognitivas comprende a personas adultas mayores (43)(46)(48)(50)(54)(63)(64)(68), adultas más jóvenes (42)(44)(45)(49)(51)(52)(53)(55)(56)(57)(58)(59)(60)(61)(63)(65)(66)(67), y a muestras clínicas (42)(50)(51)(53)(55)(56)(58)(59)(60)(61)(62)(63) y no clínicas (43)(44)(45)(46)(48)(49)(52)(54)(57)(62)(63)(64)(67)(68). En efecto, la inflamación afectaría negativamente el rendimiento cognitivo en las distintas etapas de la adultez, y en individuos con y sin antecedentes de enfermedad inflamatoria o neuropsiquiátrica. Vale resaltar que la literatura científica ha propuesto diversos mecanismos en su intento por dilucidar de qué modo la inflamación afecta la cognición, por ejemplo al interferir en procesos de plasticidad neuronal (21), inducir muerte neuronal y procesos neurodegenerativos (21)(28), por atrofia de estructuras cerebrales que sustentan la actividad cognitiva (69), o bien, por el deterioro del funcionamiento endotelial del cerebro (70).
A pesar de que la revisión actual aporta evidencias a favor de una asociación negativa entre la inflamación y la cognición, es necesario advertir que algunos estudios longitudinales no arribaron a los resultados esperados (43)(64). En Arce-Rentería et al. (43) una PCR más alta se asoció transversalmente con peor fluidez verbal, sin embargo esta asociación perdió significación cuando las medidas cognitivas fueron analizadas prospectivamente. De forma similar, Wennberg et al. (64) reportaron asociación transversal entre dos marcadores de inflamación (la IL-6 y el TNFα) y dos dominios cognitivos (memoria y lenguaje), aunque nuevamente esas asociaciones perdieron fuerza cuando se analizaron longitudinalmente. Los autores de ambos estudios (43)(64) atribuyeron la ausencia de asociación al tiempo de seguimiento, porque pudo no haber sido suficiente para detectar el declive cognitivo. En efecto se sugieren nuevos estudios prospectivos de mayor duración como en Walker et al. (63) o John et al. (57). Además en Arce-Rentería et al. (43) y Wennberg et al. (64) la inflamación se midió por única vez al inicio del estudio, y no es posible entonces asegurar el nivel de inflamación durante y al momento de finalizar el seguimiento, ya que por ejemplo la PCR varía individualmente con el tiempo. Un tercer estudio longitudinal (47) tampoco obtuvo resultados esperados, con ausencia de asociación entre citoquinas, quimiocinas, PCR y el desempeño cognitivo. Sus autores recurren entre otras explicaciones a la falta de medición de inflamación central. Además, retomando el razonamiento de los estudios anteriores (43)(65), en Brummel et al. (47) el tiempo de seguimiento también pudo haber sido insuficiente para registrar cambios cognitivos (entre 3 y 12 meses), y fue efectuada una única medición inflamatoria al inicio. Sumado a lo anterior la evaluación de dominios cognitivos se limitó a una única tarea, el TMT B, y a una única función, la flexibilidad cognitiva.
En otro orden de cosas, los estudios recuperados examinaron la inflamación a través de un amplio número de biomarcadores, con decenas de citoquinas, quimiocinas, PCR, TSPO, OPN, GlycA, leucocitos y hasta alelos que codifican proteínas inflamatorias. Ese amplio repertorio de mediciones se traduce en ostensibles diferencias respecto a los criterios adoptados por cada investigador para evaluar la inflamación, asunto que compromete y limita la comparabilidad de resultados entre estudios. A pesar de esa gran dispersión, hay dos medidas que resultaron ser frecuentes, la PCR e IL-6. Por lo tanto, en virtud de unificar criterios de evaluación, se sugiere priorizar biomarcadores de inflamación recurrentes, PCR e IL-6.
Debe tenerse presente que solo dos trabajos informaron marcadores de neuroinflamación (46)(58). Por ejemplo, en Li et al. (58) se evaluó la proteína TSPO, un marcador de actividad microglial, mediante tomografía por emisión de positrones (TEP). Los autores observaron que el aumento de TSPO en la corteza prefrontal se asoció con peor desempeño atencional. Considerando la desigual proporción entre medidas de neuroinflamación y de inflamación periférica, serán conveniente nuevos estudios que exploren la inflamación central, por ejemplo mediante concentración de citoquinas proinflamatorias en líquido cefalorraquídeo, o a través de la exploración de TSPO vía TEP cerebral.
Cabe reflexionar también sobre los criterios y procedimientos de medición cognitiva. En líneas generales los estudios recuperados concuerdan en las áreas cognitivas evaluadas. De hecho la memoria fue evaluada en el 77% de los trabajos, las FE en el 70%, y el lenguaje en el 66%. Sin embargo, distintos trabajos recuperados difieren en los métodos de evaluación para un mismo dominio cognitivo. Por ejemplo para evaluar la memoria/aprendizaje en su modalidad auditivo-verbal, Ashraf-Ganjoeui et al. (44) y Beydoun et al. (45) administraron el test CVLT, Ruhanya et al. (59) y Saloner et al. (60) emplearon el test HVLT-R, y Wennberg et al. (64) el test de Rey. En consecuencia, y a los fines de mejorar la comparabilidad entre estudios se sugiere a investigadores de esta área unificar criterios de selección de los métodos de evaluación cognitiva.
Esta revisión no está exenta de limitaciones. La búsqueda bibliográfica se restringió a la base de datos PubMed, por lo que no es posible descartar que existan otros artículos con información relevante en bases no consultadas. Por el contrario, una fortaleza de esta revisión es haber controlado la validez interna y externa de los artículos seleccionados, excluyendo los estudios que no controlaron los factores de confusión o que informaron tamaños de muestra inferiores a 50 casos.
CONCLUSIÓN
La presente revisión sugiere que un mayor nivel de inflamación se asocia a peor desempeño cognitivo en varios dominios. Los trabajos recuperados evidencian dichos hallazgos para adultos de distintas edades, tanto en población sana como en pacientes con enfermedades psiquiátricas y neurodegenerativas, VIH positivo y otras enfermedades médicas. Asimismo, ocho estudios longitudinales advierten que la inflamación elevada predice un declive cognitivo más pronunciado. Para mejorar en un futuro la comparabilidad entre estudios, se sugiere a investigadores del área, unificar los criterios de selección de biomarcadores inflamatorios y de métodos de evaluación cognitiva. Se recomienda también incorporar medidas de neuroinflamación y estudios longitudinales con seguimientos más prolongados. Finalmente, se espera que este trabajo contribuya a investigadores y clínicos, al resumir y analizar la evidencia reciente relacionada con dos temas cruciales en investigación biomédica y salud pública como son la inflamación y el declive cognitivo.