Introducción
La epilepsia es una condición crónica caracterizada por una hiperexcitabilidad neuronal que provoca una serie de descargas eléctricas anormales en diversas regiones del cerebro (1). Esto genera en los pacientes síntomas como las convulsiones recurrentes, alteraciones del comportamiento, conciencia y a nivel de las sensaciones (2). La epilepsia representa un 1% del total de la población; de los cuales un tercio es diagnosticado con epilepsia refractaria (ER) (3,4). Se postula que su incidencia a nivel mundial es de 65 millones de personas, con alrededor de 20 a 70 nuevos casos por cada 100,000 habitantes (5)(6)(7). En esta línea, el diagnóstico tiende a realizarse clásicamente durante la infancia y el envejecimiento (8); no obstante, aproximadamente el 75% de los casos de epilepsia comienza durante la infancia (2).
Clásicamente, el tratamiento para la epilepsia se enfoca en administración de fármacos antiepilépticos. En este sentido, Iannotti et al. (2014) (9) destacan que los medicamentos antiepilépticos tienen efectos positivos sobre el control de la sintomatología; no obstante, estos son efectivos solo en dos tercios de los pacientes (incluidos aquellos con ER). Este postulado está en línea con otras investigaciones (9)(10), promoviendo el cuestionamiento en la literatura del por qué este tipo de fármacos no son efectivos en todos los pacientes con epilepsia, independiente de su rango etario (11)(12).
Si bien la mayoría de los fármacos antiepilépticos han mostrado eficacia, el problema radica en que la mayoría de estos se han desarrollado en base a pacientes adultos con crisis focales, para luego ser transferidos a su uso en población infantojuvenil donde existen diversos cuadros epilépticos con sintomatología de mayor complejidad (p.e., Síndrome de Dravet, de Lennox-Gastaut y de Doose) (13). En base a esto, líneas de investigación destacan la gran necesidad de nuevas terapias para pacientes con ER (especialmente en etapa infantojuvenil), las cuales puedan promover un control eficaz de la sintomatología, sin interferir en el normal funcionamiento de los pacientes (14)(15).
Las terapias alternativas actuales para pacientes con ER han centrado el foco de interés en el uso de cannabidiol; no obstante, su uso había sido propuesto para el manejo de las convulsiones ya en el año 1881 (16). El cannabidiol (CBD) se ha destacado por su gran potencial benéfico en el control de las convulsiones en la ER; además, por no ejercer efectos psicoactivos (17). Asimismo, diversos estudios en modelos pre clínicos han destacado el efecto positivo de CBD y sus componentes en la reducción de los síntomas convulsivos en la epilepsia (18)(19)(20).
En término general, cannabis es un término genérico el cual incluye a los cannabinoides, la marihuana y el cáñamo; sin embargo, con frecuencia es utilizado como sinónimo de marihuana (21). La literatura reporta la existencia de tres especies principales de cannabis, destacando entre ellas la cannabis sativa, cannabis indica y cannabis ruderalis, las cuales difieren en su composición ya que se reportan más de 200 compuestos en su estructura química, de los cuales 104 corresponden a cannabinoides (22)(23).
En Estados Unidos la cannabis es la segunda droga más consumida después del tabaco, siendo utilizada por alrededor de 178 millones de personas entre 15 años y más (24)(25). Si bien su consumo se ha asociado a efectos negativos como la adicción, también se ha reportado que puede tener un rol terapéutico de importancia en diferentes enfermedades crónicas como el cáncer, enfermedades neurodegenerativas, trastornos metabólicos, dolor neuropático y diabetes (21)(26)(27). Adicionalmente, ensayos clínicos previos han analizado igualmente su uso en pacientes con diagnóstico clínico de epilepsia (28)(29). En línea, el interés de investigación actual se ha enfocado principalmente en el grupo de cannabinoides conocidos como delta-9-tetrahidrocannabinol (Δ9-THC) y CBD (8).
El uso de CBD al igual que diversos fármacos antiepilépticos, tiene un efecto sobre el sistema nervioso central, y conlleva el riesgo de efectos secundarios como riesgo de psicosis (30). Clásicamente, la cannabis medicinal se presenta en formato inhalado; sin embargo, en la actualidad existe una variedad de productos en presentaciones orales (31). En esta línea, Pellesi et al. (2018) (32) postulan que las Preparaciones Orales de Cannabis (POC) son consideradas la más adecuadas para las aplicaciones terapéuticas, ya que, promueven mayor duración de sus efectos y menor exposición a agentes carcinógenos inhalados; pese a esto, las investigaciones en POC en pacientes infantojuveniles con ER son limitadas.
Diversos estudios (33)(34)(35)(36)(37)(38) en población infantil sugieren que el uso de POC en base a CBD para el tratamiento de la epilepsia tiende a ser seguro y eficaz. En contraste, Leo et al. (2016) (39) destacan que aún existe carencia de conocimiento sobre las propiedades farmacocinéticas y dosis de administración de CBD en este grupo de la población.
Las tendencias terapéuticas actuales se orientan a la búsqueda de tratamientos efectivos y no invasivos que permitan disminuir la frecuencia e intensidad de las crisis convulsivas en pacientes con epilepsia. Esto, se suma al incremento en el uso de cannabis en la población a nivel mundial. En consideración, la mayor cantidad de estudios enfocados a estudiar el efecto de CBD para la ER se concentra en población adulta. A partir de esto, resulta necesario poder conocer el potencial terapéutico que tiene el uso de POC en población infantojuvenil, especialmente considerando que son pacientes que se encuentran en una etapa crítica de neurodesarrollo.
Por tanto, el objetivo de la presente revisión es sintetizar la evidencia sobre efectividad y seguridad de POC para el tratamiento de ER en la población infantojuvenil. Los resultados, permitirán a la comunidad médica, farmacéutica y científica contar con una visión generalizada sobre el uso y administración de POC en este grupo de la población como una alternativa terapéutica, orientando así, a una decisión centrada en la evidencia disponible.
Metodología
Se realizó una revisión de alcance bajo los criterios y diagrama de flujo que establece la declaración PRISMA ScR para revisiones de alcance (40). El presente manuscrito no fue registrado en el repositorio PROSPERO. PROSPERO actualmente no acepta registros para revisiones de alcance, revisiones de la literatura o revisiones de mapeo. La lista de chequeo PRISMA ScR para revisiones de alcance puede encontrarse en el material suplementario (Apendice 1)
Estrategia de búsqueda para la identificación de resultados
La búsqueda de los artículos se realizó utilizando las siguientes bases de datos electrónicas, en el orden indicado: SciELO, ScienceDirect, PubMed y Web of Science. Con el propósito de obtener datos actualizados, la investigación estuvo limitada a artículos publicados entre Enero del 2013 y Diciembre del 2020, los cuales estuvieran relacionados con el uso de cannabis en sujetos con epilepsia. La sintaxis general de la búsqueda fue: [epilepsy] AND [cannabidiol], OR [cannabinoids], OR [drug resistant epilepsy], OR [refractory epilepsy], OR [seizures], OR [chilhood], OR [adolescent], adaptada a cada base de datos.
La estrategia completa de búsqueda en todas las bases de datos se presenta en el material suplementario. (Apendice 2)
Selección de los estudios y criterios de selección
Para la selección de los artículos los criterios de inclusión fueron: a) artículos publicados en idioma inglés y español entre Enero de 2013 a Diciembre de 2020, puesto que, en dichos idiomas se concentra la mayor cantidad de evidencia disponible sobre la temática; b) población de estudio con diagnóstico clínico de epilepsia o epilepsia asociada a síndrome principal, menores a 20 años de edad; c) ensayos clínicos desde fase 1, considerando resultados tanto transversales o longitudinales; d) estudios con preparaciones farmacéuticas y artesanales administradas por vía oral sin limitación de dosificación mínima; e) estudios que reportaran datos sobre efectividad a través de variables como: recuento de número de crisis convulsivas, medición de actividad eléctrica cerebral, cambios conductuales, cognitivos o emocionales. En cuanto a los criterios de exclusión, no fueron considerados en la presente revisión de alcance: a) estudios en animales; b) estudios pre-clínicos y de fase 0; c) revisiones sistemáticas con o sin meta-análisis; d) estudio de casos.
Extracción de datos
Inicialmente, con el objetivo de eliminar artículos duplicados, se procedió a importar los estudios a software Mendeley versión 1.19.4. Luego, se realizó la selección de los artículos a través de lectura de título y resumen. Se seleccionaron los artículos que cumplían con los criterios de inclusión y, cuando las decisiones no se podían tomar solo a partir del título y resumen, se recuperaron también los documentos a texto completo. Los artículos seleccionados fueron verificados de forma independiente por 2 revisores (B.B y D.T.R ). No obstante cuando existieron discrepancias, se consultó a un tercer revisor (I.C).
Herramientas de evaluación de calidad metodológica
La evaluación del índica de calidad metodológica de los 7 artículos incluidos en esta revisión, se realizó mediante la Escala de Jadad (41). La elección de esta escala se basó en que es un instrumento diseñado y validado para evaluar de manera independiente la calidad metodológica de los estudios clínicos. De acuerdo al instrumento, se les asignó a cada artículo incluido en la presente revisión un puntaje que fluctuó entre 0 a 5 puntos. De acuerdo a sus lineamientos, se consideró como baja calidad metodológica aquellos estudios que obtuvieran un puntaje inferior a 3. Asimismo, cabe destacar que cada artículo fue calificado de forma independiente por los 2 revisores mencionados y se compararon las puntuaciones. Cuando hubo desacuerdo, se incorporó el tercer evaluador para lograr consenso.
Estrategia para la síntesis de datos
La presente revisión de alcance proporcionó una síntesis narrativa de los hallazgos a partir de los estudios incluidos y relacionados con la administración de preparaciones orales de cannabis artesanales y farmacéuticas para el tratamiento de las ER en población infantojuvenil. La información principal se presenta en la sección de resultados, la cual incluye 3 tablas de resúmenes con las principales conclusiones de los artículos incluidos. De forma complementaria, durante la discusión se analizan los principales reportes relacionados con efectividad y seguridad en los artículos seleccionados. Finalmente, se presentan sugerencias claves para el desarrollo de futuras investigaciones, con el propósito de promover evidencia científica de mayor calidad metodológica.
En forma complementaria, se presenta en la Tabla 1 un análisis de los artículos incluidos en la presente revisión de alcance (42)(43)(44)(45)(46)(47)(48), organizando la información en base a características generales de los estudios, así como sus objetivos y población incluida. Asimismo, la Tabla 2 presenta una síntesis de los estudios enfocada en la efectividad del uso de POC en sus presentaciones tanto farmacéuticas como artesanales. Finalmente, la Tabla 3 presenta un análisis de las principales reacciones adversas reportadas por los diferentes estudios, en conjunto con los principales hallazgos de los 7 estudios incluidos en la presente revisión de alcance.
Resultados
Búsqueda de literatura
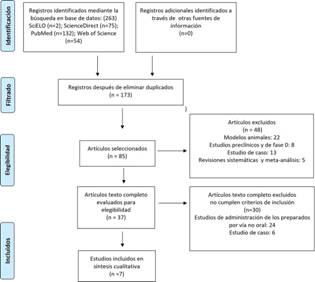
La búsqueda y selección de las publicaciones realizada en la presente revisión de alcance se ilustra en el diagrama de flujo PRISMA representado en la Figura 1. Un total de 263 títulos fueron identificados inicialmente en las bases consultadas, los cuales se redujeron tras la eliminación de duplicados a 133. Posteriormente, se aplicaron los criterios de cribado y de elegibilidad, los cuales consideraban; rango etario menor a 20 años de edad, administración de las preparaciones por vía oral, reporte de datos relacionados con efectividad y tipo de estudio realizado. Con base a los criterios de elegibilidad, se obtuvieron 85 artículos, seleccionando posteriormente 55 para ser analizados a texto completo tras aplicar los criterios de exclusión. En la etapa final, aplicando criterios de selección, el proceso de búsqueda culminó con 7 artículos seleccionados para análisis cualitativo de la información. (Figura 1)
Características generales de los estudios analizados
Los 7 estudios (42)(43)(44)(45)(46)(47)(48), considerados en la presente revisión de alcance incluyeron una muestra total de 471 sujetos, de los cuales únicamente se consideró en el análisis 414. Los participantes restantes abandonaron y/o no completaron los estudios; no obstante, se debe considerar que algunos de ellos correspondían al grupo placebo. La edad de los sujetos incluidos fluctuó entre 6 meses y 20 años de edad, siendo los diagnósticos de mayor prevalencia, asociados a epilepsia, los síndromes de Lennox-Gastaust, Dravet, Doose, Landau-Kleffner y West. Por otra parte, en relación a la variable sexo, ésta fue reportada sólo en 3 de los 7 estudios incluidos (53% mujeres) (Tabla 1).
Tabla 1 Cuadro resumen estudios seleccionados.
| Primer autor, año | Devinsky, 2018 (42) | McCoy, 2018 (43) | Press, 2015 (44) | Treat, 2016 (45) | Tzadok, 2016 (46) | Porcari, 2018 (47) | Hausman-Kedem, 2018 (48) |
| Título | Randomized, dose-ranging safety trial of cannabidiol in Dravet syndrome | A prospective open-label trial of a CBD/THC cannabis oil in Dravet syndrome | Parental reporting of response to oral cannabis extracts for treatment of refractory epilepsy | Duration of use of oral cannabis extract in a cohort of pediatric epilepsy patients | CBD-enriched medical cannabis for intractable pediatric epilepsy: The current Israeli experience | Efficacy of artisanal preparations of cannabidiol for the treatment of epilepsy: Practical experiences in a tertiary medical center | Efficacy of CBD-enriched medical cannabis for treatment of refractory epilepsy in children and adolescents - An observational, longitudinal study |
| Diseño de estudio | Ensayo clínico controlado, aleatorizado, doble ciego. Diseño experimental | Estudio transversal (prospectivo). Diseño experimental | Estudio retrospectivo. Diseño no experimental | Estudio retrospectivo. Diseño no experimental | Estudio retrospectivo. Diseño no experimental | Estudio retrospectivo. Diseño no experimental | Ensayo no controlado (observacional, longitudinal) |
| Objetivo | Evaluar la seguridad y farmacocinética preliminar de formulación farmacéutica de CBD purificado en niños con Síndrome de Dravet | Establecer la dosificación y la tolerabilidad de un extracto de cannabis (TIL-TC150) en niños con síndrome de Dravet | Reportar la eficacia de POC en pacientes pediátricos con epilepsia | Evaluar la duración del uso de POC como una medida del beneficio percibido en una cohorte de pacientes con epilepsia pediátrica | Describir la experiencia del uso en niños y adolescentes con diagnóstico de epilepsia intratable, mediante el uso de preparaciones de cannabis | Determinar la eficacia de los preparados artesanales de CDB en niños con epilepsia | Evaluar la eficacia del cannabis medicinal para el tratamiento de la epilepsia refractaria |
| Muestra | 4 Grupos: Grupo CBD 1 (N=10), Grupo CBD 2 (N=8), Grupo CBD 3 (N=9), Grupo placebo (N=7) | 1 grupo experimental (N=20) | Grupo de estudio (N=75) | Grupo de estudio (N=119) | 6 grupos de estudio en base a diagnóstico clínico (N1=25, N2=20, N3=8, N4=3, N5=11, N6=7) | 3 grupos experimentales. Grupo CBD (N=48). Grupo CBD más clobazam (N=54). Grupo clobazam (N=74) | Grupo de estudio (N=57) |
| Edad (años) | 4 a 10 años | 2 a 17 años | 6 meses a 18 años | 6 meses a 18 años | 1 a 18 años | 1 a 18 años | 1 a 20 años |
| Sexo % (H/M) | - | 50/50 | 45/55 | - | - | 46/54 | - |
| Muestra (I/F) | 34/32 | 20/19 | 75/75 | 119/84 | 74/74 | 176/102 | 57/46 |
| Diagnóstico clínico | Síndrome de Dravet | Síndrome de Dravet | Síndrome de Dravet, Síndrome de Doose, Síndrome de Lennox-Gastaut | Síndrome de Dravet, Síndrome de Doose, Síndrome de Lennox-Gastaut | Encefalopatía epiléptica con etiología genética conocida, Encefalopatía epiléptica sin etiología genética conocida, Daño cerebral adquirido, Malformaciones congéticas cerebrales, Encefalopatía isquémica-hipóxica, otros síndromes no especificados | Síndrome de Lennox-Gastaut, Síndrome de West, Síndrome de Dravet, Epilepsia de ausencia infantil, y otros tipos de epilepsia | Malformaciones corticales, Encefalopatía epiléptica con etiología genética conocida, Encefalitis viral, y otras formas de epilepsia |
| Origen de la muestra | MC | HOSP | HOSP | HOSP | HOSP | HOSP | HOSP |
| Puntaje Escala Jadad | 5 | 1 | 0 | 0 | 0 | 1 | 1 |
*Nota: (-): no reportado. H: hombre. M: mujer. I: inicial. F: final. MC: multicentro. HOSP: Hospital.
Evaluación de calidad metodológica
En base a los criterios de la Escala de Jadad (41), se realizó el análisis de los 7 artículos seleccionados en esta revisión de alcance (Tabla 1). Del análisis de calidad metodológica se observó que únicamente el estudio realizado por Devinsky et al. (2018) (42) obtuvo la asignación máxima de 5 puntos. En contraste, en los 6 estudios restantes tras el análisis realizado se obtuvo una baja calidad metodológica (puntaje menor a 3); siendo 3 artículos calificados con puntuación total 0 (44)(45)(46), y los 3 restantes con puntaje total de 1 (43)(47)(48).
Efectividad POC farmacéutica y artesanal
Respecto al total de estudios seleccionados (Tabla 2), en 2 de ellos (42)(43) se administró POC de origen farmacéutico, y en 5 (44)(45)(46)(47)(48) POC de origen artesanal. A lo anterior se agrega, que en la totalidad de los estudios seleccionados los sujetos permanecieron durante el periodo de administración de los POC, bajo administración de fármacos antiepilépticos, tales como: clobazam, levetiracetam, lamotrigina, lacosamida, carbamazepina, neurofarm, ácido valproico, y topiramato.
De la totalidad de los estudios seleccionados, 4 reportaron las fórmulas utilizadas (42)(43)(46)(48), las cuales estaban representadas por CBD/THC, CBD/THC y CBD purificado. De acuerdo a los reportes de Tzadok et al. (2016) (46) y Hausman-Kedem et al. (2018) (48) en sus estudios se estandarizaron las concentraciones de ingredientes y se aseguró la calidad en la elaboración del producto final, mediante utilización de cromatografía liquida de alto rendimiento, espectrometría de masas y cromatografía de gas. Los restantes estudios en los cuales se administraron preparaciones de origen artesanal, no reportaron análisis de estandarización de concentraciones. Del total de estudios, 5 (42)(43)(46)(47)(48) reportaron las dosificaciones utilizadas, las cuales fluctuaron en un rango entre 0.0018 a 50 mg/kg por día.
La información relacionada con la efectividad de las POC fue analizada de acuerdo con la disminución y el aumento en la frecuencia de crisis convulsivas. En esta línea, sólo un estudio analizado no reportó datos sobre la efectividad en la disminución de las crisis convulsivas (42), siendo el promedio general en los 6 estudios restantes del 41.3% en la efectividad de los fármacos para disminuir las crisis.
En referencia a la efectividad de las POC de origen farmacéutico, se consideró únicamente el estudio realizado por McCoy et al. (2018) (43), el cual reporta efectividad del 47% en la disminución de crisis convulsivas durante el periodo de pre tratamiento. De los 5 estudios en que se administró POC de origen artesanal, sólo reportó disminución en la frecuencia de crisis convulsivas, sobre el 50% durante el periodo de pre tratamiento, los estudios de Tzadok et al. (2016) (46) con un 51% versus un 52% de efectividad reportado en el estudio de Hausman-Kedem et al. (2018) (48), en sus respectivas muestras. En contraste, del total de sujetos incluidos en la presente revisión de alcance (41), de las 157 personas, sólo un 10.6% reportó aumento de las crisis convulsivas en comparación al periodo pre-tratamiento.
Tabla 2 Cuadro resumen efectividad POC farmacéutica y artesanal.
| Primer autor, año | Devinsky, 2018 (42) | McCoy, 2018 (43) | Press, 2015 (44) | Treat, 2016 (45) | Tzadok, 2016 (46) | Porcari, 2018 (47) | Hausman-Kedem, 2018 (48) |
| Preparación | FAR | FAR | ART | ART | ART | ART | ART |
| Formulación | CBD libre de THC | CBD/THC | - | - | CBD/THC | - | CBD/THC |
| Dosis diaria | 5 mg/kg 10 mg/kg 20 mg/kg | 2-16 mg/kg 0.04-0.32 mg/kg | - | - | 1-10 mg/kg 10-20 mg/kg | 0.018-50 mg/kg 5.8 mg/kg 1.5 mg/kg | 4-32 mg/kg |
| Periodo administración (semanas) | 3 | 3 | 26 | 52 | 13-26 | - | - |
| Efectividad (disminución crisis convulsivas) (%) | - | 9/19 (47%) | 25/75 (33%) | 20/84 (24%) | 38/74 (51%) | 42/102 (41%) | 24/46 (52%) |
| Aumento de crisis convulsivas (%) | 1/32 (3%) | 4/19 (21%) | 10/75 (13%) | 10/84 (12%) | 13/74 (18%) | 3/102 (2.9%) | 2/46 (4%) |
| Medición convulsiones | - | Reporte por padres/tutores legales EEG | Registro-análisis FC Reporte por padres/tutores legales | Registro-análisis FC Reporte por padres/tutores legales | Registro-análisis FC Reporte por padres/tutores legales | Registro-análisis FC | Reporte por padres/tutores legales |
| Estudios complementarios | MSANG pre-post CBD HEMT BIOQ ExFís SigVit ECG | EEG IndCV ExNeuro | EEG Análisis S/V | - | BIOQ CLAR | EEG RM | CLAR CGAS ESPMAS |
| Hallazgos | El CBD no afectó los niveles de fármacos antiepilépticos. La exposición a CBD y sus metabolitos aumentó proporcionalmente con la dosis administrada. El CDB produjo más efectos adversos que el placebo administrado. | Se observaron anomalías de las transaminasas hepáticas y plaquetas en sujetos que recibían ácido valproico. El fármaco CDB/THC fue seguro y bien tolerado, dando como resultado una reducción en el recuento de convulsiones y una mejora calidad de vida. | El estudio demostró que algunas familias informaron una mejoría tras el uso de POC en pacientes pediátricos con epilepsia. | La tasa de respuesta fue variable en base al diagnóstico clínico. Los pacientes con Síndrome de Lennox-Gastaut presentaron una tasa de respuesta estadísticamente significativa. Los sujetos con Síndrome de Dravet y Síndrome de Doose presentaron las tasas de respuesta más bajas. | El tratamiento CDB produjo un efecto positivo en la carga de convulsiones en niños y adolescentes con epilepsia refractaria. Los grupos conformados por encefalopatías epilépticas con o sin mutaciones genéticas conocidas presentaron mejor respuesta en relación a la disminución en la frecuencia de crisis convulsivas. | Los hallazgos apoyan la eficacia de las preparaciones de CBD ART para la reducción de crisis convulsivas, con pocos efectos secundarios significativos. La respuesta al CDB fue independiente del uso clobazam. Se reporta una diferencia que no es estadísticamente significativa en la disminución de la frecuencia de convulsiones entre los grupos: CBD, más clobazam, CBD y grupo clobazam. | Los resultados sugieren que la adición de extracto de cannabis enriquecido con CDB para el régimen de tratamiento de los pacientes con epilepsia refractaria puede resultar en una reducción significativa en la frecuencia de crisis convulsivas. Se plantea que la administración sublingual es tres veces más alta que la administración oral, lo cual podría relacionarse con una mayor eficacia. |
*Nota: (-): no reportado. FAR: farmacéutica. ART: artesanal. MSANG: muestra de sangre. HEMT: hematología. BIOQ: bioquímica. ExFís: examen físico. SigVit: signos vitales. ECG: electrocardiograma. EEG: electroencefalografía. IndCV: índice calidad de vida. ExNeuro: examen neurológico. FC: frecuencia cardiaca. S/V: sueño-vigilia. CLAR: cromatografía líquida de alto rendimiento. RM: resonancia magnética. CGAS: cromatografía de gases. ESPMAS: espectrometría de masas.
Seguridad en el uso de POC
La reacción adversa con mayor prevalencia fue la somnolencia/fatiga reportada en 6 de los 7 estudios, fluctuando entre un 8.3% y un 89.5% de los sujetos incluidos con un promedio general de 27.4%. La segunda mayor prevalencia de reacciones adversas se reportó por pérdida de peso y/o disminución del apetito, correspondiendo a un 17.6% del total de la muestra. Por su parte, la tercera reacción adversa con mayor prevalencia (12.2%) correspondió a los síntomas de irritabilidad y/o agresividad reportada sólo en 3 estudios. Finalmente, cabe destacar que los trastornos gastrointestinales (8.2%) y los síntomas de sedación tras la administración de POC, fueron las reacciones adversas con menor prevalencia en los estudios analizados (Tabla 3).
Tabla 3 Reacciones adversas más frecuentes en cada estudio
| Ref. | Somnolencia/Fatiga (%) | Trastornos Gastrointestinales (%) | Irritabilidad/Agresividad (%) | Pérdida de peso/Disminución del apetito (%) | Sedación (%) |
| (42) | 5/32 (15.6%) | - | - | 5/32 (15.6%) | - |
| (43) | 17/19 (89.5%) | 1/19 (5.3%) | 4/19 (21.1%) | 5/19 (26.3%) | - |
| (44) | 9/75 (12%) | 8/75 (10.7%) | - | - | - |
| (45) | 7/84 (8.3%) | 6/84 (7.1%) | - | - | - |
| (46) | 16/74 (21.6%) | 5/74 (6.8%) | 5/74 (6.8%) | - | - |
| (47) | - | - | - | - | 4/102 (3.9%) |
| (48) | 8/46 (17.4%) | 5/46 (10.9%) | 4/46 (8.7%) | 5/46 (10.9%) | - |
*Nota: Ref.: referencia. (-): no reportado.
Discusión
A pesar de que las POC han demostrado cierto grado de efectividad en la disminución de la frecuencia de crisis convulsivas en pacientes con ER en nuestro análisis, Neale (2017) (49) destaca que dicha efectividad podría estar asociada a características como etiología de la epilepsia y a la administración de fármacos antiepilépticos. En línea, cabe destacar que en el caso de los estudios analizados en la presente revisión, la administración de otros fármacos antiepilépticos podría ser considerada como un factor que pudo haber potenciado/antagonizado los efectos de los POC.
Treat et al. (2017) (45) refieren que los pacientes diagnosticados con el síndrome de Lennox-Gastaut presentan una tasa de respuesta favorable, significativamente mayor en la disminución de la frecuencia de las crisis convulsivas en comparación a otras patologías epilépticas. Esto, está en línea con los reportes del estudio realizado por Hausman-Kedem et al. (2018) (48), quienes refieren que la tasa de respuesta es variable entre las diferentes etiologías de epilepsias.
Neale (2017) (49) en su estudio destaca que la dosis terapéutica atingente de CBD para la población infantojuvenil, aún no ha sido consensuada. Sin embargo, otro estudio (42) menciona efectos positivos en las concentraciones plasmáticas de CBD y sus metabolitos, reportando que a mayor dosis administrada (rango entre 5 a 20 mg/kg/día), menor es la frecuencia de las crisis convulsivas. Estos datos están en línea con los hallazgos de Hausman-Kedem et al. (2018) (48), los cuales reportan que a mayor dosis de CBD, mayor tasa de respuesta al tratamiento representada por una disminución en la frecuencia de crisis convulsivas.
Tanto la efectividad como los efectos adversos relativamente similares entre los POC de origen farmacéutico y artesanal reportados en los estudios analizados, podrían estar asociados al CBD como principal principio activo y al origen natural de las preparaciones farmacéuticas. Sin embargo, la relativa facilidad para obtener un aceite de cannabis artesanal, no debe hacer suponer que su elaboración sin control asegure una provisión adecuada de sus principios activos. Nuestro planteamiento se sustenta en que las concentraciones de los principios activos se encuentran influenciadas por condiciones como métodos de cultivos, condiciones geoclimáticas, partes procesadas de la planta, y por las técnicas de procesamiento utilizadas (50)(51)(52)(53)(54).
Por otra parte, Stella (2013) (55) menciona que el Δ9-THC y sus derivados alteran el equilibrio natural de los endocannabinoides, originando respuestas como disminución en la coordinación motora, el procesamiento de operaciones temporales y el aprendizaje asociativo; además de alteraciones en la percepción y audición. Adicionalmente, dependiendo de la frecuencia de consumo, edad de inicio, las concentraciones de CBD que se utilizan, y la sensibilidad de las personas, su uso podría causar trastornos psicológicos (56). En consideración, en el total de los estudios analizados en la presente revisión de alcance, no se reportaron presencia de efectos sobre la percepción, memoria, orientación y aprendizaje asociados a la administración de Δ9-THC. Esta situación podría estar asociada con las bajas concentraciones de Δ9-THC disponibles en las preparaciones. Asimismo, cabe destacar que en los estudios analizados no se reportaron casos de letalidad/mortalidad relacionadas a la administración de los POC en la población infantojuvenil sometida a estudio.
De nuestro conocimiento, existe una revisión de literatura previa (57) cuyo objetivo fue determinar los efectos adversos de CBD y su toxicidad; no obstante, en los estudios analizados se consideran artículos de los años 90 y la población objetivo incluye en su mayoría población adulta y adulta mayor. Por otra parte, recientes revisiones de literatura (58)(59) abordan el uso de CBD en Síndrome de Dravet y Síndrome de Lennox-Gastaut, con el objetivo de entregar lineamientos sobre su uso. Sus resultados sugieren que la administración de CBD como tratamiento alternativo debe ser evaluado en forma individual, considerando la eficiencia y seguridad en cada caso. En contraste, otros recientes estudios experimentales (60)(61) que incluyeron población infantil y adulta, destacan que el uso de CBD en estos grupos no generaría efectos secundarios a nivel cognitivo y conductual; sin embargo, sugieren mayor investigación replicando los protocolos implementados en cuanto a dosis para obtener resultados más objetivos y confiables en el tratamiento de pacientes con epilepsia. En consideración, nuestra revisión se destaca por su enfoque exclusivo en población infantojuvenil, destacando no sólo los efectos adversos de los estudios analizados, sino que también, dando énfasis en la efectividad, seguridad y análisis de las dosis de administración.
Limitaciones y lineamientos futuros
En cuanto a las limitaciones del estudio, es importante destacar en primera instancia que la revisión de alcance no comprende un metaanálisis de los siete estudios incluidos. Adicionalmente, la síntesis de la información presentada es cualitativa, lo cual genera limitaciones para determinar la efectividad del uso de POC en pacientes infantojuveniles con ER. Otro aspecto a considerar, es el filtro de años utilizados, puesto que, si bien la búsqueda total entrega un número limitado de artículos para análisis cualitativo, esto se debe a que la mayor cantidad de estudios clínicos se enfoca en población adulta y adulta mayor. Asimismo, en cuanto al idioma de los estudios publicados, extiende una clara tendencia a ser publicados en idioma inglés versus español, el cual también fue un criterio establecido en nuestra metodología.
Por otra parte, en los últimos años se han realizado avances significativos asociados al uso de POC; no obstante, es pertinente destacar que las investigaciones actuales y consideradas en la presente revisión destacan por una baja calidad metodológica. De acuerdo con la Escala de Jadad (41), se considera como riguroso un estudio clínico a aquel que obtiene un mínimo de 5 puntos, lo cual en base a nuestros resultados obtenidos, sólo se evidenció en un estudio (42). Las principales deficiencias en las metodologías de los estudios incluidos están dadas por no describirse como estudios doble ciego aleatorizados, con ausencia de grupo de control y sin una metodología adecuada de aleatorización ni enmascaramiento. Pese a la baja valoración de los estudios incluidos, estos fueron igualmente incluidos en la presente revisión de alcance, dado que no se pesquisaron en base a nuestros criterios de inclusión/exclusión, estudios de mayor calidad metodológica.
Futuras investigaciones, deberían considerar no sólo los síntomas adversos reportados con frecuencia en los estudios, sino que también el impacto del uso de POC sobre las funciones cognitivas en este grupo de pacientes, teniendo como premisa que es un periodo crítico para el neurodesarrollo. Finalmente, cabe destacar que la presente revisión de alcance entrega una visión general sobre el uso de POC para el tratamiento de la ER, permitiendo dar directrices basadas en la evidencia disponible, a los profesionales involucrados en el diagnóstico y tratamiento de este cuadro clínico, a la hora de tomar decisiones sobre su uso como terapia alternativa para el manejo de síntomas.
Conclusiones
De acuerdo con los resultados obtenidos, las POC de origen farmacéutico y artesanal, presentaron un grado variable de efectividad (41.3% en disminución de crisis convulsivas) y seguridad (reacciones adversas reportadas ≤ 27.4%). No obstante, es necesario considerar que los estudios analizados fueron de una baja calidad metodológica. En consideración, la elección de administración de POC como diana terapéutica debe ser analizada con precaución, y no ser considerada como la primera opción terapéutica para las crisis convulsivas en población infantojuvenil; sino que, como un tratamiento complementario para pacientes con epilepsia.
Finalmente, es necesario la realización de estudios rigurosos y de alta calidad metodológica orientados a evaluar la efectividad y seguridad de las POC de origen farmacéutico y artesanal, mediante estudios aleatorizados, doble ciego y longitudinales en la población referida. Asimismo, futuros estudios clínicos deberían orientar su objetivo a determinar posibles concentraciones y dosificaciones pertinentes para el manejo de este grupo de pacientes.