Introducción
El envejecimiento considera diversos cambios que afectan la calidad de vida, siendo los cerebrales y cognitivos de interés en investigación(1)(2). La disminución persistente en el volumen de los lóbulos frontal y temporal son comunes, repercutiendo en la función ejecutiva, la velocidad del procesamiento, la memoria, la atención, el lenguaje y por ende, en los mecanismos de neuroplasticidad(3)(4)(5).
El Deterioro Cognitivo Leve (DCL) es un estadio intermedio entre el envejecimiento normal y patológico pero que no afecta la independencia en las actividades diarias(6)(7)(8). A nivel mundial, afecta a personas de 60 años y más, con una prevalencia anual de 13.2/1.000 habitantes(6). Líneas de investigación(6)(9), señalan que un diagnóstico tardío de DCL está asociado a el progreso hacia estadios de demencia avanzada dentro de los próximos 5 años de diagnosticado el cuadro.
Si bien el déficit en memoria es característico en el DCL de tipo amnésico y amnésico multidominio, también se han reportado declives en las habilidades visuoespaciales, la atención, el funcionamiento ejecutivo y el lenguaje (p.e., DCL no amnésico de dominio único) (8)(10) . La gravedad y el tiempo de expresión del perfil neurocognitivo, son claves para determinar el progreso a demencia tipo Alzheimer, demencia frontotemporal, demencia por cuerpos de Lewy y/o demencia Vascular.
Las demencias son uno de los mayores desafíos para la salud pública a nivel mundial(11) debido al deterioro cognitivo significativo, las manifestaciones conductuales y la heterogeneidad de éstas(12)(13) . Los cuadros de demencia más frecuentes y estudiados son la demencia tipo Alzheimer (EA) y la demencia frontotemporal (14); no obstante, también se imponen otros por su alta prevalencia como la demencia por cuerpos de Lewy (DPCL), la enfermedad de Parkinson (EP) asociada a demencia, y la demencia vascular (DV) (15)(16).
La DPCL constituye una forma común de demencia, y en algunos casos asociada a EP y EA. Su prevalencia fluctúa alrededor del 5% y hasta un 30% del total de casos de demencia (17). Neuropatológicamente se caracteriza por alteraciones en la corteza cerebral, en los núcleos del tronco encefálico y en partes del prosencéfalo, debido a la formación de fijaciones neuronales de proteínas de filamento anormalmente fosforiladas, agregadas con α-sinucleína y ubiquitina (18)(19). Desde una perspectiva neuropsicológica, los declives característicos involucran la memoria, atención, funcionamiento ejecutivo y habilidades visuoespaciales; sin embargo, también se reportan dificultades lingüísticas y comunicativas (20).
Cabe destacar, que se han reportado algunas similitudes con otros cuadros clínicos. La pérdida neuronal colinérgica en sujetos con DPCL justifica el deterioro cognitivo y emocional, como ocurre en la EA mientras que la disminución de neuronas dopaminérgicas expresaría déficits similares a EP. Estas similitudes, dificultan el diagnóstico certero y diferencial entre EA y EP, lo cual repercute en las intervenciones terapéuticas (21).
Por su parte, la EP es un cuadro neurodegenerativo con alta prevalencia junto a la EA, siendo su curso clínico variable (22). Clásicamente, las asociaciones en EP guardan relación con dificultades motoras; sin embargo, durante etapas iniciales, un 30-40% de los sujetos puede presentar DCL asociado a EP (23); impactando en la calidad de vida y las tasas de mortalidad (24). La memoria de trabajo y las funciones ejecutivas serían las habilidades con mayor afectación; mientras que la atención, las funciones visuoespaciales y la fluidez verbal semántica, tendrían menor deterioro (25). No obstante, Smith & Caplan (2018) (23) destacan que los déficits lingüísticos (a nivel de sintaxis y gramática) serían claves para el progreso del cuadro.
Desde otra perspectiva, la DV es la segunda causa de demencia con una prevalencia del 15-30% (26). Sengupta et al. (2019) (27) establecen una heterogeneidad en la DV, destacando que los declives cognitivos no sólo involucran la memoria, sino también el lenguaje. Si bien, el compromiso lingüístico requiere mayor investigación en la DV, hallazgos sugieren dificultades en el reconocimiento, nominación y en la repetición de las palabras; declives similares reportados en EA (28).
El diagnóstico neuropsicológico en el DCL y estas formas de demencias son un desafío para los profesionales de salud en etapas iniciales. La etiología multifactorial, y los síntomas cognitivos-lingüísticos que se superponen, promueven mayor investigación para mejorar la identificación de sintomatología neuropsicológica certera en este grupo de pacientes. Si bien, la investigación se ha enfocado principalmente en la EA y demencia frontotemporal (29) aún se debe profundizar en la sintomatología cognitiva-lingüística reportada en estas demencias. Por tanto, el objetivo de la presente revisión de la literatura es caracterizar los perfiles cognitivos-lingüísticos en personas mayores con DCL, DPCL, DV y EP. Los hallazgos permitirán a los diferentes profesionales de salud ligados al trabajo con esta población, mejorar los procesos de detección, evaluación, diagnóstico y posterior tratamiento en estos pacientes.
Metodología
La presente revisión de literatura se realizó considerando los criterios y diagrama de flujo establecidos en la declaración PRISMA (30).
Estrategia de búsqueda para la identificación de estudios
La búsqueda de referencias bibliográficas consideró las bases de datos Pubmed, Scopus y Web of Science. La búsqueda estuvo limitada a artículos publicados entre los años Enero 2000 y Diciembre 2020. La sintaxis general de la búsqueda fue: [aging] AND [cognitive function] AND [language impairment] OR [mild cognitive impairment] OR [dementia] OR [vascular dementia] OR [parkinson disease] OR [lewy bodies dementia], todos los términos adaptados a cada base de datos.
Selección de estudios y criterios de inclusión/exclusión
No se aplicaron criterios de exclusión por género. Los artículos seleccionados para efecto de filtrado por título y resumen debían cumplir con los siguientes criterios de inclusión: ser estudios de cohorte y revisiones sistemáticas con reporte de evaluación neuropsicológica para cognición y lenguaje, estudios exclusivamente en idioma inglés (dicho idioma concentra el mayor número de publicaciones en el área), y reportar participantes con diagnóstico clínico de DCL, DV, DPCL y/o EP, desde los 60 años de edad cronológica. Se excluyeron documentos editoriales, protocolos o tesis, estudios en animales, pacientes con otras formas de demencia (p.e., demencias mixtas) y con antecedentes de delirium o patología psiquiátrica (p.e., esquizofrenia).
Extracción de datos
Inicialmente con el objetivo de eliminar artículos duplicados, se procedió a importar los estudios a software Mendeley versión 1.19.4. Posteriormente, dos revisores aplicaron los criterios de inclusión/exclusión a todos los títulos y resúmenes. Consecuentemente, se seleccionaron aquellos artículos que cumplían con los criterios de inclusión establecidos; siendo recuperados los documentos a texto completo cuando las decisiones no se podían tomar sólo a partir del título y el resumen. El proceso de selección de artículos fue realizado por dos investigadores en forma independiente (C.M.W y D.T.R); no obstante, un tercer investigador (C.M.O) confirmó la selección para evitar discrepancias.
Estrategia para la síntesis de datos
Se proporcionó una síntesis narrativa de los hallazgos a partir de los estudios incluidos, presentando las principales características de estos en la Tabla 1. La síntesis realizada resume las características generales de los estudios, considerando antecedentes de la población analizada, promedio y rango de edad, así como los instrumentos y medidas utilizadas (Tabla 1). Adicionalmente, en la Tabla 2 se presenta el resumen de los principales hallazgos cognitivos-lingüísticos para los cuadros de DCL, DV, DPCL y EP.
Resultados
Búsqueda de literatura
El proceso paso a paso de selección de artículos se ilustra en el diagrama de flujo establecido por la declaración PRISMA (Figura 1). En total, se identificaron títulos y resúmenes de 3.676 artículos, de los cuales 1.690 fueron descartados por ser duplicados. Posteriormente, al aplicar los criterios de inclusión y exclusión, 363 artículos fueron descartados; 246 de ellos fueron excluidos por el criterio de tipo de estudio y 117 por tipo de población. De los 597 artículos seleccionados, 185 fueron excluidos por criterios de inclusión/exclusión, quedando 234 artículos evaluados a texto completo para su elegibilidad. De los 185 artículos excluidos, 84 estudios fueron descartados por el criterio de población, 48 estudios por criterio de diagnóstico, y 53 estudios por criterio de tipo de estudio. Finalmente, 49 artículos fueron incluidos en esta revisión de literatura para análisis exhaustivo.
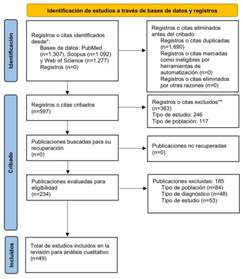
Figura 1 Diagrama de flujo PRISMA. *Considera, si es factible, informar del número de registros identificados de cada base de datos o registro buscado (en lugar del número total de todas las bases de datos/registros). **Si se utilizaron herramientas de automatización, indicar cuántos registros fueron excluidos por los investigadores y cuántos fueron excluidos por herramientas de automatización.
Características generales de los artículos
En la Tabla 1 se muestran las características generales de los 49 estudios totales incluidos (19)(20)(21)(23)(24)(27)(31)(73) en la presente revisión de literatura. De ellos, el 84% corresponde a artículos originales y un 16% a artículos de revisión. Considerando el rango de años de publicación, el mayor número de estudios se concentra en los años 2020 (8 artículos), 2018 (7 artículos) y 2016 (6 artículos); en contraste, los años con menor número de publicación comprenden el rango de 2004 a 2006 con un artículo cada uno. La muestra total fue de 4.868 personas mayores, siendo la edad promedio de 71,0 años, con un rango etario de mayor prevalencia entre 60-80 años.
En cuanto a los instrumentos/medidas de evaluación utilizados, se reporta el uso frecuente de Mini Mental State Examination (MMSE) y la Evaluación Cognitiva de Montreal (MoCA Test) para el DCL tipo amnésico, no amnésico, vascular, y asociado a EP. Por otra parte, para DV, DPCL y EP se reporta mayor frecuencia en la utilización de pruebas como Clock Drawing Test, WAIS Logical Memory: Delayed Recall, Verbal Fluency, Magnetic Imaging Resonance y Clinical Dementia Rating Scale. (Tabla 1)
Tabla 1 Cuadro resumen características generales estudios analizados
| Título | Autores | Tipo Artículo | Año | Población | Promedio Edad | Rango | edad | Instrumentos Medidas | |
|---|---|---|---|---|---|---|---|---|---|
| (años) | (años) | ||||||||
| 60 -70 | 71 -80 | 81 o + | |||||||
| Comparing the neuropsychological profiles of mild dementia with Lewy bodies and mild Alzheimer’s disease (31) | Xu Y, Chen K, Zhao Q, Guo Q. | Artículo original (estudio comparativo) | 2018 | 37 sujetos con DPCL leve, 48 sujetos con EA leve y 80 personas mayores sanas. | 68,5 | ü | - | - | RAVLT MES EBPM BNT VFT DST ST MMSE |
| Neuropsychological profile of dementia with Lewy bodies (21) | Oda H, Yamamoto Y, Maeda K. | Artículo de revisión | 2009 | Población con DPCL. | - | - | - | - | - |
| Cognitive profile in prodromal dementia with Lewy bodies (32) | Kemp J, Philippi N, Phillipps C, Demuynck C, Albasser T, Martin-Hunyadi C, Schmidt-Mutter C, Cretin B, Blanc F. | Artículo original (estudio comparativo) | 2017 | 37 sujetos con DPCL en etapa prodrómica y 29 personas mayores sanas. | 68 | ü | ü | - | RL/RI-16 DMS-48 DST FAB TMT (A-B) FLE DSST ONT FSE ROCF VOSP PBB Mini- SEA RME |
| Regional Structural Hippocampal Differences Between Dementia with Lewy Bodies and Parkinson's Disease (33) | de Schipper LJ, Hafkemeijer A, van der Grond J, Marinus J, Henselmans JML, van Hilten JJ. | Artículo original (estudio comparativo) | 2019 | 14 sujetos con DPCL y 62 sujetos con EP. | 72,5 | ü | ü | - | MDS-UPDRS (part III) SENS-PD MMSE SCOPA-COG SCOPA-P VBM MRI |
| Sentence processing in Lewy body spectrum disorder: the role of working memory (24) | Gross RG, McMillan CT, Chandrasekaran K, Dreyfuss M, Ash S, Avants B, Cook P, Moore P, Libon DJ, Siderowf A, Grossman M. | Artículo original (estudio comparativo) | 2012 | 16 sujetos con EP, 17 sujetos con demencia leve (8 con EP y 9 con DPCL), y 12 personas mayores sanas. | 71 | ü | ü | - | MMSE DRS UPDRS ST DSR Trails B DR P&P MRI |
| Cognitive fluctuations in connection to dysgraphia: a comparison of Alzheimer's disease with dementia Lewy bodies (34) | Onofri E, Mercuri M, Donato G, Ricci S. | Artículo original (estudio comparativo) | 2015 | 30 sujetos con EA, 26 sujetos con DPCL, y 30 sujetos con EA (en edades tempranas). | 79,5 | ü | ü | - | MMSE UPDRS CAF PQ |
| A review of cognitive impairments in dementia with Lewy bodies relative to Alzheimer's disease and Parkinson's disease with dementia (19) | Metzler-Baddeley CA. | Artículo de revisión | 2007 | Población con DPCL, EP y EA. | - | - | - | - | - |
| Nonamnestic mild cognitive impairment progresses to dementia with Lewy bodies (35) | Ferman TJ, Smith GE, Kantarci K, Boeve BF, Pankratz VS, Dickson DW, Graff-Radford NR, Wszolek Z, Van Gerpen J, Uitti R, Pedraza O, Murray ME, Aakre J, Parisi J, Knopman DS, Petersen RC. | Artículo original (estudio comparativo) | 2013 | 337 sujetos con DCL no amnésico, DPCL y EA. | 73,3 | ü | ü | - | MMSE CDR UPDRS UAQ MSQ ESS MFS |
| Narrative Organization Deficit in Lewy Body Disorders Is Related to Alzheimer Pathology (36) | Grossman M, Irwin DJ, Jester C, Halpin A, Ash S, Rascovsky K, Weintraub D, McMillan CT. | Artículo original (estudio comparativo) | 2017 | 56 sujetos con DPCL y 15 personas mayores sanas. | 69,4 | ü | - | - | UPDRS MMSE BNT VFT PVLT MRI |
| Prodromal Dementia with Lewy Bodies: Clinical Characterization and Predictors of Progression (37) | van de Beek M, van Steenoven I, van der Zande JJ, Barkhof F, Teunissen CE, van der Flier WM, Lemstra AW. | Artículo original (estudio comparativo) | 2020 | 73 sujetos con DPCL prodrómica y 124 sujetos con EA prodrómica. | 68 | ü | - | - | MMSE GDS DAD NPI |
| The Cognitive Profile of Mild Cognitive Impairment Due to Dementia with Lewy Bodies-An Updated Review (38) | Hemminghyth MS, Chwiszczuk LJ, Rongve A, Breitve MH. | Artículo de revisión | 2020 | Población con DPCL. | - | - | - | - | - |
| Neurocognitive Deficits Distinguishing Mild Dementia with Lewy Bodies from Mild Alzheimer’s Disease are Associated with Parkinsonism (39) | Brønnick K, Breitve MH, Rongve A, Aarsland D. | Artículo original (estudio comparativo) | 2016 | 113 sujetos con EA probable y 77 sujetos con probable DPCL. | 75,8 | ü | ü | - | UPDRS NPI FIS CDR MMSE CVLT-II ST VFT TMT |
| Lewy Body Dementias: Dementia with Lewy Bodies and Parkinson Disease Dementia (40) | Gomperts SN. | Artículo de revisión | 2016 | Población con DPCL y con demencia por EP. | - | - | - | - | - |
| Differences in cognitive profiles between Lewy body and Parkinson’s disease dementia (41) | Martini A, Weis L, Schifano R, Pistonesi F, Fiorenzato E, Antonini A, Biundo R. | Artículo original (estudio comparativo) | 2020 | 18 sujetos con DPCL y 21 sujetos con demencia en EP. | 72,7 | ü | ü | - | MMSE MOCA PDQ-8 BDI-II STAI Y-1 STAI Y-2 |
| Communication impairment in Parkinson’s disease: Impact of motor and cognitive symptoms on speech and language (23) | Smith KM, Caplan DN | Artículo de revisión | 2018 | Población con EP. | - | - | - | - | - |
| Cognitive impairment in Parkinson’s disease is multifactorial: A neuropsychological study (42) | Smith CR, Cullen B, Sheridan MP, Cavanagh J, Grosset KA, Grosset DG. | Artículo original (estudio observacional) | 2020 | 45 sujetos con DCL asociado a EP. | 69,1 | ü | ü | - | MOCA IQCODE UPDRS KBNA WAIS-IV RBANS IQCODE |
| Verbal adynamia in parkinsonian syndromes: behavioral correlates and neuroanatomical substrate (20) | Magdalinou NK, Golden HL, Nicholas JM, Witoonpanich P, Mummery CJ, Morris HR, Djamshidian A, Warner TT, Warrington EK, Lees AJ, Warren JD. | Artículo original (estudio comparativo) | 2018 | 18 sujetos con demencia por EP, 7 sujetos con Parálisis Supranuclear progresiva (PSP) y 7 sujetos con Síndrome Corticobasal (SCB). | 70,3 | ü | ü | - | MMSE UPDRS NART RMT VOSP WASI BNT GNT PALPA |
| Parkinson’s Disease Dementia and Dementia with Lewy Bodies Have Similar Neuropsychological Profiles (43) | Aldridge GM, Birnschein A, Denburg NL, Narayanan NS. | Artículo original (estudio comparativo) | 2018 | 22 sujetos con DPCL y 25 sujetos con demencia por EP. | 72 | ü | ü | - | WAIS-III BVRT RAVLT WMS-RW BNT TMT (A-B) GDS |
| Cognitive decline profiles differ in Parkinson disease dementia and dementia with Lewy bodies (44) | Smirnov DS, Galasko D, Edland SD, Filoteo JV, Hansen LA, Salmon DP. | AO (estudio comparativo) | 2020 | 29 sujetos con demencia por EP, 58 sujetos con DPCL y 174 sujetos con EA. | 73,6 | ü | ü | - | CDR DRS POD UDPRS WAIS-R WMS BNT (30 ITEMS) TMT (A-B) VLLT CDT CERAD |
| Cognitive Profiles of Patients with Mild Cognitive Impairment or Dementia in Alzheimer’s or Parkinson’s Disease (45) | Hildebrandt H, Fink F, Kastrup A, Haupts M, Eling P. | Artículo original (estudio comparativo) | 2013 | 20 personas mayores sanas, 29 sujetos con DCL asociado a EP, 25 sujetos con DCL tipo amnésico, 34 sujetos con EA y 15 sujetos con demencia por EP. | 71,1 | ü | ü | - | CERAD MMSE BNT LPS 50+ ZVT WMS MWI BDI |
| Clinical and Neuropsychological Differences between Mild Parkinson’s Disease Dementia and Dementia with Lewy Bodies (46) | Petrova M, Mehrabian-Spasova S, Aarsland D, Raycheva M, Traykov L. | Artículo original (estudio comparativo) | 2015 | 27 sujetos con demencia por EP y 24 sujetos con DPCL con Parkinsonismo. | 69,1 | ü | ü | - | FCSRT TMT (A-B) MCST WAIS ST BNT MMSE UPDRS |
| Dementia with Lewy Bodies versus Alzheimer's Disease and Parkinson's Disease Dementia: A Comparison of Cognitive Profiles (47) | Park KW, Kim HS, Cheon SM, Cha JK, Kim SH, Kim JW. | Artículo original (estudio comparativo) | 2011 | 10 sujetos con DPCL, 76 sujetos con EA y 17 sujetos con demencia por EP. | 70,2 | ü | ü | - | MRI MMSE CDR B-ADL DST BNT RCFT SVLT ST COWAT |
| Detecting Mild Cognitive Deficits in Parkinson's Disease: Comparison of Neuropsychological Tests (48) | Hoogland J, van Wanrooij LL, Boel JA, Goldman JG, Stebbins GT, Dalrymple-Alford JC, Marras C, Adler CH, Junque C, Pedersen KF, Mollenhauer B, Zabetian CP, Eslinger PJ, Lewis SJG, Wu RM, Klein M, Rodriguez-Oroz MC, Cammisuli DM, Barone P, Biundo R, de Bie RMA, Schmand BA, Tröster AI, Burn DJ, Litvan I, Filoteo JV, Geurtsen GJ, Weintraub D; IPMDS Study Group “Validation of Mild Cognitive Impairment in Parkinson Disease”. | Artículo de revisión | 2018 | Población con EP sin demencia y personas mayores. | - | - | - | - | TMT ST WAIS -IV WMS HVLT RAVLT CVLT-II MWCST BNT JOLO MMSE MOCA MDRS |
| Pragmatic Language Disorder in Parkinson’s Disease and the Potential Effect of Cognitive Reserve (49) | Montemurro S, Mondini S, Signorini M, Marchetto A, Bambini V, Arcara G. | Artículo original (estudio comparativo) | 2019 | 47 sujetos con EP y 45 personas mayores sanas. | 71,2 | ü | ü | - | APACS CRIq MOCA UPDRS-III H&Y TT DSB SET |
| Disentangling the Role of Working Memory in Parkinson's Disease (50) | Salmi J, Ritakallio L, Fellman D, Ellfolk U, Rinne JO, Laine M. | Artículo original (estudio comparativo) | 2020 | 52 sujetos con EP y 54 personas mayores sanas. | 65,5 | ü | - | - | UPDRS PDQ-39 SPDDS TELE TICS-m WMQ BRIEF- A GDS LARS |
| Predict cognitive decline with clinical markers in Parkinson’s disease (PRECODE-1) (51) | Wilson H, Pagano G, Yousaf T, Polychronis S, De Micco R, Giordano B, Niccolini F, Politis M. | Artículo original (estudio comparativo) | 2020 | 294 sujetos con EP, clasificados en grupos con DCL asociado a EP y sin DCL asociado a EP. | 61,2 | ü | - | - | MOCA MDS-UPDRS GDS SCOPA-AUT ESS RBDQ UPSIT HVLT-R H&Y SDMT BJLO |
| Neuropsychological Profiles in Mild Cognitive Impairment due to Alzheimer’s and Parkinson’s Diseases (52) | Hessen E, Stav AL, Auning E, Selnes P, Blomsø L, Holmeide CE, Johansen KK, Eliassen CF, Reinvang I, Fladby T, Aarsland D. | Artículo original (estudio comparativo) | 2016 | 13 sujetos con DCL asociado EP, 19 sujetos con DCL tipo amnésico asociado a EA y 25 personas mayores sanas. | 65,8 | ü | - | - | RAVLT RCFT TMT (B) COWAT D-KEFS ST UPDRS-III H&Y MRI MMSE |
| Semantic Function in Mild Cognitive Impairment (53) | Taler V, Monetta L, Sheppard C, Ohman A. | Artículo original (estudio comparativo) | 2020 | 38 sujetos con DCL y 41 personas mayores sanas. | 74,5 | ü | ü | - | MOCA P&P CVLT-II BNT WCST WMS-III ST FAS |
| Mild cognitive impairment and its management in older people (54) | Eshkoor SA, Hamid TA, Mun CY, Ng CK. | Artículo de revisión | 2015 | Población con DCL. | - | - | - | - | - |
| Connected speech and language in mild cognitive impairment and Alzheimer’s disease: A review of picture description tasks (55) | Mueller KD, Hermann B, Mecollari J, Turkstra LS. | Artículo de revisión | 2018 | Población con DCL y EA. | - | - | - | - | - |
| Vocabulary Size in Speech May Be an Early Indicator of Cognitive Impairment (56) | Aramaki E, Shikata S, Miyabe M, Kinoshita A. | Artículo original (estudio comparativo) | 2016 | 8 sujetos con DCL y 14 personas mayores sanas. | 78,7 | ü | ü | - | HDS-R Pruebas de vocabulario Pruebas de escritura |
| Deterioration of semantic associative relationships in mild cognitive impairment and Alzheimer Disease (57) | Caputi N, Di Giacomo D, Aloisio F, Passafiume D. | Artículo original (estudio comparativo) | 2016 | 19 sujetos con DCL tipo amnésico, 16 sujetos con EA, 20 sujetos con EA de tipo moderada y 20 personas mayores sanas. | 71,4 | ü | ü | - | MMSE RAVLT RPM WVRT |
| Patterns of semantic memory impairment in Mild Cognitive Impairment (58) | Joubert S, Felician O, Barbeau EJ, Didic M, Poncet M, Ceccaldi M | Artículo original (estudio comparativo) | 2008 | 20 sujetos con DCL tipo amnésico y 20 personas mayores sanas. | 73,3 | ü | ü | - | MMSE TMT (A-B) WAIS - III BVRT |
| Episodic, but not semantic, autobiographical memory is reduced in amnestic mild cognitive impairment (59) | Murphy KJ, Troyer AK, Levine B, Moscovitch M. | Artículo original (estudio comparativo) | 2008 | 17 sujetos con DCL tipo amnésico y 18 personas mayores sanas. | 75,2 | ü | ü | - | MMSE HVLT-R GDS HADS BVMT-R BNT TMT |
| The cognitive and neural expression of semantic memory impairment in mild cognitive impairment and early Alzheimer’s disease (60) | Joubert S, Brambati SM, Ansado J, Barbeau EJ, Felician O, Didic M, Lacombe J, Goldstein R, Chayer C, Kergoat MJ. | Artículo original (estudio comparativo) | 2010 | 15 sujetos con DCL tipo amnésico, 16 sujetos con EA temprana y 16 personas mayores sanas. | 73,1 | ü | ü | - | MMSE RL/RI TMT SVT WMS BNT VOSP VBM FCSRT |
| Working memory binding and episodic memory formation in aging, mild cognitive impairment, and Alzheimer’s dementia (61) | van Geldorp B, Heringa SM, van den Berg E, Olde Rikkert MG, Biessels GJ, Kessels RP. | Artículo original (estudio comparativo) | 2015 | 26 adultos jóvenes, 18 adultos de mediana edad y 25 personas mayores. 27 sujetos con EA, 19 sujetos con DCL y 25 personas mayores sanas. | 72,8 | ü | ü | - | NART MMSE WMS - III TMT RAVLT VOSP |
| Multiple cognitive deficits in amnestic mild cognitive impairment (62) | Kramer JH, Nelson A, Johnson JK, Yaffe K, Glenn S, Rosen HJ, Miller BL. | Artículo original (estudio comparativo) | 2006 | 22 sujetos con DCL tipo amnésico, 33 sujetos con EA leve y 35 sujetos sanos. | 73,8 | ü | ü | - | MMSE CDR SVT BNT RAVLT CVLT TMT GDS |
| Detecting subtle changes in visuospatial executive function and learning in the amnestic variant of mild cognitive impairment (63) | Papp KV, Snyder PJ, Maruff P, Bartkowiak J, Pietrzak RH. | Artículo original (estudio comparativo) | 2011 | 62 sujetos con DCL tipo amnésico y 94 personas mayores sanas. | 68,7 | ü | ü | - | MMSE RAVLT ROCF WMS MRI GMLT |
| Selectivity of executive function deficits in mild cognitive impairment (64) | Brandt J, Aretouli E, Neijstrom E, Samek J, Manning K, Albert MS, Bandeen-Roche K. | Artículo original (estudio comparativo) | 2009 | 124 sujetos con DC (36 amnésico dominio único; 45 amnésico multidominio; 26 no amnésico dominio único y 17 no amnésico multidominio) y 68 personas mayores sanas. | 75,2 | ü | ü | - | MMSE BNT WMS-R CDT ADL-PI CDR RNG TTT D-KEFS Stroop Test HBT PMT D-KEFS Tower Test D-KEFS Sorting Test VCAT SBAT IGT EJT TMT BTA |
| The overall impairment of core executive function components in patients with amnestic mild cognitive impairment: a cross-sectional study (65) | Zheng D, Dong X, Sun H, Xu Y, Ma Y, Wang X. | Artículo original (estudio transversal) | 2012 | 34 sujetos con DCL amnésico y 36 personas mayores sanas. | 67,7 | ü | - | - | MMSE MRI B-ADL CDR MOCA GDS RAVLT |
| Pattern of cognitive deficits in vascular dementia (27) | Sengupta P, Ganguly J, Pal S, Ghosal M. | Artículo original (estudio observacional) | 2019 | 50 sujetos con DV. | 63,5 | ü | - | - | MMSE KCSB DST CDT TMT GO/NO-GO Test MRI |
| Cerebral gray matter volume reduction in subcortical vascular mild cognitive impairment patients and subcortical vascular dementia patients, and its relation with cognitive deficits (66) | Li M, Meng Y, Wang M, Yang S, Wu H, Zhao B, Wang G. | Artículo original (estudio comparativo) | 2017 | 31 sujetos con DCL vascular (subcortical), 29 sujetos con DV subcortical y 31 sujetos sanos. | 63,4 | ü | - | - | MRI SPM8-VBM8 CDR MMSE MOCA B-ADL HIS NPI GDS TMT RAVLT SDMT VFT |
| Magnetic Resonance Imaging and Neuropsychological Correlates of Subcortical Vascular Dementia (67) | Paul MA, War FA, Sharma V, Kushwaha S. | Artículo original (estudio exploratorio) | 2018 | 12 sujetos con DV subcortical. | - | ü | ü | - | MRI FAB RAVLT FS NPI |
| Cognitive variations among vascular dementia subtypes caused by small-, large-, or mixed-vessel disease (68) | Ying H, Jianping C, Jianqing Y, Shanquan Z. | Artículo original (estudio exploratorio) | 2016 | 402 sujetos con DV (283 con DV de vasos pequeños, 97 con DV de vasos grandes, y 22 con DV de compromiso mixto de vasos). | 69,3 | ü | - | - | MRI MMSE DSFT CHMS WMS WMS-R WAB TMT (B) NPI |
| Subcortical vascular dementia: integrating neuropsychological and neuroradiologic data (69) | Price CC, Jefferson AL, Merino JG, Heilman KM, Libon DJ. | Artículo original (estudio comparativo) | 2005 | 69 sujetos con demencia, de los cuales 34 cursaban con EA. | 78 | ü | ü | - | MRI MMSE GDS WMS-MC CVLT |
| Distinctive cognitive profiles in Alzheimer’s disease and subcortical vascular dementia (70) | Graham NL, Emery T, Hodges JR. | Artículo original (estudio comparativo) | 2004 | 19 sujetos con DV subcortical, 19 sujetos con EA y 19 personas mayores sanas. | 68,6 | ü | - | - | MMSE WAIS CRD ACE CBI MRI FAS VOSP ST RMT TEA |
| Limitations in differentiating vascular dementia from Alzheimer’s disease with brief cognitive tests (71) | Matioli MN, Caramelli P. | Artículo original (estudio comparativo) | 2010 | 15 sujetos con DV leve, 15 sujetos con EA y 30 personas mayores sanas. | 72,7 | ü | ü | - | RMI MMSE GDS NEUROPSI HIS FAS CDT |
| The contribution of medial temporal lobe atrophy and vascular pathology to cognitive impairment in vascular dementia (72) | Bastos-Leite AJ, van der Flier WM, van Straaten EC, Staekenborg SS, Scheltens P, Barkhof F. | Artículo original (estudio exploratorio) | 2007 | 590 sujetos con DV. | 72,5 | ü | ü | - | MRI MMSE ADAS SDMT DBT DCT VFT |
| The Dementia Rating Scale (DRS) in the diagnosis of vascular dementia (73) | Porto CS, Caramelli P, Nitrini R. | Artículo original (estudio exploratorio) | 2007 | 12 sujetos con DV, 56 sujetos con EA, y 60 personas mayores sanas. | 69,2 | ü | - | - | MRI MMSE BCSB WMS-R RAVLT WAIS HVOT BNT WCST FAS TMT (A-B) MAC-Q IQCODE DRS |
*Nota: -: No reportado. ü: Pertenece. RAVLT: Rey Auditory Verbal Learning Test. MES: Memory and Executive Screening. EBPM: Event-based Prospective Memory Test. BNT: Boston Naming Test. VFT: Verbal Fluency Test. DST: Digit Span Test. ST: Stroop Test. MMSE: Mini Mental State Examination. RL/RI-16: The French version of the Free and Cued Selective Reminding Test. DMS-48: The Delayed Matching to Sample-48 items. FAB: Frontal Assessment Battery. TMT: Trail Making Test (parts A and B). FLE: Formal Lexical Evocation. DSST: Digit Symbol Substitution Test. ONT: Oral Naming Test (of 80 pictures). FSE: Formal Semantic Evocation. ROCF: Rey-Osterrieth Complex Figure Test. VOSP: Visual Object and Space Perception Battery. PBB: Praxis Brief Battery. Mini-SEA: Mini-Social Cognition & Emotional Assessment Test Battery. RME: French version of the Reading the Mind in the Eyes Test. MDS-UPDRS: The Movement Disorder Society Unified Parkinson’s Disease Rating Scale motor scale. SENS-PD: SEverity of Non-dopaminergic Symptoms in Parkinson’s Disease. SCOPA-COG: SCales for Outcomes in PArkinson’s disease-COGnition. SCOPA-P: SCales for Outcomes in PArkinson’s disease- Psychiatric. VBM: Voxel-Based Morphometry. MRI: Magnetic Resonance Imaging. DRS: Dementia Rating Scale. DSR: Digit Span Reverse. DR: Delayed recall. P&P: Pyramids and Palm Trees Test. CAF: Clinician assessment of fluctuation. PQ: Cognition Test. CDR: Clinical Dementia Rating scale. UAQ: Unctional Activities Questionnaire. MSQ: Mayo Sleep Questionnaire. ESS: Epworth Sleepiness Scale. MFS: Mayo Fluctuations Scale. PVLT: Philadelphia Verbal Learning Test delayed recall. GDS: Geriatric Depression Scale. DAD: Disability Assessment for Dementia. NPI: Neuropsychiatric Inventory. FIS: Fluctuation Inventory Scale. CVLT-II: California Verbal Learning Test II. ST: Silhouette test. MOCA: Montreal Cognitive Assessment. PDQ-8: Parkinson’s Disease Questionnaire. BDI-II: Beck Depression Inventory. STAI Y-1: StateTrait Anxiety Inventory forms. IQCODE: Informant Questionnaire on Cognitive Decline in the Elderly. KBNA: Kaplan-Baycrest Neurocognitive Assessment. WAIS-IV: Wechsler Adult Intelligence Scale, Fourth Edition. RBANS: Repeatable Battery for the Assessment of Neuropsychological Status. PANDA: Parkinson Neuropsychometric Dementia Assessment. NART: National Adult Reading Test. RMT: Recognition Memory Test. WASI: Wechsler Abbreviated Scale of Intelligence. GNT: Graded Naming Test. PALPA: Psycholinguistic Assessment of Language Processing in Aphasia. BVRT: Benton Visual Retention Test. WMS-RW: Wechsler Memory Scale-Logical Memory subtest. POD: Pfeffer Outpatient Disability. VLLT: Verbal List Learning Test. CDT: Clock drawing Test. CERAD: Consortium to Establish a Registry for Alzheimer's Disease test. LPS 50+: Leistungsprüfsystem (the German version of the FAS test). ZVT: Zahlenverbindungstest (which is similar to the Trail Making Test, Version A). MWI: Mehrfachwahl-Wortschatz-Intelligenztest (multiple choice vocabulary intelligence test). FCSRT: Free and Cued Selective Reminding Test. MCST: Modified Card Sorting Test. B-ADL: Barthel Activities of Daily Living. RCFT: Rey Complex Figure Test. SVLT: Seoul Verbal Learning Test. COWAT: Controlled Oral Word Association Test. HVLT: Hopkins Verbal Learning Test. MWCST: Modified Wisconsin Card Sorting Test. JOLO: Judgement of Line Orientation. MDRS: Mattis Dementia Rating Scale. APACS: Assessment of Pragmatic Abilities and Cognitive Substrates. CRIq: Cognitive Reserve Index questionnaire. H&Y: Hoehn y Yahr scale. TT: Token Test. DSB: Digit Span Backward. SET: Story-Based Empathy Task. SPDDS: Self-assessment Parkinson’s Disease Disability Scale. TELE: Telephone Screening Protocol. TICS-m: Telephone Interview for Cognitive Status-modified. WMQ: Working Memory Questionnaire. BRIEF- A: Behavior Rating Inventory of Executive Function. LARS: Lille Apathy Rating Scale. SCOPA-AUT: Scales for Outcomes in Parkinson’s disease-autonomic. RBDQ: REM sleep behaviour disorders (RBD) screening Questionnaire. UPSIT: University of Pennsylvania Smell Identification Test. SDMT: Symbol Digit Modalities Test. BJLO: Benton Judgement of Line Orientation. D-KEFS: Delis-Kaplan Executive Function System. WCST: Wisconsin Card Sorting Test. Wechsler - III: Wechsler Adult Intelligence Scale - III. FAS: fluency tasks, animal, and letter. HDS-R: Hasegawa Dementia Scale. RPM: Raven Progressive Matrix. WVRT: Wepman’s Visual Recognition Test. HADS: Hospital Anxiety and Depression Scale. BVMT-R: Brief Visuospatial Memory Test-Revised. SVT: Stroop-Victoria Test. GMLT: Groton Maze Learning Test. ADL-PI: Activities of Daily Living - Prevention Instrument. RNG: Random Number Generation. TTT: Tinker Toy Test. HBT: Hayling and Brixton Tests. PMT: Porteus Maze Test. VCAT: Verbal Concept Attainment Test. SBAT: Stanford Binet Absurdities Test. IGT: Iowa Gambling Test. EJT: Experimental Judgment Test. BTA: Brief Test of Attention. KCSB: Kolkata Cognitive Screening Battery. SPM8-VBM8: Statistical Parametric Mapping 8-Voxel-Based Morphometry 8. HIS: Hachinski ischemic scale. FS: Focal signs. ACE-III: Addenbrooke’s Cognitive Examination (III). SLB: Sydney Language Battery. IFS: INECO Frontal Screening. DSFT: Digit Span Forward Test. CHMS: Choynowski's Memory Scale. WAB: Western Aphasia Battery. KCTB: Kolkata Cognitive Test Battery. WMS-MC: Wechsler Memory Scale-Mental Control Subtest. CBI: Cambridge behavioural inventory. TEA: Test of Everyday Attention. NEUROPSI: Neuropsychological Test Batery. ADAS: Alzheimer’s Disease Assessment Scale. DBT: Digits Backward Test. DCT: Digit Cancellation Task. BCSB: Brief Cognitive Screening Battery. HVOT: Hooper Visual Organization Test. MAC-Q: Memory Complaint Questionnaire.
La Tabla 2 resume las características cognitivas-lingüísticas para cada cuadro clínico. En el DCL (considerando sus subtipos) se evidencia declive a nivel de memoria, función ejecutiva y lenguaje con deterioro fonológico y semántico que repercute en la fluidez verbal. En cuanto a los cuadros de demencia, en DV existe compromiso a nivel de memoria, orientación, atención, funciones ejecutivas, y praxis-gnosis; sumado a declives lingüísticos en fluidez semántica y fonológica. Por su parte, en DPCL se reporta deterioro significativo en tareas atencionales, mnésicas, visuoconstructivas y funcionamiento ejecutivo; mientras que el lenguaje impresiona con dificultades en fluidez verbal (semántica y fonológica), además de alteraciones sintático-gramaticales y discursivas. Finalmente, en la EP cuando evoluciona a demencia predomina el compromiso en la función ejecutiva, habilidades visuoespaciales y memoria; además de déficits lingüísticos en la producción y procesamiento sintáctico-gramatical, en la fluidez verbal y en el uso de verbos. (Tabla 2)
Tabla 2 Cuadro características cognitivas-lingüísticas
| Ref. | DCL | DV | DPCL | EP | ||||
|---|---|---|---|---|---|---|---|---|
| Cognición | Lenguaje | Cognición | Lenguaje | Cognición | Lenguaje | Cognición | Lenguaje | |
| (31) | (A (ME (FE (HVE | (FVS | - | - | ||||
| (21) | - | - | - | - | (A (ME (FE (HVC | - | - | |
| (32) | - | - | - | - | (FE (MVI (MVE (HVC (MT (P | (EVL (DEN (EVS | - | - |
| (33) | - | - | - | - | (C | - | - | |
| (24) | - | - | - | - | (MT | (PO | (MT | (PO |
| (34) | - | - | - | - | (A (MS | (E (DEN | - | - |
| (19) | - | - | - | - | (HVC (POE (A (FE (MT (ME (MS | (HVC (POE | ||
| (35) | - | - | - | - | (A (HVE (M | (LE | - | - |
| (36) | - | - | - | - | (HN | - | - | |
| (37) | - | - | - | - | (A (FE (HVE (M | - | - | |
| (38) | - | - | - | - | (A (FE (HVE | - | - | |
| (39) | - | - | - | - | (A (FE (HVC (MVE | (FV | - | - |
| (40) | - | - | - | - | (A (FE (HVE (MCP | (FE (HVE (M | ||
| (41) | - | - | - | - | (A (HVE | (LE (FS | (A (HVE | (LE |
| (23) | - | - | - | - | - | - | (MVE (MT (PLA | (SIN (FV |
| (42) | - | - | - | - | (M (FE | (LE | (HVE (FE (M (A | (LE |
| (20) | - | - | - | - | - | - | (MT (ME | (EXP (FV (REC (O |
| (43) | - | - | - | - | (FE (HVE | (AV | (FE (HVE | (AV |
| (44) | - | - | - | - | (FE (HVE (M | (LE | (FE (HVE (M | (LE |
| (45) | (ME | - | - | - | - | - | (HVC (A | (LE |
| (46) | - | - | - | - | (A (FE (HVC | (A (FE (HVC | ||
| (47) | - | - | - | - | (A (ME (FE (HVE | (A (ME (FE (HVE | ||
| (48) | - | - | - | - | - | - | (A (ME (FE (HVE | (LE |
| (49) | - | - | - | - | - | - | (C | (PRAG (D (HN (I |
| (50) | - | - | - | - | - | - | (MT (AS) | - |
| (51) | - | - | - | - | - | - | (MVE (VP (MT (HVE (A | (FS |
| (52) | - | - | - | - | - | - | (FE | |
| (53) | (SEM (FON (DEN (REC | - | - | - | - | - | - | |
| (54) | (ME (MCP | - | - | - | - | - | - | - |
| (55) | (SEM (SIN | - | - | - | - | - | - | |
| (56) | (C | (VA | - | - | - | - | - | - |
| (57) | (SEM | - | - | - | - | - | - | |
| (58) | (SEM (FV (DEN | - | - | - | - | - | - | |
| (59) | (MAE (MAS | - | - | - | - | - | - | |
| (60) | (SEM (DEN (REC | - | - | - | - | - | - | |
| (61) | (ME (MT | - | - | - | - | - | - | |
| (62) | (M (FE | (FV | - | - | - | - | - | - |
| (63) | (HVE (MT (FE | - | - | - | - | - | - | |
| (64) | (PLA (RP (MT | - | - | - | - | - | - | |
| (65) | (FE (MT (CI (FC | - | - | - | - | - | - | |
| (27) | - | - | (M (A (FE | - | - | - | - | |
| (66) | - | - | (M (A (FE | (LE | - | - | - | - |
| (67) | - | - | (FE (FC (CI (M (P (G (HVC | - | - | - | - | |
| (68) | - | - | (FE (HVE (M (OTE (CAL (PA (P (G | (LE | - | - | - | - |
| (69) | - | - | (M (FE (HVC | (LE | - | - | - | - |
| (70) | - | - | (MS (FE (A (HVE | - | - | - | - | |
| (71) | - | - | (MD | (FS (FF | - | - | - | - |
| (72) | - | - | (FE | - | - | - | - | |
| (73) | - | - | (FE (PLA (VP (A | - | - | - | - |
*Nota: Ref.: Referencia. -: No reportado. : declive. : mejora. A: Atención. ME: Memoria episódica. FE: Funciones ejecutivas. HVE: Habilidades visuoespaciales. FVS: Fluidez verbal semántica. HVC: Habilidades visuoconstructivas. MVI: Memoria visual. MVE: Memoria verbal. MT: Memoria de trabajo. P: Praxias. C: Cognición. EVL: Evocación léxica. DEN: Denominación. EVS: Evocación semántica. PO: Procesamiento de oraciones. MS: Memoria semántica. E: Escritura. POE: Percepción de objeto y espacio. M: Memoria. LE: Lenguaje espontáneo. HN: Habilidades narrativas. FV: Fluidez verbal. MCP: Memoria a corto plazo. FS: Fluidez semántica. PLA: Planificación. SIN: Sintaxis. EXP: Expresión (a nivel de palabra y oración). REC: Reconocimiento. O: Ortografía. AV: Aprendizaje verbal. PRAG: Pragmática. D: Discurso. I: Inferencias. AS: actualización selectiva de la memoria de trabajo. VP: Velocidad de procesamiento. SEM: Semántica. FON: Fonología. VA: Vocabulario activo. MAE: Memoria autobiográfica episódica. MAS: Memoria autobiográfica semántica. RP: Resolución de problemas. CI: Control inhibitorio. FC: Flexibilidad cognitiva. G: Gnosias. OTE: Orientación. CAL: Cálculo. PA: Pensamiento abstracto. MD: Memoria diferida. FF: Fluidez fonológica.
Discusión
Los principales hallazgos metodológicos en los 49 artículos incluidos sugieren que existen perfiles cognitivos-lingüísticos característicos para cada uno de los cuadros clínicos considerados. Si bien, cada cuadro analizado considera sintomatología particular, las alteraciones en memoria, lenguaje y función ejecutiva tienden a estar presentes en cada uno de ellos.
Memoria
Los declives en memoria son un síntoma clásico reportado en pacientes con DCL tipo amnésico, siendo un biomarcador precoz del progreso a cuadros de demencia. Líneas de investigación demuestran, al igual que los presentes resultados, que tanto la memoria episódica como inmediata manifiestan un declive significativo en sujetos con DCL de tipo amnésico y amnésico multidominio (45)(54). Estos hallazgos son consistentes con el estudio de van Geldorp et al. (2015)61 el cual establece que además del deterioro de memoria episódica en DCL de tipo amnésico, existe un déficit en la memoria de trabajo como ocurre en EA.
Por otra parte, Park et al. (2011) (47) analizaron 10 pacientes con DPCL, 76 con EA y 17 con demencia por EP, evidenciando que los sujetos con DPCL y EA logran puntuaciones significativamente más bajas comparados con EP a nivel de memoria verbal episódica. Estos hallazgos sugieren que el declive mnésico se experimenta en etapas previas, especialmente en estadios de DCL de tipo amnésico y asociado a EP. Estos antecedentes están en línea con un estudio previo enfocado en DPCL, EP y EA, confirmando que la memoria es susceptible a mayor declive ante cuadros neurodegenerativos, y que el compromiso se extiende más allá de la memoria episódica, reclutando también a la memoria de trabajo y semántica, especialmente en DPCL y EA (19). Asimismo, otras investigaciones sugieren claras diferencias en el perfil cognitivo de DV y EA, destacando que los pacientes con EA presentan peor rendimiento en tareas de memoria episódica y diferida; mientras que, aquellos con DV presentan mayores dificultades en memoria semántica (70)(71).
Los declives mnésicos presentan una afectación desde estadios tempranos, por lo cual, pesquisar correctamente estos síntomas en pacientes con DCL (incluidos sus subtipos) permitiría implementar intervenciones precoces para evitar una rápida progresión a estadios de demencia avanzada. Asimismo, considerar este deterioro en la evaluación neuropsicológica es clave, ya que, sería un biomarcador cognitivo de utilidad para diferenciar entre estos cuadros de demencia.
Lenguaje
El lenguaje en el envejecimiento patológico es susceptible a experimentar declives, tanto en cuadros de DCL como de demencias, especialmente a nivel de lenguaje espontáneo, fluidez verbal (semántica y fonológica) y habilidades sintáctico-gramaticales como se evidencia en nuestros resultados. Una reciente revisión (74) destaca que en el DCL se manifiestan importantes déficits lingüísticos en la comprensión oral y escrita, y dificultades en tareas de denominación, lo cual repercute significativamente en la producción del discurso. Otros estudios (53)(58) confirman el compromiso lingüístico en pacientes con DCL de tipo amnésico, destacando declives semánticos y fonológicos manifestados en tareas de acceso al léxico.
En la DV los síntomas lingüísticos comprenden la dificultad para encontrar palabras, nominar objetos, comprender el lenguaje hablado/escrito, y discurso incomprensible (75), siendo estos signos similares a los reportados en las primeras etapas de la EA, particularmente en aspectos semánticos (28). En esta línea, la evidencia en sujetos con enfermedad cerebral de vasos pequeños y EA, sugiere deficiencias en tareas de fluidez de tipo semántica y fonológica en pacientes con DV, mientras que, sujetos con EA tienden a manifestar deterioro únicamente en la fluidez semántica (76).
En concordancia, un estudio realizado en 18 sujetos con DPCL y 21 con EP, señala que en DPCL existe un peor desempeño en tareas lingüísticas que involucran fluidez verbal semántica en comparación a pacientes que presentan EP (41). Adicionalmente, otros síntomas lingüísticos en EP descritos en la literatura incluyen déficits a nivel pragmático, en producción y procesamiento gramatical, sintaxis y uso de verbos (23)(49). Si bien, las alteraciones lingüísticas en cuadros como la EA han sido bien reportadas, aún existe carencia de conocimiento en pacientes con EP. Esto se debe a que este cuadro clínico ha sido vinculado principalmente a alteraciones motoras y, por ende, a alteraciones expresivas que involucran dificultad en el habla (disartria hipocinética) (77)(78).
Si bien la evaluación del lenguaje es considerada en pacientes con demencia, debe ser considerada también en etapas previas (p.e., DCL). En este sentido, la evidencia sugiere que el lenguaje puede ser un biomarcador de importancia para predecir el progreso patológico, y diferenciar entre estos cuadros clínicos.
Funciones ejecutivas
Las funciones ejecutivas son particularmente relevantes, ya que, predicen el desempeño cognitivo y funcional en personas mayores (79). Diversos estudios (80)(81)(82)(83)(84) sugieren que su declive es un síntoma reportado con frecuencia tanto en el DCL (amnésico multidominio y asociado a enfermedad cerebrovascular) como las demencias.
Se ha reportado que en pacientes con DCL amnésico multidominio los déficits a nivel de memoria originan un rápido compromiso de las funciones ejecutivas (62)(65)(85), afectando principalmente habilidades como la planificación y resolución de conflictos. Asimismo, se postula que estos declives serían importantes para diferenciar entre sujetos que cursan con compromiso cognitivo asociado a la edad de aquellos con DCL (64).
Por otra parte, la literatura sugiere que los pacientes con DPCL presentan declives significativos en el funcionamiento ejecutivo y en tareas atencionales como las reportadas en casos de EA; no obstante, comparando ambos cuadros se evidencia mayor deterioro en DPCL (19)(39). Cabe destacar que también se reportan similitudes en términos de deterioro en demencia por EP (43). En línea, un estudio que analizó 10 pacientes con DPCL, 76 con EA y 17 pacientes con demencia por EP, confirma que la función ejecutiva (especialmente el control inhibitorio, la planificación y la flexibilidad mental) se ve significativamente comprometida en DCPL y demencia por EP, en comparación a sujetos con EA (47).
Asimismo, también se ha reportado que los pacientes con DV subcortical, impresionan con marcada deficiencia en la conceptualización, flexibilidad mental, programación, interferencia y control inhibitorio, debido a una significativa disfunción frontal (67). Adicionalmente, se postula que la presencia de disfunción ejecutiva se observa igualmente en DV de pequeños vasos, especialmente en casos que cursan con grado leve de atrofia a nivel del lóbulo temporal medial (72).
Correlato neurobiológico
La atrofia del lóbulo temporal medial reportada en DCL de tipo amnésico que repercute sobre la memoria, es considerada como un marcador diagnóstico como ocurre en la EA (86). Consecuentemente, la atrofia de la corteza prefrontal dorsolateral, así como el deterioro de la sustancia blanca en el lóbulo frontal, están relacionados con el declive de la función ejecutiva (65).
En el caso de pacientes con DV subcortical, se evidencia una reducción del volumen de la materia gris en el hipocampo, ínsula, circunvolución temporal superior e inferior, así como también en corteza orbitofrontal y circunvolución frontal superior. Estos patrones de atrofia se correlacionan con la pérdida de habilidades como la memoria, atención, lenguaje y funciones ejecutivas (66). Asimismo, Paul et al. (2018) (67) destacan que un número menor de estos pacientes pueden exhibir compromiso del lóbulo parietal con consecuencias como apraxia constructiva, ideacional, cinética y agnosia visual, siendo la apraxia constructiva la más recurrente. En contraste, en DPCL existe afección en las regiones frontal, temporal y parietal, así como también en estructuras subcorticales, lo cual impacta sobre el funcionamiento ejecutivo, atencional y visuopercepción (19)(87).
Por su parte, una reciente publicación destaca que en la EP el declive en la planificación, memoria de trabajo y funciones ejecutivas se deben al compromiso del lóbulo frontal y cuerpo estriado; mientras que, las alteraciones en la atención, fluidez verbal y habilidad visuoespacial, se asocian a atrofia temporal y disfunción cortical posterior (88). En este sentido, los cambios neuropatológicos en EP deben ser considerados como marcadores para determinar la progresión a estadios de DCL asociado a EP y demencia por EP.
Similitudes y diferencias neuropsicológicas
Pese a la diversidad de los cuadros clínicos abordados y considerando los resultados obtenidos en base a los perfiles cognitivos-lingüísticos, resulta necesario destacar cierta sintomatología neuropsicológica clave para distinguir el DCL y las demencias.
Durante el DCL de tipo amnésico se evidencia compromiso de memoria, función ejecutiva y déficit en tareas de fluidez verbal, mismas características evidenciadas en EA de grado leve (62). Asimismo, el desempeño en tareas de denominación de objetos/personas son síntomas comunes en el DCL de tipo amnésico y la EA en etapas tempranas, afectando principalmente la habilidad de seleccionar, manipular y recuperar información previamente almacenada (60). Por otra parte, la evidencia sugiere que tanto en DPCL y demencia por EP se presentan déficits significativos en el funcionamiento ejecutivo, habilidades visuoespaciales y aprendizaje verbal (43).
En esta línea, sujetos con demencia por EP y EA en estadios avanzados, muestran desempeños similares en tareas de atención, habilidades visuoconstructivas y lenguaje; sin embargo, los sujetos con EA muestran un deterioro característico en la memoria episódica (45). En contraste, se ha reportado que la DV y la EA, de grado leve a moderado, presentan declives lingüísticos similares, afectando particularmente en tareas semánticas de denominación y producción/comprensión del discurso (28).
Aportaciones y lineamientos futuros
El considerable aumento de personas mayores en la sociedad promueve grandes desafíos para los profesionales de salud vinculados a pacientes que cursan con DCL y demencias, especialmente desde la evaluación y diagnóstico. Por tanto, conocer en detalle los perfiles cognitivos-lingüísticos en estos grupos, contribuye a mejorar la evaluación neuropsicológica, y consecuentemente, el proceso de intervención.
Los perfiles cognitivos-lingüísticos en DCL, DV, DPCL y EP representan un área de interés actual, ya que mediante ellos es posible una detección temprana y certera. Tal es el caso del estudio en DCL, donde se establece gran énfasis en el diagnóstico precoz para retrasar la progresión a cuadros demenciales. Así, una detección oportuna de la sintomatología del DCL permite potenciar los niveles de reserva cognitiva, promoviendo mejoras no sólo cognitivas sino también funcionales. Este postulado está en línea con el estudio de Toloza Ramírez & Martella (2019) (89), quienes establecen que el efecto neuroprotector de la reserva cognitiva se limita sólo a cuadros pre-demencia, por lo cual pesquisar de manera precoz los síntomas neuropsicológicos permite intervenir eficazmente mediante programas de estimulación cognitiva.
La EA es la forma más prevalente y primera causa de demencia en personas mayores. Si bien, presenta síntomas clínicos y cognitivos característicos, la investigación actual (29) sugiere que esta sintomatología también se reporta en cuadros de demencia frontotemporal. Por tanto, los declives en memoria, función ejecutiva y lenguaje deben ser analizados con cautela en la evaluación neuropsicológica para evitar diagnósticos errados (29). Así, nuestros hallazgos promueven avances en los diagnósticos neuropsicológicos certeros basados en los perfiles cognitivos-lingüísticos reportados (Tabla 2), sugiriendo además similitudes claves en cuadros de DV, DPCL y EP.
En consideración, investigaciones futuras deberían considerar estos dominios cognitivos-lingüísticos, ya que, se postulan como biomarcadores importantes para identificar y diferenciar correctamente estos cuadros demenciales de la EA. Adicionalmente, es necesario considerar mayor investigación también en dominios cognitivos como la atención y habilidades visuoespaciales/visuoconstructivas, ya que, los presentes hallazgos sugieren cambios sutiles, pero significativos, para el diagnóstico. Para esto, es necesario la confección de nuevas pruebas y/o tareas cognitivas-lingüísticas sensibles y específicas para cada cuadro clínico, en conjunto a estudios que consideren el uso de técnicas de neuroimagen avanzadas como la resonancia magnética funcional para explorar las bases cognitivas-lingüísticas conducentes a diagnósticos certeros y diferenciales.
Cabe destacar que de nuestro conocimiento, esta revisión es la primera que aborda estos cuadros clínicos en conjunto, y entrega directrices de utilidad para el diagnóstico neuropsicológico en base a perfiles cognitivos-lingüísticos; además de generar un importante aporte teórico, ya que, disminuye el vacío de conocimiento en esta área de estudio.
Limitaciones de la revisión
Nuestro estudio presenta algunas limitaciones importantes de destacar. Primero, no comprende un meta-análisis de los estudios incluidos, enfocándose principalmente en un análisis cualitativo de la información obtenida. En segundo lugar, el número de bases se limitó sólo a tres (PubMed, Scopus y Web of Science), por lo cual, futuras revisiones deberían ampliar el número para evitar sesgos en la selección e inclusión de artículos. En tercer lugar, los instrumentos/medidas de evaluación frecuentemente reportados como el MMSE y MoCA Test, si bien son sensibles para detectar el DCL, e incluso de cuadros de demencia como es el caso del MoCA Test (90), estos no consideran una evaluación exhaustiva del lenguaje, dificultando pesquisar los declives en esta función cognitiva. Esta misma problemática se refleja en la evaluación de demencias, ya que si bien los test más empleados son de utilidad (Tabla 1), estos no son específicos para cada cuadro y sus características cognitivas-lingüísticas. Finalmente, es necesario considerar que la presente revisión no contempló análisis de estudio publicados durante el año 2021, ya que, la búsqueda de literatura se extendió hasta Diciembre 2020.
Conclusión
En el DCL se sugiere la presencia de cambios sutiles, pero significativos, sobre la memoria y el funcionamiento ejecutivo, además de declives en lenguaje espontáneo que afectan principalmente el componente fonológico-semántico.
Las alteraciones en memoria, atención y función ejecutiva son síntomas clásicos de DV; no obstante, lingüísticamente el compromiso se expresa en tareas de fluidez verbal tanto semánticas como fonológicas. Estas mismas alteraciones en el lenguaje también se reportan en DPCL, pero se agregan dificultades sintáctico-gramaticales y en la comprensión/expresión del discurso. Asimismo, desde una arista cognitiva los síntomas en DPCL no sólo comprenden déficit en memoria y función ejecutiva, sino que también dificultades atencionales y en habilidades visuoconstructivas.
Por otra parte, en la EP asociada a demencia tiende a ser característico el declive a nivel mnésico, de función ejecutiva y en habilidades visuoespaciales. Adicionalmente, el déficit reportado en el lenguaje comprende al igual que en DPCL, alteraciones sintáctico-gramaticales y de fluidez verbal; sin embargo, se impone en mayor medida la dificultad en el uso de verbos.
Finalmente, cabe destacar que el diagnóstico precoz de pacientes con DCL y estas formas de demencia es necesario para prolongar los niveles de funcionalidad y calidad de vida en las personas mayores. Asimismo, la evaluación neuropsicológica debería considerar en forma especial, un análisis y visión detallada del procesamiento lingüístico y su sintomatología tanto en DCL como en DV, DPCL, y EP.














