INTRODUCCIÓN
La neuralgia del trigémino (NT) se caracteriza por un dolor facial generalmente unilateral de episodios recurrentes a lo largo de las ramas del nervio trigémino (1). La manifestación del dolor se describe como lancinante, agudo, repentino, superficial, similar a un choque eléctrico, de inicio y término brusco (2)(3). Además, se acompaña de hiperalgesia mecánica, química y térmica (4).
El origen más común es la compresión nerviosa que sufre la raíz del ganglio trigeminal cercano a su punto de entrada en el ángulo pontocerebeloso, usualmente dicha compresión se debe a una prolongación arterial o venosa anormal, siendo los principales vasos involucrados: la arteria cerebelosa superior, la arteria cerebelosa anteroinferior, las venas pónticas y la arteria basilar (2). Por otra parte, el hallazgo de ausencia de la compresión neurovascular en pacientes con NT o la presencia de compresión neurovascular en personas asintomáticas generó que se postulen una serie de teorías alternativas como el funcionamiento anormal de los canales iónicos (5). La alteración en la expresión de los canales de sodio, potasio y calcio podría aumentar la actividad neuronal de manera ectópica y espontánea, para así generar excitabilidad en el nervio y reducir el umbral de los nociceptores y de esta forma ser más sensibles a los estímulos de baja intensidad (3).
Los canales de sodio voltaje dependiente (VGSC) son complejos proteicos glicosilados que atraviesan la membrana celular; estos canales se despolarizan rápidamente aumentando la conductancia de Na+ en respuesta a estímulos nociceptivos, temperatura, tacto y propiocepción (6).
En la actualidad, se conoce muy poco sobre la base molecular de la NT (5). Los cambios electrofisiológicos son inciertos, pero están acompañados con variaciones en la expresión de canales iónicos, de receptores y de neuropéptidos que podrían aumentar la excitación de las neuronas y generar la patología en el paciente (7). En diversos estudios se ha evaluado la relación entre los subtipos Nav1.3, Nav1.7, Nav1.8 y Nav1.9 de los VGSC con la NT, debido a la participación de estos subtipos en otros dolores neuropáticos (8). Se ha encontrado que la expresión de algunos de estos subtipos de VGSC aumentan y otros disminuyen tras la lesión del nervio trigémino. Esta variación en la expresión, al parecer estaría implicada en el incremento de la generación y transmisión de potenciales de acción desencadenados por estímulos que normalmente serían subumbrales, y que activaría el dolor neuropático (9)(10). Aunque varios estudios han aclarado algunos mecanismos fisiopatológicos subyacentes a la NT, la base molecular sigue siendo difícil de alcanzar (4)(11)(12). Debido a ello la presente revisión tiene como objetivo dar una necesaria puesta al día sobre las implicaciones de los VGSC en la fisiopatología de la NT.
NEURALGIA DEL TRIGÉMINO
La NT es un dolor neuropático crónico que afecta a una o más ramas del nervio trigémino y causa dolor paroxístico entre el 91 y 99% de los casos; es decir un dolor profundo y de corta duración que puede presentarse al realizar actividades diarias como hablar, lavarse la cara y masticar e incluso este dolor puede propagarse más allá del área estimulada (13)(14).
De acuerdo con su etiología la NT se divide en: 1) clásica, causada por compresión del nervio trigémino debido a un vaso sanguíneo; 2) secundaria, causada por esclerosis múltiple o tumor benigno en el ángulo pontocerebeloso; 3) e idiopática (13). Según la hipótesis de la ignición, el efecto principal de la compresión microvascular es inducir patología localizada de la raíz del trigémino. Esto hace que las neuronas aferentes del trigémino, tanto los axones lesionados como los somas axotomizados, sean hiperexcitables (15). Siguiendo la teoría clásica, Mingxing Liu refiere que el aumento de la presión sanguínea puede generar compresión neurovascular a nivel de la raíz intracraneal del V par craneal. Esta comprensión podría ocasionar desmielinización, que mediante citoquinas proinflamatorias como TNF, IL-1, IL-6 induciría la expresión de los VGSC y canales mecanosensibles como Piezo 2. A su vez, estos canales mecanosensibles permitirían el flujo de Ca++ hasta alcanzar el potencial que active los VGSC, los cuales generan potenciales de acción ectópicos, asociados a la alodinia e hiperalgesia en la NT (16).
En una revisión sistemática se refiere que en un estudio epidemiológico realizado por Tallawy et al. en 13541 personas con edades comprendidas entre 37 y 52 años se encontró una prevalencia del 0.03% de la NT (17); sin embargo, en el mismo trabajo nos dicen que Mueller et al. encontraron una prevalencia de 0.3% en una muestra de 3336 personas entre la edad de 42 y 67 años(17). Por otra parte, se ha reportado que la incidencia es mayor en las mujeres con una relación mujer-hombre de 2-3:1, además el porcentaje de afección de una sola rama (maxilar o mandibular) es cercana al 60%; el porcentaje de afección de las dos ramas es cercana al 35% y la afección de la rama oftálmica es menor al 4% (7).
CANALES DE SODIO VOLTAJE DEPENDIENTE: ESTRUCTURA Y FUNCIÓN
Los VGSC son complejos proteicos transmembranales encargadas de la conducción de estímulos en diferentes partes del organismo y comprenden nueve isoformas que van desde Nav1.1 hasta Nav1.9. Estas isoformas se clasifican en sensibles a la tetrodotoxina (Nav1.1, Nav1.2, Nav1.3, Nav1.4, Nav1.6 y Nav1.7) y resistentes a la tetrodotoxina (Nav1.5, Nav1.8 y Nav1.9) (8). Aunque algunos indican que existen 10 subtipos de canales incluyendo al NavX(18).
Los canales de sodio son canales heteromultíméricos que consiste en la unión de una o más subunidades (19). La subunidad α, de las diferentes isoformas de los VGSC, son codificadas por genes que van desde SCN1A a SCN11A (núcleo supraquiasmático). Esta subunidad está compuesta por 2000 aminoácidos y representada estructuralmente por la unión de 4 dominios (DI hasta DIV). Cada dominio tiene 6 segmentos transmembranales (S1 hasta S6) (20)(21). La unión de los segmentos transmembranales S5 y S6 forma el poro por donde fluyen los iones Na+, como se puede observar en la Figura 1. (Figura 1)
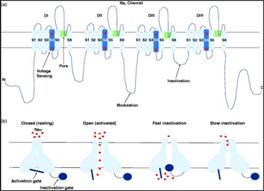
Figura 1 La estructura y los estados de los VGSC. (A): La subunidad α de los VGSC está formada por cuatro dominios (DI hasta DIV). Cada dominio está formado por 6 segmentos transversales (SI hasta S6). El segmento S4 capta el voltaje necesario para la activación del canal y la unión de los segmentos S5 y S6 forma el poro que permite el flujo de Na+. (B): Los VGSC presentan tres estados diferentes: cerrado, abierto e inactivado. En su estado cerrado la compuerta de activación está bloqueando el canal e impide el flujo de iones; en su estado abierto la compuerta de activación deja de bloquear el paso de iones y se da el flujo de Na+; mientras que en su estado de inactivado el canal impide el flujo de Na+ al estar bloqueado por la compuerta de inactivación, pasando a su estado cerrado cuando el bloqueo del canal pasa de la compuerta de inactivación al de la compuerta de activación. Tomado de Hameed et al(22).
Además de las subunidades α, encontramos a las subunidades β que son consideradas como auxiliares de las primeras y están compuesta principalmente de tres partes: un dominio transmembrana independiente; un extremo C-terminal intracelular; y un extremo N-terminal extracelular (18). Las subunidades β son codificadas por genes que van desde SCN1B a SCN4B (20). Por otra parte, las subunidades α son responsables de las funciones electrofisiológicas como la selectividad iónica, la resistencia a la tetrodotoxina y la sensibilidad y activación voltaje dependiente; dicha unidad solo muestra las características electrofisiológicas adecuadas cuando se co-expresa con la subunidad β(18), la cual permite la fijación de las isoformas Nav a la célula y su intercomunicación con otras proteínas de anclaje, influyendo en su excitabilidad neuronal y en la expresión, cinética y farmacología de los VGSC(20).
PROPIEDADES ELECTROFISIOLÓGICAS DE LOS CANALES DE SODIO VOLTAJE DEPENDIENTE
Cada isoforma del VGSC se activa a un umbral de potencial específico, el cual induce el desplazamiento de S4 para abrir la compuerta de activación, permitiendo el flujo de Na+, lo cual inicia y mantiene la despolarización (20). La repolarización es la fase siguiente del potencial de acción donde se da, por una parte, la inactivación de los VGSC y, por otra parte, la salida de iones potasio (20)(21). La inactivación de los VGSC puede darse de forma rápida, debido a la veloz unión de los dominios DIII-DIV al segmento S4, o de forma lenta, debido a procesos relacionados con los aminoácidos que recubren el segmento S6(21)(22). Asimismo, el flujo lento de los iones Na del canal Nav1.7 y su lenta inactivación, generan una corriente en rampa, la cual aumenta el potencial generado por estímulos sensoriales e inicia nuevos potenciales de acción (9). En tanto, la gran cantidad de flujo continuo de Na+ del canal de Nav1.8 y la rápida recuperación de su estado activado le permite aumentar la duración de los potenciales de acción (9)(22).
Los canales Nav1.9 se activan e inactivan cerca del potencial de membrana en reposo (9). Estos canales generan flujos constantes de Na+, ello es debido al bloqueo lento y parcial de sus compuertas que permite mantener el potencial en meseta a voltajes subumbrales. Este flujo activa los nociceptores y produce potenciales de acción a un umbral reducido, que sobreexcita las neuronas y generan el dolor neuropático (4).
Según el modelo computarizado de Hodgkin-Huxley modificado, se ha observado que el ingreso constante de estímulos nociceptivos en el ganglio trigeminal y el aumento en el flujo de sodio de los canales lentos de Nav1.8 producen un incremento en la actividad de la corteza somatosensorial generando y perpetuando el dolor de la NT (23). Un estudio realizado por Tanaka et al, muestra los cambios biofísicos causados en el VGSC por la sustitución de la metionina 136 por valina en el segmento transmembrana 1 del dominio 1. Dichos autores sostienen que la sustitución genera un aumento significativo en las corrientes pico transitorias y resurgentes (confiere hiperexcitabilidad) del canal Nav1.6 y que también reduce el umbral para el potencial de acción en las neuronas del ganglio del trigémino, activando a las neuronas implicadas más rápidamente (1).
NEURALGIA DEL TRIGÉMINO RELACIONADA CON LOS CANALES DE SODIO VOLTAJE DEPENDIENTE
Las neuronas primarias craneofaciales sensoriales del ganglio del trigémino expresan el ARNm de las isoformas de Nav1.3, Nav1.8 y Nav1.9 y de las subunidades β1, β2 y β3 durante el periodo embrionario. Esta expresión disminuye durante el desarrollo, a excepción de la expresión de la subunidad β1, la cual aumenta (24). Sin embargo, una lesión nerviosa puede alterar la expresión de dichas moléculas en los VGSC, variando así sus propiedades electrofisiológicas (10). Esto implica la modulación de las corrientes de sodio que contribuyen a la hiperexcitabilidad neuronal asociada a la generación de estados de dolor neuropático (19); en consecuencia, los canales de Nav cumplen un rol muy importante en la activación de dicho dolor (4).
El dolor neuropático causado tras una lesión nerviosa puede estimular la producción de la proteína quinasa y esta proteína a su vez, estimula el incremento de la expresión del canal de Nav1.7. Además, se ha observado que en la fase aguda de la patología hay un incremento del canal de Nav1.8 en neuronas no lesionadas, mientras que en la fase crónica se ha encontrado un aumento de la expresión del canal de Nav1.8 en las neuronas lesionadas (22). La alodinia e hiperalgesia de la NT podrían ser causadas por la generación de potenciales de acción producidos por el incremento del canal de Nav1.3 en el nervio y ganglio del trigémino después de la lesión nerviosa. Al parecer ello es debido a que se ha encontrado un aumento de la expresión del ARNm de dicha isoforma del VGSC después de la lesión del nervio infraorbitario (25).
Wenhua Xu et al, encontraron 1.3 veces más la expresión del ARNm del canal de Nav1.3 y, por otro lado, una menor expresión del ARNm de los canales de Nav1.7, Nav1.8 y Nav1.9, además de un menor umbral al dolor mecánico en el ganglio trigémino después de la lesión y ligadura del nervio infraorbitario en ratas. Además, señalan que la variación en la expresión de estas isoformas alteraría el flujo de Na+ iniciando potenciales de acción involuntarios en la NT (9). A su vez, Mingxing Liu et al, indican que la lesión del nervio trigémino podría aumentar el nivel de IL-6 y este, a su vez, aumentar la expresión del canal de Nav1.3 en el nervio y ganglio del trigémino, los cuales desencadenarían potenciales de acción ectópicos e indeseables asociados a la alodinia e hiperalgesia de la NT. Esto, tras encontrar que la expresión del canal de Nav1.3 aumentaba en ratas inyectadas con IL-6 y, por otra parte, disminuye en ratas sometidas a lesión por constricción del nervio infraorbitario e inyectadas con Anti-IL-6(12).
Luiz et al. demostraron la participación del canal de Nav1.9 en el desarrollo de la NT, al encontrar hiperalgesia mecánica y térmica en ratones homocigotos Nav1.9+/+ sometidos al modelo de lesión por constricción del nervio infraorbitario en comparación con ratones homocigotos Nav1.9-/-(4). Yoon et al, señalan que el aumento de la expresión de los canales Nav1.3, Nav1.7 y Nav1.9 y la reducción de la expresión de la proteína ácida fibrilar glial y fosforilada-p38 en el nervio y ganglio trigémino, pueden causar el dolor de la NT y este dolor puede contrarrestarse con la administración simple o doble de QX-314 (derivado de lidocaína cuaternaria impermeable a la membrana) inmediatamente después de la lesión del nervio (26).
En un modelo de lesión del nervio alveolar inferior en hurones se ha encontrado que el aumento de la expresión de canales resistentes a tetrodotoxina en el nervio lesionado generaría potenciales de acción involuntarios, al encontrarse un aumento de la expresión de las isoformas Nav1.8 y Nav1.9 en el nervio alveolar lesionado y una reducción de las isoformas Nav1.3, Nav1.7 y Nav1.9 en el ganglio trigémino del lado lesionado; sin embargo, estos hallazgos pueden ser exclusivos de la especie o el modelo inducido, dado que otros dolores neuropáticos han mostrado diferentes expresiones de las isoformas Nav1.3, Nav1.7 y Nav1.8 en el nervio y ganglio lesionado(10). Por otro lado, Siqueira et al, encontraron un aumento de la expresión del canal de Nav1.3 y una disminución de la expresión del canal de Nav1.7 en el tejido gingival de personas que padecían NT; sin embargo, no presentaban alteraciones a nivel de la raíz del ganglio trigémino. Por ello, plantearon que la canalopatía (alteraciones a nivel de los genes que modulan la expresión de los canales de Nav) puede darse previo a la desmielinización y causar el dolor de la NT (11). Por lo tanto, los subtipos Nav1.3, Nav1.7, Nav1.8 y Nav1.9 son las posibles isoformas del VGSC involucradas en la generación de la NT a través de la producción de potenciales de acción ectópicos asociados al aumento o disminución de su expresión, como se describe en la Tabla 1.
Tabla 1 Canales de sodio voltaje dependiente relacionados a la fisiopatología de la Neuralgia del Trigémino*.(9)(10)(11)
| VGSC | Sensibles a la tetrodoxina | Resistentes a la tetrodoxina | ||
| Nav1.3 | Nav1.7 | Nav1.8 | Nav1.9 | |
| Gen codificador | SCN3A | SCN9A | SCN10A | SCN11A |
| Voltaje de activación | -24 | -25 | -2 | -54 |
| Voltaje de inactivación | -70 | -74 | -36 | -54 |
| Propiedades electrofisiológicas | -Flujo continuo de iones Na -Activación, inactivación y reactivación rápida | -Flujo continuo de iones Na -Inactivación y reactivación lenta -Corriente en rampa | - Flujo continuo de iones Na - Activación rápida, inactivación lenta y reactivación rápida | - Flujo continuo de iones Na - Inactivación lenta y parcial - Corriente en meseta a nivel subumbral |
| Expresión fisiopatológica (tras lesión nerviosa) | -Incremento en el ganglio de trigémino, nervio trigémino y nervio infraorbitario de ratas; en el ganglio y nervio trigémino de hurones y en el tejido gingival de humanos. | -Disminuyó en el nervio y ganglio trigémino de ratas y en el tejido gingival de humanos. -Incremento en el nervio y ganglio del trigémino de hurones. | -Disminuyó en el nervio y ganglio del trigémino de ratas. - Incremento en el nervio y ganglio del trigémino de hurones. | -Incremento en el nervio y ganglio del trigémino de ratas. |
*Se recalcan las principales características bioeléctricas, encontradas, de los subtipos de canales de sodio voltaje dependientes en la fisiopatología de la Neuralgia del Trigémino.
NEURALGIA DEL TRIGÉMINO RELACIONADA CON LA GENÉTICA
Las mutaciones pueden controlar la apertura, cierre e inactivación del canal y esto generar cambios físicos en sus propiedades, estando relacionadas las mutaciones de ganancia de función con neuropatías dolorosas; en cambio, las mutaciones con pérdida de función se relacionan con manifestaciones indoloras (27). Las mutaciones que inactivan a los genes SCN9A y SCN11A que codifican a los canales de Nav1.7 y Nav1.9, respectivamente, generan insensibilidad congénita al dolor; mientras que las mutaciones de ganancia de función como la del gen SCN9A generan manifestaciones del dolor como la eritromelalgia hereditaria y el trastorno de dolor (7). Además, se ha encontrado que las mutaciones de ganancia de función del gen SCN8A del canal de Nav1.6 se ha relacionado con la posibilidad de sufrir NT (8).
Según Di Stefano et al, la variante p.AAla1304Thr del gen SCN10A puede causar NT, al expresarse como una mutación de ganancia de función que aumenta la expresión del canal de Nav1.8; esto debido a que fue una de las 41 variantes raras que encontraron, dichos investigadores, en el secuenciación del exoma completo de 11 personas con NT clásica e idiopática familiar(28). Además, se ha reportado que los polimorfismos rs6746030 del gen SNC9a y rs6334 del gen NTRK1 se relacionan con trastornos dolorosos y reducción de la sensibilidad mecánica, respectivamente (29)(30). Sin embargo, en un estudio realizado por Grazielle et al, no se encontró presencia de estos polimorfismos en personas con o sin NT ni en los diferentes grados de severidad de la NT. Por lo tanto, señalan que estos polimorfismos podrían no estar relacionados con la causa de esta patología (31).
CONCLUSIONES
Aún la base molecular de la neuralgia del trigémino está en proceso de entendimiento; sin embargo, se sabe que la patología estaría relacionada con alteraciones, tanto congénitas como adquiridas, en la expresión de diversas isoformas de los canales de sodio voltaje dependientes. Dichas alteraciones generarían un incremento en la generación y transmisión de potenciales de acción desencadenados por estímulos que normalmente serían subumbrales. Se considera necesario profundizar en la temática abordada en el presente trabajo para elucidar mejor la fisiopatología de esta alteración en búsqueda de las mejores opciones terapéuticas para los pacientes.














