Introducción
La Esclerosis Múltiple (EM) es una enfermedad crónica inflamatoria autoinmune del sistema nervioso central (1). Su prevalencia mundial estimada es de 36 casos por cada 100.000 habitantes, sin embargo, se encuentran variaciones significativas en las diferentes regiones del mundo (2). La incidencia de la enfermedad se estima en 107.000 personas diagnosticadas al año (2). En Colombia, la prevalencia de la EM es de 7 casos por cada 100.000 habitantes (3). La relación entre mujeres y hombres con la enfermedad es aproximadamente 2:1 a nivel mundial (3). La edad promedio del diagnóstico es a los 32 años, una etapa de la vida que se asocia con un proyecto de vida definido y una familia que se altera por el diagnóstico de la enfermedad (2).
La EM se asocia a una gran carga física, emocional y económica. Es la principal causa neurológica de discapacidad en los adultos jóvenes (2). Existen consecuencias para la sociedad como deserción escolar, el abandono del trabajo y la pensión temprana por discapacidad (4). Estas se deben tanto a los síntomas motores, visuales, cognitivos y sensitivos propios de la enfermedad, como a otras entidades que se correlacionan con ésta, como la fatiga, el dolor crónico, la ansiedad y la depresión (5). La disminución en la productividad asociada a la pérdida de ingresos, la necesidad de un cuidador debido a la perdida de la autonomía del paciente, la pensión temprana, la asistencia médica especializada, las ayudas diagnósticas avanzadas, la rehabilitación y la medicación, son algunos de los factores que derivan en un gran costo económico de la enfermedad (3)(6)(7)(8), posicionándola como una de las entidades más costosas para algunos sistemas de salud (6).
Una estrategia esencial para reducir esta carga de la enfermedad es mantener a las personas que viven con EM en condiciones óptimas de funcionalidad. El tiempo libre de discapacidad se define como la etapa de la enfermedad donde aún no hay discapacidad, esta última definida por la escala extendida de discapacidad de Kurtzke (EDSS) mayor a 3,5; a partir de este hito, los pacientes pierden la capacidad para caminar más de 500 metros y un sistema funcional evidencia alteración grado 4 (9). El tiempo de progresión a discapacidad es heterogéneo y depende tanto de características del paciente, como hábitos saludables, antecedentes y comorbilidades de la presentación de la EM (10)(11)(12), como de características del tratamiento (13)(14). Entender estos factores asociados permite identificar de forma temprana a los pacientes en alto riesgo de progresión acelerada a discapacidad y focalizar en ellos intervenciones multidisciplinarias para reducir la carga por discapacidad.
No obstante, no existen suficientes estudios sobre el tiempo libre de discapacidad en personas latinoamericanas que viven con EM que reconozca las particularidades de la enfermedad en la región. El objetivo de este estudio fue describir el tiempo libre de discapacidad desde el diagnóstico de EM y analizar factores asociados a la velocidad de progresión en pacientes.
Métodos
El reporte de este estudio sigue las recomendaciones de la guía STROBE (15). La investigación fue avalada por el comité de ética del Instituto Neurológico de Colombia-INDEC (acta del 28 de octubre 2019) bajo la clasificación de riesgo mínimo según la resolución 8430 de 1993 del Ministerio de Salud de Colombia.
Diseño del estudio y contexto. Se realizó un estudio retrospectivo de seguimiento a una cohorte basada en registros médicos de los pacientes que consultaron al INDEC entre los años 2013 al 2021. El inicio del seguimiento se definió como la fecha del diagnóstico de la enfermedad y los pacientes fueron seguidos la última consulta externa por neurología. El INDEC, ubicado en la ciudad de Medellín, es un centro de referencia a nivel de nacional de control de la EM.
Participantes. Se incluyeron pacientes que cumplieron los criterios: 1) diagnóstico confirmado de EM según los criterios de McDonald, 2) asistencia a los controles por neurología por consulta externa al menos una vez durante el tiempo de estudio, y 3) con evaluación de la EDSS en al menos una de las consultas. Se excluyeron los pacientes que no contaban con registro de resonancias magnéticas (RM). Los pacientes fueron identificados electrónicamente mediante en la base de datos de la institución (código diagnóstico G35X) y posteriormente se realizó verificación manual del cumplimiento de los criterios de elegibilidad.
Variables. Como variable de resultado se tomó el tiempo libre de discapacidad, definida como el tiempo en años entre el diagnóstico de EM y el cumplimiento de criterios para discapacidad clínicamente relevante, reflejada en una valoración en la EDSS mayor de 3,5 (9). Como variables potencialmente asociadas al tiempo libre de discapacidad se consideraron características demográficas como: edad, sexo y estado de convivencia, y las características clínicas: fenotipo de la enfermedad, tiempo desde los síntomas de inicio hasta el diagnóstico, edad del diagnóstico, síntomas iniciales por sistema funcional de la EDSS, complicaciones por sistema funcional, tratamiento modificador de la enfermedad, comorbilidades y su tratamiento y áreas con lesiones desmielinizantes en la resonancia magnética.
Fuentes de información y sesgo. La información se tomó de las historias clínicas. Se extrajo los registros a una base de datos de EM. Se realizó verificación de la información digitada y control de calidad al 100% de los registros. Las valoraciones del EDSS registradas en las historias clínicas fueron validadas por un investigador médico neurólogo.
Tamaño de la muestra. Se tomaron de forma consecutiva todos los pacientes elegibles dentro del periodo de estudio para un total de 216. De acuerdo con estudios de simulación para modelos de supervivencia paramétricos estimados mediante regresión de Weibull, este tamaño de muestra implica un poder estadístico mayor al 80% para Hazard Ratios (HR) >1,75 (<0,57) (16).
Análisis estadístico. Las características clínicas y demográficas de los pacientes se analizaron mediante estadísticos descriptivos. Para el análisis de factores asociados con el tiempo hasta una EDSS mayor a 3.5, se realizó un modelo paramétrico de supervivencia para datos censurados en intervalo. Mediante comparación de bondad de ajuste con los estadísticos de Akaike (AIC) se seleccionó la distribución de Weibull como la de mejor ajuste para los datos obtenidos en la muestra. Se presentan estimaciones del HR no ajustadas y ajustadas (aHR), junto con el intervalo de confianza de 95% y valor p, obtenidas mediante modelos de regresión simple y múltiple, respectivamente. Las medianas de tiempo libre de discapacidad se obtuvieron mediante estimación marginal a partir de los modelos de regresión simple. Se presenta la función de tiempo libre de discapacidad.
Para escoger variables candidatas al modelo de regresión múltiple se consideró el criterio de Hosmer Lemeshow (p ≤ 0.25). Como criterio para mantener las variables en el modelo final se consideró el criterio de información de AIC e importancia clínica, la significación estadística se estableció en p < 0,05. El supuesto de riesgos proporcionales se verificó mediante regresión de Cox para datos censurados en intervalo. Los análisis se ejecutaron en Stata versión 17.
Resultados
Se obtuvo un registro de 1.103 pacientes potencialmente elegibles, dentro de los que no cumplieron los criterios de inclusión se encontraron: 238 pacientes por vivir fuera del área metropolitana del Valle de Aburra, 437 no tenía confirmación de diagnóstico, 186 tuvieron consultas en otros servicios diferentes a consulta externa (urgencias, ayudas diagnosticas), 216 pacientes no tenían registro de la escala EDSS. En total fueron analizados 216 pacientes que se incluyeron en el estudio. Entre estos, 69 presentaban discapacidad en la primera valoración por neurología por lo que fueron censurados a la izquierda, 130 no habían presentado discapacidad en la última valoración, por lo cual fueron censurados a la derecha y 9 progresaron a discapacidad entre visitas a neurología por lo cual fueron censurados en intervalo.
Características clínicas y demográficas. La mayoría de los participantes eran mujeres (76,9%), la mediana de la edad al diagnóstico fue de 35 años (IQR 26,8- 44 años). El fenotipo con mayor cantidad de pacientes fue el remitente recurrente (EMRR), seguidos por primario progresivo (EMPP). El 16,7% ha presentado enfermedades metabólicas, el 9,3% de los pacientes ha padecido enfermedades cardiovasculares y en igual proporción enfermedades neurológicas. En cuanto al tratamiento de dichas comorbilidades, el 25,1% ha tenido tratamiento para diversas patologías y el 18,5% con analgésicos (Tabla 1).
Tabla 1 Características sociodemográficas y clínicas (n = 216)
| n | % | |
|---|---|---|
| Edad al diagnóstico de EM, Me (IQR) | 34.5 | (26- 43) |
| Sexo | ||
| Mujer | 166 | 76.9 % |
| Hombre | 50 | 23,1 % |
| Estado de convivencia | ||
| Con pareja | 89 | 41,2 |
| Sin pareja | 127 | 58,8 |
| Fenotipo | ||
| EMRR | 163 | 75,5 |
| EMRR | 31 | 14,4 |
| EMSP | 22 | 10 |
| Comorbilidades | ||
| Enfermedades metabólicas | 36 | 16,7 |
| Otras enfermedades | 25 | 11,6 |
| Enfermedades cardiovasculares | 20 | 9,3 |
| Enfermedades Neurológicas | 20 | 9,3 |
| Enfermedades mentales | 18 | 8,5 |
| Cáncer | 5 | 2,3 |
| Enfermedades infecciosas | 4 | 1,9 |
| Enfermedades autoinmunes | 3 | 1,4 |
| Tratamientos para las comorbilidades | ||
| Otros fármacos | 55 | 25,5 |
| Fármacos analgésicos | 40 | 18,5 |
| Fármacos cardiovasculares | 40 | 18,3 |
| Fármacos Metabólicos | 33 | 15,3 |
| Fármacos Suplementos de vitaminas | 31 | 14,4 |
| Fármacos relajantes musculares | 16 | 7,4 |
| Fármacos hipoglicemiantes | 9 | 4,2 |
| Medicamentos para la marcha | 9 | 4,2 |
| Toxina botulínica | 7 | 3,2 |
*EM: esclerosis múltiple; EMSP: esclerosis múltiple secundaria progresiva; Me: mediana; IQR: rango intercuartílico, RM: resonancia magnética.
Con respecto a aparición de los síntomas iniciales hasta el diagnóstico, la mediana fue de 12 meses (IQR 6 - 42), en el inicio de la enfermedad se presentaron manifestaciones clínicas según sistemas funcionales de la EDSS donde el 21,1% fueron cerebelosas, 33,3% sensitivos y el 31,9% presentaron otros síntomas. En las complicaciones, por los sistemas funcionales de la EDSS, el 47,2% tiene alteraciones en la visión, el 44,4% complicaciones cerebelosas y 17,3%, no han tenido complicaciones (Tabla 2).
Respecto a las RM se encontró que el 78% ha presentado lesiones en médula, el 71,8% lesiones periventriculares y el 70,3% yuxtacorticales. El uso de los fármacos modificadores de la enfermedad se ha distribuido de la siguiente manera: al 17,6% de los pacientes le han formulado alguna vez interferón beta 1B, 14,8% natalizumab y sin tratamiento modificador de la enfermedad (Tabla 2).
Tabla 2 Características clínicas, frecuencia de la prescripción y uso de tratamientos modificadores de la enfermedad a pacientes con esclerosis múltiple (n = 216).
| Variable | n | % |
|---|---|---|
| Tiempo de síntomas iniciales hasta el diagnostico, Me (IQR) | 12 | (6-42) |
| Síntomas al inicio de la enfermedad | ||
| Sensibilidad | 71 | 33,3 |
| Otros | 68 | 31,9 |
| Visión | 62 | 29,1 |
| Cerebelosos | 45 | 21,1 |
| Piramidales | 41 | 19,2 |
| Tronco- encéfalo | 3 | 1,4 |
| Funciones mentales | 1 | 0,5 |
| Vejiga- Intestino | 13 | 6,1 |
| Asintomática | 1 | 0,5 |
| Complicaciones | ||
| Visión | 102 | 47,2 |
| Cerebelosas | 96 | 44,4 |
| Sin complicaciones | 37 | 17,3 |
| Sensibilidad | 39 | 17,1 |
| Piramidales | 28 | 13.1 |
| Vejiga-intestino | 27 | 12,5 |
| Otras | 27 | 12,5 |
| Funciones mentales | 6 | 2,8 |
| Tronco encéfalo | 0 | 0 |
| Ubicación de los hallazgos en la RM | ||
| RM Medula | 163 | 78 |
| RM Periventricular | 150 | 71,8 |
| RM Yuxtacortical | 147 | 70,3 |
| RM Cerebelo | 82 | 39,2 |
| RM Tallo | 80 | 38,3 |
| Lesiones activas | 65 | 31,1 |
| RM Nervios ópticos | 17 | 8,1 |
| Fármacos modificadores de la enfermedad | ||
| Interferón Beta 1 B | 38 | 17,6 |
| Natalizumab | 32 | 14,8 |
| Sin tratamiento modificador | 32 | 14,8 |
| Teriflunomida | 1 | 10,6 |
| Fingolimod | 22 | 10,2 |
| Avonex | 11 | 9,7 |
| Peginterferon | 23 | 7,34 |
| Betaferon | 21 | 5,98 |
| Rebif | 11 | 5,1 |
| Copaxone | 8 | 3,7 |
| Acetato de glatiramer | 6 | 2,8 |
| Rituximab | 4 | 1,9 |
| Dimetilfumarato | 3 | 1,4 |
| Ocrelizumab | 2 | 0,9 |
*Me: mediana; IQR: rango intercuartílico, RM: resonancia magnética.
Tiempo libre de discapacidad. La mediana global del tiempo de supervivencia fue de 12 años (IC95% de 7.56- 17.66 años). En cuanto al tiempo libre de discapacidad se encontró que las personas con otros síntomas (de acuerdo a la clasificación de la EDSS) iniciales de la enfermedad tuvieron una mediana libre de discapacidad de 31.4 años (IC95% 1,71 - 61,09), mientras que los que no presentan este tipo de síntomas tienen la mediana libre de discapacidad de 8.81 años (IC95% 5,12 - 12,41). En pacientes con complicaciones cerebelosas la mediana fue de 2.63 años (IC95% 0,94 - 4,32), con complicaciones de visión fue de 8.59 años (IC95% 4,48 - 12,70), con lesiones de tallo, detectadas en RM, fue de 12.88 años (IC95% 4,51 - 21,25) y entre pacientes sin lesiones fue de 13.42 años (IC95% 6,76 - 20,09). La figura 1 presenta la supervivencia libre de discapacidad de todos los pacientes. (Figura 1)
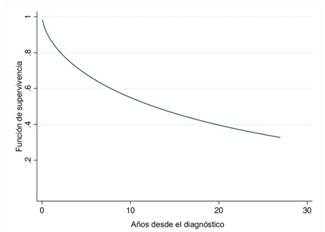
Figura 1 Curva de supervivencia libre de discapacidad de los pacientes que ingresaron al estudio, muestra la funciona de supervivencias versus los años desde el diagnóstico de la EM.
Entre los pacientes con EMRR, la mediana de tiempo libre de discapacidad fue de 38.72 años (IC95% 4,09 - 73,36). Este tiempo fue más corto entre los hombres con mediana de 6.14 años (IC95% 2,29 - 10,00) que entre las mujeres con mediana de 15.6 años (IC95% 8,20 - 23,01). Las personas con edad de diagnóstico mayores a 40 años tienen tiempos más cortos comparados con los menores de 40 años (Tabla 3).
Tabla 3 Medianas de tiempo libre de discapacidad en Esclerosis múltiple
| Mediana | (IC95%) | ||
|---|---|---|---|
| Otros síntomas iniciales | |||
| Sí | 31,41 | 1,71 | 61,10 |
| No | 8,82 | 5,22 | 12,41 |
| Complicaciones cerebelosas | |||
| Sí | 2,63 | 0,94 | 4,33 |
| No | 159,38 | 101,31 | 420,07 |
| Complicaciones Visión | |||
| Sí | 8,59 | 4,48 | 12,70 |
| No | 16,53 | 7,87 | 25,18 |
| RM Tallo | |||
| Sí | 12,89 | 4,52 | 21,25 |
| No | 13,43 | 6,76 | 20,09 |
| RR | |||
| Sí | 38,73 | 4,09 | 73,36 |
| No | 1,19 | 0,04 | 2,33 |
| Sexo | |||
| Hombre | 6,15 | 2,29 | 10,01 |
| Mujer | 15,61 | 8,21 | 23,01 |
| Edad al diagnóstico | |||
| >40 años | 5,55 | 2,30 | 8,81 |
| <40 años | 22,67 | 6,53 | 38,80 |
*Tiempos presentados en años; RM: resonancia magnética
Factores asociados al tiempo libre de discapacidad. En el modelo ajustado, las complicaciones cerebelosas (aHR = 8.18; IC95% 4.09-16.35), las complicaciones de visión (aHR = 2.25; IC95% 1.25-4.05) y edad al diagnóstico mayor a 40 años (aHR = 1.28; IC95% 0.68-2.4) se asociaron a menor tiempo de progresión a discapacidad, mientras que otros síntomas iniciales (aHR = 0.35; IC95% 0.18-0.68), lesiones de tallo (aHR = 0.6; IC95% 0.33-1.1), el fenotipo RR (aHR = 0.17; IC95% 0.08-0.33) y sexo femenino se asociaron a mayor tiempo de progresión (Tabla 4).
Tabla 4 Modelo de factores asociados a la progresión a discapacidad en Esclerosis Múltiple
| No ajustado | Ajustado | |||||||
|---|---|---|---|---|---|---|---|---|
| HR | IC (95%) | valor p | aHR | IC (95%) | valor p | |||
| Otros síntomas iniciales | ||||||||
| Si | 0,46 | 0,26 | 0,79 | 0,010 | 0,35 | 0,18 | 0,68 | <0,001 |
| NO | 1,00 | 1,00 | ||||||
| Complicaciones cerebelosas | ||||||||
| Si | 10,2 | 5,45 | 19,13 | 0,010 | 8,18 | 4,09 | 16,35 | <0,001 |
| NO | 1,00 | 1,00 | ||||||
| Complicaciones Visión | ||||||||
| Si | 1,74 | 1,11 | 2,74 | 0,020 | 2,25 | 1,25 | 4,05 | 0,010 |
| NO | 1,00 | 1,00 | ||||||
| RM Tallo | ||||||||
| Si | 1,07 | 0,66 | 1,73 | 0,780 | 0,60 | 0,33 | 1,10 | 0,100 |
| NO | 1,00 | 1,00 | ||||||
| RR | ||||||||
| Si | 0,13 | 0,08 | 0,21 | 0,010 | 0,17 | 0,08 | 0,33 | <0,001 |
| NO | 1,00 | 1,00 | ||||||
| Sexo | ||||||||
| Hombre | 1,96 | 1,19 | 3,22 | 0,010 | 0,98 | 0,47 | 2,05 | 0,960 |
| Mujer | 1,00 | 1,00 | ||||||
| Edad al Diagnostico | ||||||||
| >40 años | 2,16 | 1,36 | 3,42 | 0,010 | 1,28 | 0,68 | 2,40 | 0,440 |
| <40 años | 1,00 | 1,00 |
Discusión
Este estudio tuvo como objetivo describir el tiempo libre de discapacidad en pacientes con EM y analizar los factores asociados a la progresión de la discapacidad. El tiempo libre de discapacidad ha sido abordado en diferentes estudios, Tomassini y otros, analizaron la evolución de la discapacidad de la EM para alcanzar una EDSS de 3,5, identificaron una mediana de tiempo libre de discapacidad de 12 años y la edad mayor de 45 años de los pacientes pronosticó una discapacidad en aumento (17). En nuestro estudio se presentaron datos representados en mediana de tiempo libre de discapacidad de 12 años, con mediana de edad de ingreso al estudio de 40.5 años. En otros estudios indican que alcanzar una EDSS de 3 puede tardar hasta 15 años, pero solo alrededor del 20% de los pacientes progresan (18).
Las variables de caracterización sociodemográficas han tenido gran relación con el origen y pronóstico de la EM, se ha descrito que es más frecuente en mujeres que en hombres (19), pero estos últimos con peor pronóstico (2)(20), lo cual se relacionada con los resultados de este estudio, teniendo en cuenta que los hombres progresan más rápido a discapacidad comparado con las mujeres. La edad ha sido importante en el desarrollo de la EM, según la literatura la edad media de inicio de síntomas de la enfermedad está entre los 25 a 30 años (19), un tiempo que es muy importante para el desarrollo académico, familiar y personal de las personas. Además, se ha destacado que entre mayor edad peor es el pronóstico en cuanto a progresión de la discapacidad, aunque es más frecuente encontrar que el diagnóstico se haga antes de los 40 años (19)(21)(22), en el presente estudio las personas con edades de diagnóstico por encima de los 40 años tuvieron tiempos libres de discapacidad más cortos.
El fenotipo de EM del paciente también es un factor que puede influir en la discapacidad ya que el inicio de la patología con EMPP, puede llevar a tener una progresión de la discapacidad en menor tiempo (20)(23). Gran parte de los pacientes con fenotipo EMRR después de los 20 años van a necesitar algún instrumento de ayuda para deambular (19), este periodo puede ser inferior a 10 años en EMPP (24). Además, otros datos han informado que los hombres padecen más del fenotipo EMPP, lo cual puede aumentar las posibilidades de peor pronóstico (25). En este estudio se encontró que el 54% de los pacientes con este fenotipo son de sexo masculino. Los datos de la literatura guardan relación con el presente estudio en donde los tiempos de progresión son mayores en el fenotipo EMRR, por ende, menores en los fenotipos progresivos (26).
En la literatura se menciona que la presentación de síntomas iniciales relacionados con la valoración realizada con la EDSS son variables dentro de la enfermedad, los síntomas piramidales, visuales y cerebelosos hacen presencia, además de otros signos y síntomas que se pueden presentar en los pacientes que hacen necesario realizar un diagnóstico diferencial (27). Otros estudios hacen aproximaciones más específicas, encontrando que las alteraciones de marcha y visuales al inicio de la enfermedad repercuten después de un tiempo (superior a 4 años) en el pronóstico de esta (28). En el presente estudio los otros síntomas de inicio (según la EDSS) que fueron obtenidos de acuerdo a la aplicación de la EDSS, explicaron de una mejor forma el tiempo de progresión. Estos pacientes tienen tiempos libres de discapacidad más amplios, aunque otros trabajos han argumentado que los pacientes con sintomatología sensitiva o visual tienen mejor pronóstico a lo largo de la enfermedad (18).
En estudios se han encontrado diferentes complicaciones a lo largo del desarrollo de la enfermedad y la posible discapacidad que se genera. Las alteraciones cerebelosas se pueden presentar en más del 90% de los pacientes, estas incluyen las alteraciones motoras, recordando que la EDSS cuando tiene un valor superior a 6, calcula con buena precisión las alteraciones en la marcha (29); esto guardó relación con los hallazgos de este estudio puesto que las complicaciones cerebelosas tuvieron asociación estadística e hicieron parte del modelo multivariado. Otras de las complicaciones que se encuentran en la literatura con altos porcentajes son las de las alteraciones sensitivas, tronco-cerebrales, esfinterianas y visuales (30), algunos datos tienen en cuenta que las complicaciones de la vejiga tienen relación con el deterioro de la medula espinal (31). En este estudio se encontró que los pacientes con complicaciones de visión tuvieron menores tiempos de progresión que quienes no tienen este tipo de complicaciones.
Las imágenes por RM ayudan a mantener al paciente controlado desde el momento del diagnóstico hasta cada una de las fases de la enfermedad, estas permiten reconocer las complicaciones de los pacientes e identificar tanto las necesidades del paciente como la existencia de posibles complicaciones (14). Es de recordar que las lesiones en RM pueden aparecer incluso en periodos de estabilidad clínica, además se ha descrito una menor actividad radiológica de la enfermedad en aquellos pacientes que reciben fármacos modificadores de la enfermedad (32). La RM magnética es utilizada en gran parte de la población de pacientes con la enfermedad, la literatura muestra que es útil y necesaria para el seguimiento de los pacientes, pero cuando se correlaciona con la EDSS la efectividad disminuye en etapas progresivas tardías (33). En el caso de las lesiones de tallo, algunos de los pacientes del presente estudio que las tuvieron, tienen tiempos más prolongados en obtener puntajes más altos en la escala EDSS, a pesar de que se ha descrito que la identificación de estas lesiones guarda relación con las complicaciones cerebelosas y estás a su vez en un pronóstico más desfavorable de la enfermedad (34).
Las principales limitaciones de este estudio son el muestreo no probabilístico, por tanto, no es un estudio representativo del área metropolitana del Valle de Aburrá y el hecho de que por tratarse de un estudio retrospectivo se puede incurrir en sesgos de memoria respecto a las variables reconstruidas. No obstante, esto se hizo en el marco de la entrevista clínica con el neurólogo.
Conclusión
Las complicaciones cerebelosas, complicaciones de visión, edad mayor a 40 años, se asociaron como factores con menor tiempo de progresión, mientras que otros síntomas iniciales, RM de tallo, fenotipo EMRR y sexo son factores asociados a tiempos de progresión más prologados. Estos factores clínicos e imagenológicas, conocidos desde el diagnóstico, permiten identificar pacientes de alto riesgo de rápida progresión a discapacidad, para un acompañamiento oportuno e integral.














