El hipoparatiroidismo es una enfermedad caracterizada por una producción insuficiente de hormona paratiroidea (PTH), que resulta en hipocalcemia e hiperfosfatemia. La etiología más común es la lesión o extracción involuntaria de las glándulas paratiroides durante una cirugía de tiroides (75%); el resto se debe a enfermedades autoinmunes, infiltrativas y/o genéticas cuyo diagnostico etiológico es muchas veces difícil de lograr y cuya terapéutica actual resulta aún controversial. Las causas de hipoparatiroidismo aislado no quirúrgico pueden ser genéticas o autoinmunes; dentro de las primeras se encuentran las mutaciones activantes del receptor sensor de calcio (CaSR), las del gen de PTH y las del GCMB; también se describieron mutaciones bialélicas del gen AIRE que causan hipoparatiroidismo aislado. Dentro de las autoinmunes se encuentran los anticuerpos estimulantes del CaSR y los anticuerpos contra el INFα. (1)
Presentamos el caso de una paciente femenina de 24 años, derivada por hipocalcemia. Desde los 7 años era atendida en otro centro por cuadro de hiperexcitabilidad y rigidez generalizada, con diagnóstico de síndrome de “Stiff Person”, por el cual recibió 3 pulsos de Inmunoglobulinas (2012-2014). Refería parestesias faciales; negaba antecedentes de candidiasis mucocutánea y presentaba signos de Trousseau y Chvosteck negativos. Laboratorio: Calcemia 4.7 mg/dl (8.5-10.2), Calcemia Iónica 1.74 mg/dl (4.5-5.5), Albúmina: 5.28 g/dl, Fosfatemia 9.12 mg/dl (2.7-4.5), Magnesemia 2.4 mg/dl (1.7-2.55), PTH <3 pg/mL (16-87), 25(OH)D 21 ng/ml (30-100) y 1,25(OH)D 6.7 pg/ml (18-60) (Tabla 1). Ecocardiograma: insuficiencia tricuspídea leve sin otras alteraciones; TAC de cerebro: múltiples calcificaciones cerebelosas y en ganglios basales (Figura 1); Ecografía renal normal. Ante la ausencia de antecedentes de candidiasis mucocutánea y de signo-sintomatología de insuficiencia adrenal, se descartó la posibilidad de un síndrome poliglandular autoinmune tipo 1. La ausencia de dimorfismo facial, fisura palatina y alteraciones renales permitió arribar al diagnóstico de hipoparatiroidismo aislado, no asociado a síndrome de Di George u otros como el Kenny-Caffey, el HDR o el Bartter tipo 5 (1). La paciente fue medicada con sales de calcio y magnesio EV, calcitriol 0.75 μg y carbonato de calcio oral como quelante del fósforo. Posteriormente se rotó a vía oral requiriendo Citrato de Calcio 3g/día (6 comprimidos), Carbonato de Calcio 3g/día (6 comprimidos), Calcitriol 0.75 μg/día (3 comprimidos) y HoloMg 325 mg/día (1 comprimido), para mantener los objetivos terapéuticos (calcemia 8-8,5 mg/dl; fosfatemia < 6mg/dl) (2). Actualmente la paciente se encuentra en espera de la autorización para recibir tratamiento con rhPTH 1-84(3), debido al deterioro de calidad de vida secundario a la ingesta crónica de una gran cantidad de comprimidos y la dificultad de mantener una adherencia adecuada al tratamiento por inconvenientes al acceso de dicha medicación.
Tabla 1 Resultados de laboratorio.
| Valor obtenido | Valor de referencia | |
|---|---|---|
| Calcio Total | 4,7 mg/dl | 8.5-10.2 |
| Ca iónico | 1,74 mg/dl | 4.25-5.2 |
| Fosforo | 9.12 mg/dl | 2.7-4.5 |
| Magnesio | 2.4 mg/dl | 1.7-2.55 |
| Albumina | 5,28 mg/dl | 3.50-5.2 |
| PTH | <3 pg/ml | 16-87 |
| 25 OH VD | 21 ng/ml | 30-100 |
| 1-25 OH VD | 6.7 pg/ml | 18-60 |
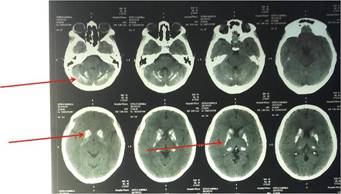
Figura 1 Las flechas rojas señalan las calcificaciones cerebelosas y a nivel de los núcleos grises de la base.
Uno de los efectos secundarios principales del inadecuado tratamiento es la presencia de calcificaciones ectópicas en los núcleos de la base (putamen, globo pálido, caudado), presente en un 15-20% de los pacientes con Hipoparatiroidismo, un estudio demostró que la prevalencia se eleva al 36% cuando la causa del Hipoparatiroidismo es la mutación activante del CaSR (Receptor Sensor de Calcio). Su fisiopatología aún es desconocida y permanece siendo un enigma, pero se cree estaría relacionada principalmente al aumento del producto Fosfo/Cálcico (multiplicación del calcio sérico por el fósforo sérico), cuyo umbral por encima de 55, produciría el depósito de cristales de hidroxiapatita en otros tejidos, otra teoría sugiere la existencia de canales iónicos en los ganglios basales que actuarían activamente en la excreción de fósforo, también se cree que una alteración en el ratio PIT1/PIT2 (Transportador de fósforo dependiente de sodio 1/2) podría tener un rol en su fisiopatología (4). Estudios demostraron además que en aquellos pacientes con cataratas y/o convulsiones tendrían 4-5 veces más probabilidad de tener calcificaciones de los ganglios de la base (BCG). Generalmente se presentan bilaterales, simétricos, densos y difusos, y el principalmente afectado es el globo pálido. El mismo es un desorden progresivo, asociado al tiempo de evolución del hipoparatiroidismo, que podría estar asociado a alteraciones cognitivas. (5)
A diferencia de otras endocrinopatías que cuentan con terapia hormonal sustitutiva específica, el hipoparatiroidismo aun no cuenta al menos en Argentina con terapia hormonal especifica. Sin embargo, ya existen terapéuticas potenciales tales como el Teriparatide rhPTH (1-34) o rhPTH (1-84) (6). Esta última fue aprobada por la FDA en enero 2015 y el estudio REPLACE ha demostrado su efectividad en el tratamiento del hipoparatiroidismo cuando se compara con calcio y vitamina D vía oral (7). Otros estudios demostraron que el Teriparatide conduce a mejoría del perfil fosfo-cálcico, la hipercalciuria y la calidad de vida en estos pacientes. (8)
El estudio de un hipoparatiroidismo no quirúrgico es siempre un desafío diagnóstico y terapéutico dada su escasa frecuencia de presentación en adultos, los diagnósticos diferenciales que enmascaran la enfermedad, la necesidad del estudio genético no siempre disponible y la dificultad para acceder a una terapéutica específica que mejore la sintomatología y la calidad de vida.














