Introducción
Los eventos cerebrovasculares agudos (ictus) conllevan un alto riesgo de consecuencias devastadoras para sus víctimas y tienen un gran impacto en la salud de una sociedad. A nivel mundial, se estima que existen aproximadamente 14 millones de ictus nuevos y 6 millones de muertes relacionadas a ictus cada año, representando así la causa más común de discapacidad crónica en adultos y la segunda causa de muerte más frecuente después de la enfermedad coronaria (1). Mas del 70% de ictus y muertes relacionas a ictus ocurren en países en vías de desarrollo (2). Mas aún, se pronostica un aumento de la morbimortalidad relacionada a ictus en los países en vías de desarrollo debido al envejecimiento poblacional y a la transición epidemiológica de enfermedades traumáticas e infecciosas a enfermedades crónicas no transmisibles (2)(3).
El ictus isquémico es el tipo más frecuentes de ictus y puede originarse por patologías heterogéneas(4). La aterosclerosis carotidea (AC) es responsable del 10 al 20% de todos los ictus isquémicos(5)(6). El principal factor que determina el riesgo de ictus en individuos con AC es el grado de estenosis luminar causado por la placa aterosclerótica. Se considera AC moderada cuando la estenosis es del 50-69% y AC severa cuando es =70%(7)(8). Además, existen biomarcadores detectados por métodos de imagen no invasivos que revelan la presencia de AC subclínica. Estos biomarcadores incluyen el aumento del grosor de la íntima media carotidea (GIMC) y la presencia de placa carotidea no estenosante (Figura 1). Los biomarcadores de AC subclínica no solo han sido relacionados a un aumento del riesgo de ictus, pero también a una mayor incidencia de eventos cardiovasculares(9).

Figura 1 Ultrasonido carotideo mostrando área engrosamiento focal invadiendo el lumen de =1.5 mm consistente con placa carotidea.
La AC es de especial interés para los neurólogos vasculares debido a su alta prevalencia, alto riesgo de ictus recurrente y a la existencia de varias medidas terapéuticas para su manejo y prevención. Estudios pioneros demostraron que la revascularización mediante endarterectomía carotidea (EAC) disminuye significativamente el riesgo de ictus recurrente en pacientes con isquemia cerebral secundaria a AC con estenosis luminar =50% (10)(11)(12). Posteriormente, la revascularización endovascular mediante angioplastía y stent carotideo (SC) surgió como una alternativa terapéutica(13). En la actualidad, la revascularización carotidea es el procedimiento invasivo más comúnmente realizado para prevenir ictus(14). Paralelo a esto, el adelanto en terapias médicas en los últimos años incluyendo el uso de estatinas, el manejo de medicamentos anti-hipertensivos, y el control intensivo de factores de riesgo como el tabaquismo y la inactividad física, han resultado en una disminución en el riesgo de eventos vasculares en individuos con AC(15)(16). En el presente artículo presentamos una revisión sobre la morbilidad de la AC, su fisiopatología, métodos diagnósticos y manejo terapéutico médico y quirúrgico. El objetivo de nuestro artículo es resumir los conocimientos actuales sobre la AC para así identificar donde existen espacios que requieren más investigación.
Prevalencia y factores de riesgo de la aterosclerosis carotidea
La prevalencia de AC depende de la población estudiada y de los criterios que se utilicen para definir AC. Se estima que la prevalencia de AC subclínica y de AC con estenosis en la población general ha aumentado más del 50% en los últimos 20 años, especialmente en el grupo de edad de 50 a 59 años(17). Una reciente revisión sistemática de la literatura reportó que, en el grupo de edad de 30 a 79 años, la prevalencia global de aumento de GIMC (=1mm) y la presencia de placa carotidea (engrosamiento focal invadiendo el lumen =1.5 mm o =50% de la íntima media adyacente) es del 28% y 21%, respectivamente(17). Esta revisión sistemática muestra que la prevalencia de biomarcadores de AC aumenta significativamente con la edad y fue mayor en hombres comparado a mujeres en todos los subgrupos de edad. Por ejemplo, en hombres de 75 a 79 años de edad, la prevalencia de aumento de GIMC fue del 75% y la presencia de placa carotidea fue del 63%(17). Otra revisión sistemática reportó que la prevalencia de AC con estenosis luminar =50% en la población general oscila entre el 2 al 7%(18). Similar a los biomarcadores de AC subclínica, la prevalencia de AC con estenosis =50% es mayor en hombres comparado a mujeres y en aquellos de edad avanzada, siendo del 7 al 20% en hombres mayores de 70 años(18).
Además de la edad avanzada y el sexo masculino, otros factores tradicionales de riesgo vascular asociados a AC son hipertensión arterial, diabetes mellitus, hiperlipidemia (elevación de lipoproteínas de baja densidad y disminución de lipoproteínas de alta densidad), tabaquismo, consumo de alcohol en exceso, síndrome metabólico, hiperuricemia, homocisteína elevada, obesidad (en especial obesidad abdominal), e inactividad física(17)(19)(20)(21)(22). Algunos de estos factores tienen una relación dosis-respuesta con la AC, como se demostró el estudio Framingham en el cual hubo una correlación positiva independiente entre la severidad de estenosis carotidea y valores continuos de edad, presión arterial sistólica, colesterol total y cigarrillos diarios(19). Es importante mencionar que los factores tradicionales de riesgo vascular explican menos del 25% de la variación interindividual de biomarcadores de AC subclínica(23)(24), y menos del 40% de la variación interindividual de la severidad de estenosis carotidea(20). Esto último sugiere que existen varios factores de riesgos no tradicionales que juegan un papel importante en el desarrollo de AC, entre los cuales se encuentras factores genéticos(25), deficiencias nutricionales(26)(27), estados pro-inflamatorios(28), e incluso la geometría anatómica de la arteria carótida(29).
Finalmente, existen diferencias raciales y étnicas en la prevalencia de AC(30)(31)(32). Dichas diferencias son atribuidas ya sea a una distribución diferente de factores de riesgo, o alternativamente, a diferentes predisposiciones genéticas para desarrollar AC. Por ejemplo, el estudio poblacional Northern Manhattan Study (NOMAS), el cual incluyó una cohorte multiétnica de individuos viviendo en una zona urbana común en Nueva York, demostró que los Hispanos tenían valores menores de GIMC y menor presencia de placa comparado a los participantes de raza Negra o Caucásica(30) Curiosamente, la influencia de la hiperlipidemia fue mucho más marcada en el grupo de Hispanos, lo que sugiere diferente vulnerabilidad a ciertos factores de riesgo(30). Un estudio poblacional realizado en una zona rural de la costa ecuatoriana mostró que la prevalencia de AC se encuentra en los limites inferiores de lo reportado en la literatura. Este estudio reportó frecuencias del 14%, 24% y 3.4% para aumento de GIMC, presencia de placa, y estenosis carotidea =50%, respectivamente(34). Esto último contrasta con una prevalencia mayor de estenosis intracraneal reportada en Hispanos e indígenas americanos(35)(36).
Fisiopatología de la aterosclerosis carotidea
Similar a la formación de aterosclerosis en otros territorios vasculares, la AC se origina por una lesión física o metabólica del endotelio. El daño del endotelio afecta la permeabilidad de la íntima resultando en el depósito de material lipídico y desencadenando una respuesta inflamatoria local. Dicha inflamación atrae varias células inflamatorias entre las que se encuentran macrófagos, los cuales al rodear moléculas lipídicas forman células espumosas. Este proceso comienza en etapas tempranas de la vida y se caracteriza por la formación de estrías grasas arteriales. En situaciones donde la injuria endotelial persiste, la perpetuación de la respuesta inflamatoria resulta en una mayor proliferación celular, disfunción del musculo liso vascular y generación de una capa fibrosa. Esto último se conoce como ateroma o placa aterosclerótica(37). Las placas ateroscleróticas son lesiones biológicamente activas que promueven la remodelación vascular. Inicialmente la remodelación vascular genera una dilatación arterial compensatoria dirigida a mantener el lumen de la arteria(38). Sin embargo, el crecimiento progresivo de las placas ateroscleróticas puede resultar en invasión del lumen de la arteria, causar la disrupción del flujo sanguíneo laminar, y subsecuentemente comprometer la perfusión cerebral. Paralelamente, el constante estrés metabólico junto a otros factores no completamente identificados puede causar ulceración y ruptura de la placa aterosclerótica resultando en agregación plaquetaria y tromboembolismo distal.
Las lesiones ateroscleróticas carotideas se encuentran principalmente a nivel de la bifurcación de la arteria carótida común (ACC) en sus ramas arteria carótida interna (ACI) y arteria carótida externa (ACE). La localización de las placas ateroscleróticas se atribuye a las alteraciones de flujo producidas por la división de corrientes sanguíneas rápidas(39)(40). Este fenómeno hemodinámico produce áreas de flujo turbulento a nivel de la pared externa del bulbo carotideo y el segmento proximal de la ACI, lo que a su vez desencadena cambios endoteliales aterogénicos(41)(42). Variantes anatómicas como el ángulo de bifurcación carotidea y el diámetro del bulbo carotideo pueden influir el comportamiento del flujo sanguíneo y así ser un determinante en el riesgo de AC(29).
Diagnóstico de la aterosclerosis carotidea
El riesgo de ictus en individuos con AC se encuentra estrechamente relacionado al grado de estenosis del lumen arterial. En pacientes con AC sin historia de isquemia cerebral previa (AC asintomática), el riesgo de ictus relacionado a AC con estenosis <60% es menor al 1% anual. Este riesgo se duplica o triplica en aquellos con estenosis =60%(42). El riesgo de ictus recurrente en aquellos pacientes con AC que se presentan con un ataque isquémico transitorio (AIT), isquemia de la retina, o infarto hemisférico ipsilateral (AC sintomática) es mucho mayor, pudiendo llegar hasta el 20% en los primeros 90 días después de un evento isquémico índice en aquellos pacientes con AC severa que no reciben revascularización carotidea temprana(43)(44). Similar a la AC asintomática, el riesgo de ictus recurrente en pacientes con AC sintomática aumenta en relación al grado de estenosis. Mas aún, existe una correlación linear entre el beneficio de la revascularización carotidea y el grado de estenosis luminar(45). Es por eso que existen dos factores fundamentales en el diagnóstico y estratificación de la AC: 1) Presencia de síntomas isquémicos relacionados (AC sintomática versus AC asintomática), y 2) grado de estenosis luminar.
La presencia de AC debe ser investigada como parte de la batería diagnóstica etiológica de un ictus isquémico, así como en la presencia de síntomas hemisféricos transitorios sugestivos de AIT y frente a la perdida monocular de la visión, ya sea persistente o transitoria (amaurosis fugax) (46). Hallazgos incidentales como infartos embólicos silentes de la circulación anterior en neuroimagen o placas de Hollenhorst en fundoscopía, también deben sugerir la investigación de AC(47). Por otra parte, la investigación de AC es considerada innecesaria en pacientes con síntomas no focales como síncope o alteraciones transitorias de la conciencia(48)(49). Es importante también mencionar que la presencia de soplos carotideos en el examen físico se correlaciona pobremente con el grado de estenosis carotidea. Sin embargo, el soplo carotideo continúa siendo una herramienta práctica para identificar individuos con alto riesgo cardiovascular(50).
La angiografía por sustracción digital es el "gold standard" para el diagnóstico y estratificación de la AC. No obstante, este método diagnóstico deber ser reservado para situaciones muy particulares debido a las complicaciones relacionadas al procedimiento invasivo. Los métodos diagnósticos no invasivos para detectar AC incluyen el ultrasonido carotideo (UC), la angiografía por tomografía computada (ATC), y la angiografía por resonancia magnética (ARM), entre los cuales la ARM con contraste es el método no invasivo más preciso para determinar AC severa (70-99%)(51). Es importante recalcar que el uso de contraste con gadolinio en ARM de cuello es necesario para delimitar correctamente el espacio vascular de los tejidos blandos adyacentes(52) . A pesar de la ARM ser más precisa, el UC es el método diagnóstico mas utilizado debido a su bajo costo y fácil accesibilidad(53). Las ventajas y desventajas de cada método diagnóstico se resumen en la tabla 1. (Tabla 1)
Tabla 1 Ventajas y desventajas de los diferentes métodos diagnósticos para la enfermedad carotidea aterosclerótica.
| Sensibilidad / Especificidad | Ventajas | Desventajas | |
| Ultrasonido carotideo | 85-92% 77-89% | -Método no invasivo -No utiliza radiación -No utiliza contraste -Bajo costo y de fácil acceso | -Operador dependiente -No evalúa circulación intracraneal -Sobrestima el grado de estenosis en presencia de oclusión carotidea contralateral -Criterios diagnósticos no definidos |
| Angiografía por tomografía computada | 68-84% 91-97% | -Método no invasivo -Evalúa la circulación intracraneal -Rápida adquisición -Bajo costo relativo | -Utiliza radiación -Utiliza contraste intravenoso -Riesgo de injuria renal -Sujeto a artefacto por placas calcificadas -Subestima el grado de estenosis |
| Angiografía por resonancia magnética con contraste | 88-97% 89-96% | -Método no invasivo -No utiliza radiación -Evalúa la circulación intracraneal -Método no invasivo más preciso | -Alto costo -Utiliza contraste intravenoso (gadolinio) -Riesgo de fibrosis sistémica en pacientes con insuficiencia renal severa -Tiempo de adquisición largo -Sujeto a artefactos de movimiento -No disponible si hay contraindicaciones para resonancia magnética |
| Angiografía por sustracción digita | “Gold standard” | -Posibilidad de intervención terapéutica -Evalúa circulación intracraneal | -Método invasivo con riesgo de complicaciones neurológicas (~1%) -Alta exposición a radiación -Utiliza contraste (riesgo de injuria renal) -Acceso limitado a centros con alta especialización neurovascular |
La valoración del grado de estenosis en angiografía con sustracción digital es basada en los criterios utilizados por los estudios originales que demostraron el beneficio de la revascularización carotidea(10)(11). En el estudio North American Symptomatic Carotid Endarterectomy Trial (NASCET), el grado de estenosis se calculó usando como numerador el punto de mayor estenosis y como denominador el segmento distal sano de la ACI(10). En el estudio European Carotid Surgery Trial (ECST), el denominador utilizado fue el diámetro original del segmento estenosado(11). A pesar de diferencias significativas entre NASCET y ECST, existe una correlación directa entre estos dos métodos como se muestra en la figura 2(54). Sin embargo, la mayoría de guías de tratamiento utilizan los criterios de NASCET y generalmente se favorece estos criterios en reportes radiológicos(53). La ACT y la ARM pueden generar imágenes con reconstrucciones en tercera dimensión y valorar el grado de estenosis mediante criterios similares a los utilizados en la angiografía con sustracción digital. (Figura 2)
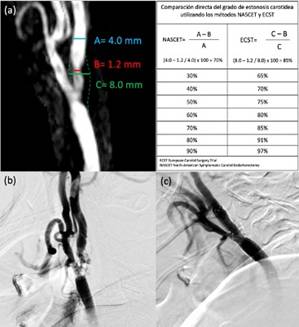
Figura 2 (a) Angiografía por resonancia magnética mostrando enfermedad aterosclerótica extracraneal de la arteria carótida derecha con estenosis del 70% de acuerdo a los criterios NASCET y de 85% de acuerdo a los criterios ECST; (b) Confirmación del grado de estenosis carotidea mediante angiografía por sustracción digital con cateterismo selectivo de la arteria carótida común derecha; (c) Estatus post revascularización carotidea endovascular mediante angioplastía y stent con mínima estenosis residual.
El UC utiliza la onda de flujo sanguíneo a través del segmento de mayor estenosis luminar para determinar el grado de severidad en AC. Los parámetros obtenidos en UC incluyen la velocidad sistólica pico (VSP) y la velocidad de fin de diástole (VFD) en la ACC y ACI. La VSP en la ACI junto a la caracterización de la placa carotidea es probablemente la forma más práctica de estimar el grado de estenosis carotidea. La Sociedad de Radiólogos en Ultrasonido (Society of Radiologists in Ultrasound ENT#091;SRUENT#093;) recomienda valores de VSP >125 cm/s para determinar estenosis =50% y VSP >230 cm/s para estenosis =70%(53). Otras organizaciones han propuesto valores de corte alternativos con diferentes precisiones diagnósticas(55)(56)(57) Otros parámetros de UC que son útiles para el diagnóstico de AC cuando los valores de VSP no son confiables incluyen el índice entre VSP de la ACI y ACC, y el índice entre VSP de la ACI y la VFD de la CCA (índice de St. Mary) (53)(58)(59).
Existen varias condiciones que pueden alterar la onda de flujo sanguíneo en UC y que deben ser consideras a la hora de interpretar los hallazgos de UC. Entre ellas se encuentran las lesiones oclusivas en tándem, estenosis u oclusión carotidea contralateral, y variaciones en el gasto cardiaco del paciente. Además, variables dependientes del operador, el equipo utilizado, y la técnica aplicada pueden influir los resultados obtenidos en UC(60). Para evitar la alta variabilidad en la valoración de estenosis carotidea por UC, varias organizaciones internacionales incluyendo Intersocietal Accreditation Commission (IAC), American Institute of Ultrasound in Medicine (AIUM), Society for Vascular Ultrasound (SVU), y American College of Radiology (ACR) han publicado protocolos actualizados para el reporte de UC en EAC y recomiendan la acreditación y validación interna en centros de salud donde se realicen estos exámenes(46)(53)(61)(62).
Tratamiento de aterosclerosis carotidea
El tratamiento médico en pacientes con AC consiste en el uso de antiplaquetarios, estatinas, y el control de factores de riesgo. El uso de monoterapia antiplaquetaria (ej. aspirina) es recomendado para la prevención secundaria de ictus y eventos cardiovasculares en pacientes con AC sintomática(63)(64). Evidencia indirecta de estudios clínicos randomizados en pacientes con ictus isquémicos no cardioembólicos no favorece el uso prolongado de anticoagulación sistémica o terapia antiplaquetaria dual con aspirina y clopidogrel para la prevención secundaria de ictus en pacientes con AC(65)(66). A pesar de no existir estudios randomizados que sustenten el uso de monoterapia antiplaquetaria en AC asintomática, las guías de tratamiento recomiendan su uso debido al elevado riesgo de eventos cardiovasculares comparado a la población en general(63). De igual forma, se recomienda el uso de monoterapia antiplaquetaria antes, durante y después de la revascularización por EAC(64), mientras que para la revascularización endovascular por SC se recomienda el uso de terapia antiplaquetaria dual (ej. aspirina y clopidogrel) por lo menos por 30 días después del procedimiento(64). Recientemente, el estudio Cardiovascular Outcomes for People Using Anticoagulation Strategies (COMPASS) mostró que, en pacientes con enfermedad vascular periférica (incluyendo AC), la combinación de dosis baja de rivaroxaban (2.5mg dos veces al día) y aspirina (100mg diarios) es superior a monoterapia con aspirina para disminuir el riesgo de eventos cardiovasculares e ictus. No obstante, la terapia combinada de rivaroxaban y aspirina también se asoció a un aumento en el riesgo de complicaciones hemorrágicas, principalmente gastrointestinales(67).
Todos los pacientes con AC deben reducir los niveles séricos de lipoproteína de baja densidad por debajo de 70 mg/dL mediante el uso de estatinas(64)(68). En los últimos años los anticuerpos monoclonales inhibidores de la PCSK9 han surgido como terapia adyuvante a las estatinas y han mostrado eficacia para disminuir los niveles de lipoproteína de baja densidad y prevenir ictus(69)(70). De igual manera, las guías de tratamiento recomiendan el control de la presión arterial con valores menores a 140/90 mmHg (<130/80 mmHg en pacientes diabéticos) y el control de la glicemia (hemoglobina glicosilada A1C <7.0%) para prevenir ictus en pacientes con AC(64). Finalmente, el manejo multimodal de factores de riesgo modificables incluyendo el tabaquismo, la obesidad y la inactividad física pueden tener un gran impacto en la prevención de ictus en pacientes con AC. Los estudios originales que mostraron el beneficio de la revascularización carotidea en pacientes con AC asintomática con estenosis de 60-99% no siguieron protocolos óptimos de manejo médico(71)(72). El estudio CREST-2 se encuentra actualmente en curso y tiene como objetivo investigar la efectividad del manejo medico intensivo versus la revascularización carotidea en pacientes con AC asintomática severa(73).
El riesgo de ictus recurrente en pacientes con AC sintomática severa es muy alto, especialmente en las primeras semanas después de un evento isquémico(43)(44). Data combinada de tres estudios randomizados realizados al principio de la década de 1990 reveló un beneficio significativo de la revascularización por EAC comparado a terapia médica para la prevención de ictus ipsilateral en pacientes con estenosis =70% (reducción de riesgo absoluto ENT#091;RRAENT#093;= 16%/5años, p<0.01, numero necesario para tratamiento ENT#091;NNTENT#093;=6.3), un beneficio menor en pacientes con estenosis 50-69% (RRA=4.6%/ 5años, p=0.04, NNT=22), y ausencia de beneficio en pacientes con estenosis <50% u oclusión carotidea total ENT#091;45ENT#093;. El beneficio de la revascularización por EAC disminuye cuando se realiza tardíamente después de un evento isquémico. Por ejemplo, en pacientes con estenosis =70% el NNT es 4 en las primeras dos semanas después de un evento isquémico versus NNT de 14 después de las doce semanas(74).
Varios estudios randomizados han demostrado la equivalencia terapéutica entre la revascularización por EAC y la revascularización endovascular por SC en pacientes con riesgo quirúrgico moderado(75)(76)(77)(78). Sin embargo, la EAC parece ser más segura en pacientes de edad avanzada y posee menor riesgo de ictus periperatorio comprado a la revascularización por SC, por lo que EAC continúa siendo el estándar de tratamiento en pacientes con AC moderada a severa(79). Basadas en el estudio Stenting and Angioplasty with Protection in Patients at High Risk for Endarterectomy (SAPPHIRE), situaciones en la que SC debe ser considerado sobre EAC incluyen alto riesgo quirúrgico por enfermedad cardiaca o pulmonar, oclusión carotidea contralateral, parálisis del nervio laríngeo recurrente contralateral, historia de radiación del cuello, y re-estenosis después de EAC(80).
Finalmente, la revascularización transcarotidea es una nueva alternativa quirúrgica en pacientes con AC. Con el objetivo de proteger el flujo cerebral, esta técnica se basa en el clampeo de la ACC en su porción proximal seguido de la creación de una derivación externa arterio-venosa entre a ACC y la vena femoral para lograr una inversión del flujo cerebral, para luego cateterizar la ACC y colocar un stent en el segmento estenosado(81). El recientemente publicado estudio ROADSTER-2 reportó un alto éxito quirúrgico y una tasa de complicaciones <2% en pacientes con AC sintomática (estenosis =50%) o asintomática (estenosis =80%) que se sometieron a revascularización transcarotidea(81). Nuevos estudios que comparen la revascularización transcarotidea con EAC y SC tradicional van a ser necesarios para validar su beneficio en pacientes can AC.
Conclusiones
En resumen, la AC es altamente prevalente en la población general y se encuentra relacionada a la edad avanzada, sexo masculino y factores tradicionales de riesgo vascular. Sin embargo, estos factores explican un porcentaje bajo de la variación interindividual de AC, sugiriendo que existen factores no tradicionales que juegan un papel importante en el desarrollo de AC. La presencia de síntomas isquémicos previos y el grado de estenosis luminar son imprescindibles para el diagnostico correcto y estratificación de riesgo en pacientes con AC. En la actualidad existen varios métodos de diagnóstico no invasivos para AC estenosante que han mostrado ser precisos en comparación al "gold standard" que es la angiografía con sustracción digital. Estos métodos poseen ventajas y desventajas que deben ser evaluadas de manera individual de acuerdo a las características del paciente y a los recursos disponibles. La evidencia actual soporta un beneficio significativo de la revascularización carotidea temprana, ya sea EAC o SC, en pacientes con AC severa sintomática. El beneficio de la revascularización carotidea en pacientes con AC moderada sintomática o aquellos con AC asintomática es mas modesto y requiere la consideración de factores como el riesgo periperatorio, la expectativa de vida y las preferencias del paciente. Nuevos avances en terapias médicas para la aterosclerosis incluyendo algoritmos de manejo anti-hipertensivo, el uso de estatinas y nuevos antilipídicos (ej. inhibidores de la PCSK9), y el control multimodal de factores de riesgo pueden resultar en un beneficio significativo en la historia natural de la AC. Finalmente, nuevas técnicas como la revascularización transcarotidea han mostrado resultados prometedores como alternativas quirúrgicas de revascularización en pacientes con AC. La extensa literatura en el diagnóstico y tratamiento de AC sustenta prácticas basadas en evidencias. Sin embargo, existen muchos campos en el manejo de la AC que requieren más investigación.














