Introducción
La trombosis venosa cerebral (TVC) es un trastorno trombótico que produce la oclusión de uno o más senos durales del cerebro, a menudo en combinación con trombosis de venas corticales (1)(2). Su diagnóstico puede ser desafiante debido a la diversidad de los factores de riesgo subyacentes, la presentación clínica variable y los hallazgos de imágenes no específicos (3). Por lo tanto, se requiere un amplio conocimiento en sus bases teóricas, ya que su diagnóstico oportuno puede conducir a un tratamiento más efectivo, mientras que un reconocimiento tardío a menudo se asocia con una alta morbilidad y mortalidad (3). En esta revisión, proporcionaremos una visión general, integral y contemporánea de las características concernientes a la epidemiología, anatomía, fisiopatología, diagnóstico y al tratamiento de la TVC.
Materiales y método
Se realizó una búsqueda bibliográfica en la base de datos de PubMed/MEDLINE utilizando los términos “trombosis venosa”, “trombosis cerebral” en español y en inglés, introducidos como términos MeSH. Se incluyeron estudios publicados en el periodo enero del 2015 hasta agosto del 2020, sin restricción de idioma y que informaron datos relevantes sobre, las características epidemiológicas, anatómicas, fisiológicas, de historia clínica, de diagnóstico y del tratamiento de pacientes con TVC. Se excluyeron estudios que trataron de trombosis arterial y trombosis venosa en otras partes del cuerpo, así como también a los que no se pudo acceder al texto completo.
Desarrollo
Epidemiología
La TVC es un trastorno poco frecuente, con una incidencia anual estimada de 3 a 4 casos/ millón de habitantes (4); aunque un estudio retrospectivo realizado en Australia en 2016 encontró una incidencia anual de 15.7 casos/ millón de habitantes (5). Este aumento de la incidencia puede explicarse por la creciente mejora de técnicas de imagen, ampliamente disponibles en la actualidad (6).
Esta enfermedad afecta a la población pediátrica y adulta con mayor incidencia entre las mujeres en edad fértil (6). Es 3 veces más frecuentemente en mujeres que en hombres, probablemente debido a factores de riesgo específicos de género, por ejemplo, el uso de anticonceptivos orales y, con menos frecuencia, embarazo, puerperio y terapia de reemplazo hormonal (4).
Anatomía
Las venas cerebrales, no presentan válvulas en su recorrido, no acompañan a las divisiones del territorio arterial y carecen de las capas típicas de las paredes de los vasos (6)(7); lo que permite la dilatación y el movimiento del flujo sanguíneo en cualquier dirección en caso de que se obstruyan (8). El drenaje venoso cerebral puede ser dividido en:
Senos venosos durales: Ubicados entre las capas meníngeas y periósticas de la duramadre. Reciben el drenaje venoso de los hemisferios cerebrales, venas corticales superficiales, diploicas, meníngeas y venas emisarias. Se dividen en dos grupos (6):
Grupo Posterosuperior: seno sagital superior, seno sagital inferior, seno recto, prensa de Herófilo (confluencia de los senos), senos transverso y sigmoideo (senos laterales) y los bulbos yugulares.
Grupo anteroinferior: seno petroso superior e inferior, seno cavernoso, plexo venoso del clivus y el seno esfenoparietal.
Venas corticales superficiales: Drenan la sangre venosa de la corteza cerebral y una porción de la sustancia blanca subyacente. Tienden a drenar en el seno sagital superior o en el seno transverso, dependiendo de su proximidad. Comprenden la vena anastomótica superior (de Trolard) y la vena anastomótica inferior (de Labbé) (6).
Venas cerebrales profundas: Drenan la sangre venosa proveniente de la sustancia blanca profunda y los ganglios basales, de manera centrípeta. Comprenden las venas cerebrales internas, Vena cerebral magna (de Galeno) y venas basales de Rosenthal (6).
Etiología y factores de riesgo
La patogénesis de la TVC es compleja y multifactorial (6). Se han descrito más de 100 factores causales de TVC (6), de los cuales al menos uno está presente en el 85% de pacientes, y alrededor del 50% tiene dos o más factores de riesgo (FR) (4)(9); aun así, en aproximadamente el 12.5% de los casos se considera idiopática (6).
Una forma de clasificar los factores de riesgo es dividirlos en temporales y permanentes. Los FR temporales contemplan los factores género-específicos (más común en mujeres); tratamiento quimioterápico y otras condiciones transitorias que afectan a la región de la cabeza y cuello (infecciones locales, traumatismo de cabeza, entre otras) (6). Los FR permanentes contemplan a los estados protrombóticos hereditarios, malignidades, y desórdenes mieloproliferativos (6).
En general, la TVC es común en cualquier afección que conduzca a un estado protrombótico, incluido el embarazo, el estado posparto o aquellos con anticonceptivos orales (4). En relación con el embarazo, la TVC es más prevalente en el tercer trimestre y en el puerperio; facilitada por la hipercoagulabilidad del periparto o secundario a hipovolemia (6).
Fisiopatología
El desarrollo de trombosis venosa se asocia con una etiología sistémica o local que provoca un desequilibrio de los procesos protrombóticos y trombolíticos, esto conduce a la iniciación y propagación de trombos en los senos durales o venas cerebrales (2)(7).
Es útil distinguir dos mecanismos fisiopatológicos separados: la trombosis de los senos cerebrales principales y la trombosis de las venas corticales (1). La oclusión del primero bloquea el transporte del líquido cefalorraquídeo, lo que disminuye su absorción y posteriormente conlleva a hipertensión intracraneal (HIC) (10). En el segundo mecanismo, la oclusión de venas corticales obliga a la sangre venosa a retornar a pequeños vasos y capilares (7), produciéndose un aumento de la presión venosa y capilar (11). Estas altas presiones en combinación con el flujo de retorno provocan una ruptura de la barrera hematoencefálica y una disminución de la perfusión cerebral, lo que conduce a isquemia cerebral focal, edema citotóxico o hemorragia intracerebral (2).
Manifestaciones clínicas
Las manifestaciones clínicas de la TVC son muy variables y a menudo inespecíficas, lo que ocasiona un diagnóstico comúnmente tardío (3). Pueden instaurarse de manera aguda (<2 días), subaguda (2 días a 1 mes) y crónica (> 1 mes), observándose en 30, 50 y 20% de los casos, respectivamente (12). Puede variar según la extensión y ubicación del trombo, parénquima cerebral afectado y circunstancias clínicas concurrentes (Tabla 1) (3)(13). Sin embargo, la presentación clínica en muchos pacientes con TVC puede no correlacionarse con la ubicación ni con la extensión del trombo (8). También varía según la edad, así en pacientes de edad avanzada la encefalopatía es más frecuente, mientras que la cefalea es menos frecuente (6).
Los signos y síntomas, se puede agrupar en cuatro síndromes distintos, a menudo inespecíficos: HIC aislada (el más común), deficiencias neurológicas focales, encefalopatía difusa (el más grave) y síndrome del seno cavernoso (8)(14)(15)(16).
Tabla 1 Principales manifestaciones clínicas, en relación con el sitio de la trombosis.
| SITIO DE LA TROMBOSIS | MANIFESTACIONES CLÍNICAS |
| Senos venosos durales: | SHIA (Cefalea, papiledema, alteraciones visuales, vómitos y tinnitus). |
| Seno sagital superior | Hemiparesia, convulsiones, cefalea asociada a otros síntomas, semiología relacionada a parálisis de sexto par craneal. |
| Seno cavernoso | Edema periorbitario, dolor orbitario, quemosis, proptosis y parálisis de los movimientos oculares. |
| Seno transverso | Afasia (STI), Cefalea aislada crónica y generalizado, otitis o sinusitis subyacente. |
| Seno sigmoideo | Cefalea aislada, dolor occipital y de cuello. |
| Seno recto | Encefalopatía difusa (cognición deteriorada y estupor o coma, con o sin signos o síntomas focales acompañantes). |
| Venas profundas: | Trastornos de conciencia (estupor o coma), estado mental alterado, paraparesia, síntomas conductuales (confusión, amnesia, bradifrenia y mutismo), encefalopatía difusa. |
| Venas superficiales: | Síndromes focales (Convulsiones, deficiencias motoras y sensoriales, paresia, afasia, defectos del campo visual, incluida la ceguera cortical, parálisis de los nervios craneales o trastornos hemisensoriales. |
*SHIA: Síndrome de hipertensión intracraneal aislada, STI: Seno transverso izquierdo. Fuente: Elaboración propia a partir de la búsqueda bibliográfica para este estudio.
-Cefalea (70 - 90%), suele ser el síntoma primario y más común (13). Es más frecuente en mujeres y en pacientes jóvenes (7). En general no existe asociación entre el sitio de trombosis o las lesiones parenquimatosas asociadas con su ubicación (7). Además, tiene una presentación muy variable sin un patrón obvio (11); pudiendo ser generalizada o difusa, y no aliviarse con el sueño (4). Se le puede clasificar según su gravedad (13): trueno, de inicio súbito e intensidad máxima al inicio (4), puede durar más de una hora (13) y similar a una hemorragia subaracnoidea (10); aguda, que dura <24 horas (13); progresivo, presente por más de 24 horas (13), relacionado a HIC, intenso y generalizado, empeoramiento persistente con esfuerzo, maniobras de Valsalva y cuando el paciente está acostado (7); y similar a la migraña, que es de localización recurrente y unilateral (13).
Las presentaciones sin cefalea son escasas y ocurre con mayor frecuencia en pacientes mayores, hombres, con cáncer y en algunas afecciones asociadas, como la trombosis venosa cortical aislada (1)(10).
-Convulsiones (30 - 40%), comúnmente tónico-clónicas generalizadas o focales (13), que pueden evolucionar a un estado epiléptico (7). Son más frecuente en pacientes que presentan deficiencias motoras, lesiones supratentoriales, en particular si son hemorrágicas (6) y en trombosis del seno sagital superior o venas corticales (14). Además, tienen incidencia más alta en comparación con la presentación de un accidente cerebrovascular arterial (6).
-Papiledema (30 - 60 %), causado por HIC (13), puede llevar a diplopía y ceguera (15). Además, es raro en pacientes sin cefalea (14).
-Deficiencias neurológicas focales (30 - 50 %), La presencia de estas puede ayudar en la localización del trombo (14). Lo más común es una disminución de la potencia (monoparesia o hemiparesia) (12) y la afasia (14).
-Trastornos de conciencia: principalmente coma, como resultado de infartos venosos grandes o edema bilateral de los ganglios basales y el tálamo (1); esto último también puede producir delirio o amnesia (14).
Otros síntomas, descritos durante el inicio de la TVC incluyen dolor occipital y de cuello, que generalmente se asocian con afectación del seno sigmoideo (3).
Diagnóstico
El diagnóstico de TVC debe realizarse en base a estudios clínicos y estudios de imagen, además de exámenes de laboratorio (14).
Los exámenes de laboratorio de rutina que incluyen recuento sanguíneo completo, química, análisis de panel de coagulación y análisis de orina, no son específicos para establecer el diagnóstico de TVC, aun así, puede contribuir a identificar trastornos asociados (8)(9)(11), como anemia, enfermedad hepática, enfermedad renal y afecciones inflamatorias o infecciosas (11).
Las pruebas genéticas se recomiendan en pacientes sin FR, recurrencia de TVC u otras trombosis, y aquellos con antecedentes familiares de trombosis (8).
La punción lumbar puede utilizarse para evaluar otras causas de cefalea, como meningitis o hemorragia subaracnoidea; pero los hallazgos a menudo son inespecíficos, como aumento de proteínas, aumento de eritrocitos y linfocitosis que pueden imitar otros procesos patológicos (9)(11).
El dímero D puede estar elevado en pacientes con TVC (9) y correlacionarse con una mayor extensión del trombo y la aparición aguda de síntomas (17); sin embargo, una prueba de dímero D no puede descartar la condición, especialmente en pacientes con FR (9).
La neuroimagen es imprescindible en el diagnóstico y localización de la TVC, y debe realizarse en todos los pacientes sospechosos de TVC (2)(8). Sus hallazgos son diversos y dependen de la modalidad de imagen elegida (3). La tomografía computarizada (TC), la venografía por TC, la resonancia magnética (RM), la venografía por RM y la angiografía por sustracción digital, son las modalidades de neuroimagen disponibles actualmente para el diagnóstico de TVC (14).
Tomografía computarizada (TC): A menudo es la primera técnica de imagen utilizada (18)(19). Las anomalías observadas se clasifican en signos directos e indirectos (19), dependiendo de la capacidad de demostrar el trombo o ilustrar los hallazgos asociados (3).
-Sin contraste: puede ser normal en el 25% - 30% de los casos (14).
Signos directos: Se observa una hiperdensidad espontánea, que se denomina "signo de cordón" cuando se encuentra dentro de una vena cortical y "triángulo denso" cuando está a nivel del seno sagital superior (figura 1A) (19). Indican que el trombo es agudo, pero pueden persistir hasta por 2 semanas, después de lo cual se vuelven isodensos al parénquima cerebral (6).
Signos indirectos : Son más comunes e incluyen, ventrículos pequeños, estructuras venosas dilatadas y anomalías parenquimatosas con o sin hemorragia (en el 80% de los casos,) (9). La isquemia venosa que a menudo causa infarto reversible (6), puede ser bilateral, sin o con un componente hemorrágico y es el signo indirecto más específico de TVC (19). El edema cerebral se describe en 20 a 50% de los casos, puede ser difuso o localizado, aislado o asociado con otras lesiones (19).
-Con contraste: Requiere la administración intravenosa un material que contiene yodo (20).
Signos directos : se puede hallar el "signo delta vacío" (figura 1B), un defecto de llenado intraluminal rodeado de senos venosos durales contrastantes, que indica la presencia de un trombo (14). Se observa cuando el trombo se encuentra en los senos sagitales y transversales superiores, porque en las imágenes posteriores al contraste solo se observa una mejora de la duramadre y no del trombo (21). Aparece desde el quinto día y desaparece después de 2 meses (19). Además, es el signo directo más frecuente, presente en el 25% a 75% de los casos (21).
Signos indirectos : Presentes en el 20% de los casos (19). Principalmente hay una mejora de contraste de morfología y extensión variables, como el realce de contraste de la hoz y del tentorio cerebral (19). (Figura 1)
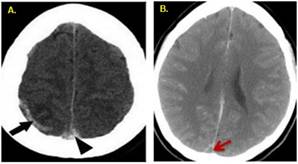
Figura 1 A. TC cerebral, corte axial sin inyección de contraste que muestra el signo del cordón (flecha negra) junto con un signo triangular denso (punta de flecha). B. TC cerebral después de la inyección de contraste que muestra el signo delta vacío (flecha roja) (19).
Venografía por TC (VTC): Es una TC helicoidal, desarrollada mediante la administración de contraste con optimización de tiempo (6)(22), que muestra el defecto de llenado, un mayor reforzamiento de la pared venosa y el drenaje venoso colateral aumentado (Figura 2) (14). Es útil en estadios subagudos o crónicos de la enfermedad debido a las densidades variables dentro del vaso trombosado (20).

Figura 2 Cortes axiales de TC de un paciente con trombosis sinusal aguda. A. La imagen de TC sin contraste muestra un aspecto hiperdenso de ambos senos transversales (flechas) y B. La venografía por TC después de la administración de un agente de contraste yodado muestra un defecto de llenado en ambos senos transversales (flechas) (22).
Así mismo, mediante técnicas mejoradas en 2D y 3D se puede proporcionar imágenes anatómicas detalladas de la circulación venosa cerebral superficial y profunda, libres de sobre proyecciones de los huesos y del parénquima cerebral (figura 3) (22). El diagnóstico correcto mediante esta técnica varía según el sitio de la trombosis, siendo aproximadamente el 99% para las trombosis de senos venosos y el 88% para las trombosis de venas corticales (2)(11). Junto con la VRM son modalidades de imagen neurovascular, y son las más eficientes en el contexto de la TVC (3). La decisión de seleccionar la opción más adecuada depende de numerosas variables, cuyas ventajas y desventajas se resumen en la tabla 2. (Figura 3)(Tabla 2)
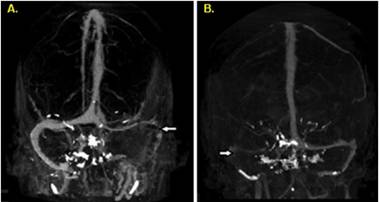
Figura 3 Imágenes de proyección de intensidad máxima de la venografía por tomografía computarizada que muestra. A. no visualización del seno transverso izquierdo y sigmoide (flecha blanca). B. no visualización del seno transverso izquierdo y sigmoide (flecha blanca) (14).
Tabla 2 Venografía por tomografía computarizada y venografía por resonancia magnética en el diagnostico de tromobosis venosa cerebral
| TÉCNICA | VENTAJAS | DESVENTAJAS |
| VTC | Adquisición más rápida. | El coágulo agudo denso puede imitar el seno opacificado, lo que resulta en falso negativo. |
| Menos propenso a los artefactos de movimiento. | Mayor incidencia de reacciones adversas a los contrastes yodados; riesgo de nefropatía inducida por contraste. | |
| Más adecuado para pacientes inestables. | Visualización potencialmente limitada de las estructuras de la base del cráneo en una pantalla 3D. | |
| Más accesible. | Exposición a radiación ionizante. | |
| Mejor representación de los vasos pequeños. | Limitado para variantes anatómicas que pueden imitar la trombosis sinusal. | |
| Generalmente cuesta menos que la RM. | Detección deficiente de trombosis venosa cortical y profunda. | |
| Visualiza surcos óseos. | Baja resolución para pequeñas lesiones parenquimatosas. | |
| Más sensible para la detección de bajo flujo. | ||
| No hay contraindicación para pacientes con dispositivos ferromagnéticos. | ||
| Más fácil de usar en pacientes con claustrofobia. | ||
| VRM | Sin riesgo de radiación. | Contraindicado en pacientes con dispositivos ferromagnéticos y en la mayoría de los marcapasos. |
| Mayor sensibilidad para pequeñas lesiones parenquimatosas. | TOF VRM es más propenso a los artefactos de imagen relacionados con el flujo y da como resultado una tasa de falsos positivos más alta, pero el VRM mejorado con contraste puede superar esta limitación. | |
| La VRM se puede realizar en pacientes con insuficiencia renal grave si se realiza sin contraste (2D TOF). | Más propenso a los artefactos de movimiento. | |
| Baja tasa de reacciones adversas de contraste. |
*VTC: venografía por TC, VRM: venografía por RM2, TOF: VRM por tiempo de vuelo, 2D TOF: 2D VRM por tiempo de vuelo. Fuente: Elaboración propia a partir de la búsqueda bibliográfica para este estudio.
Resonancia magnética (RM): técnica muy efectiva para el diagnóstico de TVC, porque visualiza tanto la trombosis, su evolución, cualquier lesión parenquimatosa asociada y a veces, la causa subyacente (19). Un protocolo de estudio debe incluir imágenes ponderadas por:
-Secuencias de RM convencional (Spin-eco y FLAIR): Con las técnicas nativas de RM, se visualiza directamente un trombo (22). Los hallazgos varían según la edad de la trombosis y el tipo de secuencia practicada (T1, T2 o FLAIR) (Figura 4) (19)(20). Así tenemos que hasta los 5 días el trombo se observa en T1 isointenso y en T2/FLAIR hipointenso, debido a la presencia de desoxihemoglobina; de 6 - 15 días tanto en T1, T2 y FLAIR el trombo es hiperintenso debido a la presencia de metahemoglobina; y pasado los 15 días en T1, T2 y FLAIR es isointenso, aunque en T2 y FLAIR puede mantenerse hiperintenso, debido a que puede haber fibrosis o recanalización (6). Estas variaciones se deben al efecto paramagnético de los productos de descomposición de la hemoglobina (6) y sus productos secundarios (3).
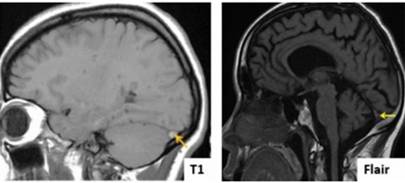
Figura 4 RM cerebral, corte sagital que muestra trombosis en el seno lateral izquierdo como un área hiperintensa (T1 y FLAIR) (flecha amarilla) (19).
Dado que la TVC se diagnostica en promedio aproximadamente 7 días después del inicio de los síntomas, en las secuencias T1 y T2 se observan áreas hiperintensas, que corresponden a los hallazgos de RM más comunes (20). A menudo estas áreas están rodeadas por un anillo negro hipointenso (depósito de hemosiderina) (19).
-Secuencia eco de gradiente (GRE) ponderada T2* e imagen ponderada de susceptibilidad T2* eco-planar (SWI): Mejoran el diagnóstico de TVC, especialmente en la fase aguda (16), porque son muy sensibles a la presencia de sangre (19). Muestran el trombo hipointenso, claramente visible en las diferentes etapas de la progresión de la enfermedad (19). Son particularmente útiles en la etapa aguda de la trombosis de senos durales y en el diagnóstico de trombosis venosa cortical (7), en especial las imágenes SWI, porque combinan GRE con información de fase, dando un diagnóstico más certero (21).
Estudios han demostrado que la secuencia GRE T2* tiene mayor sensibilidad para el diagnóstico de TVC en comparación con imágenes por RM sin mejorar (21). Además, se ha demostrado que SWI ayuda a predecir complicaciones cerebrovasculares en la TVC dando información sobre estasis venosa cerebral. A pesar de todo, SWI es poco utilizado, debido al mayor tiempo de adquisición (entre 5 y 10 minutos) (21).
-Imágenes ponderadas por difusión (DWI): Muestra el trombo como hiperintenso, en el 10 al 41 % de los casos (figura 5A) (19) . Puede utilizarse como factor de pronóstico, ya que la difusión restringida dentro de las venas o senos trombosadas puede predecir una recanalización deficiente (3)(6).
También permite la detección sensible del edema (figura 5B), y su diferenciación como edema citotóxico por la disminución de los valores de coeficiente de difusión aparente (CDA) o como edema vasogénico con un aumento de los valores de CDA (3). (Figura 5)
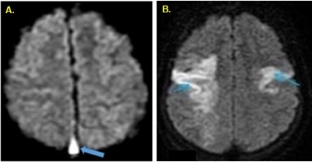
Figura 5 A. Secuencia de difusión de RM cerebral que muestra una hiperseñal en el seno sagital superior, favoreciendo una trombosis (flecha azul). B. Imagen por DWI, muestra una restricción de difusión (edema citotóxico) (flecha) (19).
-Secuencias de sangre negra ponderadas en 3D T1: Técnica que no requiere contraste, y que ha mostrado resultados prometedores en el diagnóstico de TVC (6)(16). Representa al trombo como hiperintenso con excelente contraste en relación con los tejidos circundantes (Figura 6), debido a que suprime la señal de sangre (7), mejorando la visualización del trombo agudo contra la sangre negra normal (6). Además, permite medir el volumen total de los trombos (7).
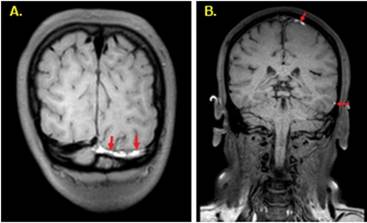
Figura 6 Imágenes coronales 3DT1 TSE SPAIR: A. con una alta intensidad de señal del seno transverso izquierdo (flechas) en un paciente con trombosis sinusal subaguda (6-15 días) y B. con alta intensidad de señal en dos venas corticales (flechas) en otro paciente indicativo de trombosis venosa cortical subaguda (6 a 15 días de edad) (22).
-Venografía por resonancia magnética (VRM): Es útil no solo para la observación del trombo sino también para la evaluación de la recanalización después de la terapia (9). Puede ser con o sin la utilización de contraste (6). Siendo mejores para el diagnóstico de TVC, las secuencia con inyección de contraste, debido a que las secuencia sin inyección pueden estar sujetas a artefactos de flujo (9)(11)(16)(19). Las técnicas actualmente disponibles que no utilizan contraste son (2D -más utilizada-, 3D VRM por tiempo de vuelo y 3D venografía por contraste de fase); y las que utilizan contrate (La VRM 3D con contraste estático y VRM 4D con resolución temporal) (3)(6)(9). Sus ventajas y desventajas están resumidas en la Tabla 3.
Tabla 3 Venografía Por Resonancia Magnética Con Contraste Y Sin Contraste, En El Diagnostico De Trombosis Venosa Cerebral.
| VENTAJA | DESVENTAJA | ||
| VRM sin contraste (sin CE): | 2D o 3D TOF | Sin administración de contraste. | Falsos positivos: pérdida de señal debido a la saturación en el plano. |
| Tiempos de adquisición relativamente cortos (5-8 min). | Falsos negativos: señal alta del tejido de fondo con valores cortos de T1 que pueden imitar el flujo sanguíneo. | ||
| Técnica ampliamente disponible. | Sensible a los artefactos de movimiento y al flujo turbulento. | ||
| Los trombos hiperintensos pueden imitar el seno permeable. | |||
| VCF (2D o 3D) | Gran supresión de tejidos de fondo (estacionarios). | Tiempos de adquisición relativamente largos (> 15 min). | |
| No se ve afectado por los productos de degradación de la sangre. | Necesidad de predecir la variable de codificación de velocidad óptima. | ||
| Puede detectar flujo en 3 planos ortogonales. | Fácilmente afectado por la velocidad del flujo sanguíneo y la turbulencia. | ||
| Capacidad para cuantificar el flujo y determinar la dirección del flujo. | Operador dependiente. | ||
| Puede diferenciar entre flujo lento y el trombo. | Solo apto para senos sagitales y transversales. | ||
| VRM con contraste mejorado (CE): | 3D CE VRM (estático) | Gran supresión de la señal de fondo. | Necesidad de un agente de contraste. |
| Sin efectos de saturación en el plano que a menudo son problemáticos con la técnica TOF. | Falsos negativos: el coágulo puede mejorar, simulando un seno abierto. | ||
| Tiempo de adquisición relativamente rápido. | Los trombos hiperintensos pueden ser difíciles de detectar. | ||
| Capaz de evaluar la recanalización (parcial). | El trombo crónico puede parecerse al realce sinusal normal. | ||
| Alta resolución con efecto de volumen parcial disminuido. | |||
| Bueno para evaluar tanto los senos venosos como las venas corticales. | |||
| No se ve afectado por el artefacto de flujo. | |||
| Puede diferenciar la vena hipoplásica de la trombosis. | |||
| VRM 4D CE (dinámico) | Las mismas ventajas que 3D CE VRM. | Las mismas desventajas que 3D CE VRM. | |
| No es necesario un sofisticado sistema de disparo para inyección de contraste en comparación con 3D CE VRM. | Puede pasar por alto la trombosis de vena cortical. | ||
| Máxima sensibilidad y especificidad en la evaluación de los senos venosos. | |||
| Identificación de trombos crónicos. |
*VRM: venografía por resonancia magnética, 2D o 3D TOF: 2D o 3D VRM por tiempo de vuelo, VCF: 3D venografía por contraste de fase, CE: con contraste mejorado. Fuente: Elaboración propia a partir de la búsqueda bibliográfica para este estudio.
Además, la VRM con contraste utiliza un agente a base de gadolinio (22), que tiene un efecto paramagnético que acorta el tiempo de relajación T1, lo que da un contraste intravascular positivo (6); así mismo permite una visualización luminal directa como un defecto de llenado del trombo, similar a la VTC (22), con una sensibilidad y especificidad comparables (9).
Angiografía por sustracción digital (ASD): Esta técnica era el estándar de oro para el diagnóstico de TVC, ya que su resolución espacial y temporal es mejor que la TC o la RM (15). Sin embargo, al ser un examen invasivo (15), hoy en día se realiza solo en situaciones particulares, como cuando se planifican procedimientos endovasculares o para aclarar hallazgos equívocos de TC o RM (6).
Tratamiento
Se enfoca en abordar primero las complicaciones potencialmente mortales, incluyendo compromiso respiratorio, convulsiones o hipertensión intracraneal (4)(9). Seguido de terapia anticoagulante, atención de apoyo y tratamiento de causas y complicaciones subyacentes (9).
Anticoagulación: La selección del anticoagulante aún no está definida, pero se recomienda iniciar con heparina de bajo peso molecular (HBPM) o heparina no fraccionada (HNF) lo antes posible, seguida de anticoagulación oral con un antagonista de la vitamina K (warfarina) (2)(4)(9). Sin embargo, estudios experimentales controlados aleatorizados demostraron que el tratamiento con HBPM redujo significativamente la mortalidad, en comparación con HNF (14). La warfarina se administra una vez que esté estable el paciente, con el objetivo de alcanzar un INR de 2 - 3 (9)(19).
Alternativamente a esta primera línea, han surgido los anticoagulantes orales directos (AOD) como apixaban, rivaroxaban y dabigatrán que ofrecen ventajas sobre los antagonistas de la vitamina K; como el rápido inicio de acción, menor interacción con otros medicamentos y farmacocinética predecible (14). Por lo tanto, su uso puede ser considerado como una opción terapéutica potencial en casos en que la warfarina está contraindicada (14). Un estudio reciente realizado por Covut et al. encontró que ninguno de los nueve pacientes con TVC tratados con apixaban y rivaroxaban desarrollaron algún sangrado serio o evento tromboembólico en los siguientes 12 meses (23).
La American Heart Association/American Stroke Association y la European Federation of Neurological Societies recomiendan que la anticoagulación sistémica debe iniciarse aún en pacientes que presentan hemorragia parenquimal (14). Su duración es de 3 a 6 meses si la TVC es provocada y de 6 a 12 meses si no es provocada (4)(9). Se debe considerar la anticoagulación indefinida en pacientes con TVC recurrente (4).
Trombólisis: Se puede lograr usando trombólisis química (uroquinasa o rt-PA), trombectomía mecánica o una combinación de ambos (1). Esta técnica, sola o en combinación con una trombectomía tiene altas tasas de recanalización, pero en general se asocia con mayores complicaciones hemorrágicas sin que se pueda demostrar un resultado clínico mejorado (24), por lo que puede estar indicada en el contexto de un trombo grande y extenso o si falla la anticoagulación (9).
Intervención quirúrgica: La trombectomía quirúrgica se reserva para casos de deterioro neurológico severo a pesar de la terapia médica máxima (4)(9). En casos de infartos venosos grandes y hemorragias que causan un efecto masivo con riesgo de hernia, se cree que la cirugía descompresiva mejora los resultados clínicos (4)(21), aunque esto es evidencia de nivel C (4).
Se recomienda futuras revisiones, ya que varias de las técnicas de diagnóstico descritas son nuevas y no están descritas a profundidad; además de que se espera que en el futuro se obtenga mayor evidencia para la utilización de los nuevos anticoagulantes orales o la introducción de nuevos fármacos que provean una mayor eficacia en el tratamiento de la TVC.
Conclusiones
La TVC es una enfermedad neurológica rara, pero que se le está dando mayor importancia, por lo que en los últimos años se ha tenido un avance importante en su diagnóstico. Este se debe realizar en base a la clínica y a estudios de imagen, basados en una combinación de estudios de RM o TC. En donde la VRM y la VTC son las mejores modalidades de neuroimagen que se dispone. El estándar de tratamiento actual es a base HBPM y warfarina, debido a que no existe suficiente evidencia para el uso de AOD.














