Introducción
En España, según los datos más recientes del INE recogidos en el informe de la Fundación Retina(1), existen 58.300 personas con una discapacidad visual. De esta cifra el 67% son mujeres y el 33% restante hombres. Sin embargo, según los datos de la ONCE(2) existen 71.834 afiliados con discapacidad visual, de los cuales el 80,80% tienen una discapacidad visual grave y un 19,20% son personas invidentes, es decir, no ven nada o sólo perciben luz (2). Dentro del número total de afiliados el 51,71% son hombres y el 48, 29% mujeres. El mayor número de personas con ceguera, y no otro tipo de discapacidad visual se sitúan, según los datos más recientes, entre los 0 y 30 años.
La pérdida de un sentido, como es la visión, motiva la investigación sobre la plasticidad cerebral y la actividad del córtex visual, ya sea con o sin tareas auditivas, sensoriales, táctiles o de movimiento. Sin embargo, la actividad del área visual primaria, así como su papel en la percepción a través de señales corticales una vez desarrollada la ceguera aún se está investigando(3). Así como el periodo crítico para el desarrollo de la plasticidad intermodal(4)
En un primer momento se pensaba que la anatomía del córtex visual en sujetos ciegos y videntes era análoga. Sin embargo, se encuentran diferencias estadísticamente significativas(5) no solamente entre las personas ciegas y las personas sin problemas visuales, sino también dentro de los sujetos con dicha discapacidad. Todos los hallazgos encontrados llegan a un punto común: la relevancia en la plasticidad del área visual entre la ceguera congénita, temprana y tardía.
Según Ortíz (6) la edad o el momento en que se pierde la vista es clave, puesto que es el momento en el que el cerebro comienza a reorganizarse, de tal manera que se han observado diferencias tanto a nivel funcional como anatómico.
A nivel funcional
En sujetos con ceguera congénita se ha llegado a observar una actividad en áreas occipitales casi igual a la de los videntes. Sin embargo en aquellos sujetos con una discapacidad visual tardía, esta actividad se ve más pronunciada en áreas occipito-temporales(7)(8)(9).
A nivel anatómico
Además de la actividad en el área occipital, se ha podido observar un engrosamiento de la corteza occipital, en concreto en el área visual primaria (V1), tanto en personas con una ceguera temprana como congénita(3). Dichos cambios se han encontrado durante los últimos años en estudios de neuroimagen a través no sólo de estudios de actividad basal de la corteza visual primaria, sino de investigaciones con tareas auditivas, semánticas, de memoria, táctiles, propioceptivas y de movimiento(10).
Todas estas diferencias, a dos niveles, vienen dados en gran parte por la neuroplasticidad intermodal o cruzada, es decir, neuronas multisensoriales o vías alternativas de percepción que compensan un déficit sensorial(3)(10)(11). Es posible que esta plasticidad se deba, además, a las neuronas destinadas a la corteza visual. Tal y como explica Harrar et. al. (10) se estima que el 30% de dichas neuronas se dedican al procesamiento visual, el 8% se ocupa de la información táctil y el 3% a la auditiva.
En el área táctil, los sujetos con discapacidad visual siempre se han caracterizado por ver con las manos algo que no es del todo una metáfora. Como ya explicó Bach-y-Rita quien ve no es el ojo sino el cerebro. Gracias a los estudios recientes(5)(6)(10) se ha observado cómo los sujetos ciegos, sobre todo con mayor tiempo con el déficit, llegan a tener una representación mental muy detallada. Esas imágenes mentales se fundamentan con la unión de la percepción táctil, información auditiva y otros detalles sensoriales.
Por otro lado, el córtex auditivo primario (A1) se ha observado que tiene una conexión casi directa con el área visual primaria (V1). En el caso de los invidentes congénitos existe una conexión directa y afianzada entre A1 y V1, mientras que en la ceguera tardía la conexión se produce entre el A1 y el surco intraparietal(12)(13)(14).
No obstante, V1 tiene relación no solamente con la información auditiva y táctil, sino también con la memoria y el lenguaje. Existen diversos estudios(8)(13)(15)(16)(17)(18)(19) en los cuales V1 se activa en tareas de lenguaje (ya sea mediante Braille o de forma auditiva) y memoria operativa (semántica y aritmética) con mayor intensidad en sujetos con ceguera temprana o congénita.
El área visual primaria, como se ha explicado, se activa en diferentes tareas y tiene distintas conexiones “cruzadas”. Por tanto, existe evidencia de las diferencias entre entre los cambios asociados a los distintos tipos de ceguera. No obstante, resulta complicado definir cómo se interrelacionan los cambios anatómicos y funcionales y cómo dependen del momento en que se pierde la visión. Es por ello, que el objetivo principal de esta revisión es la aclaración y definición de dichas modificaciones.
MÉTODOS
Se ha realizado una búsqueda de información y una metodología en base a la declaración PRISMA(20). El criterio de inclusión de los diferentes artículos en este estudio ha sido, siguiendo el acrónimo PICO: personas invidentes con ceguera congénita, temprana o tardía y la técnica de MRI o fMRI, en la que se compara la actividad, la funcionalidad o la densidad del córtex visual primario de los participantes. Dicha comparación podía producirse entre dichos grupos o cotejando cada uno con un grupo de control o grupo de videntes.
Para la búsqueda de bibliografía se dispuso de las bases de datos Scopus, Web of Science, PsycARTICLES, PsycINFO, MEDLINE, Psychology Database, PUBMED y BioMed. Además, se realizó una búsqueda de las principales referencias del artículo de Huang. et. al. (21) .
En las bases de datos mencionadas se emplearon las palabras congenitally blind o late blind, o early blind, visual cortex o primary visual cortex, fMRi o MRI. Se filtró la búsqueda por año, posterior a 2009, a partir del estudio sobre la neuroplasticidad intermodal en el córtex visual(22) (sin contar con las referencias del artículo antes mencionado).
Las frases y palabras clave se usaron en una misma sintaxis, utilizando las conjugaciones necesarias para encontrar los estudios con el objetivo marcado en esta investigación. Sin embargo, con la técnica MRI o fMRI se emplearon dos búsquedas: una añadiendo la técnica y otra obviándola. En concreto, las conjugaciones utilizadas en términos de sintaxis para la búsqueda avanzada en las distintas bases de datos son las siguientes:
1. (congenitally blind) OR (late blind) OR (early blind) AND (visual cortex) OR (primary visual cortex)
2. (congenitally blind) OR (late blind) OR (early blind) AND (visual cortex) OR (primary visual cortex) AND MRI OR fMRI
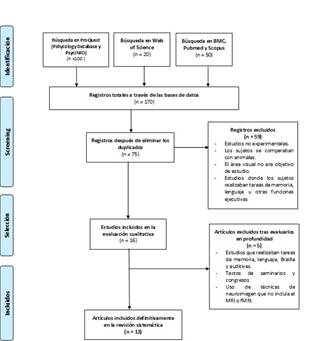
Una vez obtenidos los resultados de las búsquedas con los criterios mencionados se procedió a la criba de los artículos. Para la selección, en primer lugar, se eliminaron todos aquellos estudios que estuvieran duplicados para comenzar con la exclusión de aquellos no relevantes en esta revisión. Los criterios de exclusión empleados fueron: a) artículos no experimentales tales como, revisiones o capítulos de libros; b) artículos de estudios con animales; c) estudios que no contemplaran la actividad, funcionalidad o densidad del área visual; y d) artículos que se centraran en funciones ejecutivas como memoria o lenguaje, así como sensoriales (Figura 1).
Inmediatamente después de la inclusión de los estudios relevantes para este trabajo se extrajeron en una tabla los datos relevantes de cada uno de los artículos para un mejor análisis de los resultados.
En ella se incluyeron los datos de: a) referencia del artículo; b) tipo de muestra; d) objetivo del estudio; e) técnica utilizada; y f) resultados.
Por último, para la evaluación del sesgo de los artículos escogidos se utilizaron las recomendaciones del capítulo 8 del Manual Cochrane de Revisiones Sistemáticas de Intervenciones, versión 5.1. 0 (23) .
Se valoraron los sesgos de selección, donde la ceguera congénita se hubiera producido en el nacimiento o en los primeros meses, así como la generación aleatoria de la secuencia. Del mismo modo se evaluó, el sesgo de detección y realización, de manera que se garantizara el cegamiento de los participantes, del personal y del resultado; el sesgo de desgaste, debido a la naturaleza de las herramientas utilizadas; y de notificación selectiva de los resultados por parte de los evaluadores. Para tener constancia de los sesgos se asignaron, en una tabla con la referencia de los artículos y el tipo de sesgo, los valores de riesgo: bajo, poco claro y alto.
RESULTADOS
Se presenta, mediante la Tabla 1, el resumen cualitativo de los once artículos clasificados por: referencia, muestra, tipo de muestra, diseño, objetivo del estudio, técnica utilizada y resultados. Como ya se explicó, todos los registros expuestos son investigaciones de neuroimagen (MRI, fMRI, PET) en resting-state, sin ningún tipo de tarea ejecutiva, lingüística o sensorial. (Tabla 1)
Tabla 1 Resumen Cualitativo de los Estudios Seleccionados
| REFERENCIA | TIPO MUESTRA | OBJETIVO | TÉCNICA | RESULTADOS |
| Cavaliere et. al. (32) | 12 sujetos con ceguera congénita (de entre 13 y 42 años) 15 sujetos de ceguera tardía (de entre 15 y 52 años) y 15 controles videntes (de entre 13 y 46 años) | Cambios de la anisotropía fraccional de la sustancia blanca (FA) y la comisura anterior (CA) entre individuos ciegos congénitos (CB) y ciegos tardíos (LB) | MRI | ( FA de la CA posterior en CB y LB en comparación con SC ( Área CA en CB que en LB ( Cuerpo calloso en CB y LB, y menos conexión. |
| Qin et. al. (30) | 39 sujetos ceguera congénita (entre 25 y 65 años) 56 controles videntes (entre 25 y 65 años) | La organización funcional se conserva en varias áreas visuales de nivel superior en sujetos con ceguera congénita. | fMRI | ( Grosor cortical en V1, V2, V3 y VP ( FC entre S1 y las áreas V1 y V2, así como la corriente ventral. (FC áreas visuales ipsilateral superior y tempranas (V1 y V2) (FC entre las áreas visuales interhemisféricas. |
| Qin et. al. (25) | 19 sujetos ceguera congénita (entre 20 y 39 años). 34 sujetos ceguera tardía (entre 20 y 38 años), 42 controles videntes (entre 19 y 37 años) | La densidad de la conectividad funcional (FCD) | MRI | ( FCD en CB y LB en corteza occipital. CB < LB ( FCD en CB y LB en vía ventral y dorsal Vía ventral el FCD en CB > LB |
| Hasson et. al. (28) | 18 sujetos ceguera congénita (entre 13 y 42 años) 18 controles videntes (entre 7 y 40 años) | Diferencias del grosor cortical entre la ceguera temprana y los videntes. | MRI | ( Grosor cortical en regiones occipitales ( Grosor cortical en regiones motoras Regiones visuales interconectadas SC>CB CB<SC en conexiones de regiones visuales y del lenguaje y otras regiones |
| Huang et. al. (21) | 30 sujetos ceguera tardía (entre 14 y 38 años) 30 controles videntes (entre 14 y 38 años) | Conectividad funcional intrínseca (FC) entre la corteza visual primaria (V1) y otras áreas sensoriales. | MRI | ( FC en los sujetos experimentales entre V1 derecho y V1 izquierdo. ( FC entre V1 y cortezas motoras y somatosensoriales ( FC entre el V1 izquierdo y el colículo superior derecho, el V1 derecho y el hipocampo izquierdo ( + edad inicio de la ceguera y FC |
| Huang et. al. (34) | 44 sujetos ceguera tardía (entre 12 y 39 años) 55 sujetos videntes (entre 13 y 43 años) | Conectividad funcional intrínseca (FC) interhemisférica | MRI | ( FC entre las regiones: circunvolución bilateral / PreCUN / MOG/ BA 2/3/4/6 /18/19/30/31. PreCG/ PostCG en LB |
| Jiang et. al. (31) | 27 sujetos ceguera temprana (entre 8 y 29 años) 20 sujetos ceguera congénita (entre 5 y 27 años) 44 sujetos ceguera tardía (entre 6 y 31 años) 50 controles videntes (entre 7 y 29 años) | Actividad y volumen de la sustancia gris en los distintos tipos de ceguera | MRI | ( Sustancia gris en CB y LB ( Metabolismo basal de la glucosa en CB y LB Actividad vía ventral CB> EB y LB ( Homogeneidad córtex visual en LB ( FCD vía visual dorsal y ventral en LB ( -: activación y grosor cortical en LB ( FC córtex visual en EB |
| Li, et. al. (29) | 30 sujetos ceguera temprana (entre 8 y 30 años) 18 sujetos ceguera en la adolescencia (entre 9 y 32 años) 32 sujetos ceguera tardía (entre 7 y 32 años) 19 sujetos ceguera congénita (entre 5 y 27 años) 88 controles videntes (entre 7 y 28 años) | Mapeo de la trayectoria del grosor cortical del V1 en función de los años de ceguera. | MRI | ( Grosor cortical de V1 en EB y AB Grosor de V1 derecho ( Grosor de V1 izquierdo (EB/AB/LB/CB) Grosor cortical de V1 EB/AB/LB > CB Grosor cortical de V1 en CB > SC |
| Ptito et. al. (26) | 11 sujetos ceguera congénita (entre 20 y 54 años) 21 controles videntes (entre 22 y 68 años) | Alteraciones de volumen en las vías visuales de la ceguera congénita. | MRI | ( Volumen de BA17 bilateral ( Volumen BA18/19 y corteza temporal media Alteración sustancia blanca en la cuerpo calloso y áreas visuales |
| Reislev et. al. (11) | 12 sujetos ceguera congénita (entre 13 y 42 años) 15 sujetos ceguera tardía (entre 15 y 52 sujetos) 15 controles videntes (entre 13 y 46 años) | Las características microestructurales de las vías visuales dorsal (fascículo longitudinal superior) y ventral (fasciculación frontal inferior y fascículo occipital inferior inferior) | MRI | ( FA en la vía ventral y no en la dorsal CB y LB ( Densidad en ILF en CB (FA en ILF e IFOF en CB y LB LB niveles FA parecidos a CB |
| Shi et. al. (24) | 17 sujetos ceguera congénita (media de 22 años) 19 sujetos ceguera tardía (media de 26 años) 29 controles videntes (media de 22 años) | Diferencias en el córtex visual entre los dos tipos de ceguera. | MRI | ( Grosor cortical de V1 en LB >CB/SC ( Conexiones corticorticales y talamocorticales |
| Wang et. al. (27) | 20 sujetos ceguera congénita (entre 5 y 26 años) 21 sujetos ceguera tardía (entre 7 y 33 años) 40 controles videntes (entre 7 y 32) | Cambios de la anisotropía fraccional de la sustancia blanca (FA) entre individuos ciegos congénitos (CB) y ciegos tardíos (LB) | MRI | ( FA en CB >LB´: sustancia blanca, tálamo y cuerpo calloso ( Sustancia blanca en LB |
| Wittenberg et. al. (19) | 5 sujetos ceguera congénita (entre 36 y 66 años) 5 sujetos ceguera tardía (entre 42 y 73 años) 10 controles videntes (entre 44 y 55 años) | Comprobar la conexión entre la corteza somatosensorial primaria (S1) y la corteza visual temprana (V1 y áreas vecinas) | rTMS PET MRI | rCBF en la corteza occipital CB > LB ( Activación en BA17/18 CB > LB ( Conexión de S1 con V1 en CB y LB. CB>LB |
*Abreviaciones CB: ceguera congénita; LB: ceguera tardía; EB: ceguera temprana; AB: ceguera en la adolescencia; BA: Área de Broadman; +: correlación positiva: -: correlación negativa; rCBF: flujo sanguíneo cortical; rTMS: estimulación magnética transcraneal; PreCUN: precúneus; ILF: fascículo inferior longitudinal; MOG: occipital medio izquierdo; PreCG: circunvolución precentral izquierda; PostCG: circunvolución poscentral; IFOF: fascículo inferior frontal-occipital; SLF: fascículo superior longitudinal; VP: área visual ventral posterior.
El objetivo de evaluación en todos los artículos tiene una variabilidad considerable. Las variables estudiadas se enfocan en gran medida en base a los datos anatómicos, de conectividad funcional, de conectividad anatómica y en función de los datos de actividad o técnica.
Es importante señalar que, como se aprecia en la revisión, no todos los estudios se ciñen únicamente en la comparación de la ceguera congénita y tardía. Además, se investigan por separado dichas discapacidades con relación a los controles videntes o añadiendo otro tipo de patologías, como por ejemplo la ceguera temprana y la adolescente.
En la Tabla 2 se puede apreciar un predominio considerable de alto riesgo en la generación de secuencia de todos los artículos. Esto es debido a que la asignación utilizada en casi todos los estudios es un criterio médico (el tipo de ceguera), ya asignado por el instituto u hospital de investigación. (Tabla 2)
Tabla 2 Resumen del Riesgo de Sesgo
| SESGO DE SELECCIÓN | SESGO DE REALIZACIÓN | SESGO DE DETECCIÓN | SESGO DE DESGASTE | SESGO DE NOTIFICACIÓN | ||
|---|---|---|---|---|---|---|
| REFERENCIA | GENERACIÓN DE LA SECUENCIA | OCULTAMIENTO DE LA ASIGNACIÓN | CEGAMIENTO DE LOS PARTICIPANTES | CEGAMIENTO DE LOS EVALUADORES DEL RESULTADO | DATOS DE RESULTDO INCOMPLETOS | NOTIFICACIÓN SELECTIVA DE LOS RESULTADOS |
| Cavaliere et. al., (2020) | POCO CLARO | BAJO | BAJO | BAJO | BAJO | BAJO |
| Hasson et. al., (2016) | ALTO | BAJO | BAJO | BAJO | BAJO | BAJO |
| Huang et al., (2018) | ALTO | BAJO | BAJO | BAJO | BAJO | BAJO |
| Huang et. al.., (2020) | ALTO | BAJO | BAJO | BAJO | BAJO | BAJO |
| Jiang et al., (2015) | ALTO | BAJO | BAJO | POCO CLARO | BAJO | BAJO |
| Li et al., (2017) | POCO CLARO | BAJO | BAJO | POCO CLARO | BAJO | BAJO |
| Ptito et. al., (2008) | ALTO | BAJO | BAJO | POCO CLARO | POCO CLARO | BAJO |
| Qin et. al., (2013) | ALTO | BAJO | BAJO | BAJO | BAJO | BAJO |
| Qin et. al., (2015 | ALTO | BAJO | BAJO | ALTO | POCO CLARO | BAJO |
| Reislev et. al., (2016) | POCO CLARO | BAJO | BAJO | POCO CLARO | POCO CLARO | BAJO |
| Shi et al., (2009) | BAJO | BAJO | BAJO | BAJO | BAJO | BAJO |
| Wang et al., (2013) | ALTO | BAJO | BAJO | POCO CLARO | POCO CLARO | BAJO |
| Wittenberg et. al., (2004) | ALTO | BAJO | BAJO | POCO CLARO | BAJO | POCO CLARO |
Asimismo, no se explica de modo claro el procedimiento de asignación en el caso de los controles, excepto en el artículo de Shi et al (24). Por contraste, no se ha visto ningún riesgo en no utilizar procedimientos de ocultamiento de la selección y cegamiento de los participantes, ya que su exposición no sesgaría ninguna investigación.
Los riesgos más señalados, además del sesgo de selección, es el de cegamiento de los evaluadores y el sesgo de desgaste. En general, no están claros los procedimientos que se utilizan para evitar estos riesgos, siendo imprescindible el cegamiento de los evaluadores en uno de ellos(25), dado que realiza un procedimiento similar dos años después. En cuanto al sesgo de desgaste cuatro de los artículos(11)(25)(26)(27) no muestran de forma clara los resultados primarios de su estudio.
DISCUSIÓN
El objetivo del presente trabajo era encontrar diferencias significativas en los procesos y actividad del córtex visual primario entre los individuos con ceguera congénita, temprana y tardía. Para llegar a dicha meta se realizó la presente revisión sistemática de 13 artículos, en estudios sin tarea o resting-state, y analizando de manera cualitativa el tipo de muestra, su tamaño, la técnica de neuroimagen utilizada y los resultados de cada uno de los estudios.
Los hallazgos encontrados conforme a las diferencias con relación al córtex visual entre los distintos tipos de ceguera se dividen entre diferencias locales en anatomía, cambios locales en actividad, en conectividad anatómica, así como distinciones en la conectividad funcional. No obstante, es importante señalar que la mayoría de los estudios utilizan la resonancia magnética, sin embargo, en otros casos se han realizado estudios de fMRI y PET, lo que podría indicar diferencias en los hallazgos.
Diferencias locales en anatomía
El primer aspecto que en el que se han hallado diferencias anatómicas es el grosor cortical. Este parece que aumenta en la ceguera congénita en comparación con los sujetos videntes en V1, V2, V3 y VP(28)(29)(30). pero si se compara con los sujetos con ceguera temprana y tardía dicho grosor es menor(24)(29). Por otro lado, tal y como explican los autores, si se observa únicamente V1, se puede apreciar que las personas con ceguera tardía tienen un mayor grosor cortical que los sujetos invidentes congénitos y los controles sin discapacidad visual.
El volumen, otro de los aspectos estudiados, es menor en todos los tipos de ceguera en las áreas de Brodman 17, 18 y 19(31). No obstante, la activación de dichas áreas es mayor en la congénita que en la tardía(19).
Teniendo en cuenta dichos resultados Jiang et al. (31) estudiaron la relación entre la activación cerebral local y el grosor cortical hallando una correlación negativa entre las variables. Según los autores, tras la pérdida del sentido de la vista se induce un deterioro estructural tanto de la sustancia gris como de la sustancia blanca de las áreas visuales, por lo que las neuronas restantes pueden estar llevando a cabo diferentes actividades y estar sobrecargadas; por ello esta actividad puede estar remanente en estado de reposo.
Finalmente, los mismos autores encuentran que la homogeneidad del córtex visual de los sujetos con ceguera tardía aumenta de manera significativa. Dicha homogeneidad es llamativa dados los resultados significativamente menores en conectividad y funcionamiento cortical de estos sujetos con respecto al resto de poblaciones.
Cambios locales en actividad
Con respecto a las diferencias en la actividad, en las vías ventral y dorsal se encuentra un aumento significativo cuando se compara cualquier tipo de discapacidad visual y los sujetos videntes. Sin embargo, cuando se analizan las diferencias entre ceguera congénita, temprana y tardía se aprecian discrepancias entre las investigaciones. En el estudio de Jiang et al. (31) se encuentra una mayor conectividad en la ceguera tardía en comparación con la temprana y la congénita en estas vías; mientras que Qin et al. (25) no encuentra diferencias entre las distintas discapacidades visuales. No obstante, estas disimilitudes pueden tener que ver con el sesgo alto de detención de Qin et al. (25).
Por otra parte, la actividad de la vía ventral se encuentra en consenso entre estos dos autores encontrando una mayor actividad en la congénita, respecto a la tardía y a la temprana. El resultado de la vía ventral es un importante resultado, dado que dicha vía suele estar encargada del color, la forma y la profundidad lo que confirmarían los estudios sobre las imágenes mentales(5)(6).
Modificaciones en conectividad anatómica
Con respecto a la sustancia blanca, una de las modificaciones de conectividad anatómica, según los estudios de Ptito et. al. (26) Wang et. al. (27) y Cavaliere et. al. (32) existe una alteración significativa en el cuerpo calloso y en las áreas visuales en aquellos sujetos con ceguera congénita y tardía. En la anisotropía fraccional de la sustancia blanca (FA), por otra parte, según Reislev et. al(11) Wang et. al. (27) y Cavaliere et. al. (32) se encuentra un decrecimiento en la vía ventral, pero no en la dorsal tanto para la ceguera tardía como para la congénita. No obstante, dicho decrecimiento es menor en los individuos con una discapacidad congénita que aquellos con ceguera tardía, como ya se vaticinaba en los cambios locales de la actividad.
Es importante destacar, además, los niveles tan similares de FA entre los sujetos con una invidencia tardía y aquellos con una discapacidad congénita, confirmaría la relación positiva de la conectividad y el inicio de la discapacidad(21).
El metabolismo basal entre las dos poblaciones en las que se centra dicha revisión es un aspecto relevante para Jiang et al. (31). En los resultados de su estudio se aprecia un aumento en el metabolismo basal y la glucosa en los sujetos con discapacidad visual congénita y tardía, en comparación con los sujetos controles videntes. Sin embargo, en este estudio no se encuentran diferencias como en los de De Volder et al.(33) y Wittenberg et al. (19) donde sí parecía haber un mayor aumento en la ceguera congénita.
Con respecto a la sustancia gris, los mismos autores(31) señalan un nivel significativamente menor que los controles, confirmando los estudios anteriores descritos en Ortíz(6).
Distinciones en conectividad funcional
En cuanto al funcionamiento cortical existen más similitudes que discrepancias entre la ceguera congénita, temprana y tardía. Por un lado, el funcionamiento cortical es menor en todos los tipos de discapacidad visual en comparación con los controles videntes. Además, se aprecia un descenso digno de mención de dicho funcionamiento entre V1 izquierdo y el colículo superior derecho, así como el V1 derecho y el hipocampo izquierdo.
Tanto la ceguera tardía como la congénita tienen un descenso del funcionamiento cortical entre V1 y áreas somatosensoriales como S1(21)(30)(34), siendo mayor esas conexiones en la ceguera congénita que en la tardía(19). Este decrecimiento se ve más pronunciado entre las áreas visuales V1 izquierdo y V1 derecho(21)(28)(30)(31).
Por otro lado, la conectividad funcional (FCD) es un aspecto con el que se compara con gran asiduidad entre los distintos tipos de ceguera. La FCD, con respecto a los videntes, es menor en el córtex visual, tanto en los sujetos con discapacidad visual adquirida de forma tardía como congénita. Sin embargo, ese decrecimiento es menos pronunciado en la congénita que en la tardía(25).
Dados todos estos datos con respecto a la conectividad funcional y el funcionamiento cortical, Huang et al. (21) estudiaron la relación entre la edad de inicio de la ceguera y el nivel de la conectividad funcional encontrando una relación significativamente positiva entre dichas variables, confirmando los estudios previos, recogidos por otros autores(7)(8)(35).
Conclusión
Se puede concluir por tanto que existen diferencias importantes entre el grosor y el volumen entre la ceguera congénita, temprana y tardía, de tal manera que, cuanto antes se padezca la discapacidad visual menor serán estas dos variables (grosor y volumen). Además, el estudio de Jiang et. al.(31) revela como al haber un deterioro estructural cuando se pierde la visión, las neuronas que permanecen se sobrecargan e implican una mayor actividad en áreas visuales en aquellos sujetos.
Por otro lado, se ha comprobado la mayor conectividad entre las vías ventral y dorsal en la ceguera congénita, con respecto a la tardía y la temprana, debido probablemente al menor decrecimiento de la anisotropía fraccional de la sustancia blanca (FA) en la discapacidad visual congénita.
Asimismo, existe un mayor funcionamiento cortical entre las áreas visuales y somatosensoriales en la ceguera congénita que en la tardía, que se produce a su vez en la conectividad funcional.
Limitaciones
Realizando una visión global, los resultados recogidos en esta revisión están limitados, en su mayoría, por la selección de pacientes. Además de por ser escogidos del Instituto u Hospital sin realizar una generación de secuencia, la amplitud del rango de edad, así como la diversidad de enfermedades que provocan cada tipo de ceguera son limitaciones que señalar. En cuanto a la edad, algunos artículos como el de Hasson et al. (28), Ptito et al., (26) Reislev et al. (11) y Wittenberg et al. (19), tienen una muestra muy pequeña con diferencias de edad muy amplias, algo importante sobre todo en el caso de los niños y adolescentes, puesto que el cerebro aún se está desarrollando. Por otro lado, todos los artículos expuestos en esta revisión no tienen en cuenta el tipo de enfermedad que ha provocado la ceguera a sus sujetos. Es importante que se diferencie si es debido a la retinopatía del prematuro, retinitis pigmentosa, glaucoma, retinoblastoma…etc. Sólo en el estudio de Huang et al. (21) se utiliza la misma enfermedad para la muestra de sujetos con ceguera.
Por otro lado, como se observa en los resultados, el área visual primaria no es el eje de gran parte de los estudios escogidos, excepto los de Huang et al. (21), Li et al. (29), Qin et al. (30) y Wittenberg et al. (19). Asimismo, en el caso de Qin et al. (25), como ya se ha señalado el sesgo de cegamiento de los evaluadores y de generación de secuencia son altos e importantes, puesto que no se indica su procedimiento, algo imprescindible teniendo en cuenta que realizaron un estudio anterior con el mismo tipo de muestra.
A pesar de las limitaciones, estos datos se deberían tener en cuenta a la hora de realizar cualquier tipo de estudio con tarea que implique esta población. Dado que se parte de una conexión ya existente sin realizar ningún tipo de tarea (ejecutiva, sensorial o lingüística), aportaría mayor información sobre la conectividad que se encuentre en este tipo de estudio.
Para futuras investigaciones, además, se podrían realizar estudios longitudinales con sujetos que hayan adquirido esta discapacidad visual de forma tardía, observando la plasticidad del córtex en las áreas donde se han encontrado diferencias en esta revisión. Por ende, se deberían realizar estudios con grupos de sujetos que tengan la misma enfermedad (intragrupo), ya que cada patología puede tener diferentes resultados en cuanto a la conectividad o a la estructura.
Además, contribuye a un mayor conocimiento de la plasticidad del cerebro en función de la patología y la duración de ésta. Gracias a ello, la investigación, puede adaptar el desarrollo de la rehabilitación, adaptación (sobre todo en el caso de las tardía) y, como se decía al principio, materiales, software u otro tipo de tecnologías a los distintos tipos de ceguera, fomentando la activación de aquellas áreas con las que el córtex visual está conectado, por medio de tareas y ejercicios.