Introducción
La Esclerosis Múltiple (EM) es una enfermedad desmielinizante, inflamatoria y neurodegenerativa del sistema nervioso central (SNC) (1). Su etiología es desconocida y su patogenia autoinmune, caracterizada por la presencia de lesiones (placas) inflamatorias desmielinizadas en el SNC (2).
Se trata de una enfermedad de gente joven que debuta entre los 20 y 40 años de edad, más frecuente en mujeres que en hombres, crónica y potencialmente incapacitante (3).
La distribución y prevalencia de la enfermedad es heterogénea. Hay regiones donde la enfermedad es prácticamente desconocida, mientras en otras áreas la prevalencia supera los 100 casos por 100 000 habitantes (4).
En el diagnóstico de la EM se tienen en cuenta actualmente los criterios de Mc Donald publicados en 2001 y revisados en 2010 (5). Estos criterios tienen como objetivo llegar al diagnóstico temprano de EM, manteniendo una alta sensibilidad y especificidad, y estableciendo que para el diagnóstico se necesita demostrar la presencia de eventos separados en el tiempo y en el espacio sin que exista una mejor posibilidad diagnóstica. Este diagnóstico se basa esencialmente en el cuadro clínico y las anomalías detectadas en las imágenes de resonancia magnética (IRM) (5).
Un reporte reciente de Arrambide y cols. propone que la observación radiológica de la diseminación de las lesiones en cualquier momento de la enfermedad, sumado a la presencia de bandas oligoclonales positivas, puede considerarse como criterio adicional para el diagnóstico de la EM (6).
La utilización de los Potenciales Evocados Multimodales (PEM) en el diagnóstico de EM ha disminuido luego del advenimiento de las IRM dentro de los criterios para el diagnóstico de la enfermedad. Solamente se ha considerado el potencial evocado visual (PEV) en pacientes que reportan trastornos visuales previos (5). Este potencial evocado, conjuntamente con el potencial somatosensorial, ha sido ampliamente usado gracias a su alta sensibilidad, y a su capacidad para demostrar diseminación espacial en la EM (7).
No obstante, la batería de PEM no es considerada entre los criterios de diagnóstico a pesar de su capacidad demostrada para detectar lesiones subclínicas.
En los últimos años se han introducido algunas formas novedosas de evaluar estas técnicas electrofisiológicas a través del cálculo de un puntaje global de PEM que posibilita considerar sus resultados con un valor predictivo de discapacidad y para monitorear los efectos de tratamientos en estos pacientes (8)(9). Sin embargo, no existen referencias de la posible relación de este puntaje global de PEM con los estudios de imágenes y el grado de discapacidad de los pacientes con Esclerosis Múltiple.
A pesar de la alta sensibilidad de las IRM propuestas como método de elección para el diagnóstico de la enfermedad, no se debe excluir el uso de la información brindada por los PEM ya que son técnicas con un bajo costo económico, no invasivas, y que brindan información subclínica durante el curso de la enfermedad en forma silente.
Existen además referencias en la literatura de estudios que correlacionan los resultados de los PEM con los hallazgos de las IRM en otras patologías, en los que se encuentra una estrecha relación entre ambas técnicas (10)(11)(12). Es por tanto objetivo del presente estudio evaluar la relación existente entre el puntaje global de los PEM, las anomalías estructurales evidenciadas por las IRM y el grado de discapacidad demostrado en pacientes con EM en la forma clínica recaída-remisión.
Pacientes y métodos
Se estudiaron todos los pacientes con EM diagnosticada según criterios de Mc Donald que acudieron al laboratorio de Potenciales Evocados del Centro Internacional de Restauración Neurológica, CIREN Habana, en el periodo comprendido entre 2013 y 2018 y que cumplieron los siguientes criterios de inclusión:
-Todos los pacientes que cumplieron con los criterios de Mc Donald 2010 para el diagnóstico de EM forma clínica recaída-remisión.
-Pacientes que tenían como mínimo 1 año de evolución de la enfermedad.
-Pacientes a los que se indicó la batería de los PEM.
Fueron excluidos del estudio
-Pacientes que tenían otra enfermedad neurológica o psiquiátrica.
-Pacientes con menos de 18 años de edad.
-Pacientes que estuvieran en fase activa de la enfermedad
Evaluación clínica
Se recogieron todos los datos demográficos y clínicos de los pacientes, incluido el valor de la escala de discapacidad de Kurtzke (EDSS) (13).
Evaluación por imágenes
Las imágenes fueron obtenidas en un equipo de resonancia magnética nuclear (Magnetom Symphony) con un poder de resolución de 1.5 Tesla. Se obtuvieron imágenes de difusión por Resonancia Magnética Nuclear empleando para ello el siguiente protocolo: adquisición de imágenes ponderadas en difusión (b = 1300 s/ mm²) para 12 direcciones de gradiente de difusión y una imagen sin ponderar en difusión (b = 0 s/mm²) con un tiempo de repetición de 8300 ms, tiempo de eco 160 ms, grosor de corte 3 mm, matriz de adquisición 128 x 128, 30 cortes axiales y un campo de visión de 256 x 256 mm.
Para el procesamiento de las imágenes se empleó el protocolo estándar para pacientes con EM. Se cuantificaron las anomalías en función del número de niveles afectados por lesiones desmielinizantes en las zonas: periventricular, yuxtacortical, subcortical, infratentorial, cuerpo calloso y médula espinal.
Evaluación electrofisiológica:
Se realizaron en cada paciente los siguientes PE: Potencial evocado auditivo de tallo cerebral (PEATC), Potencial evocado visual a patrón (PEV) y Potencial evocado somatosensorial con estimulación del nervio tibial posterior (PESS).
Para el registro se colocaron electrodos de superficie con el empleo de pasta conductora (ELEFIX), previa limpieza de la zona en cuestión con la aplicación de alcohol al 90% y gel abrasivo (Skin Pure).
Las condiciones de registro para cada una de las técnicas electrofisiológicas aparecen definidas en la tabla 1. Se emplearon los montajes establecidos para cada técnica siguiendo la colocación de electrodos del sistema internacional 10-20 y el equipo utilizado fue un Neuropack µ (Nihon Kohden, Japan). (Tabla 1)
Tabla 1 Condiciones de registro
| Parámetros | PEATC | PEV patrón | PESS tibial |
| Tiempo de análisis (ms) | 10 | 300 | 200 |
| No. de promediaciones | 1000 | 50 | 1000 |
| Estímulo | Clics monoaural | Damero | Eléctrico |
| Frecuencia del estímulo (Hz) | 10 | 1 | 3 |
| Duración del estímulo (ms) | 0.1 | - | 0.2 |
| Sensibilidad (μV/div) | 10 | 20 | 20 |
| Filtros pasabanda (Hz) | 100-3000 | 1-100 | 20-1000 |
Una vez obtenidos los registros se procedió a realizar la evaluación visual de los mismos fuera de línea, y tabular la batería para realizar el cálculo del puntaje global.
Las variables a evaluar en términos generales para todos los potenciales fueron las siguientes: presencia o no de componentes fundamentales, definición morfológica, latencia absoluta de los componentes, duración de intervalos interpicos, amplitud, y diferencia entre lados de latencia y amplitud.
Fueron considerados registros positivos de anomalía cuando:
-Se observó ausencia de los componentes fundamentales.
-Hubo marcada distorsión de la morfología.
-El valor obtenido en las restantes variables superó en 2,5 desviaciones estándar al valor promedio que es definido como norma en nuestro laboratorio.
Para el cálculo del puntaje global se dio un valor ascendente de afectación entre 0 y 3 a cada respuesta evocada, donde 0 es normal; 1 con incremento de latencia (latencia absoluta e intervalos interpicos) con amplitud y morfología normal; 2 con incremento de latencia y/o amplitud y morfología anormal y; 3 con la ausencia de respuesta evocada. Se evaluó cada lado, lo que sumó un total de 18 puntos como máximo (3 puntos x 2 lados x 3 modalidades de PEM).
Análisis Estadístico
El procesamiento de los datos se realizó con el paquete estadístico STATISTICA versión 8. Se evaluó la relación del puntaje global de PEM con la duración de la enfermedad (prueba de correlación de Spearman).
Se correlacionó el valor del puntaje global de la batería de Potenciales Multimodales con la puntuación de la escala de discapacidad de Kurtzke y con la evaluación de las IRM según número de niveles afectados (prueba de correlación de Spearman).
En todos los análisis el nivel de significación considerado fue p<0.05.
Consideraciones éticas
El estudio de los sistemas sensoriales con la técnica de PEM se realizó en todos los pacientes siguiendo el protocolo de actuación establecido para pacientes con EM en la Clínica de Afecciones Raquimedulares, Neuromusculares y EM del CIREN (última versión Noviembre 2017). En todos los casos se explicó al paciente la metodología a seguir para el registro de los PEM enfatizando en la inocuidad del procedimiento y su carácter no invasivo. El estudio se realizó acorde a los principios de la ética médica, siguiendo las recomendaciones para la investigación en seres humanos definidas en la Declaración de Helsinki (14).
Resultados
Características demográficas de la muestra
Del total de pacientes evaluados se seleccionó una muestra de 35 sujetos que cumplieron los criterios de inclusión. De ellos 29 fueron del sexo femenino y 6 del sexo masculino. La edad promedio fue de 40.42 ±9.65 años, y la duración promedio de la enfermedad fue de 6.4± 5.83 años.
Evaluación clínica
El valor promedio en la escala de discapacidad de Kurtzke fue de 3.22 ±1.12.
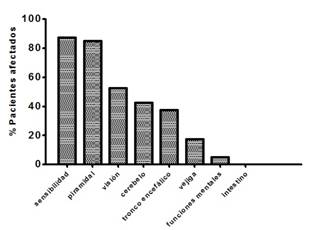
Se evidenció que la mayoría (>80%) de los pacientes con EM estudiados presentaron manifestaciones clínicas con predominio de trastornos de sensibilidad y de lesión piramidal, seguidos por disfunción visual (Figura 1).
Evaluación electrofisiológica
En los pacientes estudiados predominaron las anomalías en los PESS de nervio tibial posterior seguidas por el PEV y el PEATC (Figura 2).
Se observó un mayor compromiso tanto de la latencia como de la morfología en la exploración de la vía somestésica dorsal lemniscal al estimular el nervio tibial posterior por detrás del maléolo medial. Un comportamiento similar se evidenció en la vía visual con respecto a la latencia y morfología. Sin embargo, el estudio del PEATC mostró un compromiso predominante en la amplitud y morfología de los componentes evaluados a nivel central (Figura 3). Tres pacientes mostraron además afectación periférica con anomalías de la onda I. En todas las técnicas electrofisiológicas se hizo evidente también la ausencia de respuestas lo que expresa un grado mayor de afectación (Figura 3).
Se realizó el cálculo del puntaje global de los PEM sensoriales y cómo contribuyó cada modalidad en el mismo; la mayor contribución fue de los PESSt (3.0), siguiendo los PEV (2.0) y en menor medida el PEATC (1.6), para un puntaje total promedio de 6.6± 3.21.
Evaluación de IRM
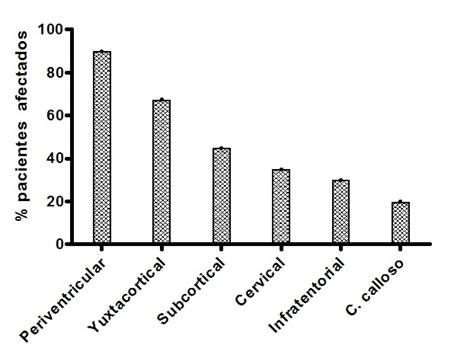
Las lesiones desmielinizantes típicas de la enfermedad fueron evidenciadas en las regiones clásicamente descritas en los pacientes con EM,  predominando en las regiones periventricular, yuxtacortical y subcortical (Figura 4). Adicionalmente se constataron lesiones en zonas menos comunes como el cuerpo calloso.
predominando en las regiones periventricular, yuxtacortical y subcortical (Figura 4). Adicionalmente se constataron lesiones en zonas menos comunes como el cuerpo calloso.
Análisis de correlación
Se encontró una correlación positiva estadísticamente significativa entre el puntaje global de los PEM y la escala de discapacidad de la enfermedad (prueba de correlaciones de Spearman, R=0.33, p< 0.50). También se encontró una correlación significativa entre el puntaje global de PEM sensoriales y el número de niveles afectados en la IRM (prueba de correlaciones de Spearman, R= 0.42, p< 0.50).
Al evaluar el efecto de la duración de la enfermedad sobre las variables estudiadas se aprecia una tendencia al incremento de la discapacidad y del puntaje global de los PEM a medida que aumenta la duración de la enfermedad, aunque no se alcanzó un valor estadísticamente significativo (prueba de correlación de Spearman, p> 0.05).
Discusión de los resultados
En este estudio se demostró que existe una estrecha relación entre la evaluación electrofisiológica, la presencia de lesiones desmielinizantes en las IRM y el grado de afectación clínica en los pacientes estudiados.
Cuando se realizó el análisis solo con los PEM sensoriales que más se reportan en la literatura consultada (visual y somestésico) (15)(16)(17) esta correlación no resultó significativa ni con el grado de discapacidad ni con los niveles de lesiones en las imágenes, lo que demuestra el valor que tuvo la inclusión de la evaluación auditiva en el puntaje global.
Aun cuando las IRM son consideradas la “regla de oro” para el diagnóstico de la EM, puede suceder que las placas desmielinizantes no sean detectables mediante estas técnicas. En estos casos los estudios electrofisiológicos se adelantan, mostrando disfunción en las vías sensoriales estudiadas desde las etapas tempranas de la enfermedad (18).
En el presente estudio predominaron las afectaciones de los potenciales somatosensoriales y visuales, menos en el auditivo, lo que está en correspondencia con la sintomatología de los casos estudiados. Este resultado coincidió con el trabajo reportado por Stojanka Djuric y cols. en un estudio de 293 pacientes con EM recaída remisión y EM primaria progresiva, con una duración de la enfermedad entre 2 y 6 años. A estos pacientes se les hicieron estudios de IRM y PEM (PEV, PEATC y PESS del nervio mediano y tibial posterior). La mayor alteración fue encontrada en PESS de nervio tibial posterior y mediano y resultados similares a los nuestros se encontraron para el PEV y el PEATC (19).
Con respecto a la naturaleza de las lesiones, los resultados de los estudios electrofisiológicos de los pacientes incluidos en este trabajo se correspondieron con lo reportado por otros autores (20)(21)(22), encontrando que la mayor parte de las alteraciones estuvieron referidas a las variables que denotan la existencia de un daño desmielinizante (latencia absoluta, intervalos interpicos, distorsión morfológica y ausencia de componentes). Nuevamente se registró el mayor porcentaje de anomalías en los potenciales que exploran las vías más largas (somestésica y visual) que se manifiestan fundamentalmente por la afectación de latencia y distorsión morfológica, referido a la afectación de la mielina, característica preponderante de esta enfermedad.
Sin embargo, en este estudio, se encontró una marcada afectación del PEATC respecto a su amplitud y morfología, mayor que la latencia, lo que sugiere el daño de los axones de la vía auditiva, aunque la mayoría de los pacientes estudiados en este trabajo no han manifestado, clínicamente, compromiso de la audición. Nuevamente se demuestra la capacidad y la ventaja de los PE sensoriales en revelar las lesiones silentes o subclínicas de las vías estudiadas. En concordancia con estos resultados Eggermont reportó recientemente que la reducción de la amplitud o ausencia de respuesta en el PEATC puede estar reflejando una desincronización en la descarga de las fibras que forman la vía auditiva (23). De igual forma Dinca y cols. reportaron la mayor afectación en la amplitud de la onda V, encontrando la ausencia o la disminución de la amplitud de la onda V en un 87 % de los pacientes con PEATC anormales (24).
Adicionalmente ha sido descrito por Di Mauro y cols. el compromiso periférico (coclear) temprano en pacientes con EM en estadios iniciales de la enfermedad, lo que también fue encontrado en algunos pacientes del presente estudio. Estos autores estudiaron pacientes con la forma recaída-remisión aun sin tratamiento con audición clínicamente normal y sin anomalías en las IRM. Sin embargo, el PEATC mostró la afectación subclínica de la vía auditiva conjuntamente con las emisiones otoacústicas (25).
Los PEM como batería de estudio han sido usados para pronosticar el curso de la EM y evaluar los efectos de diferentes tratamientos en la misma (26)(27).
En el presente estudio se constató una correlación positiva entre la escala de discapacidad de la enfermedad y el puntaje global de los PEM sensoriales, lo que coincidió con lo reportado por otros autores durante estudios de seguimiento (27)(28)(29).
Ivernizzi y cols. realizaron un estudio retrospectivo de 80 pacientes con EM, en los cuales se evaluaron el PEATC, PEV, PESS, y Potencial evocado motor (PEm), al inicio y durante 5 años de seguimiento, reportando una correlación muy significativa al inicio, 1, 3 y 5 años del seguimiento, particularmente para el PESS y PEm (26).
En un estudio de 108 pacientes con EMRR durante el seguimiento a los 5, 10 y 15 años London y cols. evaluaron las anormalidades de PEV, PEATC, PESS y PEm y calcularon el puntaje global de PE. Constataron una correlación significativa entre el puntaje global de PE y la EDSS a los 10 y 15 años del seguimiento después de la aparición de la enfermedad. Estos autores demostraron que el 73% de los pacientes que tenían el valor del puntaje mayor de 4 presentaron alto riesgo de progresión de la discapacidad(30).
Los PEM y su puntaje global se han usado también para evaluar la efectividad del tratamiento en la EM. Margaritella y cols. realizaron un estudio retrospectivo de 56 pacientes con EM forma recaída remisión que se sometieron al tratamiento con interferón β y acetato de glatiramer. Evaluaron las diferencias entre la escala de discapacidad de Kurtzke y el puntaje global de PE (PEV y PESS) antes del tratamiento, a 1,7 y 3,6 años del tratamiento, y encontraron que no hubo diferencia significativa de la escala de discapacidad en los pacientes durante el seguimiento; sin embargo, observaron una gran diferencia en el puntaje global de los PE, sobre todo del grupo con interferón β. Con este resultado concluyeron que se podría incluir el puntaje global de los PE como una variable para evaluar la efectividad de nuevos tratamientos en pacientes con EM en el futuro (31).
Iodice y cols. estudiaron 20 pacientes que fueron examinados previos al tratamiento con Fingolimod y hasta un año después, encontrando una correlación significativa entre la EDSS y el puntaje global de los PEM en los diferentes momentos del seguimiento (32).
En el presente estudio también se realizó la correlación del valor del puntaje global con el número de niveles de lesiones afectados y visualizados en las IRM, encontrando que el mayor número de niveles de lesiones en las IRM se correspondió con un mayor valor del puntaje global de los PEM.
En un análisis similar Magnano y cols. limitaron su estudio específicamente a las funciones del tallo cerebral con técnicas electrofisiológicas, IRM y mediante la evaluación de los reflejos del tallo cerebral en un grupo de pacientes durante un periodo de 15 meses, encontrando cambios en los PE, no así en las evaluaciones clínica ni de imágenes, lo que demuestra una vez más el valor de las técnicas electrofisiológicas para evidenciar lesiones silentes en el tallo cerebral (33).
En contraposición con estos autores se encuentran los resultados de Crnošija y cols. que realizaron un estudio para validar el puntaje del Potencial evocado miógeno vestibular (PEMV) como prueba electrofisiológica de la disfunción del tallo cerebral en los pacientes con los primeros síntomas de EM e investigar la correlación entre este potencial y los resultados de las IRM del tallo cerebral. Los autores determinaron el puntaje clínico funcional del tallo cerebral (brainstem functional system score, BSFS) en 121 pacientes que tenían manifestaciones de Síndrome clínicamente aislado, analizaron las lesiones presentadas en las IRM del tallo cerebral (Médula Oblongada, Puente y Mesencéfalo) y observaron que todos los pacientes con signos de afectación clínica de tallo cerebral durante la evaluación neurológica (BSFS> 1) presentaron un puntaje de PEMV alto comparado con los pacientes que no tuvieron signos neurológicos del tallo cerebral. Encontraron además una correlación significativa entre la clínica del tallo cerebral, la lesión del puente en las IRM y las latencias prolongadas y/o ausencia de respuesta del PEMV, concluyendo que el puntaje de este potencial es válido en la evaluación de lesiones del tallo cerebral en pacientes con EM temprana (34).
Estos dos últimos grupos de investigadores limitaron sus estudios al análisis de las funciones del tallo cerebral. En ningún otro reporte encontramos referencias a la relación entre la magnitud de las lesiones de las IRM y el puntaje global de PE, lo que constituye el aspecto novedoso de este trabajo.
Conclusiones
La relación del puntaje global de los Potenciales Evocados Multimodales Sensoriales con las lesiones estructurales y con el grado de discapacidad confirma la utilidad de este puntaje para el estudio de los pacientes con Esclerosis Múltiple en su forma recaída-remisión, aun cuando no forman parte de los criterios diagnósticos de la enfermedad. Quedaría por definir en estudios futuros a partir de qué valor este puntaje podría ser considerado con tal criterio.