INTRODUCCIÓN
Las encefalitis autoinmunes son un grupo de enfermedades producidas por anticuerpos dirigidos contra diferentes antígenos neuronales y que cursan con diversos síntomas neurológicos y psiquiátricos. Entre los antígenos de superficie neuronal más frecuentemente implicados se encuentra el complejo proteico del canal de potasio dependiente de voltaje (VGKC). Los dos antígenos principales de este complejo, son la la proteína 1 inactivada del glioma rica en leucina (leucine rich glioma inactivated protein 1 [LGI1]) y a la proteína símil 2 asociada a contactina (contactin-associated protein-like 2 [Caspr2]) (1).
La encefalitis autoinmune asociada a anticuerpos dirigidos contra LGI1 es una entidad neurológica de curso subagudo que se caracteriza por la presencia de alteraciones cognitivas y conductuales, trastornos del sueño y crisis epilépticas (1). El diagnóstico se realiza en base a la clínica, siendo características la presencia de crisis distónicas faciobraquiales (FBDS) y se confirma con la presencia de anticuerpos anti LGI1 en suero y/o líquido cefalorraquídeo (LCR) (2)(3). La presencia de hiperintensidad temporal medial uni o bilateralmente en la resonancia magnética cerebral es frecuente basales (2)(3)(4). En la mayoría de los pacientes los síntomas responden al tratamiento inmunomodulador con corticoesteroides, inmunoglobulinas y plasmaféresis (2)(3)(4).
A continuación, describimos la evolución clínica de una paciente con una presentación inicial atípica de encefalitis autoinmune por anticuerpos anti LGI1 y realizamos una revisión de la literatura.
CASO CLÍNICO
Mujer de 76 años con antecedentes de hipertensión arterial y diabetes mellitus tipo 2 en tratamiento con metformina y atenolol. Es remitida a Urgencias por presentar un episodio de pérdida de conocimiento súbito acompañado de rigidez y movimientos tónico-clónicos generalizados con traumatismo craneoencefálico secundario. Mientras es atendida en domicilio por el servicio de emergencias, presenta tres episodios más, sin recuperación del nivel de conciencia entre los mismos y se objetiva temperatura de 38,8 ºC. Previamente al episodio, la paciente se encontraba totalmente asintomática. Únicamente, su marido refirió encontrarla discretamente confusa en las horas previas al episodio.
En la exploración en el servicio de urgencias la paciente se encontraba estuporosa, Glasgow 10 (O4M5V1). Pupilas isocóricas y normorreactivas. Presentaba apertura ocular espontánea e intentaba localizar visualmente ante estimulación verbal, aunque impresionaba de heminegligencia y posible hemianopsia homónima derechas. No obedecía órdenes. Presentaba una hemiparesia derecha con un balance motor 1/5. La exploración de la sensiblidad no fue valorable. Reflejos osteotendinosos estaban presentes y eran simétricos en las cuatro extremidades. El reflejo cutáneo plantar era flexor izquierdo e indiferente derecho.
En las pruebas complementarias realizadas en Urgencias destacaba una leucocitosis (21000 leucocitos/mm3) con neutrofilia (75,7%), pH 7,05, pO2 86 mmHg, pCO2 56 mm Hg, HCO3 14.8 mmol/L, Lactato basal 13.6 mmol/L. En la tomografía computerizada (TC) cerebral no se observaron alteraciones agudas significativas. Ante la presencia de fiebre y leucocitosis se realizó punción lumbar para descartar proceso infeccioso del sistema nervioso central. En el estudio urgente de líquido cefalorraquídeo no se encontraron alteraciones significativas (hematíes 2120 /mm3, leucocitos 2 /mm3, glucosa 126 mg/dL, proteínas totales 0.51 g/L).
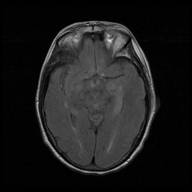
Tras descartarse la presencia de infección del SNC y de proceso vascular cerebral agudo, ingresó en el servicio de Neurología con tratamiento antiepiléptico para completar el estudio etiológico. Durante las primeras horas de su estancia en planta presentó varias crisis epilépticas y empeoramiento del nivel de consciencia motivo por el cual precisó ingreso en la unidad de cuidados intensivos. Ante la sospecha de encefalitis autoinmune se inició tratamiento combinado con metilprednisolona (1 g/día durante 5 días) e inmunoglobulinas humanas vía intravenosa (0,4 g/Kg/día durante 5 días). La paciente presentó importante mejoría clínica, con total resolución de las crisis epilépticas y mejoría del nivel de consciencia. En la resonancia magnética cerebral se observó una hiperintensidad en hipocampo izquierdo en secuencias T2 y T2/FLAIR con restricción de la difusión hídrica en secuencia DWI. Los resultados del análisis del LCR presentaron positividad para anticuerpos anti LGI1. Se realizó un estudio etiológico completo incluyendo TC torácico-abdominal, PET-TC, valoración ginécológica y valoración por servicio de digestivo, que no mostró la existencia de proceso neoplásico subyacente. Progresivamente la paciente presentó mejoría clínica durante su ingreso, presentando al alta una alteración de la memoria inmediata. (Figura 1)
DISCUSIÓN
Los anticuerpos anti-LGI1 fueron descritos por primera vez en 2010 (1). La proteína LGI1 forma parte del complejo del canal de potasio dependiente de voltaje (VGKC). Los VGKCs están presentes en la membrana de neuronas tanto del sistema nervioso central como del sistema nervioso periférico, donde ejercen su acción como mediadores de la repolarización tras el potencial de acción. Esta proteína es secretada al espacio sináptico donde actúa como ligando entre la proteína transmembrana presináptica ADAMS23 y la postsináptica ADAMS22, formando un complejo proteínico transináptico que regula la transmisión mediada por receptores del ácido α-amino-3-hidroxi-5-metilo-4-isoxazolpropiónico (AMPAR) (5). Los anticuerpos anti-LGI1 neutralizan el complejo proteínico transináptico y producen una reducción de receptores AMPAR (6) . Esta disminución de receptores AMPAR en las interneuronas inhibitorias produciría un aumento de la excitabilidad del hipocampo (7).
En la mayoría de los casos, la presencia de anticuerpos anti - LGI1 se manifiesta en forma de encefalitis límbica, sin embargo, pueden producir otros cuadros menos frecuentes como el síndrome de Morvan (1). Aunque los datos epidemiológicos de la encefalitis límbica por anticuerpos anti - LGI1 no se conocen con exactitud, en la población holandesa se ha estimado una incidencia anual de 0,83 casos/millón de habitantes (2). La presentación clínica característica es un cuadro de evolución subaguda que cursa con alteraciones cognitivas, alteraciones psiquiátricas y del comportamiento, desorientación, trastornos del sueño y crisis epilépticas.
Se han descrito tres tipos de crisis epilépticas: Convulsiones distónicas faciobraquiales (FBDS), crisis focales y crisis tónico - clónicas generalizadas (CTCG). Las FBDS son características de la encefalitis anti-LGI1 y están presentes entre el 47 - 72% de los casos (2)(8)(9). Las FBDS son contracciones tónicas involuntarias que afectan al brazo y en ocasiones a la cara y/o a la pierna ipsilateral, de pocos segundos de duración (habitualmente < 3 s) que ocurren con una frecuencia de hasta 100 veces al día (2)(8). Estas crisis son generalmente resistentes al tratamiento antiepiléptico, pero presentan buena respuesta al tratamiento inmunomodulador. Además, un reciente estudio relaciona el cese de las FBDS con menor desarrollo de deterioro cognitivo residual (10). Las crisis epilépticas focales presentan predominantemente semiología discognitiva y autonómica. Al igual que en nuestro caso, previamente se han reportado casos con crisis pilomotoras. Aunque también ocurren varias veces al día, son en la mayoría de los casos sutiles, y pueden pasar desapercibidas (11)(12). Las CTCG ocurren en aproximadamente el 60% de los casos. Característicamente, tienen lugar de manera más tardía, durante la fase más grave y ocurren de media en 3 o 4 ocasiones durante el curso de la enfermedad (2)(13). El electroencefalograma (EEG) interictal muestra descargas epilépticas o enlentecimiento focal. Las crisis epilépticas focales y las CTCG se correlacionan con descargas epileptiformes en el EEG (12)(13). Durante las FBDS no se han encontrado descargas epileptiformes, sin embargo, se ha observado la presencia de una onda lenta frontal contralateral y también se ha descrito una actividad electrodecremental generalizada unos 500 ms antes de las FBDS (13)(14). Los hallazgos electrofisiológicos y radiológicos durante las crisis epilépticas indican que tanto el hipocampo como la corteza motora actúan como diana para estos anticuerpos (13). Sin embargo, las alteraciones clínicas y electroencefalográficas multifocales registradas en estos pacientes sugieren una hiperexcitabilidad cerebral difusa (12).
Las alteraciones cognitivas más frecuentes son la alteración de la memoria reciente y la desorientación. Las alteraciones conductuales incluyen apatía, depresión y ansiedad (3). Hasta el 50% de los pacientes presentan alteraciones del sueño, entre las que se encuentra el insomnio y las alteraciones del sueño REM (15).
En las pruebas complementarias, es frecuente la presencia de hiponatremia (1)(2)(3)(16). La mayoría de los pacientes presentan hiperintensidad del lóbulo temporal medial unilateral o bilateral en la RMN cerebral y en algunos pacientes con FBDS se ha descrito hiperintensidad en los ganglios basales (2)(3)(4). El estudio bioquímico del líquido cefalorraquídeo (LCR) suele ser normal, aunque puede presentar discreta pleocitosis (3). La detección de los anticuerpos se puede realizar tanto en LCR como en suero. Los hallazgos en cuanto a la sensibilidad de detección en estudios previos son contradictorios, por lo tanto, se recomienda la determinación tanto en suero como en LCR (2)(3). Además, aunque la asociación a tumores es infrecuente (1), se debe realizar un estudio extenso complementario ya que en los estudios reportados hasta el momento se ha encontrado hasta en un 11% de los casos neoplasia subyacente (1)(2)(3)(4)(8)(17)(18).
La inmunoterapia precoz con corticoides intravenosos, inmunoglobulinas y/o plasmaféresis es el tratamiento de elección. Ha demostrado su eficacia en la remisión de las crisis epilépticas y se ha asociado con mejoría de las secuelas cognitivas a largo plazo (2)(3)(4). Algunos estudios sugieren, una vez superada la fase aguda, la asociación de inmunoterapia a largo plazo para disminuir las complicaciones, secuelas y recurrencias (8)(10)(19)(20). La persistencia de secuelas es importante, siendo las más frecuentes la apatía, los trastornos de memoria y la desorientación espacial (4). En los estudios con seguimiento a largo plazo se ha observado esclerosis temporal mesial y atrofia hipocámpica (2)(4). También son frecuentes las recaídas (entre el 27 - 35 % en los estudios con seguimiento mayor a 2 años) y pueden ocurrir varios años después de la enfermedad (2)(3). Estos dos factores determinan que el pronóstico de la enfermedad sea variable, por lo general favorable, aunque en ocasiones letal, con una tasa de mortalidad estimada entre el 6 - 19 % (2)(3). Se han identificado factores de mal pronóstico como la ausencia de respuesta al tratamiento inmunomodulador de primera línea y la presencia de recaídas clínicas (3).
En conclusión, la encefalitis límbica por anticuerpos anti - LGI1 es una entidad poco frecuente que puede presentar diversas manifestaciones neurológicas y psiquiátricas, en ocasiones sutiles, lo que puede dificultar el diagnóstico. El tratamiento inmunomodulador precoz es esencial tanto para la remisión de las crisis epilépticas como para mejorar el pronóstico a largo plazo. Es necesario un seguimiento estrecho de estos pacientes dado que es posible la existencia de recidivas incluso varios años después del episodio inicial.