Reporte de caso
Paciente de 71 años de edad con antecedente de EPOC en tratamiento con oxigenoterapia domiciliaria e historia de crisis convulsivas en abril del 2016, mientras estuvo hospitalizada por exacerbación aguda de su enfermedad, las cuales fueron manejadas con Fenitoína. Se realizó TC de cerebro que demostró en ese entonces hipodensidades parieto-occipitales bilaterales sugestivas de leucoencefalopatía, las cuales mostraron reversión espontánea dos años después. (Figura 1)(Figura 2)
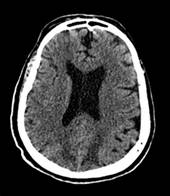
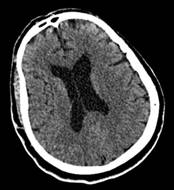
Figura 1 Tomografía simple de cerebro sin contraste (2016). Se observa hipodensidades subcorticales parieto-occipitales bilaterales.
Paciente es transferida del Hospital de Salitre del Ministerio de Salud Pública por presentar cuadro clínico de tos con expectoración, alza térmica no cuantificada y aumento del requerimiento de oxígeno de aproximadamente una semana de evolución. Al ingreso, la paciente se encontraba taquipneica, con uso de la musculatura accesoria y signos de deshidratación; siendo necesaria ventilación mecánica no-invasiva. El servicio de Neumología catalogó el cuadro como una insuficiencia respiratoria aguda, motivo por el cual se inició tratamiento broncodilatador con salbutamol, bromuro de ipatropio, ampicilina-sulbactam y levofloxacino. Posteriormente, el día 11 de hospitalización la paciente presentó 2 crisis convulsivas tónico-clónicas generalizadas, las cuales cedieron con diazepam. En el contexto aparente de descompensación de su EPOC, se solicita valoración por Neurología.
Durante el examen físico neurológico la paciente se encontraba somnolienta, intubada, en ventilación mecánica invasiva, incapaz de emitir lenguaje oral, no obedeció órdenes; pupilas isocóricas, reflejo fotomotor y consensual presentes. Al evaluar los campos visuales, no hubo respuesta a la amenaza. Los reflejos oculocefálicos y corneales se encontraban presentes. En cuanto a la motilidad, se evidenció un patrón motor sin retiro al dolor, el tono muscular se encontró disminuido en las 4 extremidades, con hiperreflexia generalizada. El signo de Trömmer se encontró presente bilateral y el reflejo plantar fue indiferente bilateral.
Se realizó tomografía cerebral sin contraste, la cual reveló presencia de zonas de hipodensidades parieto-occipitales subcorticales bilaterales debido a un probable edema vasogénico (Figura 3).
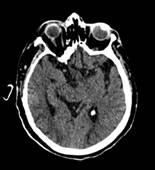
Figura 3 Tomografía simple de cerebro sin contraste (2019). Se evidencia zonas hipodensas subcorticales parieto-occipitales bilaterales asociado a un probable edema vasogénico.
La resonancia magnética cerebral mostró mismas lesiones en secuencia FLAIR en zonas parietooccipitales bilaterales, sin efecto de masa sugerente de leucoencefalopatía posterior. (Figura 4).
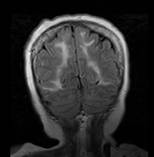
Figura 4 Resonancia magnética cerebral en secuencia FLAIR (2019). Demuestra mismas lesiones hiperintensas en zonas parietooccipitales bilaterales, sin efecto de masa.
En vista de historial previo y estudios de neuroimagen con reversión de leucoencefalopatía y nuevo estudio tomográfico con lesiones en sustancia blanca parieto-occipital bilateral, similar a lo presentado en el año 2016 en relación a cuadro convulsivo y descompensación de su EPOC se concluye que se trataría de un Síndrome de leucoencefalopatía posterior reversible recurrente con síndrome convulsivo secundario, asociados a descompensación de EPOC.
Se inicia tratamiento anticonvulsivante Fenitoína 125 mg IV cada 8 horas bajo monitoreo de EKG. Se realiza AngioRMN la cual reporta arrosariamiento de arterias vertebrales y arterias cerebrales posteriores como signo de vasoespasmo. Motivo por el cual se inicia tratamiento con Nimodipino 60 mg cada 4 horas durante 14 días hasta demostrar con imágenes reversión de vasoespasmo cerebral. Paciente presenta mejoría clínica significativa por lo cual es dada de alta.
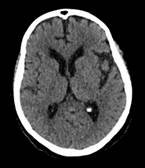
Paciente acude a control por consulta externa 2 meses después, presentando mejoría del cuadro clínico inicial. No refiere haber presentado nuevas crisis convulsivas; sin embargo, llama la atención al examen físico neurológico paresia facial central izquierda, paresia braquial izquierda y paraparesia con leve impotencia funcional de cadera. Se realiza TC de cráneo sin contraste la cual muestra reversión de lesiones descritas previamente. (Figura 5).
Revisión de la Literatura
Se entiende por síndrome de encefalopatía posterior reversible (PRES) a una entidad multifactorial, caracterizada por deterioro neurológico asociado a lesiones encefálicas reversibles en neuroimagen en localizaciones específicas. Inicialmente considerada como un tipo de encefalopatía hipertensiva, que suele acompañarse con trastornos visuales aludidos a una disfunción cortical o una isquemia en la retina, fue descrito por primera vez por While Hinchey en el año de 1996(1)(2). Inicialmente llamado “Síndrome de Leucoencefalopatía Posterior Reversible"; se propuso un nuevo nombre, “Síndrome de Encefalopatía posterior reversible "; ya que quedó claro que las áreas corticales también se afectaban con frecuencia, particularmente en enfermedades más tempranas o leves, mientras que la materia blanca más profunda se veía involucrada en casos más graves.(3)
A diferencia de otro tipo de encefalopatías hipertensivas descritas en la literatura científica, en ésta se observan hallazgos de neuroimagen en el área que engloba la vasculatura encefálica posterior principalmente, que son reversibles una vez controlada la hipertensión arterial y por tanto la hiperperfusión cerebral.(1)(4) El Síndrome de PRES es cada vez más reconocido e informado; principalmente en artículos como reporte de casos. Sin embargo, la incidencia aún no se conoce(2)(5).
Fisiopatología
Tanto su etiología como patogenia no están totalmente claras en la actualidad, pero parece estar relacionada con una falla en la autorregulación vascular cerebral y disfunción endotelial. Análogamente, se ha visto asociado con patologías inflamatorias, neoplásicas, fallas orgánicas o la ingesta de sustancias como el alcohol y la cafeína; situaciones que generan incremento de la presión arterial sistémica y/o alteraciones del endotelio vascular.(1)(6)
Se han propuesto varias hipótesis que explicarían los mecanismos fisiopatológicos responsables del síndrome de PRES. De acuerdo con la teoría vasogénica, la autorregulación normal mantiene el flujo sanguíneo cerebral constante en un rango de presión arterial sistémica por medio de la vasoconstricción y dilatación arteriolar.(7)
Cuando se produce un aumento de la presión arterial que supera los mecanismos de autorregulación cerebral, esto conduce a una hiperperfusión sanguínea, aumento de la presión hidrostática capilar y vasodilatación. Asímismo, el aumento de la presión arterial cerebral conlleva a la disfunción de la barrera hematoencefálica fisiológica con la extravasación de plasma a través de las uniones estrechas en el parénquima cerebral circundante, lo que conduciría a un edema cerebral vasogénico.(2)
La disfunción endotelial también se ha relacionado en la fisiopatología del PRES, especialmente en casos asociados con preeclampsia o terapias citotóxicas.(1)(8)
Con respecto a la hipótesis citotóxica, la activación de las células T y la disfunción de las células endoteliales son la clave de la fisiopatología de esta condición.(9)
Se especula que el sistema nervioso simpático ejerce un efecto protector ante elevaciones de la tensión arterial; razón por la cual, la circulación cerebral posterior es más vulnerable a una falla en la autorregulación que la circulación cerebral anterior debido a una menor inervación simpática.(5)(6)
Síndrome de PRES y Enfermedad Pulmonar Obstructiva Crónica
La enfermedad pulmonar obstructiva crónica (EPOC), ha sido estrechamente relacionada a la aparición de PRES. Aunque la misma no parece ser un factor de riesgo para desarrollarlo, las crisis respiratorias agudas de esta patología ocasionan la activación periférica de células T, incremento de interleucina 1 (IL-1) y el factor de necrosis tumoral alfa (TNF-alfa); como resultado los niveles plasmáticos de endotelina-1 aumentan. Dichos acontecimientos conllevan a una disfunción endotelial, dando lugar a la vasoconstricción en las arterias cerebrales e incremento de la permeabilidad de la barrera hemato-encefálica. Los casos clínicos reportados que relacionan al EPOC con el PRES, coinciden en que la aparición del PRES se da posterior a un episodio de exacerbación del EPOC.(1)(6)(9)
Características clínicas
La presentación clínica de un paciente con PRES se manifiesta con la aparición de convulsiones, acompañado de alteraciones visuales (ceguera cortical, hemianopsia homónima o visión borrosa), alteraciones del estado mental, náuseas y en menos del 15% los síntomas parecen asociados a lesiones de tallo cerebral.(6)(9)
Las alteraciones en el estado de conciencia varían en severidad desde somnolencia leve hasta confusión, estupor o coma en casos extremos.(10)
El síndrome de PRES se caracteriza por:
Cefalea: constante, holocraneana, moderado a severo y que no responde a la analgesia.(11)
Alteración del nivel de consciencia: varía de somnolencia leve a confusión y agitación, y progresa a estupor o coma en casos extremos(12)(13).
Trastornos visuales: las anomalías de la percepción visual a menudo son detectables. Se puede presentar hemianopsia, negligencia visual, auras, alucinaciones visuales y ceguera cortical(14). La ceguera cortical puede ir acompañada de negación de ceguera (síndrome de Anton).
Convulsiones: las convulsiones son a menudo la manifestación de presentación más frecuente(1)(15)(16). Las convulsiones son generalmente tónico-clónicas generalizadas; pueden comenzar focalmente y con frecuencia recurrir. Estado epiléptico se ha informado(17)(18). La pérdida visual anterior o las alucinaciones visuales sugieren el origen del lóbulo occipital en algunos pacientes. Solo una minoría de pacientes, generalmente aquellos con enfermedad más leve, están libres de crisis(8).
Diagnóstico
Su diagnóstico es netamente clínico-radiológico. Al momento no se han establecido criterios para el diagnóstico de esta entidad. Sin embargo, en un estudio llevado a cabo en la clínica Mayo por Fugate, et al. se incluyeron 120 pacientes diagnosticados con PRES, que cumplía con las características detallados a continuación:
Alteración neurológica aguda que incluya la presencia de cefalea, convulsiones, alteraciones visuales, déficit neurológico focal o sospecha de encefalopatía.
Cambios en neuroimagen sugerentes de edema vasogénico local.
Pruebas clínicas o radiológicas que sugieran reversibilidad del cuadro.(4)(9)
Neuroimágenes
Los principales hallazgos imagenológicos, observados en el 70% de los casos se deben a la presencia de edema vasogénico subcortical e incluyen lesiones focales bilaterales, que pueden ser simétricas o asimétricas en el área parieto-occipital, hipodensas en tomografía computarizada (TC) o hiperintensas en la secuencia T2 o FLAIR de resonancia magnética (RM).
Otros hallazgos descritos incluyen lesiones puntiformes sugerentes de sangrado (65% de todos los casos). Algunos autores han reportado de manera menos frecuente lesiones en lóbulos frontal y temporal, cerebelo, ganglios de la base o medula espinal. Actualmente, no existe un vínculo realmente claro entre la extensión de las lesiones y el pronóstico del paciente.(19)(20)(21)(22)(23)
Otras pruebas complementarias
Las características clínicas y radiológicas del PRES no son específicas; otras condiciones como la encefalopatía tóxico-metabólica deben ser evaluadas a fondo. Por lo tanto, los estudios de laboratorio deben incluir un conteo sanguíneo, electrolitos, creatinina, nitrógeno ureico en sangre (BUN) y pruebas de la función hepática. Las comorbilidades médicas como: sepsis, hiponatremia, insuficiencia renal, enfermedad intestinal isquémica pueden exacerbar el deterioro neurológico y es por eso que deben de diagnosticarse con prontitud.(22)
No se requiere de una punción lumbar para la evaluación de la mayoría de los pacientes con sospecha de PRES, pero se puede obtener si existe una preocupación específica por meningitis, encefalitis o malignidad. En el PRES, el líquido cefalorraquídeo (LCR) típicamente muestra un nivel de proteína moderadamente elevado (media 58 mg/dL en un estudio) pero no pleocitosis.(24)
Varios estudios de casos de PRES coinciden que en las primeras 48 horas de iniciado este cuadro, se observan datos serológicos como:
Disminución de Magnesio sérico
Aumento de lactato deshidrogenasa (LDH)
Aumento de marcadores de función hepática
Aumento de creatinina sérica
Disminución de albúmina sérica
Aumento de albúmina en líquido cefalorraquídeo (LCR).
Sin embargo, la evidencia brindada por otros estudios no es concluyente.(3)(5)
Tratamiento
El tratamiento del PRES se basa en manejo sintomático y de soporte vital básico. El objetivo principal se basa en revertir el factor desencadenante, una vez identificado. Tratar la encefalopatía hipertensiva para evitar o limitar el daño pasa a segundo plano, ya que una vez controlada la patología de base la presión arterial empieza a descender de manera paulatina y continua.(4)(5)(6)
Hipertensión
La hipertensión es una característica de la mayoría de los pacientes con PRES, independientemente de su etiología(25)(26)(27). Con la disminución gradual de la presión arterial, los pacientes a menudo mejorarán drásticamente. Excepto en los casos de hipertensión maligna, los pacientes con PRES suelen presentar sólo niveles moderados de hipertensión; sin embargo, en la mayoría de los casos, esto sigue representando un aumento significativo por encima de los niveles iniciales.
En la hipertensión maligna, el objetivo inicial del tratamiento es reducir la presión diastólica a aproximadamente 100 a 105 mmHg; este objetivo debe alcanzarse en un plazo de dos a seis horas, con una caída máxima inicial de la presión arterial que no supere el 25 por ciento del valor actual.(28)(29) Una disminución más agresiva de la presión arterial es generalmente innecesaria y puede reducir la presión arterial por debajo del rango autorregulador, lo que posiblemente lleve a una isquemia cerebral, así como a un aumento del riesgo de isquemia coronaria y renal(30). El uso de agentes antihipertensivos parenterales fácilmente titulables como clevidipina, nicardipina, labetalol y nitroprusiato es efectivo y seguro para reducir la presión arterial a un rango deseable(31).
Convulsiones
Excepto en el caso de la eclampsia, la mayoría de los pacientes con PRES y convulsiones son tratados con fármacos anticonvulsivos(11)(18)(22). Cuando las convulsiones están documentadas o se sospecha con certeza, se debe iniciar un medicamento anticonvulsivo que se puede administrar en forma de bolo intravenoso o que al menos no requiere titulación. La selección del agente debe tener en cuenta la función renal (las dosis de levetiracetam y lacosamida deben ajustarse en pacientes con insuficiencia de la función renal), el potencial de sedación (una preocupación particular con la fenitoína) y otros efectos secundarios de los fármacos y las comorbilidades del paciente(11)(18)(22)
Pronóstico
El pronóstico a corto y sobre todo a largo plazo es muy bueno.
En muchos casos, el PRES parece ser completamente reversible en un período de días a semanas, después de la eliminación del factor de incitación y el control de la presión arterial.(1)(15)(32)(33)
Las complicaciones en el PRES son extremadamente raras, ya que la mayoría de los pacientes presenta una recuperación completa de su sintomatología, las principales complicaciones incluyen trastornos visuales, déficits motores y convulsiones. Por ende, su pronóstico es bastante optimista si se diagnostica y trata de manera temprana y si se consigue controlar el factor gatillante.(6)(19)(21)(34)
El estudio realizado por Roth C y Ferbert A. evidenció que las lesiones observadas por RMN se resuelven algo más lentamente en comparación con la recuperación clínica. Los ataques recurrentes de PRES son raros. Se necesitan más investigaciones para definir mejor los factores que predisponen a unos pocos pacientes a desarrollar PRES.(6)
Discusión
El Síndrome de Encefalopatía Posterior Reversible se refiere a un trastorno neurológico transitorio con cambios radiológicos característicos reversibles en pacientes hospitalizados por una enfermedad aguda. Una variedad de condiciones clínicas como la emergencia hipertensiva, enfermedad renal, preeclampsia/eclampsia y el uso de agentes inmunosupresores están comúnmente asociados con el desarrollo de PRES.(35)
El término PRES es un término erróneo, ya que la afectación no siempre es reversible. Además, no se limita necesariamente a las regiones posteriores del cerebro, sino que también puede incluir áreas suministradas por las arterias cerebrales anteriores y medias y también a nivel del tronco encefálico.(11)
En la mayoría de casos los pacientes presentan cefalea, alteración del estado mental, pérdida de la visión y convulsiones. Como en el caso anteriormente expuesto, la paciente debutó con convulsiones tónico clónico generalizadas. En imagen los hallazgos característicos son lesiones focales y simétricas, hipodensas en TC e hiperintensas en las secuencias T2 de la RM, que afectan predominantemente a las regiones parietales y occipitales bilaterales(35)
En algunos casos los datos obtenidos pueden ser inespecíficos, por lo que la resolución clínico-radiológica puede ser la única información que nos permite obtener un diagnóstico certero. En el presente caso, la paciente desarrolló PRES en dos ocasiones las mismas que coincidieron con el período de tiempo que tuvo exacerbaciones de su enfermedad de base. Una vez que se logró manejar la exacerbación aguda de EPOC las lesiones observadas en TAC y RM revirtieron.
Existen muy pocos informes de casos que vinculen la relación de la PRES con el EPOC. El EPOC puede considerarse un trastorno autoinmune, en el que un aumento de la citoquina endotelina-1 circulante (ET-1) podría causar disfunción endotelial y edema vasogénico cerebral.(36)(37)
En conclusión, a pesar de que la asociación de EPOC y PRES es una entidad rara, se debe considerar esta patología como un diferencial en todo paciente que desarrolle encefalopatía o convulsiones en el contexto de una exacerbación aguda de EPOC.