INTRODUCCIÓN
Hace varias décadas, se creía que el paso de moléculas de agua a través de las membranas biológicas se llevaba a cabo por difusión simple. Esta hipótesis tenía sentido debido al pequeño tamaño de las moléculas de agua. Sin embargo, células como las renales podían mantener un transporte de agua a altas velocidades y ser inhibido por moléculas de mercurio, lo cual hizo pensar en la existencia de unos “poros o conductos” que permitieran dicho proceso. Fue entonces cuando en 1985, Benga et al.(1) descubrieron una proteína de 32 kDa en la membrana de los eritrocitos, que fue el primer canal de agua, hallazgo que fue publicado en 1986. En 1992, Peter Agre et al.(1)(2) encontraron la misma proteína, la purificaron y comprobaron además que la membrana plasmática de los eritrocitos tenía una alta densidad de estas proteínas y que la conferían una alta permeabilidad al paso de agua. La proteína se denominó en primer lugar CHIP28, acrónimo del inglés channel-forming integral protein de 28 kDa, que tras su clonaje y secuenciación fue sugerido el nombre de aquaporina 1 (AQP1), el cual fue adoptado oficialmente por la Organización del Genoma Humano en 1997. En 1994, los grupos de Agre y Verkman(2) de forma independiente describieron que en el cerebro se expresaba una aquaporina cDNA específica en elevada cantidad llamada en primer lugar por el grupo de Verkman, canal de agua insensible al mercurio (MIWC) que fue después denominada acuaporina 4 (AQP4) localizándose por inmunofluorescencia en ependimocitos y astrocitos del cerebro.
Las acuaporinas(1)(2)(3)(4)(5)(6) son una familia de proteínas integrales de membrana que facilitan el transporte rápido y altamente selectivo de moléculas de agua a través de las membranas plasmáticas celulares. Existen 14 tipos, de los cuales 8 transportan exclusivamente agua y el resto, las acuagliceroporinas, también glicerol y otros pequeños solutos polares. Todas poseen una estructura molecular común y las mutaciones en sus genes dan lugar a procesos fisiopatológicos conocidos. In vivo en las células cerebrales se han identificado la AQP1, la AQP4 y la AQP9(4). La AQP1 está involucrada en la formación del líquido cefalorraquídeo y se encuentra presente en altas concentraciones en la membrana plasmática de las células epiteliales del plexo coroideo, tercer y cuatro ventrículos. Así mismo, se sitúa en las células endoteliales vasculares de todo el organismo pero está ausente en el endotelio cerebrovascular a excepción de los órganos circunventriculares entre los que se encuentran la eminencia media, la cresta supraóptica, el órgano subcomisural, el órgano subfornical, el área postrema, los plexos coroideos, la glándula pineal y la neurohipofisis. La AQP4 es la más abundante de las tres, hallándose principalmente en los podocitos astrocitarios y cuya función es controlar los movimientos de agua en el cerebro, se piensa que también está implicada en la formación del edema cerebral, migración astrocitaria, actividad neuronal y adhesión entre astrocitos y células endoteliales. La AQP9 se le atribuye una implicación en procesos energéticos metabólicos que facilitarían la difusión del lactato de los astrocitos a las neuronas y participarían también en el aclaramiento del exceso de lactato en condiciones patológicas.
De esta forma, se plantea si existe una relación entre las alteraciones moleculares en las acuaporinas y diversos procesos fisiopatológicos del SNC donde éstas intervienen en el transporte selectivo de agua a través de las membranas plasmáticas.
DESARROLLO
ESTRUCTURA Y LOCALIZACIÓN
La acuaporina 4(2)(3)(5)(6)(7) se dispone en la membrana plasmática en forma de tetrámeros. Cada monómero que lo conforma es de 30kDa, tienen seis dominios helicoidales transmembrana que rodean un poro, que contiene los residuos de Asparagina-Prolina-Alanina (NPA) y tiene un diámetro de 2,8Å, el cual es menos estrecho en las acuaporinas 3,7 y 9 (3,4Å) siendo éstas además transportadoras de glicerol. La gran selectividad por el agua a parte de deberse a la estrechez del poro, se debe también a la carga positiva de un residuo de Arg donde existe un estrechamiento de la proteína que impide el paso de cationes junto con los dipolos eléctricos formados por las hélices cortas de los bucles que proporcionan cargas positivas que repelen cualquier protón que haya podido escaparse a través del poro.
Existen dos isoformas(3)(4)(6) de la AQP4, M1 o Aqp4a tiene 323 aminoácidos y no da lugar a OAPs (del inglés ortogonal arrays of particles) o matrices que se visualizan mediante microscopía electrónica de criofractura como conjuntos ensamblados de partículas. La isoforma M23 o Aqp4c posee 301 aminoácidos y en cambio, si forma OAPs. Ambas isoformas presentan una permeabilidad al agua similar. Es posible que existan isoformas menores adicionales en algunas especies(3). Los monómeros AQP4 pueden estar formados de las isoformas M1 o M23 dando lugar a homotetrámeros o bien heterotetrámeros cuando se produce la combinación de ambos(6).
Parece ser que la formación de OAPs se produce a través de asociaciones intermoleculares N-terminales entre moléculas M23, las cuales no aparecen en la isoforma M1 por la diferencia de residuos de aminoácidos. Su concentración en las membranas podocitarias está en torno a las 500-600/μm2. Aunque el significado biológico de las OAPs no se comprende completamente, existe evidencia de que las OAPs pequeñas y móviles facilitan la migración de los astrocitos, mientras que las OAP más grandes y menos móviles están involucradas en la polarización de la AQP4 a los podocitos de los astrocitos a través de interacciones con proteínas de anclaje, incluyendo α- sintrofina y el complejo distroglicano. Su función, aunque aún en estudio, parece ser la de aumentar la permeabilidad al agua, mejorar la adhesión celular, participar en la toxicidad del complemento (se unen a C1q) y formar parte en la fisiopatología de la neuromielitis óptica. Los autoanticuerpos anti-AQP4 de inmunoglobulina G (IgG) van dirigidos contra esta proteína(2)(3)(5).
El gen de la AQP1(1) se localiza en el brazo corto del cromosoma 7 mientras que el de la AQP4(5) en el cromosoma 8. La distribución de la AQP4(4)(5) en nuestro organismo se corresponde en el cerebro con el área periventricular, el área periacueductal y la sutancia gris, en la sustancia blanca de la médula espinal; y en menor proporción en músculo esquelético, núcleo supraóptico, células parietales gástricas, células de sostén (astrocitos y epéndimo del sistema nervioso central, células de Müller en retina y células de Claudio-Hensen en el oído).
Así mismo, se conoce que la AQP4 mantiene una distribución polarizada en las membranas(2)(3)(6) y se encuentra en altas concentraciones en los podocitos astrocitarios en el compartimento adluminal. Esta elevada concentración se debe a varios mecanismos de anclaje, entre ellos a su interacción con el complejo de glucoproteínas asociadas a la distrofina (DAPC) como la α-sintrofina, α-distrobrevina y α-distroglicano. Actualmente se conoce que déficits en distrofina muestra un pool de AQP4 reducido.
PROCESOS FISIOPATOLÓGICOS IMPLICADOS
Neuromielitis óptica o enfermedad de Devic
La neuromielitis óptica (NMO) es una enfermedad autoinmune conocida también como enfermedad de Devic´s, con afectación de la médula espinal y nervio óptico, presentando síntomas ceguera, dolor ocular, dolor radicular, paraplejia, espasmos. Se pensaba que formaba parte de la esclerosis múltiple, sin embargo, se ha descubierto que es una entidad diferente y que presenta la característica particular de tener anticuerpos anti-acuaporina 4 (IgG-NMO)(8)(12)(13)(14)(15)(16). La mayoría de los pacientes que desarrollan NMO suelen ser mujeres y su edad de inicio es variable desde la infancia hasta la edad adulta aunque es mucho más frecuente en personas jóvenes.
Los anticuerpos anti-acuaporina 4 son predominantemente del subtipo inmuglobulina G1 y se unen a tres epítopos de conformación tridimensional en los bucles extracelulares de AQP4, produciendo daño astrocitario por citotoxicidad dependiente del complemento. Los epítopos de IgG específicos parecen estar localizados en los tres bucles extracelulares de AQP4. La IgG específica se une a ambos tetrámeros de AQP4 y a OAPs, aunque generalmente con mayor afinidad a OAPs(9)(10)(15). Estos anti-IgG1 no atraviesan la barrera hematoencefálica en sujetos normales pero si pueden atravesar la placenta y se ha demostrado que son sintetizados fuera del SNC(11)(12). Los canales de acuaporina 4 están presentes en los astrocitos y son diana de una activación del sistema inmune, mediada principalmente por linfocitos T y B y el sistema del complemento(8)(11)(12)(12)(14)(15)(16).
El diagnóstico se basa en los criterios publicados en 2006 por Wingerchuk(8)(12)(13)(14)(16) y basta con la presencia de dos de ellos para realizar el diagnóstico. Incluyen: una mielitis aguda, neuritis óptica y al menos uno de los siguientes criterios: lesión de alguno de los tres segmentos de la médula espinal, no cumplir criterios de diagnóstico para EM o presentar anticuerpos anti-AQP4 en suero.
A nivel molecular, en la NMO se conocen mutaciones missense presentes en dos diferentes alelos en los residuos de Arg19 que pueden dar lugar a cambios en la estructura de la isoforma M1 de la AQP4 en el extremo N-terminal o afectar a la regulación de los procesos de transcripción y traducción de la isoforma M23. En cuanto a la isoforma M1, las mutaciones missense que dan lugar a proteínas truncadas afectan desde el residuo 17 al 21 (Cys-Ser-Arg-Glu-Ser) y dan lugar a fallos en la formación de los OAPs. Los residuos de arginina adyacentes a los pares de cisteínas en el extremo N-terminal son un lugar frecuente de palmitolación de proteínas de las membranas plasmáticas. Se piensa que aminoácidos, tales como arginina o lisina, facilitan la palmitolación. Así mismo, la palmitolación de la AQP4 puede impedir la interacción molecular entre los tetrámeros que se requieren para la formación de OAPs(17)(18)(19).
Actualmente, las terapias para tratar la NMO se basan en la utilización de inmunomodulares (como Rituximab) e inmunosupresores (por ejemplo, esteroides y azatioprina)(18)(14). Otras estrategias serían la utilización de Eculizumab o bien de Aquaporumab(3)(7)(8)(12)(13)(15)(17), un anticuerpo monoclonal de alta afinidad dirigido específicamente contra los AQP4-IgG específicos, que se une con firmeza a la AQP4 por mutación de su región Fc para eliminar la citotoxicidad dependiente de anticuerpo (ADCC) y complemento (CDC). Además Aquaporumab no interfiere con la permeabilidad al agua en los canales de acuaporina de los astrocitos y su toxicidad es mínima al ser altamente selectivo. Se puede utilizar tanto en la fase aguda, para detener la progresión de la enfermedad; como en la de mantenimiento, reduciendo la frecuencia y gravedad de las exacerbaciones(18).
Hipertensión intracraneal idiopática (HII)
También conocida como Hipertensión endocraneal benigna o Pseudotumor cerebri, es una patología que se caracteriza por afectar principalmente a mujeres jóvenes en edad fértil y cursar con cefalea y alteraciones visuales (Figura 1). El sobrepeso suele ser la regla llegando en ocasiones a tratarse de obesidad tipo II. En la RMN se observa una disminución del tamaño ventricular asociado en su mayoría a una estenosis del seno sigmoide. Los registros de presión del LCR presentan unas cifras superiores a los 20 mmmHg.
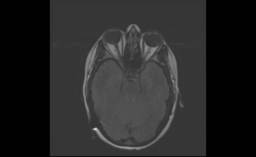
Figura 1 RM craneal, corte axial en secuencia T2 FLAIR, donde se observa una ectasia bilateral de los nervios ópticos, en paciente afecto de hipertensión intracraneal idiopática.
Múltiples estudios han intentado relacionar la etiología de la enfermedad con variantes genéticas de la AQP4, incluidos polimorfismos de un solo nucleótido (SNPs). Kerty et al.(20), utilizó una cohorte noruega y analizó la expresión génica de los SNPs y los mecanismos responsables de la regulación post-transcripcional, no encontrando una asociación estadísticamente significativa. Fue atribuido, en gran medida, al limitado tamaño de la muestra (n=28). Tampoco halló resultados significativos en su estudio Friedman et al.(21)(22). Este consistía en demostrar la presencia de anticuerpos anti-AQP4 en el LCR de pacientes con HII. Si obtuvieron resultados significativos en relación a la participación de la AQP1 en el peso, Stiebel-Kalish et al.(23) demostrando que la deficiencia en AQP1 está asociada a un fallo en la ganancia de peso ya que los ratones knockout AQP1 que fueron alimentados con una dieta al 50% de materia grasa, sólo aumentaron un 4% su peso en comparación con los ratones de tipo salvaje que lo hicieron en un 46%.
Hidrocefalia crónica del adulto o hidrocefalia de presión normal (HPN)
La hidrocefalia es una acumulación anormal de líquido cefalorraquídeo (LCR) que aumenta la presión en el interior de la cavidad intracraneal y comprime el cerebro lesionándolo a veces de forma irreversible. Una variedad es la HPN caracterizada por acúmulo de LCR y presión normal, clínicamente se presenta con la triada de Hakim: demencia, incontinencia urinaria y marcha apráxica. Su etiología es desconocida pero la posibilidad de desarrollarla es alta, sobre todo si el paciente ha sufrido una hemorragia subaracnoidea, un traumatismo craneoencefálico, una infección, un tumor o complicaciones de la cirugía(24).
Este origen idiopático, ha motivado la aparición de diferentes estudios intentando esclarecer una posible explicación fisiopatológica, relacionándola en algunos de ellos con alteraciones cuantitativas o estructurales de las moléculas de acuaporina, marcando por consiguiente el objetivo de clarificar si éstas son causa de la patología o si se trata de un mecanismo adaptativo de protección frente a la misma. Bloch et al.(24)(25), estudiaron ratones knockout AQP4 a los cuales se indujo una hidrocefalia mediante inyección de caolín en la cisterna magna, presentando una supervivencia menor que los control, observándose así el papel protector de la AQP4. En cuanto a la AQP1, Silverberg et al.(26) demostraron que la producción de LCR está disminuida en pacientes con HPN constituyendo un mecanismo adaptativo de defensa para evitar el incremento de la presión intracraneal (PIC). Mao et al. (27), al inducir hidrocefalia con una inyección de caolín, los knockout AQP1 mostraron una reducción del 25% en la tasa de secreción de LCR, una reducción de la permeabilidad osmótica del epitelio del plexo coroideo y la disminución de la PIC. Estos resultados apoyan la hipótesis de que la AQP1 facilita la secreción de líquido cefalorraquídeo en los ventrículos cerebrales por el plexo coroideo y el papel de posibles inhibidores de AQP1 en el tratamiento de la hidrocefalia.
Edema cerebral
El edema vasogénico aparece cuando existe un daño de la barrera hematoencefálica y como consecuencia el agua y algunas proteínas plasmáticas entran al parénquima cerebral desencadenando un desbalance en la presión hidrostática, es por tanto, primordialmente una expansión del espacio intersticial. La evidencia de que la AQP4 participa en la eliminación de líquido intracerebral se basaría en que la infusión de LCR en animales de experimentación deficientes en AQP4 da lugar a un incremento de la PIC que es mayor en animales de experimentación donde la AQP4 está completamente ausente(3)(28)(29). Estos hallazgos sugieren que el exceso de agua cerebral en el edema vasogénico se elimina mediante una ruta dependiente de AQP4. Además, los ratones knockout AQP4 tuvieron un mayor aumento del ventrículo(3).
El edema citotóxico se caracteriza por una acumulación de agua en el citosol, a consecuencia de perturbaciones en la distribución normal de iones y sustancias osmóticas orgánicas a consecuencia de situaciones patológicas. Un hallazgo importante es el aumento de volumen de los podocitos astrocitarios, que es donde se encuentran los canales de AQP4. Ratones de laboratorio AQP4 knockout, ataque isquémico cerebral y meningitis bacteriana mostraron un descenso del edema cerebral al disminuir la inflamación cerebral causada por la hiperhidratación. La acidosis láctica también representa un papel importante en el edema citotóxico. En ratas de laboratorio, se ha observado aumento de volumen de astrocitos producida por el ácido láctico y un incremento de la expresión de AQP4 y de la permeabilidad de la AQP9(27).
Por ejemplo, la eliminación de AQP4 en ratones es beneficiosa en un modelo de aplastamiento medular donde el edema puede ser principalmente citotóxico, pero perjudicial en un modelo de contusión donde el edema es principalmente vasogénico. Esta diferencia entre ambos tipos de edemas, puede ser causada por la diferencia osmótica del medio, siento este gradiente el que va a determinar la dirección del flujo de agua mediante el transporte pasivo a través de la AQP4(3).
Otros procesos implicados
Durante la isquemia, los tejidos se ven desprovistos de su aporte de oxígeno y glucosa necesarios para llevar a cabo sus procesos metabólicos y energéticos dando lugar a una alteración en la cadera respiratoria con aumento del complejo I y alteración de la bomba ATPasaNa+/K+ aumentando los niveles intracelulares de Na+ y los extracelulares de K+. En el cerebro, el exceso de K+ extracelular es regulado por los astrocitos a través de sus uniones estrechas o zonula occludens. Pero en situación de isquemia, este proceso se ve comprometido y el K+ se acumula en su interior, atrayendo también al Cl- para mantener la electronegatividad y al agua que sigue su potencial químico, incrementando aún más el volumen del astrocito. A su vez, también puede ocurrir, que la parte de la glucosa remanente se transforme por la vía anaerobia en lactato como se ha demostrado en diversos estudios in vitro en los que además se ha visto que este exceso de lactato aumenta la expresión de AQP4(30).
En los traumatismos craneoencefálicos y medulares, puede aparecer una alteración en la secreción de la hormona antidiurética(28) que genera hiponatremia y contribuye a aumentar el edema. La expresión de la AQP4 en estos casos, se encuentra aumentada.
Los astrocitomas son los tumores primarios del sistema nervioso central más frecuentes. Histológicamente, se clasifican en cuatro grados (I-IV) según su malignidad, siendo el tipo IV (glioblastoma multiforme) el más frecuente y agresivo. En el estudio realizado por Isoardo et al.(31) se demuestra una alta expresión de AQP4 en los astrocitomas, principalmente en el glioblastoma multiforme y se explica la relación que puede existir entre la AQP4 y los ataques epilépticos que sufren los pacientes con este tumor, comprobándose que una expresión reducida de AQP4, se asocia a un menor riesgo de convulsiones en estos pacientes. Otros estudios se centraron en la invasión y migración de células cancerosas como el llevado a cabo por Ding et al.(31)(32)(33)(34), donde la reducción de la AQP4 inhibe la expresión de la metaloproteinasa 2 (MMP-2) (cuyos niveles cuando están elevados se correlacionan con invasión celular y metástasis).
En los meningiomas, aproximadamente el 60% de los pacientes desarrollan edema peritumoral, que es una importante complicación del mismo agravando la sintomatología del paciente. El factor de crecimiento endotelial vascular (VEGF) tiene entre sus funciones incrementar la permeabilidad vascular e inducir angiogénesis, que guarda relación con la formación del edema en los meningiomas y a su vez la expresión de la AQP4 está en relación con dicho factor. Relacionando estos conceptos se encuentra el estudio de Wang et al.(35), donde se demostró que la AQP4 y el VEGF sus niveles están aumentados en los pacientes con edema peritumoral y que el VEGF era capaz de penetrar en este área e inducir el edema, pero el mecanismo exacto por el cual se produce la interacción con la AQP4 aún no está claro.
La enfermedad de Alzheimer es la forma más común de demencia. Se trata de un trastorno neurodegenerativo progresivo que se caracteriza por la presencia de depósitos de material amiloide en el cerebro y la reducción progresiva de la producción cerebral de acetilcolina que condiciona un deterioro en las actividades mentales vinculadas con la memoria y el pensamiento. En el estudio de Wilcock et al.(36), en autopsias cerebrales demostró la reducción de AQP4, canales de potasio Kir4.1 y distrofina. En el estudio de Xiao et al.(36)(37), se comprobó, in vivo, cómo la supresión del gen de la AQP4, impide el aclaramiento de β-amiloide del parénquima cerebral y exacerba los problemas en el aprendizaje y memoria.
La enfermedad de Parkinson es un trastorno neurodegenerativo que se caracteriza por la presencia de temblor, bradicinesia, inestabilidad de la marcha y rigidez. Intentando relacionar su fisiopatología con las AQP4, el estudio de Xiao et al.(37)(38), demostró en el plasma de estos pacientes un descenso en los niveles del mRNA de la AQP4, en comparación con sujetos normales. Así mismo, la delección del gen de la AQP4 da lugar a una pérdida de neuronas dopaminérgicas e inflamación de la microglia.
Existen evidencias que relacionan la patogénesis de la depresión con la neurogénesis del hipocampo. De hecho, fármacos como la fluoxetina, promueven este proceso. La delección del gen de la AQP4 suprime lo anterior como se ha podido comprobar en animales de experimentación(37).
La mielinolisis central pontina es un trastorno caracterizado por la desmielinizacion de la sustancia blanca cerebral, sobre todo en el tronco del encéfalo. En el estudio de Popescu et al.(39), se plantea la hipótesis de que en algunos pacientes la pérdida de la AQP1 y AQP4 podría representar un mecanismo de protección por el cual los astrocitos evitan la pérdida de agua y previenen la activación de la apoptosis desencadenada por el descenso del volumen celular.
Se ha podido demostrar la relación que existe entre el edema y la hiperexcitabilidad que da lugar a susceptibilidad a las crisis epilépticas(40). Un estudio in vitro, que explica el mecanismo por el cual la hiponatremia ocasiona un aumento de volumen de los astrocitos que reduce el espacio extracelular e induce crisis convulsivas. Otro estudio(28)(40) plantea que la furosemida, que inhibe el cotransportador Na+-K+-2Cl-, aumenta el volumen de los astrocitos, acumulando K+ y dando lugar a hiperexcitabilidad neuronal. Por último se demostró que los ratones knockout sin AQP4, eran más susceptibles al pentilentetrazol que los ratones control, presentando unas convulsiones de mayor duración, de menor umbral de aparición pero de menor tasa de mortalidad, ya que se libera el exceso de K+ al espacio extracelular y la capacidad de los astrocitos es reducida(28).
La encefalopatía hepática consiste en un trastorno en el cual se produce un empeoramiento de la función cerebral que acontece cuando el hígado ya no es capaz de eliminar las sustancias tóxicas de la sangre. El amoníaco, que es producido por el cuerpo cuando las proteínas se digieren, es una de las sustancias dañinas que normalmente el hígado transforma en inofensiva y en el cerebro solamente los astrocitos eliminan el exceso de amonio a través de la enzima glutamina-sintetasa que hace que el amonio se derive a la síntesis de glutamina. Como consecuencia de la hiperamonemia que da lugar esta enfermedad, se produce un cuadro de estrés oxidativo, daño en las membranas celulares y daño mitocondrial, sobrecarga de agua e iones que causan edema. En animales de experimentación, se ha encontrado en sus astrocitos daño mitocondrial que induce sobreexpresión de AQP4 que puede favorecer el edema característico de esta enfermedad(28).
FÁRMACOS
En los últimos años se ha incrementado el interés hacia las terapias dirigidas a la acuaporina, pero el resultado obtenido hasta el momento es limitado. Algunas acuaporinas son inhibidas por iones de metales pesados reactivos al sulfhidrilo, como el mercurio y el oro, aunque los compuestos que contienen metales pesados generalmente no son adecuados para su uso en células vivas debido a su toxicidad y reactividad a las proteínas no selectivas. Hay que destacar que la AQP4 no está inhibida por los compuestos que contienen metales pesados porque carece de un residuo de cisteína clave que se encuentra en casi el resto de las acuaporinas. Varios compuestos se han aceptado como inhibidores de la AQP1 como el tetraetilamonio (TEA), la azetazolamida y varios diuréticos de asa. Estos mismos compuestos la bumetanida y su análogo AqB013, inhiben también a la AQP4. Además, se han notificado múltiples fármacos antiepilépticos, que no están relacionados químicamente, que son inhibidores de la AQP4 como la zonisamida, la lamotrigina, la fenitoína y el topiramato(3). A priori resulta difícil de creer que una amplia variedad de inhibidores de la anhidrasa carbónica, diuréticos, antiepilépticos y otros fármacos comunes sin una composición química relacionada con la AQP4 pueda inhibirla, como se intenta demostrar en los estudios de Verkman et al.(3) pero no tuvieron éxito.
Se ha descrito que la administración de bumetanida intratecal tendría efectos beneficiosos en el manejo del edema cerebral por inhibición moderadamente selectiva de ambas acuaporinas 4 y 1(3).
La molécula TGN-020(3) se identificó como un inhibidor de la AQP4 mediante un enfoque de detección virtual basado en la similitud en las características estructurales de los inhibidores de la anhidrasa carbónica y antiepilépticos descritos previamente. Se informó que la inyección intraperitoneal de TGN-020 en dosis altas (200 mg / kg) reducía el edema cerebral producido por la isquemia y se describió una disminución de volumen del infarto en un modelo de ictus isquémico de rata tratado con TGN-020. Una patente presentada por Aeromics(3) describe un compuesto, IMD-0354(3) que inhibe la AQP4 y reduce la PIC en ratones después de la administración de agua. Un profármaco de fenol fosfato de IMD-0354 redujo la inflamación cerebral en un modelo de ratón que presentaba accidente cerebrovascular isquémico.
Los investigadores de Aeromics(3) publicaron que una molécula llamada AER271 es otro profármaco del inhibidor de AQP4 que bloquea la activación inducida por AQP4 de las células T. Si bien su estructura no se ha descrito, es probable que se encuentren en la misma clase de moléculas que IMD-0354 y su profármaco de fosfato.
Y como se ha descrito anteriormente el anticuerpo mononoclonal de alta afinidad aquaporumab(3)(41) que se genera a partir de un anticuerpo NMO recombinante. La capacidad del anticuerpo acuaporumab para bloquear la unión de AQP4-IgG humana policlonal a AQP4 está resultando efectiva en los últimos estudios.
CONCLUSIÓN
El descubrimiento de las acuaporinas ha supuesto una nueva diana en el estudio de la fisiopatología, de determinadas entidades mórbidas del SNC como la hidrocefalia, hipertensión intracraneal idiopática, edema, tumores cerebrales, epilepsia o isquemia, entre otras, suponiendo además una nueva línea de investigación a nivel molecular para comprender los mecanismos por los cuáles se producen y poder desarrollar así nuevas opciones terapéuticas para estas enfermedades. Pero, a pesar de los estudios actuales y los conocimientos que estos han aportado, se requieren a día de hoy, un incremento de los mismos y del tamaño muestral de algunos, para comprender mejor tales procesos.














