INTRODUCCIÓN
El dolor ha sido definido por la Asociación Internacional para el Estudio del Dolor (IASP) como "una experiencia sensorial y emocional desagradable asociada con daño tisular real o potencial o descrita en términos de tal daño" (1). El dolor es en esencia un mecanismo fisiológico de defensa descrito como una experiencia multifacética y altamente subjetiva que es única para cada persona, y que también es influenciada por procesos psicológicos y emocionales (2)(3), siendo regulado endógenamente por el sistema modulador descendente de la información nociceptiva. (4).
Varias áreas supraespinales contribuyen a la modulación de la nocicepción, ya sea directamente (enviando proyecciones neuronales a la médula espinal) o indirectamente (enviando proyecciones neuronales a otras regiones en el tronco cerebral, que a su vez envían proyecciones a la médula espinal); estas áreas supraespinales incluyen a la sustancia gris periacueductal, al locus coeruleus, el núcleo del rafe magnus, entre otras (5)(6). En dicho sistema de regulación se liberan diversas moléculas, entre las que destacan la metionina-encefalina, la serotonina y la noradrenalina, las cuales disminuyen la liberación de la sustancia P y el glutamato, neurotransmisores nociceptivos por excelencia (4).
El término estrés es empleado tanto científicamente como coloquialmente para referirse a variados procesos que están relacionados pero son claramente diferentes; así por ejemplo el "estrés" a veces se usa para referirse a eventos que suceden a una persona, como perder un trabajo o divorciarse ("factores estresantes" o "exposición al estresor"); por otra parte, el “estrés” también se refiere a las recciones cognitivas, emocionales y biológicas que provoca ("respuestas al estrés") (7). Aunque el estrés puede tener fines adaptativos, como el estrés agudo que puede producir analgesia como se observa en la respuesta "luchar o huir"; el estrés crónico puede llevar a una respuesta de mala adaptación, tales como la hiperalgesia inducida por estrés caracterizada por un aumento de la percepción nociceptiva (8)(9).
Se sabe que en el estrés crónico se producen desequilibrios en los niveles de glucocorticoides y alteraciones estructurales y funcionales en los circuitos neuronales de la nocicepción; lo que llevaría a una disminución del umbral del dolor (10)(11)(12). Además, está ampliamente documentado que el estrés exacerba el dolor existente asociado con trastornos de dolor crónico; siendo un factor etiológico importante en el síndrome de dolor de hombro / cuello y la fibromialgia. (13)(14)
La masticación es una función fisiológica periférica caracterizada por respuestas motoras, rítmicas y aprendidas que produce estimulación sobre las estructuras bucales (15). Esta estimulación es llevada hacia el neocórtex por varias vías neurales, entre la que destaca la vía sensorial ascendente la cual llega hasta la corteza somatosensorial (16)(17). La activación de la corteza somatosensorial facilita la respuesta del sistema regulador descendente de la nocicepción; así la masticación podría modular el procesamiento doloroso por medio de una integración sensorio-motriz a través de mecanismos corticales resultando en un efecto antinociceptivo (18). Algunos estudios han demostrado que la masticación mejora la respuesta antinociceptiva (5)(19). En seres humanos el comportamiento rítmico de la masticación activa a neuronas serotoninérgicas, las que jugarían un rol importante en la atenuación de la respuesta dolorosa (20). Por otra parte, se ha encontrado que la función masticatoria disminuye la percepción del estrés (21)(22). Además, la masticación y otros movimientos bucales activan a la corteza prefrontal; estando dicha área del cerebro humano implicada en el control del estrés y al ser activada por la masticación disminuiría marcadores bioquímicos salivales relacionados al estrés como el cortisol o la amilasa (23)(24).
Los autores del estudio han observado que entre el personal de salud existe gran desconocimiento sobre las implicancias que la masticación pueda tener en la regulación del estrés y el dolor. Siendo, lamentablemente en nuestra región, una práctica bastante rutinaria las extracciones dentarias, sin meditar en las consecuencias que dicho procedimiento ocasionaría sobre la salud integral de los pacientes. Debido a todo ello y a que prácticamente no hay estudios entre las variables planteadas se tuvo como hipótesis que la función masticatoria disminuiría el efecto del estrés crónico sobre el dolor en ratones albinos de la cepa Balb/c.
MATERIALES Y MÉTODOS
El estudio fue aprobado por el Instituto de Ética de Investigación de la Facultad de Medicina de la Universidad Nacional Mayor de San Marcos (UNMSM). Se emplearon 32 ratones albinos machos de 8 semanas de edad de la cepa BALB/c que se adquirieron del Centro de Producción de Animales de Experimentación del Instituto Nacional de Salud de la ciudad de Lima. Los animales tuvieron una semana de ambientación en el bioterio de la Facultad de Medicina de la UNMSM, donde recibieron alimentos y agua ad libitum con ciclos de luz y oscuridad de 12 horas alternadas y con humedad y temperatura controlada, de acuerdo a la Guide for the Care and Use of Laboratory Animal (25). En el primer día de la novena semana de vida de los ratones, éstos fueron distribuidos de manera aleatoria en 4 grupos de 8 roedores cada uno:
Grupo N (masticación normal sin estrés): continuó con la misma dieta en granos que el animal recibió desde el destete a los 21 días de vida y no se le aplicó estrés por inmovilización.
Grupo NE (Masticación normal + estrés por inmovilización): continuó con la misma dieta en granos que el animal recibió desde el destete a los 21 días de vida y se le aplicó estrés por inmovilización.
Grupo D (masticación deficiente sin estrés): se cambió a una alimentación con dieta en polvo y no se le aplicó estrés por inmovilización.
Grupo DE (Masticación deficiente + estrés por inmovilización): se cambió a una alimentación con dieta en polvo y se le aplicó estrés por inmovilización.
Modificación de la función masticatoria
Los animales recibieron desde el destete (día 21 después del nacimiento) alimentación en granos la cual es la dieta convencional para ratón. Una vez adquiridos siguieron alimentándose con la misma dieta durante la semana de ambientación en el bioterio de la Facultad de Medicina de la UNMSM. Después de dicha semana (en la novena semana de vida de los animales) los grupos N y NE siguieron alimentándose con la misma dieta granosa durante todo el experimento, pero a los grupos D y DE se les cambio a una dieta en polvo, para lo cual se pulverizaron los granos de la dieta convencional. Dicho cambio en la consistencia de la dieta se realizó con el objetivo de modificar el tipo de masticatoria, dicho paradigma está descrito en Aguirre-Siancas (26) y en De Siquiera Mendes et al (27).
Inducción de estrés por inmovilización
En la novena semana de vida de los ratones los grupos NE y DE fueron inducidos a estrés por inmovilización. Para lograrlo se colocó a cada animal en una caja de poliestireno transparente de 3 cm de alto, 3 cm de ancho y 8 cm de largo para restringir su movimiento pero sin privarle completamente del mismo, la caja tenía orificios en uno de sus extremos lo cual permitió la respiración del animal. La restricción se realizó en cada ratón durante 60 minutos entre las 8:00 y 12:00 horas durante todos los días que duró el experimento.
Evaluación de la respuesta al dolor
La evaluación de la respuesta al dolor se realizó mediante el paradigma de tiempo de retirada de la cola ante la exposición a un estímulo térmico. El procedimiento consistió primeramente en sujetar al ratón por la región cérvico - dorsal con los dedos índice y pulgar del operador con el objetivo de inmovilizarlo. Luego se procedió a sumergir rápidamente los dos tercios de la cola del roedor dentro de un beaker de marca Isolab® que se completó hasta un centímetro por debajo de su altura con agua temperada a 56 ºC +/- 0.5 ºC, de acuerdo al procedimiento descrito por Aguirre-Siancas et al (2).
Cada uno de los 8 ratones de cada grupo experimental fue evaluado mediante un único “ensayo” que se realizó en 2 momentos; un primer momento en el día final de la décima segunda semana de vida del animal y un segundo momento en el día final de la décima sexta semana de vida del animal entre las 08:00 y las 12:00 horas. Un “ensayo” consistió en la rápida inmersión de los dos tercios de la cola del roedor dentro del beaker con agua temperada. El ensayo concluyó cuando el animal sacudió su cola alejándola del estímulo térmico. El tiempo máximo de inmersión de la cola fue de 15 s, si hasta dicho tiempo el ratón no retiraba su cola se consideró que no manifestó respuesta. Todos los ensayos fueron filmados mediante una cámara Sony Handycam® modelo CX330®. Los videos luego fueron proyectados en una computadora Lenovo® modelo Yoga 2®, de donde se obtuvieron los tiempos de retirada de la cola para cada “ensayo” mediante un cronómetro digital, de acuerdo al procedimiento descrito por Aguirre-Siancas et al (2).
Análisis estadístico
Para el análisis estadístico se emplearon medidas de tendencia central como la media y de dispersión como la desviación estándar. Debido a que en la prueba de Shapiro wilk se encontró que los datos tuvieron una distribución normal se utilizó el análisis de varianza (ANOVA) para la comparación entre los 4 grupos experimentales y la prueba t de student para muestras relacionadas para la comparación dentro de cada grupo experimental, tanto en la semana 12 como en la semana 16 de vida de los animales. Se valió del programa SPSS® versión 23 para Windows® y se consideró un nivel de significancia de 0,05.
RESULTADOS
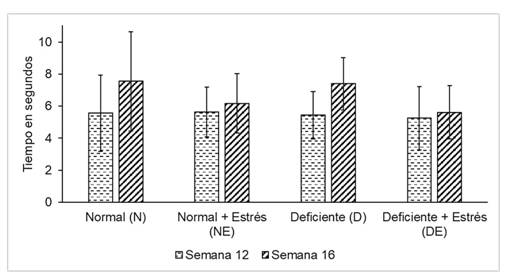
Los 32 ratones se dividieron en 4 grupos experimentales de 8 animales cada uno. Dichos grupos fueron evaluados el día final de la décima segunda y de la décima sexta semana de vida del roedor en el paradigma de tiempo de retirada de la cola ante estímulo térmico. En ambas comparaciones se aplicó la prueba de ANOVA (Tabla 1) teniendo un grado de libertad de 3 y encontrándose un valor de p > 0,05. Se obtuvo los siguientes tamaños del efecto para las comparaciones realizadas entre los grupos experimentales a la semana 12: N-NE= -0,08; N-DE= 0,31; N-D= 0,12; NE-DE= 0,39; NE-D= 0,2; DE-D= -0,19 y a la semana 16: N-NE= 1,39; N-DE= 1,94; N-D= 0,19; NE-DE= 0,55; NE-D= -1,23; DE-D= -1,78.
Tabla 1. Distribución de los resultados de la prueba del tiempo de respuesta ante el estímulo de dolor en los 2 controles realizados
| Evaluación de acuerdo a la semana de vida del animal | Grupos según tipo de masticación y estrés | Media del tiempo de retirada de la cola en segundos | DS | P |
|---|---|---|---|---|
| 12 | N NE D DE | 5,56 5,64 5,44 5,25 | 2,38 1,56 1,48 1,97 | 0,982 |
| 16 | N NE D DE | 7,55 6,16 7,39 5,61 | 3,09 1,85 1,63 1,67 | 0,176 |
Se evaluó la variación en el tiempo de retirada de la cola al comparar los tiempos encontrados en la semana 12 vs los tiempos encontrados en la semana 16 dentro de cada grupo experimental. Se aplicó la prueba t para muestras relacionadas teniendo un grado de libertad de 7. Se obtuvieron un valor de p = 0,11; p = 0,57; p = 0,13 y p = 0,83 para el grupo N, NE, D y DE respectivamente como se aprecia en la figura 1. Se encontraron los siguientes tamaños del efecto para las comparaciones hechas dentro de cada grupo experimental: N= -1,99; NE= -0,53; DE= -0,36 y D= -1,95. (Figura 1)
DISCUSIÓN
Se evaluó la respuesta ante el estímulo térmico de naturaleza nociceptiva en 32 ratones en la 12da y la 16ta semana de vida de los animales. Luego de aplicar la pueba de ANOVA no se observó diferencias entre los 4 grupos experimentales en los 2 controles realizados en sus respuestas ante el estimulo doloroso. Tampoco se encontró variación dentro de cada grupo al comparar los resultados entre los dos tiempos evaluados al emplear la prueba t para muestras relacionadas.
Okayasu et al (5) estudió el efecto de la masticación sobre la modificación del umbral doloroso. Comparó, 2 condiciones em un mismo grupo de personas. En la primera condición determinó el umbral de dolor después que los participantes masticaron goma por 5 minutos; en la segunda condición la evaluación fue después de mantener por 5 minutos la mandíbula relajada, lo cual sirvió como control. Encontraron que el umbral doloroso aumentó después de masticar goma por 5 minutos comparado con el control de forma significativa. Kamiya et al (19) estudiaron el efecto de la masticación sobre los niveles sanguíneos de serotonina y sobre el reflejo de flexión nociceptiva (RFN) por estimulación eléctrica transcutánea del nervio sural. Los participantes masticaron goma de mascar por 20 minutos. Se evaluó las variables inmediatamente después de terminar de masticar y después de 30 minutos. Se observó que los niveles de serotonina aumentaron y que disminuyó el RFN comparados con los valores basales que se tomaron antes de la masticación. Además, en dicho estudio se encontró aumento de oxigenación de la parte ventral de la corteza prefrontal durante los 20 minutos de masticación. Los hallazgos de dicha investigación son explicados por el efecto que produce la activación de las vías serotoninérgicas sobre la modulación de la respuesta dolorosa medida por el RFN (28). Sin embargo, a diferencia de estos dos reportes expuestos, en nuestro estudio no se encontró ningún efecto de la masticación sobre la disminución del estimulo doloroso. Diversos causas explicarían estas diferencias, así, en el presente estudio se empleó roedores a diferencia de los otros que estudiaron a seres humanos; en el presente estudio se analizó el estrés como una variable asociada a la masticación y tanto el estrés como la masticación fueron modificados crónicamente, en cambio en los 2 reportes descritos evaluaron unicamente el efecto de la masticacion sobre el dolor; además, en el presente estudio se empleó un estímulo térmico y el de Okayasu et al (5) y el Kamiya et al (19) un estímulo mecánico. Todas estas diferencias podrían explicar los resultados encontrados al compararlos con la presente investigación.
La sustancia gris periacueductal (PAG) se ubica alrededor del acueducto de Silvio, siendo un componente esencial para diversos circuitos neuronales como los responsables de las respuestas hacia la ansiedad y el sistema de modulación descendente de la información nociceptiva (29). La PAG desempeña un papel crucial en la regulación de la sensibilidad al dolor en situaciones de estrés induciendo analgesia (30)(31). Yamada et al (32) investigaron el efecto de la masticación bajo la inmovilización por estrés sobre la PAG en ratas. Evaluaron la concentración de la quinasa regulada por señal extracelular forforilada (pERK) como marcador de respuesta neuronal. Encontraron aumento de pERK en los roedores bajo estrés, preferentemente en las subdivisiones dorsolateral y ventromedial de la PAG; pero dicho incremento no fue encontrado en los roedores a quienes se les permitió masticar una varilla de madera mientras eran sometidos a estrés. Además, Onuki et al (32) estudiaron el efecto de la masticación y el estrés agudo por inmovilización sobre la expresión de pERK en la corteza insular, la cual es un centro de integración sensorial donde se procesa el gusto, el olfato, la visión, el tacto, la audición y el dolor (33)(34). Los investigadores encontraron que la masticación disminuyó la expresión de pERK en la corteza insular al comparar un grupo de ratas sometidas a estrés agudo y que masticó durante la inmovilización con aquellas a las que sólo se le sometió a estrés. La disminución fue más marcada sobre la corteza insular anterior que se relaciona con el procesamiento emocional, estando el dolor relacionado con dicho procesamiento. En nuestro estudio no evaluamos el estrés ni la masticación con ninguna prueba inmunohistoquímica, el indicador fue una prueba comportamental ante el dolor donde no encontramos diferencia entre los grupos de masticación con y sin estrés crónico. Probablemente el empleo de indicadores más sensibles nos hubiera dado un hallazgo diferente. Ello debido a que, a pesar de que la diferencia no fue significativa, el comportamiento antinociceptivo fue mejor en los grupos N y D, observándose una tendencia al aumento del umbral de dolor como se apreció en la figura 1, a diferencia de los grupos NE y DE.
Si bien es cierto se planteó como hipótesis que la masticación disminuiría el efecto del estrés crónico sobre la percepción del dolor, dicha hipótesis no fue confirmada por los resultados de la prueba comportamental emplea, siendo justamente el empleo de esta única prueba una de las limitaciones del estudio. Sin embargo, ciertas tendencias sobre el efecto benéfico de la función masticatoria sobre el dolor deberían ser profundizadas en próximos diseños experimentales. Para hacer más completos dichos trabajos se deberían emplear, aparte de pruebas comportamentales, indicadores séricos e inmuhistoquímicas para evaluar expresión génica de mensajeros celulares, de receptores, entre otras moléculas implicadas en la masticación, estrés y dolor. Resaltando que tanto el estrés como el dolor son dos procesos fisiológicos y fisiopatológicos que acompañan día a día al ser humano, y la masticación emerge como un mecanismo fisiológico periférico que los modularía.
CONCLUSIÓN
Se encontró que el tipo de masticación no influye sobre el estrés crónico en la modificación de la respuesta ante un estímulo térmico nociceptivo, ni en la semana décima segunda ni en la semana décima sexta de vida de los ratones de la cepa Balb/c evaluados. Por otra parte, de acuerdo a las tendencias encontradas en la presente investigación sería recomendable emplear indicadores más sensibles, como pruebas inmunohistoquímicas, en la evaluación de las variables estudiadas.