Introducción
El diagnóstico en medicina tiene su piedra angular en la obtención de la historia clínica y la exploración física; sin embargo, en la mayor parte de las patologías el uso de pruebas diagnósticas es de gran utilidad como apoyo para confirmar o descartar la presencia de enfermedad. Las pruebas diagnósticas incluyen una amplia variedad de procedimientos y dentro de estas se incluyen las pruebas terapéuticas, también llamadas desafíos o retos, en los que se administra una sustancia activa para evaluar la respuesta y apoyar la impresión diagnóstica.
En el caso de los parkinsonismos, particularmente en la Enfermedad de Parkinson (EP), así como en las distonías (aquellas denominadas como respondedoras a levodopa), la prueba con medicamentos de reemplazo dopaminérgico se considera una herramienta de “apoyo diagnóstico”. Se debe resaltar que el cuadro clínico es el principal determinante en el diagnóstico de dichas patologías. La prueba con levodopa también puede ser de cierta utilidad en el abordaje diagnóstico de las distonías. En otros trastornos del movimiento, como temblor y algunas distonías la prueba de etanol puede ser utilizada con fines de apoyo diagnóstico en la identificación de patologías con sensibilidad al etanol.
Pruebas con medicamentos dopaminérgicos
El tratamiento con mayor efectividad para el control los síntomas motores de la EP continúa siendo la levodopa. Las personas con EP habitualmente responden de manera dramática a la levodopa y en menor grado a los agonistas dopaminérgicos. No obstante, algunos pacientes con parkinsonismos, tales como la atrofia de múltiples sistemas, responden, pero de manera más discreta y parcial a este tratamiento.
Las pruebas terapéuticas con medicamentos dopaminérgicos se utilizan con relativa frecuencia con fines diagnósticos, pero también forman parte de los protocolos de cirugía funcional para personas con EP. Dependiendo del medicamento utilizado es posible estimular mecanismos presinápticos, sinápticos o bien postsinápticos. En el caso de las pruebas que utilizan levodopa, se evalúan mecanismos pre y postsinápticos, mientras que con el uso de la apomorfina se evalúa los receptores dopaminérgicos postsinápticos.
En general, las pruebas con agonistas dopaminérgicos permiten: 1) evaluar la respuesta clínica al tratamiento incluyendo latencia (tiempo de inicio del efecto), duración, magnitud de la respuesta y desarrollo de discinesias, y 2) apoyar el diagnóstico de EP.
En los criterios clínicos para el diagnóstico de la EP de la Sociedad Internacional de Parkinson y Trastornos del Movimiento (IPMDS) se considera como criterio de apoyo para el diagnóstico, que se documente la respuesta clara y beneficiosa de la terapia dopaminérgica (1). Por otra parte, existe un grupo heterogéneo de distonías denominadas como respondedoras a levodopa las cuales se caracterizan por deficiencia de enzimas involucradas en la biosíntesis de dopamina y que responden (mejoría de los síntomas) en diferentes grados a la administración de levodopa.
Las pruebas de desafío con un fármaco dopaminérgico, utilizadas para evaluar la capacidad de respuesta dopaminérgica, incluyen el desafío agudo con levodopa, el desafío crónico con levodopa y el desafío agudo con apomorfina.
Prueba aguda con levodopa
La levodopa es el fármaco cardinal para el tratamiento de la Enfermedad de Parkinson (EP) y algunas distonías respondedoras a levodopa con parkinsonismo; tras 40 años de iniciar su uso por vía oral, continúa siendo el fármaco más efectivo para este trastorno neurológico. Es un aminoácido precursor del neurotransmisor dopamina y posee propiedades farmacocinéticas y farmacodinámicas únicas. Su vida media plasmática es corta, de alrededor de 90 minutos (2); por ello, todas las formulaciones de levodopa están formuladas con inhibidores de la descarboxilasa de aminoácidos aromáticos (carbidopa o benzeracida) para prevenir el metabolismo de la levodopa en el tracto gastrointestinal y la circulación sistémica. Se ha documentado a través de estudios con tomografía por emisión de positrones que una dieta alta en proteínas puede competir con la captación de dopamina cerebral, lo cual resulta en la disminución del efecto del fármaco (3).
Indicaciones para la prueba aguda con levodopa
El reto con levodopa fue diseñado para estimular en forma aguda a los receptores centrales dopaminérgicos y es usualmente realizado en la práctica clínica, así como en la investigación clínica (protocolos quirúrgicos, administración combinada de fármacos, estudios del comportamiento y de la función autonómica). Además, también permite analizar la latencia, magnitud y duración de la respuesta a levodopa, y caracterización de las discinesias en los pacientes con EP; así como valorar qué tan conveniente es indicar tratamiento con levodopa en parkinsonismos y distonía (4).
La prueba aguda o reto con levodopa es una herramienta útil para obviar el uso innecesario de tratamiento con levodopa a largo plazo. Finalmente, la prueba aguda de levodopa también es parte del protocolo de evaluación prequirúrgica en pacientes candidatos a estimulación cerebral profunda (ECP). La correlación entre la respuesta a la prueba aguda y el desenlace con ECP, sugieren que los resultados pueden predecir un diagnóstico de Enfermedad de Parkinson, más que un parkinsonismo no relacionado con EP (5). En general se considera a esta prueba como económica, fácil de realizar y universalmente accesible.
Procedimiento para la prueba aguda con levodopa
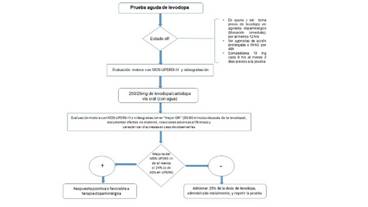
La prueba es realizada generalmente con el paciente en estado “OFF”. Habitualmente se recomiendan al menos 12 horas sin administración de fármacos dopaminérgicos de liberación inmediata o entacapone previo a la realización de la prueba, para evaluar la respuesta motora a la administración de levodopa de forma adecuada (4). En el caso de pacientes en tratamiento con agonistas dopaminérgicos de liberación prolongada, levodopa de liberación prolongada o controlada, e inhibidores de la monoaminoxidasa (selegilina o rasagilina) se sugiere no administrarlos 48 horas previas a la realización de la prueba (6). Es importante considerar la definición práctica del estado “OFF” como un estado no funcional debido a la pérdida temporal del efecto dopaminérgico consecuencia del retiro de fármacos antiparkinsonianos al menos en las últimas 12 horas, y no encontrarse dentro de la primera de hora de haber despertado (beneficio del sueño) (7) (Figura 1).
Existe la posibilidad de que el tratamiento antiparkinsónico no pueda ser suspendido por los periodos antes mencionados a juicio del neurólogo (“OFF” severo e incapacitante), en esta situación es recomendable la suspensión por el mayor tiempo posible sin someter al paciente a un riesgo o deterioro clínico importante.
Ocasionalmente puede realizarse en un estado de “ON” parcial, para evaluar discinesias difásicas o de pico de dosis y un típico estado “ON” (beneficio terapéutico máximo) (4).
Habitualmente se realiza en la mañana y con una formulación regular (no liberación prolongada o controlada) de levodopa con un inhibidor de la descarboxilasa por vía oral. En pacientes sin uso previo de levodopa o “drug-naive”, la dosis recomendada es de 250 mg (con carbidopa o benzeracida) (4). En pacientes con uso crónico de levodopa pueden requerirse dosis mayores, para realizar la prueba aguda, siendo la dosis recomendada un 50% más de la dosis matutina habitual del paciente (8). Algunos autores recomiendan el uso de una dosis de 300/75mg de levodopa/benzeracida, en pacientes que son probables candidatos a ECP (5). En el caso de pacientes que reciben ya tratamiento con agonistas dopaminérgicos o inhibidores de la monoaminoxidasa, únicamente, algunos autores sugieren calcular la dosis equivalente de levodopa para determinar la cantidad de levodopa a utilizar en la prueba (9). Fabbri y colaboradores administran la dosis equivalente de levodopa de la primera toma matutina del paciente más un 50% de dicha dosis (dosis supra-máxima del 150%) (6). Cilia y colaboradores utilizaron una dosis de levodopa de 3 mg/kg de peso en pacientes con parkinsonismo avanzado que no habían recibido levodopa previamente (10).
Un caso particular en el cual también se utiliza la prueba aguda de levodopa es en los pacientes ya bajo tratamiento con estimulación cerebral profunda. En esta situación es frecuente que se requiera al paciente en “OFF”, tanto de medicamentos como de estimulación, por lo que se recomienda apagar el neuroestimulador al menos una hora antes de la realización de la prueba (6). El protocolo del estudio EARLY-STIM consideró el “OFF estimulación” tras dos horas de apagado el neuroestimulador y el “ON estimulación” tras 30 minutos de encendido. La secuencia utilizada fue “ON estimulación/OFF medicamento”, “OFF estimulación/OFF medicamento”, “OFF estimulación/ON medicamento” y “ON estimulación/ON medicamento” (11).
El uso concomitante de domperidona (10 mg vía oral tres veces al día/intervalo de 8 horas) es usualmente requerido para evitar los efectos periféricos de la levodopa como náusea, vómito, hipotensión, confusión, somnolencia, astenia, cefalea y otros menos comunes como sudoración, visión borrosa, alucinaciones visuales y ansiedad. Debe indicarse por lo menos dos días previos a la prueba principalmente en aquellos pacientes que nunca han recibido el fármaco (12). Se debe destacar que se ha observado que estos efectos adversos asociados a levodopa son más frecuentes en los parkinsonismos atípicos, en comparación con la EP (62.1% versus 23.5%), siendo la atrofia de múltiples sistemas la que más se asocia a éstos (13). Se recomienda interrogar los antecedentes cardiacos antes de iniciar el fármaco como medida de precaución (14).
La evaluación clínica de esta prueba deberá realizarse por personal con experiencia e idealmente con videograbación para posteriormente corroborar el resultado del examen. La condición motora puede ser evaluada mediante escalas clínicas validadas, como la escala motora de la Escala Unificada de la Enfermedad de Parkinson (UPDRS-III) o más recientemente con la escala modificada por la IPMDS o MDS-UPDRS (15). Se sugiere evaluar también los efectos no motores, así como reacciones adversas al fármaco (4).
El paciente debe ser evaluado en su estado OFF o idealmente en su “peor OFF” (estado en el cual el paciente y el neurólogo acuerdan se alcanzó la mayor severidad de los síntomas). La levodopa se debe administrar en ayuno para evitar alteraciones en la absorción, el protocolo del CAPIT sugiere ayuno desde la medianoche previa al día de la prueba (16). El medicamento debe administrarse con agua, preferiblemente carbonatada para facilitar su absorción, y no se debe permitir la ingesta de alimentos o líquidos distintos a agua o té (sin crema, leche o azúcar) sino hasta concluir la prueba (17).
El tiempo para comenzar a evaluar al paciente posterior a la toma de levodopa es variable sin embargo es útil considerar la farmacocinética de la levodopa. El inicio de los efectos motores puede variar de 30 hasta 90 minutos, dependiendo de las condiciones de cada paciente (motilidad gástrica, tiempo de evolución de la enfermedad). Se recomienda que la evaluación final se realice cuando se alcance el “mejor ON” (estado en el cual el paciente y el neurólogo acuerdan se alcanzó la máxima mejoría de los síntomas). En caso de duda sobre si se alcanzó o no el mejor ON se recomienda repetir la evaluación motora en intervalos de 15 a 30 minutos.
No existe una definición completamente satisfactoria en cuanto a una respuesta positiva a la levodopa; sin embargo, se considera como clínicamente favorable una mejoría en el UPDRS-III de al menos el 30% respecto a su valor basal. Dicho umbral se fijó debido a que se ha demostrado que un mejoría entre 20% al 30% en el UPDRS con la prueba aguda de levodopa, se asocia con una respuesta sostenida a la misma de forma crónica (18). Merello y colaboradores correlacionaron el porcentaje de mejoría del 30% en el UPDRS con el MDS-UPDRS, concluyendo que la equivalencia es de un 24% en MDS-UPDRS (19).
Finalmente, existe la posibilidad de una falla de dosis, es decir ausencia parcial o total de la dosis administrada. Algunos autores utilizan una dosis “extra” de levodopa/carbidopa de 100/25mg en caso de no se alcanzar el mejor ON al cabo de 45 minutos (8); otra alternativa a considerarse es adicionar 25% de la dosis administrada inicialmente. Otros autores consideran la prueba negativa en caso de no alcanzarse la mejoría esperada al término de 120 minutos de iniciada la prueba (19).
Utilidad de la prueba aguda con levodopa
La prueba aguda con levodopa se considera más un marcador de respuesta a terapia de reemplazo dopaminérgico, que un indicador para del proceso patológico subyacente (4). Como ya se ha mencionado, algunos parkinsonismos atípicos pueden responder a terapia con levodopa sólo en etapas iniciales. Una revisión sistemática determinó que el valor diagnóstico de la prueba de levodopa y apomorfina es comparable con la terapia crónica en la diferenciación entre EP y otros tipos de parkinsonismo (20). Merello y colaboradores reportaron una especificidad del 70.9% y especificidad del 81.5% (VPP del 88.6%) de la prueba aguda de levodopa para predecir EP utilizando un punto de corte del 30% (21).
Rossi y colaboradores reportaron que una mejoría de al menos 16% en la prueba aguda de levodopa se asocia con una alta probabilidad de diagnóstico de EP (sensibilidad de 71.1% y especificidad de 71.7%) en comparación a otros parkinsonismos (22). En contraparte, Schade y colaboradores reportaron que un punto de corte de mejoría del 33% en UPDRS-III, como una prueba aguda de levodopa positiva, posee una sensibilidad del 70% y una especificidad del 71% como prueba diagnóstica de soporte en pacientes con EP de novo (23).
En la actualidad el diagnóstico de EP continúa basándose en el cuadro clínico, respuesta crónica a terapia dopaminérgica y el seguimiento clínico a largo plazo. En casos con incertidumbre diagnóstica se pueden requerir dos o más pruebas agudas de levodopa a lo largo del tiempo, en este caso es esencial utilizar el mismo protocolo en todas las ocasiones.
Prueba crónica con levodopa
Una variante de la prueba de levodopa es realizarla de forma crónica. No existe una definición completamente satisfactoria para la prueba crónica de levodopa positiva, sin embargo se ha sugerido que una mejoría motora de al menos el 20% comparado con el estado motor basal, pudiera ser considerado como clínicamente relevante; o bien, una respuesta satisfactoria de duración prolongada a la levodopa definida como una mejoría en la discapacidad (antes de la primer toma de levodopa en la mañana) de al menos el 50% de la máxima mejoría observada en la respuesta de corta duración, durante una prueba aguda con levodopa (4). Es importante considerar que una respuesta crónica positiva no puede ser descartada sino hasta alcanzar al menos una dosis de 800 mg de levodopa (dosis total) vía oral divididos en 3 a 4 tomas al día por al menos tres meses. Excepcionalmente se utilizan dosis por arriba de 1200mg o se utiliza un tiempo de observación más allá de 6 meses.
Al igual que en el caso de la prueba aguda, una respuesta inadecuada no indica necesariamente falta de respuesta sino no se han descartado alteraciones en la absorción del medicamento o dosis subóptimas.
En comparación con el parkinsonismo, existe una menor cantidad de información sobre la prueba de levodopa en el contexto de pacientes con probable distonía respondedora a levodopa. Wijemanne y Jankovic sugieren el uso de la prueba crónica de levodopa en todos los niños e infantes con distonía con la finalidad de identificar aquellas respondedoras al medicamento. En menores de 6 años de edad se recomienda una dosis diaria de levodopa de 1 a 10 mg/kg de peso administrada en múltiples tomas. En mayores de 6 años de edad y adolescentes recomiendan una dosis de 50 mg de levodopa de una a tres veces al día durante una semana; posteriormente aumentar la dosis a 50 mg tres veces al día otra semana, e incrementar hasta 200 mg de levodopa cada 8 horas. En caso de no observar una respuesta favorable tras un mes se debe suspender la levodopa y considerar que la distonía no es respondedora (24); otros autores consideran que el tiempo sugerido deber ser como máximo tres meses (25). No obstante, debe considerarse que existe una gran variabilidad entre individuos y que se han reportado dosis para la prueba que oscilan entre 0.5 y 20 mg/kg/d; por lo que algunos autores sugieren evitar su uso, más aún ante la posibilidad de utilizar otros métodos diagnósticos como DaT-SPECT, análisis metabólico de la vía y análisis genético (26). Así mismo, es importante enfatizar que una prueba con levodopa sub-óptima o ambigua en su respuesta no necesariamente descarta una distonía respondedora y puede ser necesario llevar a cabo una prueba de carga con fenilalanina o como se mencionó antes realizar pruebas genéticas o bioquímicas.
Prueba aguda con apomorfina
La apomorfina es un derivado no narcótico de la morfina, que actúa como un potente agonista dopaminérgico sobre receptores D1, D2, D3, D4. Se absorbe rápidamente, en 15-20 minutos, después de la aplicación subcutánea con una biodisponibilidad del 100%. Su vida media es de 30 a 60 minutos. La biodisponibilidad del medicamento tras la administración oral es extremadamente baja ya que tiene un metabolismo de primer paso (27).
La apomorfina se encuentra disponible en tres presentaciones para su uso clínico. 1) Jeringas prellenada con apomorfina 5mg/ml (10 ml, 50 mg de apomorfina), 2) Ámpulas de apomorfina de 10mg/ml, 2ml o 5ml, y 3) Pluma pre llenada de apomorfina 10mg/ml (3ml) (28).
Para preparar la apomorfina para su aplicación, es necesario diluirla en solución salina. Se debe cargar en una jeringa de 20cc el ámpula del medicamento y aforar la jeringa con solución salina al 0.9% para obtener 20 ml en total. Ejemplo, si vamos a utilizar un ámpula de 5mg/ml (con 10 ml), tendríamos que aforar la jeringa con 10 ml de solución salina, quedando, entonces, en la jeringa una preparación 50 mg en 20 ml.
Indicaciones para la prueba con apomorfina
Las indicaciones de la prueba con apomorfina incluyen: 1) Evaluar la respuesta clínica del paciente ante el fármaco y la tolerancia al mismo, con la finalidad de iniciar tratamiento con apomorfina subcutánea en bomba de infusión o rescates con pluma de apomorfina, 2) Caracterizar la respuesta de los pacientes al fármaco, latencia, duración, magnitud de la respuesta, 3)Evaluar la respuesta clínica de los pacientes al fármaco, y con ello dar expectativas realistas de la mejoría clínica con ECP, y 4) Apoyo al diagnóstico de enfermedad de Parkinson (4).
Procedimiento de la prueba con apomorfina
La prueba con apomorfina se inicia con la premedicación del paciente 48 horas antes. Esto se lleva a cabo con antidopaminérgicos, como domperidona por vía oral 10 mg/2-3 veces al día, para evitar efectos como náusea y vómito. Se debe considerar que este medicamento tiene riesgo de efectos adversos cardiacos como prolongación del QT, por lo que se deberá de ser cauteloso con su uso en dosis mayores de 30 mg/día; y realizar un electrocardiograma y toma de signos vitales previo a iniciar el medicamento. En caso de contraindicación para el uso de domperidona, se ha sugerido la utilización de ondansetrón o bien trimetrobenzamida (29).
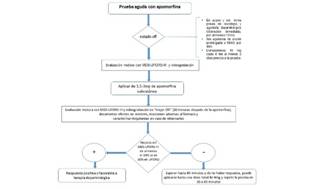
En caso de que el paciente ya se encuentre recibiendo tratamiento de reemplazo dopaminérgico es importante la suspensión de estos de manera paulatina, de tal forma que el paciente tenga al menos 12 horas libre de medicamentos agonistas dopaminérgicos esto con la finalidad de evaluar al paciente en estado de OFF de manera similar a lo recomendado para la prueba con levodopa. Se realiza la evaluación clínica del paciente mediante la parte motora del MDS-UPDRS III y se obtiene el puntaje total, previo al inicio de la prueba.
La prueba se lleva a cabo con la administración de apomorfina en inyección subcutánea, se puede aplicar en los brazos, pared abdominal, parte lateral de los muslos. Con cualquiera de los siguientes esquemas sugeridos:
1) Aplicar una única inyección de 3 mg (50µg/kg), 30 minutos después, evaluar al paciente de manera clínica con la escala MDS-UPDRS III y comparar este puntaje con el previo en estado de OFF.
2) Comenzar con una inyección de 1.5 mg (25µg/kg), 30 minutos después evaluar al paciente de manera clínica con la escala MDS-UPDRS III y comparar este puntaje con el previo en estado de OFF, si el resultado no fuera satisfactorio, o fuera parcial y el paciente no hubiera presentado efectos adversos tales como náuseas, vómito o hipotensión ortostática, repetir dosis 1.5-3 mg cada 30 minutos, hasta 9 mg (4).
3) Bolo inicial de 1mg, evaluar al paciente con la escala MDS-UPDRS III, en intervalos de 15 minutos, si la respuesta no fuera satisfactoria administrar bolos de 2 mg, por 3 dosis; si aun así la respuesta no fuera satisfactoria entonces administrar 3 mg en bolo (30).
4) Administrar un bolo inicial de 1mg, evaluar con la escala de MDS-UPDRS III, en intervalos de 45-60 minutos, si no hubiera respuesta satisfactoria, incrementar dosis de bolos 2 mg (1-2-4-6-8-10 mg) (31) (Figura 2).
Durante la prueba es necesaria la vigilancia del paciente, por lo que se sugiere que realice en un medio hospitalario. Se debe monitorizar la presión arterial sistémica cada 30 minutos, así como otros efectos adversos tales como náusea y vómito. Es muy frecuente que los pacientes durante esta prueba bostecen y tengan somnolencia.
El éxito de esta prueba, o bien el cambio significativo en el puntaje de la escala motora utilizada se realiza de la misma forma que en la prueba aguda con levodopa.
Contraindicaciones para la prueba con apomorfina
Las contraindicaciones incluyen hipotensión ortostática documentada, presencia de alucinaciones o psicosis, depresión respiratoria. En estudios que han comparado la prueba de dopaminérgica con levodopa y apomorfina, no han encontrado superioridad de una de ellas. Ambas pueden ser útiles en la evaluación; sin embargo, se debe destacar que aunque la magnitud de la respuesta clínica es similar, la latencia y duración de los efectos dopaminérgicos no son iguales entre ambos medicamentos (32).
Utilidad de la prueba aguda con apomorfina
El estudio de Rossi y cols ya mencionado previamente comparó la precisión de la prueba con levodopa/carbidopa (250/25 mg) y con apomorfina (1.5, 3 y 4.5 mg) en pacientes con diagnóstico de clínica de EP o de parkinsonismo sin encontrar superioridad de una sobre la otra. Por lo anterior, se considera una opción en pacientes en los que la prueba con levodopa es inviable (pobre absorción o intolerancia) o bien como evaluación para considerar el uso de apomorfina en infusión continua subcutánea. Se ha sugerido el uso de la prueba con levodopa como primera opción y la de apomorfina como segunda (33). Adicionalmente se ha documentado que el uso previo de levodopa crónica no altera la respuesta a la prueba con apomorfina (34).
Prueba de alcohol
El alcohol etílico o etanol es un líquido claro, incoloro, inflamable, de olor característico e hidrosoluble obtenido a través de la fermentación anaerobia de los hidratos de carbono. La absorción tiene lugar particularmente en el intestino delgado. El ritmo de absorción se acelera proporcionalmente al aumento de la concentración alcohol ingerido, hasta un máximo del 40%, a partir del cual aparece un retardo en el vaciamiento gástrico con la consecuente lentificación de la absorción, efecto que también aparece en la ingestión de alcohol acompañado de alimentos. La cinética de desaparición plasmática del etanol es de 7 g/hr (35). El etanol es un fármaco depresor no selectivo del sistema nervioso central. Adicionalmente, el etanol funciona como estabilizador de membrana, disolviéndose en un componente lipoideo, inhibe el transporte activo de sodio, potasio, aminoácidos y catecolaminas. Al igual que otros depresores no selectivos del sistema nervioso central como barbitúricos y la fenitoína, el etanol potencia los efectos inhibitorios del ácido gamma aminobutírico (GABA) e inhibe al receptor NMDA de aspartatoglutamato y reduce por lo tanto la actividad glutamatérgica (36).
La sensibilidad al etanol en los pacientes con temblor esencial (TE) no se encuentra claramente definida. En modelos animales de ratón deficiente para la subunidad alfa-1 del receptor GABA (localizados en el cerebelo) se ha demostrado que el temblor es sensible al alcohol (37). Pedrosa y cols demostraron, mediante imagen de resonancia magnética y electroencefalografía de alta densidad, que la reducción en la amplitud del temblor corresponde con cambios en la modulación cerebelosa (38). Boecker y cols a través de un estudio con tomografía de emisión de positrones demostraron que la sensibilidad al alcohol en el TE se caracteriza por una reducción en la sobreactividad sináptica a nivel del circuito olivocerebeloso (39).
Por otra parte, se ha reportado que el etanol aminora los síntomas en los pacientes con otros trastornos del movimiento diferentes al TE como distonía mioclónica (40), temblor de tarea específica, distonías focales (41) y de tarea específica (42), mioclonías asociadas a epilepsia mioclónica, mioclonías de acción post-anóxico y tics (43).
Por su prevalencia resulta de interés el caso de la distonía. Un estudio reciente en 1,258 pacientes con distonía reportó que un 29.3% de los mismos, consideran que el consumo de alcohol mejora sus síntomas (44). Este mismo estudio reportó como predictores de respuesta al etanol el poseer una historia familiar de trastornos del movimiento, una distonía generalizada y un inicio temprano de la enfermedad. El mecanismo de acción sugerido es al igual que en el caso del TE la interacción del etanol en la neurotransmisión GABAérgica.
Indicaciones para la prueba con etanol
La prueba con etanol es menos utilizada en la práctica clínica, siendo su uso más frecuente en temblor y en algunos tipos de distonía. Es bien conocido que el etanol posee un efecto benéfico en pacientes con TE (45), por lo que se ha sugerido que pueda ser utilizado como prueba clínica en la evaluación y predicción de respuesta a tratamiento con propranolol (46). En algunos casos con duda diagnóstica, la prueba con etanol permite diferenciar a pacientes con TE de aquellos con temblor parkinsoniano.
Procedimiento de la prueba con etanol
La dosis de alcohol fue adaptada para cada paciente según peso y sexo de tal forma que se obtuviera una concentración de alcohol en sangre de 0.8% de acuerdo con la fórmula de Widmark. La fórmula de Widmark es utilizada en medicina legal para estimar la concentración de alcohol en sangre (BAC) a partir de la cantidad de etanol ingerido y viceversa (47). El porcentaje de etanol varia entre las diferentes bebidas alcohólicas de un 4 a 15% para bebidas fermentadas hasta un 40% o más para bebidas destiladas (43).
La prueba con etanol se realiza al medio día (12:00 a 13:00) con la administración del etanol a una dosis individualizada para alcanzar una concentración de 0.8%. El desayuno es completo de en horario y forma habitual, y se debe evitar ingesta de alimentos posteriormente y hasta concluir la prueba. En caso de que el paciente se encuentre en tratamiento con algún medicamento supresor de temblor este debe suspenderse por al menos 48 a 72 horas previo a la prueba. Se debe pedir al paciente que tomé la cantidad de etanol indicada en el menor tiempo posible (5 a 10 minutos aproximadamente) (48). Si el paciente solicita que se diluya el etanol es posible realizarlo con agua o alguna bebida sin azúcar y sin cafeína (49).
con la primera evaluación a los 5-10 minutos de iniciada la prueba. Posteriormente se continúa evaluando al paciente en intervalos aproximados de 10 minutos hasta los 90 minutos. En caso de que el paciente se encuentre hospitalizado para la prueba es recomendable evaluar nuevamente durante la noche y en la mañana del día siguiente. Los instrumentos utilizados en la evaluación de forma más frecuente son la escala modificada de Fahn-Tolosa-Marin (50) y los espirales de Arquímedes (51).
En el caso del temblor se ha establecido que la administración de etanol mejora la intensidad del temblor en un 50% a70%, así como reducción en la amplitud (52), pero no tanto de la frecuencia de este (53). Por otra parte, se ha reportado que tras la administración de etanol el nivel sérico más alto se observa a los 40 minutos, mientras que la latencia de la mejoría máxima después de la ingesta oral es de alrededor de 60 minutos (46). Es importante mencionar que se ha reportado un efecto de "rebote" en la prueba de etanol, caracterizado por un aumento en la amplitud del temblor varias horas después de la ingesta de alcohol o incluso experimentada en la mañana siguiente (48).
Utilidad de la prueba con etanol
Hopfner y cols. reportaron que al menos el 46% de los pacientes con TE presentan sensibilidad al etanol y que la diferencia mínima detectable en la puntuación del espiral es de 2, pero que solo es aparente en paciente cuya puntuación inicial es mayor o igual a 3 (54). Otro estudio en el cual se aplicó un cuestionario para diferenciar entre TE y temblor por EP reportó que la pregunta sobre si el temblor mejora con el consumo de alcohol carece de utilidad (36% versus 16.7%, respectivamente) (55). Esta cifra es similar a lo reportado por Lang y cols. en 1982 en un estudio de 125 pacientes con EP de los cuales el 16% mencionó una mejoría discreta con el consumo de alcohol (56). El consenso más reciente de la IPMDS considera que la sensibilidad al etanol no es suficientemente consistente como para ser incluido en la definición de TE (57). Con base en lo anterior no hay evidencia suficiente para el uso de la prueba de etanol en pacientes con sospecha de TE. En el caso de la distonía la principal utilidad es la detección de la distonía mioclónica, sin embargo, en la actualidad la sospecha clínica y la comprobación genética hacen prescindible la prueba.
Discusión.
La prueba aguda de levodopa es económica, confiable, disponible fácilmente y, con las precauciones suficientes, bien tolerada. Es útil para evaluar la respuesta a terapia dopaminérgica en parkinsonismo y distonía. Actualmente se considera como un criterio de soporte para el diagnóstico de EP; el cual como se mencionó anteriormente es principalmente clínico. Se realiza también para evaluar la respuesta a tratamiento dopaminérgico en los parkinsonismos y distonías.
Otro escenario en el cual la prueba aguda con levodopa es de gran utilidad es en la valoración para selección de candidatos con EP ideales para ECP. Recientemente se ha demostrado una moderada correlación entre la tasa de captación en el DAT-SPECT y la mejoría en la puntuación del UPDRS motor en pacientes evaluados para ECP (58). No obstante, las ventajas de la prueba de levodopa son un menor costo y la posibilidad de que el paciente perciba la mejoría dando expectativas reales a la respuesta al procedimiento.
La prueba aguda con apomorfina tiene indicaciones similares en pacientes con parkinsonismo, es decir apoyo en el diagnóstico y evaluar respuesta clínica dentro del protocolo de ECP. Es una alternativa a la levodopa cuando exista la sospecha de pobre respuesta a la levodopa oral por problemas en la absorción gastrointestinal de la misma (59). También la prueba con apomorfina permite evaluar la tolerancia este fármaco, previo a considerar el tratamiento con apomorfina subcutánea en bomba de infusión o rescates con pluma de apomorfina. Las pruebas agudas con apomorfina y levodopa son muy similares en cuanto a la sensibilidad y especificidad y no son superiores a la prueba crónica con levodopa. En cuanto a su utilidad para predecir la respuesta crónica sostenida, la prueba con levodopa es discretamente superior a la de apomorfina (exactitud de 80% versus 67%, respectivamente) (60).
La prueba crónica con levodopa tiene un papel más relevante en el caso de las distonías respondedoras a levodopa. Se ha reportado un retraso en el diagnóstico de esta patología de hasta 13 años (61), por lo que la realización de la prueba puede tener un gran impacto en la calidad de vida. Si bien es cierto que con el advenimiento del DAT-SPECT (62), paneles de diagnóstico bioquímico de metabolitos de monoaminas (63) y secuenciación de genoma completo (64) la prueba con levodopa con fines diagnósticos pudiera parecer obsoleta, la falta de acceso ya sea por disponibilidad o costo en algunos países justifican su utilización. Es importante que una respuesta parcial o incompleta puede observarse en algunas de estas distonías como es el caso de la deficiencia de sepiapterina reductasa o de la deficiencia de tirosina hidroxilasa. En este grupo de pacientes también pudiera ser necesario realizar una prueba de carga con fenilalanina de acuerdo con protocolos establecidos en niños (65). La identificación precisa permite reconocer la necesidad de tratamiento complementario con 5-hidroxitriptofano o tetrahidrobiopterina según se requiera (66).
En el caso de la prueba con etanol su uso parece estar restringido al ámbito de la investigación donde actualmente se llevan a cabo ensayos clínicos con octanol en pacientes con TE (67) o bien en estudios de neuroimagen con la finalidad de profundizar en la fisiopatología de esta entidad nosológica. Lo mismo sucede para los pacientes con distonía donde la prueba de etanol permite identificar a candidatos para ensayos clínicos como en el caso del oxibato de sodio, un precursor del GABA (68).
En todo caso, es importante realizar la prueba terapéutica de forma estandarizada. Como se menciona en el presente texto existen diversas formas de llevar a cabo la prueba, diferentes tiempos de evaluación clínica y distintas formas de considerar exitosa o no la prueba. Independientemente del protocolo de prueba elegido se recomienda permanecer con el mismo para evaluaciones posteriores y regístralo por escrito incluyendo variables como tiempo de suspensión de otros medicamentos, dosis administrada, tiempo transcurrido al mejor ON, efectos adversos como discinesias, puntuación inicial y final en la escala motora utilizada y de ser posible la puntuación de cada uno de los ítems o al menos de aquellos que responden de forma mas acentuada al medicamento utilizado.