Introducción
En el transcurso del desarrollo embrionario, los circuitos neuronales deben alcanzar un nivel preciso de excitabilidad. Esto es un logro admirable si consideramos los enormes retos a los que dichos circuitos se enfrentan, ya que el sistema nervioso (SN) se desarrolla en medio de constantes cambios en el número, la anatomía, la localización y las propiedades de las neuronas que lo constituyen y de la conectividad que establecen entre sí. Sin embargo, en algunas ocasiones puede ocurrir que dicho nivel adecuado de excitabilidad no se alcance o bien se sobrepase y dando origen a convulsiones y otras manifestaciones de hiperexcitabilidad anormal en el recién nacido. En particular, la incidencia de convulsiones es particularmente alta en los recién nacidos y su presencia podría indicar disfunciones neurológicas que pueden derivar en discapacidades motoras o cognitivas(1)(2). De ahí la enorme importancia que tiene el estudiar los procesos embrionarios que contribuyen a establecer las propiedades funcionales de las sinápsis en el SN en desarrollo. En este artículo de revisión, los autores detallan diferentes aspectos de los mecanismos moleculares de plasticidad sináptica homeostática que modulan la maduración de las sinápsis durante el desarrollo y su relación con la actividad embrionaria espontánea. Con nuestra experiencia de más de una década en el campo de estudio con diversas publicaciones en el dicho área de conocimiento, discutimos nuestras aportaciones así como detallamos un total de 34 referencias bibliográficas en revistas internacionales de alto impacto que a nuestro juicio son fundamentales para definir el estado del arte de la relación entre plasticidad sináptica homeostática y la actividad embrionaria espontánea, accesibles todas ellas a través de bases de datos reconocidas como PubMed o Scopus.
Conexiones sinápticas
Por su modo de funcionamiento las sinapsis son de dos tipos: eléctricas y químicas. En las sinapsis eléctricas las señales nerviosas se transmiten directamente mediante la transferencia de carga eléctrica de una neurona a la otra a través de los pequeños poros de las uniones en hendidura (gap-junctions); en estas sinapsis la transmisión es instantánea y en general bi-direccional, pero resultan difícil de regular. Por otro lado, las sinapsis químicas son más versátiles y tienen mayores posibilidades de modulación pues el paso de las señales eléctricas requiere la mediación de mensajeros químicos conocidos como neurotrasmisores que, al ser liberados por las neuronas presinápticas, se unen a receptores específicos ubicados en la membrana de las neuronas postsinápticas. La unión del neurotrasmisor a su receptor induce cambios conformacionales en éste que le permite conducir corrientes iónicas y con ésto transmitir la excitabilidad. En general, la naturaleza excitatoria o inhibitoria de la transmisión entre neuronas depende de la clase de neurotransmisores que la neurona presináptica libere, de la clase de receptores presentes en la membrana postsináptica y de la diferencia entre el potencial de reposo de la membrana y el valor del potencial de equilibrio de la corriente iónica inducida (fuerza electromotriz para los iones permeantes). Como se explicará más adelante las modificaciones en el potencial de equilibrio para los iones que perméan a través de los receptores postsinápticos son de gran importancia en el proceso de maduración sináptica.
El establecimiento del balance funcional entre sinapsis excitadoras e inhibidoras debe sortear dos obstáculos primordiales: en primer término, durante el desarrollo se forman muchas más conexiones sinápticas de las que finalmente se establecen y operan en el SN maduro; de ahí que en algún momento de la maduración sináptica deben eliminarse las conexiones redundantes (3). Otro reto lo plantea el hecho de que el GABA, que es el principal neurotransmisor inhibidor en el SN adulto, actúa como neurotransmisor excitador durante gran parte del periodo embrionario (4)(5). El GABA excita a las neuronas inmaduras porque éstas acumulan iones cloruro (que son los iones permeantes a través de los receptores ionotrópicos sensibles al GABA) concentrándolos en el interior celular. Cuando el GABA activa a su receptor, las cargas negativas del cloruro salen de la célula a través de los receptores al GABA y depolarizan a la membrana. En contraste, en las neuronas adultas existen sistemas transportadores de cloruro capaces de establecer una concentración intracelular tan baja que se inverte el sentido del flujo iónico a través de los receptores inotrópicos del GABA, lo que provoca la hiperpolarización de la membraba postsináptica, conviertiendo al GABA en un neurotransmisor inhibitorio (6). La redundancia en el número de conexiones sinápticas y el hecho de que tanto la neurotransmisión glutamatérgica como la GABAérgica sean excitadoras se conjugan para crear la hiperexcitabilidad que es una de las características más notables de las redes neuronales en desarrollo (6).
Actividad neuronal y la maduración de las conexiones sinápticas.
Tradicionalmente, se distinguen dos fases en el desarrollo de los circuitos neuronales. Una primera fase, donde diferentes factores tróficos dirigen la expresión de genes implicados en procesos de proliferación, migración y diferenciación neuronal, sin que la excitabilidad del sistema tenga ninguna implicación. En una segunda fase la actividad nerviosa evocada por señales provenientes de los órganos de los sentidos dirige el proceso de refinamiento de la conectividad redundante inicial (7). Esta visión ha sido modificada por evidencias más recientes que indican que la actividad neuronal intrínseca de los circuitos afecta el desarrollo de los mismos desde estadíos mucho más tempranos. Por ejemplo, se ha descrito que bloqueando la actividad química y eléctrica en neuronas inmaduras se trastornan procesos tales como el establecimiento del fenotipo neuronal (8) o la expresión genética (9). Incluso otros autores sugieren que la actividad evocada por señales sensoriales sencillamente funcionaría como una agente modulador de la la maduración de las sinapsis a través de su interacción con la actividad neuronal espontánea, siendo este última la actividad neuronal más importante para la maduración sináptica (7).
Formación de las Columnas de Dominancia Ocular como ejemplo de maduración sináptica
Un ejemplo cuyo estudio ha servido para re-evaluar el papel de la actividad neuronal en la maduración sináptica, es el desarrollo de las llamadas columnas de dominancia ocular (CDO). Las CDO son conjuntos de neuronas de la corteza visual de diversos mamíferos, que se agrupan en columnas de entre 400 um y 1 mm de ancho, perpendiculares a la superficie cortical, que corren más o menos paralelas las unas a las otras formando un mosaico de zonas que responden preferencialmente a las señales provenientes de un ojo y se alternan con otras zonas que responden mayoritariamente al otro ojo. (10). David Hubel y Torsten Wiessel descubrieron que ocluyendo la visión de un ojo en gatos recién nacidos, la segregación de las CDO se veía severamente distorsionada siempre y cuando dicha manipulación se realice dentro de un lapso específico del desarrollo postnatal que estos autores llamaron periodo crítico (10). Para Hubel y Wiessel este resultado indicaba que la experiencia visual era determinante para establecer la organización columnar en la corteza visual. Esta conclusión pareció ser corroborada usando las técnicas anatomo-fisiológicas del momento (11). Sin embargo, pronto surgieron observaciones que contradecían dicha idea. Por ejemplo: no todas las especies con visión binocular presentan CDO, o usando técnicas más modernas, se ha encontrado que las CDO se empiezan a formar mucho antes del llamado periodo crítico (12). Hoy se sabe que el desarrollo de las CDO ocurre en dos etapas: una de establecimiento inicial, que utiliza actividad neuronal intrínseca o espontánea y otra más tardía que corresponde al periodo crítico y que requiere de actividad neuronal estructurada y evocada (13). Antes del establecimiento de la vision, se ha descubierto la presencia de señales en la corteza visual que provienen de la retina y se ha demostrado que influyen en el refinamiento de las proyecciones de la propia retina. Estas señales son producidas por ondas depolarizantes generadas espontáneamente por una red de interneuronas colinérgicas, las células amacrinas estelares, que causan que las células ganglionares de la retina disparen ráfagas de potenciales de acción que finalmente salen de la retina para transmitirse a la corteza visual (14).
Actividad Embrionaria Espontánea.
Diversas formas de actividad embrionaria espontánea (AEE) como la que origina las ondas depolarizantes en la retina se han descrito en la mayoría de los circuitos en desarrollo incluyendo al hipocampo, la corteza cerebral, el tronco del encéfalo y la médula espinal (15) y son una característica conspicua del SN en desarrollo. La AEE se cree sirve como fuente de depolarizaciones en los circuitos neuronales en desarrollo que contribuyen a su maduración (5). En la médula espinal esta actividad se manifiesta como ráfagas episódicas de potenciales de acción que duran varios segundos, seguidas por periodos silentes relativamente más prolongados llamados intervalos entre episodios (Figura 1). Los episodios de AEE son resultado de la naturaleza altamente excitable de los circuitos espinales embrionarios en los que la transmisión GABAérgica es excitadora y la conectividad es altamente redundante (15). Durante los episodios de AEE muchas neuronas disparan potenciales de acción y experimentan incrementos agudos en la concentración intracelular de calcio que resulta importante en varios aspectos del desarrollo (16). Los episodios de AEE en la médula espinal reclutan a la mayoría de las neuronas espinales incluyendo a las motoneuronas que inervan los músculos de las extremidades. La activación de estas motoneuronas se traduce en los llamados movimientos embrionarios de las extremidades (patadas fetales en el humano) que se observan en diferentes especies y se restringen a un lapso particular del desarrollo embrionario (15). Se ha demostrado que la AEE espinal es importante para dirigir los axones de las motoneuronas a sus músculos diana (17) y para el desarrollo apropiado de los músculos y las articulaciones (18). En nuestro laboratorio hemos estudiado como esta actividad está relacionada con los mecanismos que determinan la fuerza de las conexiones sinápticas en la médula espinal embrionaria (19)(20)(21)(22)(23)(24).

Figura 1 Trazo del registro de potencial extracelular de un nervio muscular de un embrión de pollo mostrando la ocurrencia regular de episodios de Actividad Embrionaria Espontanea (AEE) separados por los Intervalos entre Espisodios (IeE). En el esquema se muestra la disposición del electrodo de succión que registra el potencial del nervio muscular en una medula espinal aislada.
Como se ha mencionado anteriormente, los circuitos neuronales en desarrollo tienden a ser espontáneamente activos, aunque el tipo exacto de actividad depende del nivel de diferenciación de las neuronas y del grado en que éstas se establecen como redes neuronales. Por ejemplo, antes del establecimiento de las sinapsis químicas se pueden observar potenciales de acción espontáneos en células individuales u ondas de elevaciones transitorias del calcio intracelular en grupos de neuronas conectadas por sinapsis eléctricas que se coordinan a través de las uniones en hendidura (16). Tan pronto como las sinapsis químicas se establecen, aparece la AEE que es un tipo de actividad espontánea distinta que se caracteriza por estar dirigida por la red neuronal y no depender de la conectividad sináptica específica ni de la actividad de neuronas marcapasos, sino que depende exclusivamente de la neurotransmision sináptica (15).
Actividad Embrionaria Espontánea en la médula espinal en desarrollo
Inmediatamente después de un episodio de AEE, la red neuronal espinal disminuye su excitabilidad pero lentamente se recupera en el intervalo entre episodios (IeE). Varias observaciones apoyan esta conclusión: i) Los reflejos evocados al inicio del IeE son más débiles que a hacia el final (22). ii) La amplitud cúantica, es decir la amplitud de las corrientes producidas por la liberación de una sola vesícula de neurotransmisor (también conocidas como corrientes postsinápticas en miniatura) disminuye inmediatamente después de un episodio y también se recupera en el curso del IeE (19)(22). iii) Las neuronas espinales se encuentran hiperpolarizadas (aproximadamente en 10 mV) y se repolarizan progresivamente (de 0.5 a 1 mV por minuto) en el transcurso del IeE (22). Así, después del episodio las neuronas espinales se encuentran ligeramente hiperpolarizadas, la fuerza de sus sinapsis (medida por la amplitud de las corrientes postsinápticas en miniatura) en su punto más bajo y no disparan potenciales de acción. En el transcurso del IeE las neuronas gradualmente se depolarizan, la fuerza de sus sinapsis se incrementa (cada vesícula de neurotransmisor liberada evoca potenciales de mayor amplitud) y, eventualmente hacia el final del IeE, algunas alcanzan el umbral de disparo de su potencial de acción y al incrementarse el número de motoneuronas disparando potenciales de acción, se reclutan las interneuronas que interconectan a los circuitos espinales y así, con la mayoría de las neuronas espinales reclutadas, se dispara un nuevo episodio de AEE con la misma amplitud que el anterior (25).
Papel de la transmisión GABAérgica en la Actividad Embrionaria Espontánea espinal
La transmisión sináptica GABAérgica ocupa un papel central en la modulación de la excitabilidad de los circuitos neuronales durante el desarrollo de la médula espinal (22)(23)(24). La fuente de la gradual depolarización que ocurre durante el IeE es una corriente GABAérgica que se fortalece progresivamente (22). A su vez, la modulación de las corrientes GABAérgicas es el resultado de la actividad del transportador de cloruro NKCC1. El cloruro intracelular sufre cambios significativos en el transcurso de la AEE (Figura 2); cuando ocurre un episodio, los receptores para el GABA se activan masivamente abriendo un flujo de cloruro que puede reducir la concentración intracelular de este ion en aproximadamente 15 mM (22). Esto desplaza el potencial de equilibrio para el cloruro a un valor mas hiperpolarizado y por lo tanto reduce la fuerza electromotriz para el flujo de dicho ion. Una vez que el episodio finaliza la concentración incracelular del cloruro comienza a aumentar gracias a la actividad de los transportadores NKCC1 (22). Al aumentar la concentración de cloruro intracelular, la fuerza electromotriz para éste también se incrementa lo cual a su vez aumenta la amplitud de las corrientes GABAérgicas y como consecuencia, acerca al potencial de membrana al umbral de disparo de sus potenciales de acción (15). De esta forma, los cambios en la concentración intracelular del cloruro influyen en la periodicidad de los episodios de AEE a través de las corrientes GABAérgicas y de manera recíproca se podría decir que la AEE regula la fuerza sináptica GABAérgica, debilitándola después de un episodio y permitiendo su recuperación durante los IeE. Cabría entonces preguntarse si la AEE puede regular la fuerza sináptica a largo plazo.
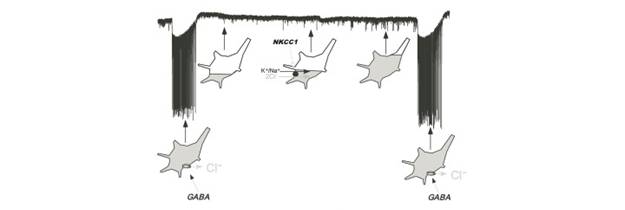
Figura 2 Episodios y modulación de la concentración de cloruro intracelular por el transportador de cloruro NKCC1. Trazo corresponde a un registro de corrente en una motoneurona bajo fijación de voltaje en la modalidad de célula completa mostrando el gradual incremento en la amplitud de las corrientes postsinápticas en miniatura durante el IeE. Los esquemas muestran la salida de cloro durante los episodios y su re-acumulacion por la acción de los NKCC1 durante el IeE.
Actividad neuronal en el desarrollo. Papel de la plasticidad sináptica.
Como hemos mencionado anteriormente, la actividad neuronal es un factor importante en el proceso de formación y maduración de los circuitos neuronales. Pero, ¿Cuál es específicamente el papel de esa actividad? ¿Es un papel permisivo que refina las estructuras construídas por un plan predeterminado? O, ¿Es un papel constructivo que puede determinar las propiedades de las sinapsis o las conductancias iónicas de las membranas? Un primer indicio para resolver este dilema se puede encontrar en el postulado de Donald Hebb de que "las neuronas que disparan al unísono se conectan entre ellas" ("cells that fire together wire together", (26). La plasticidad "hebbiana" se refiere a las modificaciones sinápticas de larga duración (fortaleciéndolas o debilitándolas) que son específicas de cada sinapsis y dependen de la correlación entre los disparos de potenciales de acción pre y postsinápticos (26)(28). El principio hebbiano para la modificación uso-dependiente de la fuerza sináptica ha sido enormente útil y constituye el mejor modelo para explicar tanto cómo se almacena la información en el SN (26)(28) y como ocurre el proceso de refinamiento de las sinapsis redundantes (29)(30). El problema con este principio radica en su naturaleza de retroalimentación positiva, ya que las sinapsis que son efectivas para excitar a la neurona postsináptica se continúan fortaleciendo constantemente y potencialmente podrían desestabilizar las tasas de disparo de potenciales de acción incrementándolas excesivamente. Una forma de evitar este problema sería la presencia de un proceso que asegure "homeostáticamente" que la red neuronal o las células individuales permanezcan dentro de un rango fisiológicamente apropiado de actividad eléctrica. Tal mecanismo existe y ha sido llamado "plasticidad homeostática" Los mecanismos de los que se vale este proceso para cumplir su cometido son la regulación a largo plazo de la excitabilidad neuronal y la regulación de la fuerza sináptica (31)(32)(33).
La mayoría de los estudios realizados hasta el momento se han enfocado en los cambios compensatorios en la fuerza sináptica. Así, en cultivos neuronales, cuando los niveles de actividad se reducen o incrementan cronícamente, la fuerza de las sinapsis glutamatérgicas y GABAérgicas cambian en una dirección que busca compensar a la modificación experimental de la actividad. De esta manera, cuando se reducen los niveles de actividad experimentalmente, la fuerza sináptica de las sinápsis AMPAérgicas se incrementa y la de las GABAérgicas disminuye (en estos experimentos las corrientes GABAérgicas eran inhibitorias). Por el contrario, cuando la actividad se incrementa experimentalmente la fuerza sináptica de las sinapsis AMPAérgicas disminuye y la de las GABAérgicas aumenta (31). En cada caso el cambio en la fuerza sináptica actúa en la dirección que tiende a restablecer los niveles de actividad original y como consecuencia la actividad de la red neuronal puede regularse homeostáticamente a sí misma.
Plasticidad homeostática como mecanismo de maduración de las conexiones sinápticas.
En nuestros estudios, hemos explorado la posibilidad de que la AEE pudiese regular de una manera homeostática la fuerza sináptica de las conexiones sinapticas de los circuitos espinales. Después de reducir la AEE en la médula espinal de embriones de pollo mediante la injección en ovo de lidocaína (un bloqueante de los canales de sodio responsables de la fase inicial de los potenciales de acción) por dos días, la fuerza sináptica de las sinápsis glutamatérgicas y GABAérgicas se incrementaron de manera compensatoria para aumentar la excitabilidad de la médula espinal y así mantener un nivel adecuado de AEE (19)(Figura 3). Más recientemente hemos encontrado que manipulaciones experimentales que aumentan la AEE en ovo disparan a su vez la reducción compensatoria de la fuerza sináptica en ambos tipos de sinapsis (20). Estos resultados son consistentes con la idea de que la plasticidad homeostática es un proceso bi-direccional en la médula espinal embrionaria, y dado que la AEE es capaz de regular coordinadamente la fuerza sináptica de todas las conexiones -puesto que todas las conexiones son excitadoras- la AEE controlaría de una forma mecanisticamente similar el balance inicial de las sinapsis excitadoras y de las que al madurar serán inhibidoras.
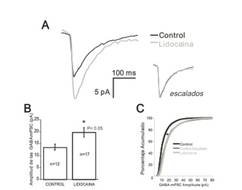
Figura 3 La amplitud de las corrientes GABAergicas postsinápticas miniatura aumenta después de reducir cronicamente las AEE en ovo. A) Trazo promedio de las corrientes GABAergicas postsinápticas miniatura en embiones control (línea negra) y en los tratados con lidocaína (línea gris) B) Grafica de barras mostrando el incremento en la amplitud de las corrientes GABAergicas postsinápticas miniatura, como medida del incremento en la fuerza sináptica en los embriones tratados con lidocaína. C) La distribución acumulativa (DA) de las amplitudes de las corrientes GABAergicas postsinápticas miniatura en control (línea negra) puede ser “escalada” para sobreponerse a la DA de las corrientes miniatura registradas en ebriones tratados con lidocaína (línea gris obscura) usando un solo factor multiplicativo.
¿Cuáles son los mecanismos responsables de la plasticidad homeostática en la médula espinal embrionaria?
En los experimentos realizados en cultivos neuronales se han descrito cambios tanto en los receptores postsinápticos como en el contenido de neurotransmisores en la vesículas de secreción. En otros sistemas, se ha encontrado que el número de receptores, la composición de sus subunidades y su proproción relativa cambian. También se han reportado cambios en el contenido de neurotransmisor en las vesículas de secreción como respuesta a las manipulaciones de la actividad de diversos circuitos (32). Nosotros hemos encontrado dos novedosos mecanismos en la médula espinal embrionaria. En el caso de las sinapsis glutamatérgicas el bloqueo crónico de la AEE dispara una substitucion de los receptores glutamatérgicos nativos por un subtipo que presenta mayor conductancia (conduce más corriente cuando se activa) que además es permeabla al calcio, lo que tendría además mayores consecuencias plásticas al ser el calcio un importante mensajero intracelular (21). En el caso de las sinapsis GABAérgicas el mecanismo para incrementar la fuerza sináptica resultó completamente inesperado. Como se ha explicado anteriormente, dado que el potencial de inversión para las corrientes GABAérgicas es modulado por la AEE, nosotros nos preguntamos si era posible que los transportadores que acumulan cloruro en el interior de las neuronas (NKCC1) fueran más numerosos o estuvieran más activos en los embriones tratados crónicamente con lidocaína que suprime la AEE. Esto aumentaría la concentración intacelular del cloruro y consecuentemente la fuerza electromotriz para este ion. Así, nosotros investigamos (Figura 4) si el potencial de inversión para las corrientes GABAérgicas se torna más depolarizado en los embriones tratados con lidocaína (esto se esperaría que sucediera si la concentración intracelular de cloruro fuera más elevada en los embriones tratados) y, en efecto, encontramos que el mecanismo homeostático empleado para incrementar la fuerza sináptica de las sinapsis GABAérgicas es mediado por un incremento en la acumulación del cloruro que produce un desplazamiento en la dirección depolarizante del potencial de inversión de las corrientes GABAérgicas (24)(33)(34). De hecho, se han descrito desplazamientos similares del potencial de inversión para las corrientes GABAérgicas en varias patologías neuronales lo que sugiere que alteraciones en los mecanismos moleculares involucrados en la plasticidad sináptica homeostática pudieran constituir una agente etiológico de las mismas (32)(33)(34).
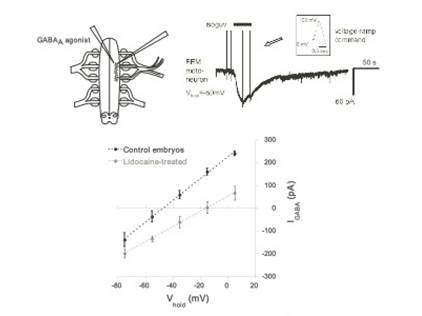
Figura 4 El potencial de equilibrio para las corrientes GABAergicas se desplaza a un valor mas depolarizado en los embriones tratados con lidocaína. Esquema mostrando la configuración empleada para registrar el potencial de equilibrio para las corrientes GABAergicas. Los registros de corriente en motoneuronas bajo fijación de voltaje en la modalidad de “patch perforado” fueron hechos inmediatamente después de aplicar un agonista GABAergicao (isoguvacina). Rampas de voltaje se aplicaron a las motoneuronas antes y después de la aplicacion del agonista para construir las curvas corriente-voltaje para motoneuronas control y tratadas con lidocaína. El potencial de inversión se desplazo de -46 mV en controles a -15 mV en los embriones tratados con lidocaína.
Conclusiones.
-Los circuitos neuronales en desarrollo exhiben propiedades transitorias que dan origen a una forma de actividad periódica y altamente integrada llamada Actividad Embrionaria Espontánea (AEE).
-La AEE permite un alto grado de sincronización entre las neuronas de un circuito neuronal y puede participar en la construcción y maduración de sus conexiones sinápticas.
-Mediante la plasticidad homeostática, la AEE en la médula espinal puede regular la fuerza de las sinapsis espinales de manera que se mantengan los niveles de actividad apropiados para el correcto desarrollo de las extremidades.
-Al ajustar coordinadamente las fuerzas sinápticas de las sinapsis GABAérgicas y glutamatérgicas, la AEE está en posición de dirigir un desarrollo inicial balanceado de los sistemas excitadores e inhibidores en un periodo en el que ambos comparten una naturaleza depolarizante.
- Finalmente, destacar que pese a las evidencias acumuladas en la bibliografía en apoyo a las conclusiones descritas, si bien hay consenso en cuanto a la implicación de la AEE y la maduración sináptica, hoy existen algunas discrepancias sobre los mecanismos moleculares involucrados a nivel de las sinapsis. La limitación fundamental para muchos de estos estudios es que han sido desarrollados en modelos in vitro (con excepciones como los experimentos de dominancia ocular descritos). Además, son necesarias investigaciones futuras para determinar la implicación de la alteración de los mecanismos de plasticidad homeostática tanto en neuropatologías del desarrollo como en adultos.














