INTRODUCCIÓN
El Síndrome de Guillaín Barré (SGB) es un trastorno neurológico enmarcado en el grupo de las neuropatías agudas que se suele presentar como una polineuropatía desmielinizante de origen autoinmune, en respuesta a un proceso infeccioso, que compromete extensamente al sistema nervioso periférico; su incidencia según diversos estudios es baja (aproximadamente 0,75-2 casos anuales por 100.000 habitantes), sin embargo su comportamiento epidemiológico es muy variable debido a que suele cursar en brotes asociados a epidemias infecciosas, lo cual dificulta su evaluación epidemiológica.(1)(2)
El SGB se manifiesta típicamente desde el punto de vista clínico con trastornos somáticos motores, que varían desde la debilidad leve en miembros inferiores hasta la cuadriplejía flácida con parálisis respiratoria; estas manifestaciones suelen cursar de forma aguda con un nadir en 2-3 semanas.(3) Adicional a esta sintomatología pueden ocurrir trastornos disautonómicos, responsables de una alta mortalidad temprana, y trastornos sensitivos frecuentemente infravalorados.(4)
A continuación se describe el caso clínico de un paciente con cuadriparesia fláccida aguda, ingresado en el servicio de Medicina Interna del Hospital General del Sur “Dr. Pedro Iturbe”, quien además presentó trastornos sensitivos que dificultaron el diagnostico inicialmente, pero durante su evolución intrahospitalaria se confirmó la presencia de un SGB.
CASO CLÍNICO
Paciente masculino de 52 años, natural y procedente de la ciudad de Maracaibo, sin antecedentes patológicos, quien consulta por presentar cuadro clínico de 7 días de evolución caracterizado por disminución de la fuerza muscular en las 4 extremidades, de forma progresiva y de predominio en miembros superiores acompañado de parestesias y dolor de moderada intensidad, tipo lancinante, de predominio en hombros y muslos que cedía parcialmente con analgésicos tipo AINES, motivos por los cuales es ingresado en nuestra institución.
Al interrogatorio no refería ningún antecedente de importancia, ni cuadros clínicos gripales o enterales recientes, ni pródromos, ni traumatismos. Su ocupación era conductor de vehículos pesados y en su examen funcional solo reportaba pérdida de peso de aproximadamente 3 kg en 1 mes, no asociado a régimen dietético.
Al examen clínico, la presión arterial fue 130/80 mmHg, frecuencia cardíaca: 90 latidos por minuto, frecuencia respiratoria: 18 respiraciones por minuto, saturación O2: 97%, temperatura: 37ºC; sus condiciones clínicas eran regulares, cardiopulmonar sin hallazgos relevantes, en abdomen se encontraba plano, RHA (+), blando, depresible, levemente doloroso a la palpación de hipogastrio, sin signos de irritación, sin visceromegalias. Neurológicamente: Consciente, orientado en tiempo, espacio persona, lenguaje coherente, juicio y pensamiento preservado, no afasia, no apraxia, no agnosia, PC: Indemnes, FM: Braquial III/V - Crural: III/V (de predominio en musculatura proximal), Reflejos osteotendinosos: hiporreflexia en 4 miembros, sensibilidad: alodinia en 4 miembros, dismetría, diadococinecia, taxia no valorable, sin signos meníngeos, ni reflejos patológicos, Glasgow 15/15.
En los exámenes paraclínicos realizados durante su ingreso se reportan, cuenta blanca: 8400 células/mm3 (neutrófilos: 74,6%, linfocitos: 19,6%), hemoglobina: 12,1 gr/dl, hematocrito: 40,3%, plaquetas: 324000 células/mm3, glicemia: 115 mg/dl, urea: 28 mg/dl, creatinina: 0,8 mg/dl, sodio: 136 mg/dl, potasio: 4,2 mg/dl, cloro: 99,3 mg/dl, calcio total: 8,9 mg/dl, magnesio: 2,2 mg/dl. En el estudio electrocardiográfico y tomografía cerebral no presentaba hallazgos patológicos. En vista de los hallazgos clínicos se decide ingresar con los diagnósticos sindromáticos: Síndrome de compresión radicular extramedular vs. Miopatía Inflamatoria; con plan de realización de nuevos estudios paraclínicos para precisar el origen de los síntomas y se indican analgésicos tipo AINES más neuromoduladores tipo pregabalina 75 mg OD.
Durante su estancia intrahospitalaria, se realiza resonancia magnética de columna lumbo-sacra que reporta: cuerpos vertebrales con preservación de altura e intensidad de señal, observándose cambios Modic tipo II en platillo inferior de L3, superior de L4, inferior de L5, y superior de S1. Asimismo impresiona hemangioma cuerpo vertebral T12. Disminución en la intensidad de señal de los discos intervertebrales lumbares L3-L4, L4-L5 y L5-S1 en relación a cambios de discopatía degenerativa con prominencia posterior de los ánulos fibrosos en los 2 primeros y protrusión posterocentral a nivel L5-S1, con diámetros del canal espinal de amplitud preservada al igual que los forámenes de emergencia de raíz nerviosa y cono medular normal.
Pese a los hallazgos imagenológicos se realiza electromiografía de los miembros que reporta: prolongadas latencias terminales motoras, velocidades tronculares motoras marcadamente lentas y velocidades sensitivas lentas. La baja amplitud de respuestas evocadas indicaba: Neuropatía periférica mixta con predominio desmielinizante. En vista de los hallazgos neurofisiológicos y el curso intrahospitalario de 15 días de evolución, se prepara para la realización de punción lumbar y plasmaféresis.
Los resultados de citoquímica de líquido cefalorraquídeo mostraron desde el punto de vista macroscópico: Aspecto: Claro - Color: Incoloro - Coágulo: No presente - pH: 7,5 - Densidad: 1015 y microscópico: Hematíes: No se observaron - Leucocitos: No se observaron - Glucosa: 67 - LDH: 13 - Proteínas: 93; compatibles con disociación albúmino-citológica. Tras estos hallazgos se modifican los diagnósticos a polirradiculopatía desmielinizante aguda: síndrome de Guillain-Barré y discopatía degenerativa de L3 a S1.
El paciente fue sometido a 4 sesiones de plasmaféresis interdiarias, de acuerdo a disponibilidad institucional, sin complicaciones durante las mismas. Tras 21 días de evolución intrahospitalaria, la fuerza muscular fue mejorando progresivamente, en miembros superiores y luego miembros inferiores, hasta iniciar deambulación no asistida, mientras que la alodinia mejoró parcialmente y se manejó con pregabalina 300 mg OD.
DISCUSIÓN
El SGB se manifiesta típicamente como una polineuropatía desmielinizante inflamatoria aguda con afectación predominantemente motora; sin embargo, la expresión clínica de este síndrome tiene un amplio espectro de manifestaciones que ha permitido incluso identificar variantes clínicas específicas como la axonal motora aguda, axonal sensitivo-motora aguda, síndrome de Miller Fisher y cuadros delimitados a los nervios craneales como la diplejía facial, todo asociado posiblemente al tipo de nervio afectado y a la extensión de este compromiso en el sistema nervioso periférico.(3)(5)
En este sentido, los síntomas sensitivos durante el curso clínico de este síndrome suelen ser subestimados, y normalmente el clínico enfoca su apreciación diagnóstica y preocupación pronóstica en base a las manifestaciones motoras que pueden comprometer la vida del paciente. No obstante, las primeras descripciones por Guillaín mencionaban la presencia de dolor,(6) posteriormente en la década de los 80 Ropper y Shahani demuestran en una serie de casos la importancia del dolor y su patrón de aparición en este grupo de pacientes.(7) Desde entonces numerosas investigaciones han caracterizado el comportamiento del dolor o déficit sensorial en el paciente con SGB; observándose en distintos grupos etarios, formas de presentación clínica, implicaciones en la calidad de vida y manejo terapéutico.(8)(9)(10)
En un análisis previo del Dutch GBS Study Group se evaluaron prospectivamente 156 pacientes con SGB, incluyendo sujetos con variantes clínicas, a quienes se les determinó la localización, intensidad y tipo de dolor durante un seguimiento de 1 año. Evidenciándose que este es un síntoma común en las diversas formas clínicas y que además de su alta frecuencia, puede aparecer como manifestación inicial (incluso antes de la debilidad muscular) y su duración puede ser de al menos 1 año requiriendo especial atención.(11)
El caso clínico descrito demuestra la interpretación errónea inicial que puede realizarse de la presencia de dolor en un paciente que cursa con parálisis fláccida aguda, dados los numerosos diagnósticos diferenciales que pueden plantearse, en este caso patología exclusiva del músculo esquelético o de la médula espinal.(12) Consideraciones que debe tomar en cuenta el médico de atención primaria o el especialista que aborde al sujeto afectado de manera temprana.
Fisiopatológicamente el proceso inflamatorio en el SGB afecta principalmente las fibras mielinizadas de los nervios motores y las eferencias autonómicas, sin embargo; reportes previos han demostrado un compromiso de las fibras pequeñas aferentes y una densidad de fibras nerviosas intraepidérmicas reducida,(13) responsables no solo de la intensidad de los síntomas sensitivos durante la fase aguda sino también de la aparición y persistencia de un síndrome de dolor neuropático a largo plazo.(14) Por su parte, Ruts et al.(15) han demostrado en un estudio prospectivo en 32 pacientes con SGB, que tanto los nervios cutáneos mielinizados como no mielinizados se encontraban difusamente afectados en pacientes con SGB clásico y sus variantes, además la densidad de fibras nerviosas intraepidérmicas presentaba una disminución progresiva correlacionándose de igual manera con la severidad del dolor agudo y la predicción de discapacidad a largo plazo.
No obstante, hasta ahora no se conocen los mecanismos moleculares subyacentes de la afectación de este grupo de fibras nerviosas nociceptivas y las teorías planteadas involucran la liberación de citocinas y biomarcadores de daño axonal.(16) En cuanto al tratamiento farmacológico, son pocos los ensayos clínicos aleatorizados realizados para la evaluación del uso de analgésicos en el paciente con SGB que experimenta dolor, siendo un abordaje complejo dada la variabilidad de este síntoma y las características nociceptivas o neuropáticas con las cuales puede presentar.(17)
En este sentido, pese a ciertas consideraciones metodológicas los hallazgos más favorables en el manejo del dolor se han obtenido con fármacos como gabapentina y carbamazepina especialmente con el primero, el cual ha demostrado una mayor efectividad en la disminución del dolor y del uso de otros fármacos adyuvantes como fentanilo.(18) Por su parte, la utilización de metilprednisolona no ha mostrado efectos positivos en la reducción de dolor o síntomas sensitivos.(10) De cualquier manera, la evidencia es poco consistente y se requieren nuevos estudios con mayor cantidad de pacientes, periodos de seguimiento más prolongados, y ensayo de grupos farmacológicos cabeza a cabeza que permitan identificar las opciones terapéuticas más adecuadas según las características del dolor exhibidas. La Tabla 1 resume los estudios clínicos con hallazgos fisiopatológicos, clínicos y terapéuticos relacionados al dolor en SGB.
Tabla 1 Estudios clínicos relacionados a dolor en síndrome de Guillain-Barre desde el punto de vista fisiopatológico, clínico y terapéutico.
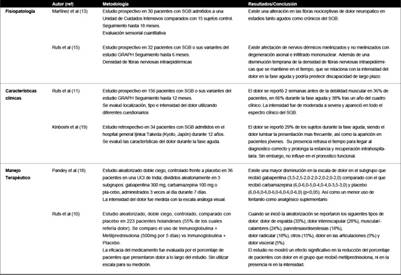
En conclusión, la presencia de síntomas sensitivos específicamente dolor en los pacientes con SGB es frecuente, siendo subdiagnosticado o infravalorado debido a desconocimiento en sus características o cronología, a la imposibilidad para ser expresado en aquellos pacientes sometidos a ventilación mecánica o al diagnóstico erróneo de otras entidades clínicas dentro del amplio grupo de patologías diferenciales ante un cuadro clínico de debilidad muscular aguda en el adulto, tal como ocurrió en el caso clínico descrito y en reportes previos.(19) Por ende, resulta necesario instruir al médico de atención primaria en la identificación temprana de esta sintomatología para brindar un adecuado manejo terapéutico.














