Introducción
La Enfermedad de Alzheimer (EA) o Demencia Tipo Alzheimer (DTA) constituye la demencia más frecuente en los adultos mayores, y es diagnosticada en 50 a 60% de los casos de demencias. La DTA es una enfermedad heterogénea, con manifestaciones variables y rasgos epidemiológicos, conductuales, neuropsicológicos, neuroanatómicos y neuropatológicos característicos, que aportan un diagnóstico diferencial con otras demencias.
El reconocimiento de los síntomas iniciales representa un enorme reto, ya que la introspección del paciente puede estar inicialmente alterada y los familiares o cuidadores pueden atribuir los síntomas a cambios propios del envejecimiento. Existe, por tanto, en la actualidad una creciente necesidad de encontrar marcadores de la EA que faciliten un diagnóstico sencillo y precoz. La DTA es semiológicamente heterogénea, con subgrupos que se caracterizan por un acopio de síntomas y signos; sin embargo, estos subgrupos no se diferencian por la edad de inicio, rapidez evolutiva o sexo, por tanto, no está claro que se trate de auténticos subtipos, cada una con una base biológica diferente. Sería importante buscar marcadores anatomopatológicos que identifiquen subtipos de EA bien definidos biológicamente y con una evolución diferente. E igualmente indagar sobre los mecanismos que subyacen a las formas esporádicas de la DTA.
Para obtener un diagnóstico definitivo de los afectados por DTA era necesario realizar autopsia, en cuyo caso el diagnostico seria post mortem. El diagnóstico de certeza de una demencia se basa en el estudio histopatológico de una biopsia o autopsia, siendo correcto el diagnóstico clínico de la EA, entre un 80 % y un 90 % de los casos(1). Sin embargo, existe la posibilidad con las investigaciones actuales(2) de encontrar en el líquido cefalorraquídeo (LCR) o en imágenes cerebrales biomarcadores que permitan realizar un diagnóstico in vivo de EA.
En el Departamento de Antioquia, Colombia, se ha reportado el grupo familiar más grande del mundo con EA por la mutación E280A en el gen PS1, caracterizada por su inicio temprano y un cuadro de deterioro cognitivo muy agresivo; éste grupo familiar ha sido estudiado clínicamente a lo largo de los últimos 30 años(3)(4)(5)(6) con ayudas clínicas entre las cuales están la imagenológica, molecular, fisiológica, psicológica y neuropatológicamente a lo largo de los últimos 30 años(3)(4)(5)(6), permitiendo incluso determinar claramente las etapas de progresión antes de la aparición de la demencia(7).
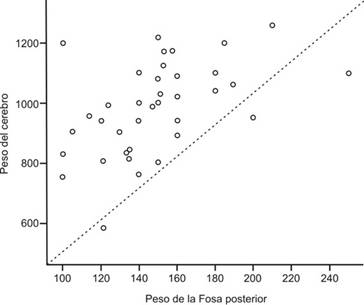
Al realizar el estudio macroscópico de los cerebros donados correspondientes a pacientes afectados por DTAF con la mutación E280A se halló una heterogeneidad en los cambios patológicos. Además, de los cerebros donados catalogados como Demencia Tipo Alzheimer (incluyendo de aparición esporádica -DTA+E) se ha encontrado mayor correlación del peso del encéfalo con respecto al peso del contenido de la fosa posterior.
Por todo lo expuesto anteriormente, se propone analizar el cruce de hallazgos patológicos de las dos categorías preestablecidas, DTA+E y DTAF E280A, se espera que exista una variabilidad en la sintomatología de los casos de DTAF E280A, y una variabilidad aún más notoria entre las características conductuales, psiquiátricas, neuropsicológicas, neurológicas y neuropatológicas entre los pacientes diagnosticados con DTA+E.
Materiales y Método
Muestra de sujetos
Para este estudio solo se tomaron los casos de donantes que fueron diagnosticados con DTA, y se dividieron en dos grupos:
1. Un grupo definido genéticamente como E280A (DTA Familiar Precoz con la mutación E280A en el gen de Presenilina 1).
2. Y otro grupo como DTA+E (Enfermedad tipo Alzheimer Esporádico).
Se identificaron en total de 130 casos, y se tenía para cada caso, un total de 120 variables. De estos casos fueron descartados 37, por no tener información suficiente de las variables requeridas, se tomaron los 83 casos diagnosticados como DTAF E280A o DTA+E. Se analizaron como variables independientes las características sociodemográficas tales como sexo, estado civil, origen, nivel de estudio, edad de muerte, edad de inicio de la enfermedad, duración de la enfermedad, antecedentes familiares y antecedentes personales. Y como variables dependientes las siguientes: Marcadores conductuales, marcadores psiquiátricos, marcadores neurológicos, marcadores neuropsicológicos, marcadores del lenguaje y marcadores neuropatológicos.
Además, de acuerdo a documentos aprobados por el comité de ética médica de la Universidad de Antioquia, todos los pacientes o sus familias habían firmado previamente un consentimiento informado para las evaluaciones y la donación de tejido.
Registros neuropsicológicos. Esta serie de registros fueron obtenidos por evaluaciones hechas en vida a los pacientes por neuropsicólogos, quienes aplicaron la Batería Neuropsicológica del Consorcio para el Estudio y Registro de la Enfermedad de Alzheimer de Colombia (CERAD-col)(8)- Versión en español de la batería neuropsicológica del CERAD validada y adaptada por el Grupo de Neurociencias de Antioquia para el diagnóstico de la EA en población colombiana hispanoparlante mayor de 50 años, que incluye las pruebas siguientes: Minimental, fluidez verbal, denominación, memoria lista de palabras, praxias constructivas, figura de rey, fluidez verbal fonológica (FAS), Wisconsin, MIS, WAIS III, y escalas funcionales tales como: Escala de trastornos de memoria (QF45), evaluación del estado funcional (FAST), escala global de deterioro (EDG), escala de Barthel de AVD y alimentación (Barthel), índice de Katz y la escala de Lawton y Brody; y unas pruebas complementarias que evalúan las Funciones Mentales Superiores que incluyen a su vez, pruebas para evaluar lenguaje (hipoespontaneidad, anomia, anartria, afasia, alexia, disfemia, agrafia, mutismo, ecolalia, perseveración, palilalia), parafasias (semánticas, fonológicas y neologismos), afecto (depresión, ansiedad, pánico, manía), comportamiento y conducta social (agresividad, irritabilidad, exhibicionismo, aislamiento, apatía desinhibición, vagabundeo) y delirios (delusiones, alucinaciones y paranoias); también se aplica los criterios del DSMIV-R (DTA), Inventario neuropsiquiatrico Cummings (Delirios, alucinaciones, agitación, depresión, ansiedad, euforia, apatía, desinhibición, irritabilidad, trastornos del sueño y de la conducta alimenticia), CDR .
Registros neurológicos. Estos datos se tomaron de las evaluaciones médicas/neurológicas realizadas por los neurólogos, quienes aplican inicialmente un examen médico general y luego un examen neurológico que abarca pares craneales, trastorno visual auditivo, motor - sensitivo, tono muscular - marcha, reflejos (Osteotendinoso y patológicos), parkinsonismo y síndrome cereboloso.
Registros neuropatológicos. Se recogieron las muestras de sistema nervioso que se procesaron siguiendo un lineamiento básico del Grupo de Neurociencias de Antioquia, los cuales combinan el protocolo del CERAD(9), que implica cortes alternativos para estudios morfológicos e histológico. Las muestras de tejido cerebral recolectadas postmortem se fijaron con formalina al 10% y luego fueron procesados en parafina. Las secciones parafinadas de los tejidos fueron tratadas con hematoloxilina-eosina para su posterior estudio microscópico.
Análisis estadístico. Todos los análisis estadísticos se hicieron utilizando el programa SPSS (SPSS inc., ILL, EE. UU.). El análisis de datos se realizó atendiendo los dos tipos de estadística: la descriptiva y la inferencial. El nivel estadístico de significancia fue P = 0,05.
Para el análisis descriptivo se emplearon frecuencias y porcentajes para el caso de las variables categóricas y se presentan en tablas de frecuencia. Para las variables cuantitativas se emplea la media y desviación típica.
Para el análisis inferencial de los datos se utilizó la prueba de Chi cuadrado un nivel de significación del 5% (α=0.05), con el fin de determinar si existe relación estadísticamente significativa entre las variables del estudio y los dos subgrupos conformados por los diagnósticos de enfermedades neurodegenerativas, a saber, DTAF E280A y DTA+E.
También se manejó el análisis de correlación de Pearson para medir el grado de asociación entre las variables obtenidas del estudio macroscópico del cerebro (variables neuropatológicas).
Por último, se empleó la prueba t de Student para la comparación de medias de los resultados de las baterías según los dos grupos de tipo de demencia Alzheimer. Cada batería o test arrojaron unos resultados que dieron cuenta de la situación neurológica, neuropsicológica y/o conductual que se realizaron a algunos donantes que fueron evaluados antes de su fallecimiento. Se tienen los datos de las pruebas aplicadas a los donantes clasificados en dos grupos según el diagnóstico de EA (DTAF E280A y DTA+E). Dado que los resultados de estas pruebas son puntajes, se compararon los promedios y se sometieron a contraste la hipótesis nula de que los promedios de las diversas pruebas son iguales en los dos grupos de comparación.
Resultados
Variables sociodemográficas
De los 83 casos analizados, el 41% correspondió a donantes clasificados como DTAF E280A, mientras que el 59% restante presentaba DTA+E. Igualmente, de los 83 casos analizados, el 72,3% de los casos correspondieron al género femenino. De otro lado, las mujeres donantes clasificadas como DTAF 280A fue un 73%, y el 70,6 % pertenecía a las donantes que se clasificaron como DTA+E.
Edad de muerte
La edad en que murieron los donantes analizados, fue categorizada en tres conjuntos, de manera tal que quienes fallecieron antes de los 50 años se concentraron en un grupo, los que murieron con edades entre 51 y 70 años en un segundo grupo y el último conglomerado se formó con los fallecidos después de los 70 años. Las edades de muerte de los donantes oscilaron entre 42 y 92 años, con una edad promedio al morir de 67.46 ± 12.43 años. La mayor parte de los donantes murió entre los 51 y 80 años correspondiente al 80.6%, y un 18.1% de las muertes ocurrieron entre los 80 y 90 años de edad. Solo un 9.7% de las muertes de los donantes ocurrió antes de los cincuenta años de edad y en uno de los donantes se registró su muerte después de los 90 años. Como es de esperar por tratarse de personas afectadas con una mutación en el gen de PS1, se aprecia una tendencia de los donantes DTAF E280A a morir a menor edad, en tanto que los de diagnóstico DTA+E murieron a edades mayores con una alta asociación estadística entre la Edad de Muerte y el Diagnóstico (ᵡ2= 34.403; g.l. = 2; p = <0.001).
Inicio de la enfermedad
El promedio de la edad de inicio (EI) de la enfermedad neurodegenerativa fue 57.2 ± 12.56 años, con edades entre 33 y 84 años de edad. Se observó que en el 32.3% de los donantes su enfermedad inició antes de los 51 años y solo uno de cada diez donantes registró una EI por debajo de los 41 años; el 83.1% de los casos la edad de inicio fue antes de los 71 años de edad. Solo un caso, el 1.5%, la EI se encontró después de 81 años de edad.
Duración de la enfermedad
El tiempo de duración de la enfermedad se clasificó en menos de seis años, entre seis y diez años y más de diez años con la finalidad de determinar la relación entre esta variable y el grupo de diagnóstico. Y se pudo apreciar que en más de la mitad de los donantes (54.4%) la EA duró entre seis y diez años; el 33.8% correspondió a donantes cuya enfermedad duró más de diez años y apenas un 12.8% eran donantes que su enfermedad no superó los seis años de duración. La duración de la enfermedad en los subgrupos de diagnóstico son relativamente homogénea, no apreciándose ninguna tendencia, ya que en el grupo DTAF E280A su enfermedad duró entre seis y diez años (65.5%) y en el grupo de DTA+E esta proporción fue del 46.2%. En vista de estos resultados podemos concluir que no hay relación estadísticamente significativa entre la Duración de la Enfermedad y el Diagnóstico.
Marcadores conductuales
Dentro de los análisis descriptivos del perfil conductual, comportamental, psiquiátrico y neuropsicológico del subgrupo de pacientes diagnosticados con DTAF E280A, se les realizó una exploración premortem, se obtuvo que los trastornos conductuales de los donantes tuvieron baja prevalencia, siendo el de mayor porcentaje los trastornos del sueño (55.4%), mientras que las convulsiones alcanzó el 37.3% de los casos, las mioclonias el 32.5%. Los trastornos alimenticios se presentaron en el 18.1%.
El porcentaje de donantes que referían antecedentes personales de trastornos del sueño fue del 55.4%. Tanto en grupo de diagnóstico DTAF E280A como DTA+E, más de la mitad de los donantes presentaba este trastorno, en proporciones ligeramente mayor en el grupo DTAF E280A y los resultados indicaron que este trastorno no se observa con mayor intensidad en algún grupo en particular, por tanto, las diferencias observadas en las frecuencias muestrales son producto del azar y no de la relación entre los trastornos del sueño y el subgrupo de diagnóstico. (ᵡ2= 0.938; g.l. = 1; p = 0.375).
Marcadores neuropsicológicos
En la revisión de los marcadores neuropsicológicos, los familiares informaron que el trastorno de memoria más frecuentemente observado fue la pérdida progresiva de la misma (54.2%). La repetidera y el olvido de los objetos se presentó en el 27.7% y 25.3% de los donantes respectivamente. También señalaron otros trastornos de la memoria, pero en menores proporciones, entre los que mencionan el no reconocimiento de los familiares (16.9%) y la confusión (15.7%) c/u. Además en su mayoría registraba amnesia anterógrada 76.2% y el 23.8% presentaba amnesia global. En el análisis inferencial de los mismos, se observó que la repetidera es el único síntoma donde se registraron diferencias significativas en los dos grupos de estudio.
En este sentido, fue mayor el porcentaje de donantes que manifestaron repetidera cuyo diagnóstico era DTAF E280A (41.2%) que en el grupo de DTA+E, en el que se obtuvo una presencia de este síntoma en 18.4%; es decir, es 2.23 veces mayor la repetidera en los donantes con DTAF E280A que en los de DTA+E con una relación estadísticamente significativa entre la repetidera y el diagnóstico (ᵡ2= 5.213; g.l. = 1; p = 0.027).
De los marcadores neuropsicológicos analizados, solamente resultaron significativas los marcadores Desorientación Espacial (p = 0.038), Apraxia (p = 0.021) y Problemas de Atención (p = 0.006). Los resultados mostraron que el 61.4% de todos los donantes presentaron este síntoma de desorientación espacial, entre los clasificados como DTA+E la proporción de donantes con desorientación espacial (71.4%) fue casi el doble de la proporción de donantes del grupo de DTAF E280A con desorientación de este tipo. En los casos de apraxia entre los donantes abarcó el 34.9% de la muestra. Entre los donantes con diagnóstico DTAF E280A, la mitad presentaba Apraxia, mientras que en el grupo de diagnóstico DTA+E, este porcentaje fue del 24.5%. Entre los donantes del grupo DTAF E280A, el 26.5% reportó problemas de atención, mientras que en el grupo DTA+E este porcentaje apenas llegó al 4.1%. Los datos revelan una tendencia de los donantes DTAF E280A a tener problemas de atención, en tanto que los DTA+E en su mayoría (95.9%) no tienen este tipo de problemas, por lo que podemos decir que existe una relación entre los problemas de atención y el diagnóstico de estos pacientes (ᵡ2= 8.752; g.l. = 1; p = 0.006).
El resto de los marcadores neuropsicológicos no estuvieron asociados con el diagnóstico, se pudo apreciar que, excepto la desorientación temporal que tuvo una prevalencia del 34.9%, la presencia de estos marcadores estuvo por debajo del 20%. En este sentido, la agrafia (16.9%), los trastornos de la función ejecutiva (14.5%), la agnosia (13.3%) y la anartria (12%) mostraron prevalencias mayores del 10% pero inferiores al 20%. Por su parte, la acalculia (9.6%), la disartria (8.5%) y la alexia (8.4%) revelaron las prevalencias más bajas.
Se exploraron cuatro trastornos del lenguaje entre los donantes, donde la pérdida progresiva del lenguaje representó la mayor prevalencia de estos trastornos (40.2%), seguido por la anomia con 31.7% de prevalencia. El mutismo y la afasia representaron el 24.4% y 22.9% respectivamente. El cruce de los trastornos del lenguaje con los grupos de diagnóstico reveló que las diferencias observadas en las frecuencias muestrales no eran estadísticamente significativas, en otras palabras, los trastornos del lenguaje son los síntomas más notorios de las evaluaciones realizadas a ambos grupos con EA.
Baterías y/o Tests neuropsicológicas
Se tenían los resultados de la aplicación de Clinical Dementia Rating (CDR) o Escala Clínica de Demencia en 20 sujetos, de los cuales 11 pertenecían al grupo E280A y el resto presentaban DTA+E. El promedio de la Escala Clínica de Demencia del grupo E280A es ligeramente mayor (4.09 ± 1.136 puntos) que el del grupo DTA+E, cuyo promedio fue 3.11 ± 1.453, siendo muy similar la dispersión de los puntajes de ambos grupos.
La comparación de medias mediante la prueba t, revela que la diferencia entre el promedio del CDR del grupo E280A y el grupo DTA+E es menor que un punto (Diferencia = 0.980) y que a un nivel de significación de 0.05 se acepta la hipótesis nula de igualdad de medias que indica que esta diferencia no es estadísticamente significativa. Dicho en otras palabras, los promedios del CDR del grupo E280A no son estadísticamente diferentes de los del grupo DTA+E y las pequeñas diferencias observadas en las medias muestrales son producto del azar y no de una influencia del grupo diagnóstico en el resultado del CDR (t = 1.694; g.l.= 18; p = 0.107.
Los resultados de la contrastación de hipótesis usando la prueba t de Student para muestras independientes señalaron que los donantes que fueron diagnosticados con DTAF E280A presentaban mayores puntajes en la escala BLESSED que los del grupo DTA+E, superando en promedio los primeros a los segundos en seis puntos. Es decir, el grupo diagnóstico sí mostró resultados estadísticamente significativos en el test BLESSED (t = 2.607; g.l.= 13; p = 0.022).
Último resultado de Blessed para esta escala se disponía de los resultados de la aplicación de esta escala en 11 sujetos, siete ubicados en el grupo DTAF E280A y cuatro al DTA+E. Al comparar los promedios Blessed de los dos grupos bajo estudio, se observa que el grupo DTAF E280A exhibió un promedio mayor (10.43 ± 4.721 puntos) al del grupo DTA+E, cuyo promedio fue casi la mitad 5.25 ± 3.862, siendo menor la dispersión de este último grupo.
De acuerdo con el MMSE, ambos grupos de diagnóstico padecían deterioro cognitivo, el grupo diagnosticado con DTAF E280A exhibieron un promedio de 22.17 ± 13.176 puntos en tanto que el grupo DTA+E tuvo un promedio marcadamente menor (9.17 ± 8.963 puntos). Los resultados dejan ver una gran diferencia entre el promedio del MMSE del grupo DTAF E280A y el grupo DTA+E, la cual fue de 13 puntos, con lo cual se puede afirmar que los donantes diagnosticados con DTAF E280A obtuvieron mayores puntajes en el test MMSE que en promedio fueron 13 veces mayor que los del grupo DTA+E, siendo esta diferencia estadísticamente significativa ya que los valores de probabilidad llevan al rechazo de la hipótesis planteada. Estos resultados llevan a concluir que las diferencias en los promedios se derivan del diagnóstico DTAF E280A o DTA+E. Es decir, el diagnóstico sí influye de manera estadísticamente significativa en los resultados del test Minimental (t = 2.826; g.l.= 22; p = 0.010).
Barthel AVD. El Neurobanco de la Universidad de Antioquia disponía de los datos del test Barthel AVD de 28 donantes. Los que estaban clasificados como E280A (n = 12) tuvo un promedio de 17.08 ± 19.593 puntos y el promedio del grupo DTA+E (n = 16) registró un promedio ligeramente menor, siendo de 10.63 ± 14.245 puntos. La comparación de medias mediante la prueba t, indica que las diferencia observadas en los promedios del test Barthel AVD de los grupos diagnóstico no son estadísticamente significativas, ya que los valores de probabilidad no permiten rechazar la hipótesis nula. Esto indica que el grupo de donantes E280A no es diferente en sus resultados en el test Barthel del grupo DTA+E. El diagnóstico no ejerce influencia estadísticamente significativa en el resultado del test Barthel (t = 1.012; g.l.= 26; p = 0.321). (Tabla 1)
Tabla 1 Resumen de la prueba t de Student para muestras independientes para la comparación de medias de los tests CDR, BLESSED, FAST, MM SE y Barthel AVD, según el grupo de diagnóstico de los donantes con enfermedad de Alzheimer. Neurobanco del Grupo de Neurociencias de Antioquia Medellín, Colombia
| Test | Grupo | Media | Desviación típica | n | Diferencia de medias | t | gl | p |
|---|---|---|---|---|---|---|---|---|
| CDR | E280A DTA+E | 4,09 3,11 | 1,136 1,453 | 11 9 | 0.980 | 1.,694 | 18 | 0,107 |
| BLESSED | E280A DTA+E | 15,50 9.50 | 3,064 6,021 | 10 5 | 6.000 | 2,607 | 13 | 0,022* |
| ULTIMO BLESSED | E280A DTA+E | 10,43 5,25 | 4,721 3,862 | 7 4 | 5,179 | 1,855 | 9 | 0,097 |
| FAST | E280A DTA+E | 10,00 13,68 | 5,244 20,633 | 21 25 | -3,680 | -0,795 | 44 | 0,435 |
| MMSE | E280A DTA+E | 22,17 9,17 | 13,176 8,963 | 12 12 | 13,000 | 2,826 | 22 | 0,01** |
| BERTHEL AVD | E280A DTA+E | 17,08 10,63 | 19,593 14,245 | 12 16 | 6,458 | 1,012 | 26 | 0,321 |
Marcadores neuropsiquiátricos
Entre los marcadores neuropsiquiátricos, solo se registraron diferencias significativas en cuanto a la desinhibición, en el resto de marcadores no hubo diferencias estadísticamente significativas. Se aprecia entonces una tendencia de los pacientes E280A a no ser desinhibidos y los resultados de la prueba de Chi Cuadrado indican que sí existe asociación estadísticamente significativa entre estas variables. Por tanto, podemos concluir que la Desinhibición sí está asociada con el Diagnóstico (ᵡ2= 6.176; g.l. = 1; p = 0.023). La proporción de donantes con diagnóstico DTAF E280A con desinhibición es 7.7 veces menor (2.9%) que la de donantes cuyo diagnóstico era DTA+E (22.4%).
Marcadores neurológicos
En relación al análisis inferencial de los marcadores neurológicos encontrados, y solamente resultó mostrar asociación estadísticamente significativa el reflejo de Glabela (p = 0.031), y la Espasticidad (p = 0.033). El resto de los reflejos son independiente del diagnóstico (p > 0.05), es decir que se presentaron en proporciones similares en el subgrupo de DTAF E280A y en el de DTA+E. La prevalencia del reflejo de Glabela entre los donantes fue del 20.5%. Entre el grupo clasificado como E280A, la proporción de reflejo de Glabela presente fue de 32.4%, siendo esta cifra casi tres veces mayor a la registrada en el grupo de diagnóstico DTA+E (12.2%). Estas diferencias observadas en las frecuencias muestrales son producto de la existencia de relación entre el reflejo de Glabela y el diagnóstico (ᵡ2= 4.983; g.l. = 1; p = 0.031)
El porcentaje de donantes que presentaba espasticidad en la muestra era del 15.7%. Entre los donantes del grupo E280A, el 26.5% correspondió a espasticidad, y entre los donantes del grupo DTA+E esta proporción apenas alcanzó el 8.2%, es decir, fue 3.23 veces mayor la espasticidad en los DTAF E280A que en los DTA+E. Estas diferencias en las proporciones de espasticidad de los dos grupos de diagnóstico fueron estadísticamente significativas (ᵡ2= 5.093; g.l. = 1; p = 0.033), en otras palabras, la espasticidad y el diagnóstico no son independientes, sino que están relacionados desde el punto de vista estadístico.
Marcadores neuropatológicos
Por último, entre los marcadores neuropatológicos se encontró dentro de la atrofia del cerebro que el 34.5% de los donantes con EA presentaban atrofia global, siendo este tipo de atrofia la más predominante. Los donantes con atrofia difusa representaron poco más de una cuarta parte del total (27.3%), en tanto que la atrofia fronto- temporal abarcó el 14.5%. Y las menos comunes fueron atrofia bitemporal (3.6%) así como las atrofias occipital, parietal y temporal como casos únicos (1.8%).
Se contó solamente con los datos de 10 mesencéfalos. De estos, solo uno (10%) tenía aspecto normal. Entre las alteraciones encontradas de los mesencéfalos estudiados destacó la resencia de sustancia nigra bien pigmentada, con un 40%, luego el 30% de sustancia nigra con despigmentación leve o moderada.
En la exploración del cerebro de 22 de los donantes con EA se encontró que el 36.4% presentaba arterioesclerosis en vasos, bien sea leve, moderada o severa. Este mismo porcentaje reveló ateromatosis en diversos grados. Las placas ateromatosas en la basilar tuvo una frecuencia de 18.2%. Casos únicos de placas ateromatosas en la basilar y carótidas, así como de placas ateromatosas en carótidas internas (4.5%).
De los 21 cerebros analizados de los donantes con EA solo uno (4.8%) no presentaba dilatación ventricular. El resto mostró algún tipo de dilatación, siendo la más frecuente la dilatación leve a moderada con un 28.6%, seguido por la dilatación ventricular laterales con 23.8%. Otros tipos de dilatación observados fueron la dilatación del tercer ventrículo y laterales que abarcó un 14.3%, la simétrica y la dilatación ventricular / hidrocefalia del tercer ventrículo (9.5% c/u) y por último la dilatación del segundo ventrículo y la del tercer ventrículo (4.8% c/u).
Los datos de hipocampo de 8 donantes se distribuyeron del siguiente modo: presencia de atrofia en más de la mitad de los cerebros (62.5%), atrofia en ambos hipocampos en un 25% y solo un caso de gliosis (12.5%).
El último hallazgo que se registró fue la atrofia observada en los temporales de los cerebros de los donantes con DTA (83.3%). También hubo un 28.6% de atrofia en occipitales y apenas un caso (14.3%) con edema.
El peso del cerebro de los donantes, fluctuó entre 490 y 1260 gramos, con un peso promedio de 962.73 ± 153.91 gramos. Más de la mitad de los cerebros (64.3%) pesaba entre 900 y 1199 gramos, por lo que fueron clasificados como cerebro de bajo peso. El 28.6% pesaba menos de 900 gramos, es decir estaban atrofiados. El 7.1% restante presentaba un peso promedio. (Tabla 2)
Tabla 2 Clasificación de los donantes con enfermedad de Alzheimer, según peso del cerebro. Neurobanco del Grupo de Neurociencias de Antioquia, Medellín, Colombia.
| Peso del cerebro | N° | % |
|---|---|---|
| Atrofiado 100 - 899 g | 16 | 28.6 |
| Bajo peso 900 - 1199 g | 36 | 64.3 |
| Promedio 1200 - 1400 g | 4 | 7.1 |
| Total | 56 | 100.0 |
El peso promedio de la fosa posterior fue 149.13 ± 30.46 gramos, con peso mínimo y máximo de 100 y 250 gramos respectivamente. Casi la mitad de los cerebros (46.3%) pesaba entre 150 y 199 gramos, por lo que fueron clasificados como cerebro de peso promedio. El 34.1% pesaba entre 120 y menos de 150 gramos, es decir corresponden a bajo peso de la fosa posterior. El 12.2% estaban atrofiados, ya que la fosa posterior pesaba menos de 120 gramos. El 7.3% restante presentaba un peso superior a los 200 gramos. (Tabla 3).
Tabla 3 Clasificación de los donantes con enfermedad de Alzheimer, según peso fosa posterior. Neurobanco del Grupo de Neurociencias de Antioquia, Medellín, Colombia.
| Peso Fosa Posterior | N° | % |
|---|---|---|
| Atrofiado 70 - 119 g | 5 | 12.2 |
| Bajo peso 120 - 149 g | 14 | 34.1 |
| Peso promedio 150 - 199 g | 19 | 46.3 |
| Peso mayor ≥ 200 g | 3 | 7.3 |
| Total | 41 | 100.0 |
Los hallazgos neuropatológicos, mostraron que, para 56 observaciones del peso del cerebro el peso promedio es 962.53 ± 153.91 gramos. En cuanto al peso promedio de la fosa posterior se registró un valor de 149.13 ± 30.46 gramos (n = 41). Entre los donantes cuya enfermedad duró entre 1 y 5 años fue mayor la proporción (83.3%) del grupo con peso de la fosa posterior superior a 200 gramos.
Discusión
Las edades de muerte de los donantes oscilaron entre 42 y 92 años, con una edad promedio al morir de 67.46 ± 12.43 años (media ± desviación típica). Todos los que murieron antes de los 50 años pertenecían al grupo DTAF E280A, ninguno de los diagnosticados como DTA+E murió antes de los 50 años. Entre los que fallecieron a edades más tardías, es decir con más de 70 años, apenas uno (3.3%) presentaba la mutación E280A-PS1. De igual modo, los mayores porcentajes de muertos después de 70 años correspondieron a DTA+E (69%). Se aprecia una tendencia de los donantes DTAF E280A a morir a menor edad, en tanto que los subgrupos de diagnóstico DTA+E murieron a edades mayores. En otros estudios similares, la edad media de muerte es de 54,8 años (rango 38 a 65), sin diferencias significativas entre hombres y mujeres(3)
Esta muerte temprana en los donantes del grupo E280A va en la línea de lo ya descrito en literatura y parece deberse a la propia acción de la mutación. La Presenilina 1 es un componente esencial del complejo g-secretasa, responsable de la producción del péptido b-amiloide, considerado clave en la fisiopatogenia de la enfermedad. Esta mutación consiste en la sustitución de ácido glutámico por alanina en el codón 280 del gen de la PS1 en el cromosoma 14(3). Esta sustitución determina un aumento de los depósitos de b-amiloide en la corteza cerebral pero con predominio del b- amiloide de 42 amino-ácido(10)(11).
Los trastornos del lenguaje son los síntomas más notorios de las evaluaciones realizadas a ambos grupos con EA. La pérdida progresiva del lenguaje representó la mayor prevalencia de estos trastornos (40.2%). Otro de los trastornos de mayor prevalencia en la investigación ha sido la anomia con 31.7% de prevalencia, coincidiendo con el un estudio realizado por Cummings JL.(12), donde también identificaron la anomia como un marcador cognitivo precoz de la EA; aparece en los estadios iniciales de la enfermedad, con conservación de los componentes fonológicos, práxicos y gramaticales del lenguaje. En un estudio similar en nuestro país realizado por Tirado V. et al(13) encontraron que los errores semánticos cualitativos en la prueba de denominación pueden constituir un signo preclínico en los portadores de mutación de la presenilina 1 para EA. El mutismo y la afasia representaron el 24.4% y 22.9% respectivamente.
De entre los Trastornos de la memoria analizados, la reiteración es el único síntoma donde se registraron diferencias significativas en los dos grupos de estudio. En este sentido, se observó que es mayor el porcentaje de donantes que manifestaron reiteración cuyo diagnóstico era E280A (41.2%) que en el grupo de DTA+E, en el que se obtuvo una presencia de este síntoma en 18.4%. De esta manera, la reiteración como queja de memoria en portadores de la mutación E280A coincide con otros estudios realizados y además, podrían representar la etapa inicial de la enfermedad(14).
Del total de cruces de variables que conformaban el grupo de trastornos neuropsicológicos, solamente resultaron significativas las variables desorientación espacial (p = 0.038), apraxia (p = 0.021) y problemas de Atención (p = 0.006). En una investigación dirigida por Menno Witter y su equipo mostraron que existen conexiones directas entre la corteza entorrinal y la región CA1 del hipocampo(15) para convertirse en un centro de la información espacial. En relación a las apraxias coincidimos con las más frecuentes en EA como son la apraxia del vestir (el paciente no logra vestirse por sí solo), la apraxia ideomotora y la apraxia constructiva. En estudios similares concluyeron que también los problemas atencionales podrían ser los síntomas más tempranos de la EA, cuando no hay sintomatología clínica objetiva(16).
Hallazgos neuropatológicos. Los cambios macroscópicos referidos en este estudio tales como la pérdida de neuronas, atrofia cerebral progresiva con profundización de surcos y cisuras, adelgazamiento de las circunvoluciones y de los hipocampos y dilatación del tercer ventrículo y de los ventrículos laterales, disminución del peso encefálico rectifican lo hallado en un estudio previo realizado por Duque-Castaño y colaboradores(17) de individuos en los que se había demostrado su condición de portadores de la mutación E280A de la PS1 en el cromosoma 14.
Con respecto a la correlación existente entre peso del cerebro y duración de la enfermedad no encontramos correlación alguna coincidiendo con algunos estudios que indagaron sobre ello, Arantxa Guimerà(18) afirma que existe una correlación negativa entre el peso del encéfalo y el tiempo de evolución de la enfermedad e igualmente fue un hallazgo neuropatológico en la investigación de Duque-Castaño(17). Recientemente hallamos un resultado similar al nuestro, donde tampoco se pudo demostrar alguna relación entre el peso del cerebro y la duración de la enfermedad(19). Por otro lado, la correlación existente referida en esta investigación entre peso encefálico y peso de la fosa posterior no se encontró en la literatura científica resultados similares que pudiéramos comparar hallazgos.
En los casos E280A se identificó una relación inversa entre peso encefálico, duración de la enfermedad, y edad de muerte, lo que confirma lo descrito tradicionalmente para la EA, y es que los pacientes cuya edad al momento de la muerte es mayor han cursado con un cuadro demencial de mayor duración y éste se asocia con una pérdida de células nerviosas de gran magnitud. Es decir, lo que se observa en el cerebro de una persona que ha fallecido con EA es un cerebro que presenta una atrofia en la que las circunvoluciones quedan estrechadas y los surcos ensanchados, además de presentar un peso inferior y sufre la mayor pérdida neuronal en el córtex entorrinal, hipocampo, córtex parietal, temporal y frontal(20).
Para efectos del análisis de relación entre peso de la fosa posterior y duración de la enfermedad, se recodificó la variable peso de la fosa posterior, con el objetivo de dicotomizar en dos categorías de peso de la fosa posterior. En tal sentido, se agruparon en peso menor a 200 gramos (que incluía atrofiado y bajo peso) y mayor o igual a 200 gramos (promedio y mayor peso) (Figura 1.).
Conclusiones
Los pacientes diagnosticados E280A comienzan a sufrir la enfermedad antes de los 50 años y mueren antes de los 50 años, mientras la DTA+E aparece a edades mayores (≥ 65 años de edad).
Tener un antecedente familiar de E280A, te hace susceptible a padecer DTA con mutación E280A, mientras que los antecedentes personales (tabaquismo, alcoholismo) no influyen en el diagnóstico de la enfermedad.
Los donantes con E280A tienen tendencia a padecer convulsiones, mioclonias, en tanto que los DTA+E en su mayoría no lo padecen; pero sí suelen presentar trastornos alimenticios, en cambio los E280A no.
La depresión es el mejor marcador conductual para establecer diagnostico ya que los donantes diagnosticados con E280A tienden a padecer depresión mientras que los DTA+E no.
La repetidera, la apraxia y los problemas de atención se da con mayor frecuencia en los pacientes diagnosticados con E280A, mientras que los donantes del grupo DTA+E padecen en mayor proporción desorientación espacial.
Los test que mejor discriminan el diagnóstico son test BLESSED y el Minimental.
La deshinbición es el mejor marcador neuropsiquiatrico para establecer diagnostico ya que los pacientes con E280A tienden a no ser desinhibidos.
El reflejo de Glabela y la espasticidad son los marcadores neurológicos que mejor clasifican la muestra, ambos aparecen en mayor proporción en los donantes diagnosticados E280A.
Existen diferencias neuropatológicas entre DTA+E y E280A que pueden estar asociadas a la fisiopatología de la forma hereditaria de E280A.
El peso del cerebro y de la fosa posterior tienen una correlación sistemática. Es decir, que a mayor peso del cerebro, mayor peso de la fosa posterior y viceversa. Sin embargo, no existe una correlación clara entre peso fosa posterior y duración de la enfermedad.
La variabilidad puede deberse a la coexistencia e interacción de la patología propia de la DTA con otras patologías.
La DTA puede manifestarse clínicamente por «variedades» neocorticales que siguen pautas alejadas a la clínica tradicional.
La heterogeneidad de la DTA obstaculiza realizar el diagnóstico de la misma y revela la factible intrusión de factores etiopatogénicos de diversa complejidad no hereditarios como genéticos.