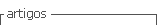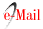INTRODUCCIÓN
Como se ha mencionado previamente, las enfermedades neurológicas no transmisibles - en particular las enfermedades cerebrovasculares - representan una de las nuevas epidemias de salud de países en vías de desarrollo de América Latina.(1) Uno de los mayores limitantes para la realización de estudios neuro-epidemiológicos de calidad en áreas rurales de estos países es la escasa disponibilidad de estudios de neuroimagen y los altos costos que implica trasladar a poblaciones enteras hacia zonas urbanas donde dichos equipos se encuentran disponibles.(2) Como en el Proyecto Atahualpa hemos tenido la posibilidad de realizar dichos estudios, incluyendo tomografía computada (TC) e imagen por resonancia magnética (IRM), hemos intentado encontrar biomarcadores simples y de bajo costo que permitan identificar candidatos óptimos para la práctica de estudios de neuroimagen y minimizar, en futuros estudios, el costo inherente a la realización de dichos estudios. En el presente estudio describimos la experiencia de nuestro grupo al respecto.
ÍNDICE TOBILLO-BRAZO
El índice tobillo-brazo (ankle-brachial index, o ABI por sus siglas en Inglés) es un procedimiento confiable para el diagnóstico no invasivo de enfermedad arterial periférica, una condición que afecta a más de 200 millones de personas alrededor del mundo.(3) Por otra parte, algunos estudios han sugerido la utilidad de un ABI anormal como predictor de la ocurrencia de eventos cerebrovasculares e infarto de miocardio. (4) (5) (6) (7) Sin embargo, es poco lo que se sabe acerca del valor del ABI como predictor de marcadores silentes de enfermedad cerebral de pequeño vaso, con excepción de algunos estudios realizados en Japón, donde se sugiere que los infartos lacunares silentes se asocian con alteraciones en la circulación arterial de las piernas.(8) (9) (10)
La determinación del ABI es relativamente sencilla. De acuerdo con las sugerencias de la AHA, éste debe ser medido con las personas acostadas en posición supina bajo temperaturas confortables.(11) Se comienza determinando la presión arterial en ambos brazos y piernas, mediante el uso de un esfigmomanómetro y un Doppler vascular portátil (con transductor de 8 MHz), siguiendo una secuencia en contra de las manecillas del reloj, comenzando en el brazo derecho y siguiendo con la arteria tibial posterior derecha, la arteria dorsal del pie derecho, la arteria dorsal del pie izquierdo, la arteria tibial posterior izquierda y el brazo izquierdo. El ABI se calcula dividiendo el valor más alto de entre las determinaciones de presión en las arterias tibial posterior y dorsal del pie en cada pierna para la presión sistólica más alta obtenida en los brazos (izquierdo o derecho). El ABI más bajo entre los dos tobillos se utiliza como valor final para motivos de clasificación, y un ABI ≤0.9 debe ser considerado como positivo para enfermedad arterial periférica. Cuando el ABI en una pierna es ≥1.4 y >0.9 en la otra, debe considerarse la presencia de arterias no compresibles (calcinosis).
Como parte del Proyecto Atahualpa, realizamos un estudio en 224 personas ≥60 años, sin evidencia clínica de enfermedad cerebrovascular, que fueron sometidas a IRM y a determinación de ABI. (12) En dicho estudio se encontró un ABI ≤0.90 en 37 personas y de ≥1.4 en 17. Los estudios de IRM revelaron infartos lacunares silentes en 27 casos, hiperintensidades de sustancia blanca de tipo moderado-severo en 47 y micro-sangrados cerebrales en 26. Los modelos de regresión logística, ajustados por variables demográficas y factores de riesgo cardiovasculares mostraron una asociación entre infartos lacunares silentes y ABI anormal (Figura 1), en particular, la relación fue significativa para valores de ABI ≤0.90 (O.R.: 3.72, 95% C.I.: 1.35 - 10.27, p=0.01) y ABI ≥1.4 (O.R.: 3.85, 95% C.I.: 1.06 - 14.03, p=0.04). Las hiperintensidades de sustancia blanca de tipo moderado-severo se asociaron con ABI ≤0.90 (p=0.03) y ABI ≥1.4 (p=0.02), pero exclusivamente en los análisis univariados, despareciendo dicha relación en los modelos de regresión. Por otra parte, no hubo ninguna asociación entre un ABI anormal y la presencia de micro-sangrados cerebrales. En este estudio, los individuos aparentemente sanos ≥60 años con ABI anormal, tuvieron casi 4 veces más probabilidades de tener un infarto lacunar silente que aquellos con ABI normal. Esto sugiere que un tamizaje con determinación de ABI permite reconocer individuos asintomáticos que necesitan estudios de imagen y tratamiento especializado.
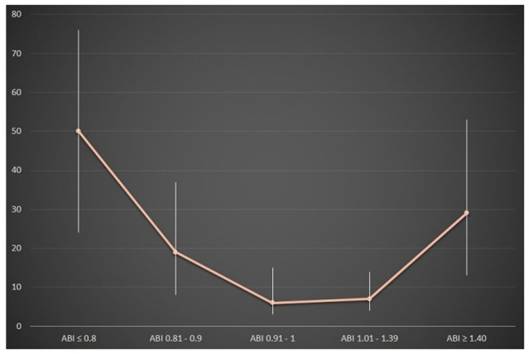
Figura 1 Gráfico que muestral la relación entre la probabilidad de tener infartos lacunares silentes (eje vertical) y el nivel de índice tobillo-brazo (ABI). Se nota una curva, con los porcentajes más altos en personas con enfermedad arterial periférica (ABI ≤ 0.8) y luego en aquellos con calcinosis (ABI ≥ 1.4).
Por otra parte, la determinación del ABI ha demostrado ser de utilidad para la detección de individuos con aterosclerosis extra e intracraneal en caucásicos y asiáticos. (13) (14) (15) En un estudio en 302 personas ≥60 años enroladas en el Proyecto Atahualpa, que fueron sometidas a TC y a determinación de ABI, 45 (15%) personas tuvieron un ABI ≤0.90 y 25 (8%) un ABI ≥1.4. La TC reveló calcificaciones del sifón carotideo Grado 1 en 98 (32%), Grado 2 en 91 (30%), Grado 3 en 83 (28%) y Grado 4 en 30 (10%) participantes. En un modelo multivariado de regresión ordinal, las personas con ABI anormal tuvieron dos veces más probabilidades de tener calcificaciones en el sifón carotideos que aquellos con ABI normal, luego de ajustar por variables demográficas y factores de riesgo cardiovasculares (OR: 2.18; C.I.: 1.29 - 3.69; p=0.004), concluyendo el ABI es un procedimiento simple y de bajo costo, que permite identificar sujetos con aterosclerosis intracraneal y riesgo de enfermedad cerebrovascular(16)
RELACIÓN NEUTRÓFILOS-LINFOCITOS
El aumento en la relación entre neutrófilos y linfocitos ha sido previamente asociado con enfermedades cardiacas y cerebrovasculares.(17) (18) (19) (20) Sin embargo, su utilidad para identificar individuos con enfermedad silente de pequeños vasos cerebrales no ha sido establecida. Utilizando la estructura del Proyecto Atahualpa, realizamos un estudio de 259 personas ≥60 años que habían sido sometidas a IRM y se determinó la relación neutrófilos-linfocitos, luego de obtener una muestra de sangre y procesarla utilizando un equipo analizador de hematología marca Sysmex XN-3000 (Kobe, Japón). Los individuos seleccionados para el presente estudio, además de encontrarse libres de enfermedad cerebrovascular, no tenían evidencia de enfermedad pulmonar obstructiva crónica, no tenían evidencia alguna de infección en la semana previa a la toma de sangre, no se encontraban recibiendo terapia inmuno-supresora y tenían un conteo de leucocitos en rango normal (4,000 - 10,000 por mm3). Los valores promedio fueron de 6,225 ± 1,303 por mm3 para el contaje leucocitario total, de 3,541 ± 1,051 por mm3 para neutrófilos y de 1,994 ± 533 per mm3 para linfocitos. El promedio de la relación neutrófilos-linfocitos fue de 1.9 ± 0.8. Con respecto a los marcadores de neuroimagen de enfermedad de pequeño vaso, 54 (20.8%) tuvieron hiperintensidades de sustancia blanca moderada-severa, 27 (10.4%) tuvieron infartos lacunares silentes, 18 (6.9%) micro-sangrados cerebrales y 66 (25.5%) >10 espacios periventriculares dilatados.
La confiabilidad de la relación neutrófilos-linfocitos para identificar individuos con marcadores de enfermedad de pequeño vaso silente, fue estimada utilizando un valor de corte pre-establecido para dicha relación de 2.8.(21) La sensibilidad y el valor predictivo positivo de la relación neutrófilos-linfocitos para detectar marcadores de enfermedad de pequeño vaso fueron muy bajos, pero la especificidad y el valor predictivo negativo fueron altas (Tabla 1). Estos datos nos sugieren que la mayoría de personas con enfermedad de pequeño vaso van a permanecer no diagnosticados si se utiliza la relación neutrófilos-linfocitos, pero que aquellos que tengan un valor por encima del propuesto (2.8), van a tener por lo menos un marcador de imagen positivo. Si esta relación va a ser utilizada en poblaciones para detectar individuos con sospecha de enfermedad de pequeño vaso, debe ser utilizado en combinación con otros biomarcadores no-invasivos que sean altamente sensitivos, tales como los procedimientos destinados a valorar rigidez arterial.(22) (23)
Tabla 1 Confiabilidad de la relación neutrófilos-linfocitos para detector marcadores silenciosos de neuroimagen de enfermedad de pequeño vaso, en 259 residentes de Atahualpa ≥60 años. Todas las determinaciones incluyen intervalos de confidencia del 95%.
| Sensibilidad | Especificidad | Valor predictivo positivo | Valor predictivo negativo | |
| Hiperintensidades de substancia blanca moderadas-severas | 7.4% (2.4 - 18.7) | 88.3% (82.9 - 92.2) | 0.14 (0.05 - 0.34) | 0.78 (0.72 - 0.83) |
| Infartos lacunares | 22.2% (9.4 - 42.8) | 90.5% (85.8 - 93.8) | 0.21 (0.09 - 0.41) | 0.91 (0.86 - 0.94) |
| Micro-sangrados profundos | 11.1% (1.9 - 36.1) | 89.2% (84.4 - 92.7) | 0.07 (0.01 - 0.25) | 0.93 (0.89 - 0.96) |
| Más de 10 espacios perivasculares dilatados | 12.1% (5.7 - 23) | 89.6% (84.2 - 93.4) | 0.29 (0.14 - 48.9) | 0.75 (0.69 - 0.8) |
RETINOPATÍA HIPERTENSIVA
Por ser la retina parte del sistema nervioso central(24) y debido a la facilidad de ser valorada mediante oftalmoscopía, la retina es una especie de “ventana hacia el cerebro”, donde se pueden reconocer una serie de padecimientos neurológicos (hipertensión endocraneal, hemorragias subaracnoideas, neuromielitis óptica, etc). Visto de este modo, existen estudios que sugieren una correlación entre retinopatía hipertensiva y marcadores de enfermedad cerebral de pequeño vaso y el reconocimiento de una retinopatía hipertensiva podría ser utilizado como una alternativa de muy bajo costo para identificar sujetos con marcadores silentes de enfermedad de pequeño vaso en estudios poblacionales realizados en áreas remotas. (25) (26) (27) (28)
En un estudio del proyecto Atahualpa, en el que se incluyeron 241 personas ≥60 años con hipertensión y pre-hipertensión arterial, que habían sido estudiados con IRM, se tomaron fotografías de retina con un aparato Easy Scan v1.2 (i-Optics B.V., Holanda) que permitieron valorar la retina sin necesidad de dilatación pupilar. Estos exámenes fueron interpretados con un oftalmólogo calificado, ciego al grado de daño cerebral. Cambios compatibles con retinopatía hipertensiva se observaron en 132 sujetos (55%), la mayoría de los que tuvieron retinopatía Grado I (68%). Los modelos de regresión logística, ajustados por variables demográficas y factores de riesgo cardiovasculares, mostraron una asociación significativa entre retinopatía hipertensiva Grados 2-3 y la presencia de hiperintensidades de sustancia blanca moderada-severa (OR: 3.87, 95% C.I.: 1.64 - 9.13, p=0.002), pero no con infartos lacunares (OR: 2.22, 95% C.I.: 0.83 - 5.92, p=0.111).(29) En resumen, este estudio demostró que las personas con retinopatía hipertensiva Grados 2-3 tienen casi 4 veces más probabilidades de tener hiperintensidades de sustancia blanca moderada-severa, lo cual sugiere que la toma de fotografías retinianas puede ser utilidad para predecir que personas deben ser sometidas a estudios de neuroimagen (Figura 2).
DOPPLER TRANSCRANEAL
El Doppler transcraneal (DTC) ha sido sugerido como una alternativa para identificar personas con enfermedad silente de pequeños vasos cerebrales, mediante el cálculo de índice de pulsatilidad de la arteria cerebral media, el cual se ha correlacionado con hiperintensidades de sustancia blanca de origen vascular.(30) (31) (32) Con tal objeto, realizamos un estudio piloto en 73 personas ≥65 años, seleccionadas aleatoriamente, libres de enfermedad cerebrovascular clínicamente evidente y de fibrilación auricular, que tengan patencia de los vasos intracraneales documentado en angio-resonancia. Para fines del estudio, se grabaron las velocidades sistólicas pico, las velocidades de fin de diástole, las velocidades de flujo medio y el índice de pulsatilidad de ambas arterias cerebrales medias y vértebro-basilares. El índice de pulsatilidad de cada una de estas arterias fue calculado de acuerdo con la ecuación de Gosling (velocidad sistólica pico menos velocidad de fin de diástole dividido para velocidad de flujo medio). Para el caso de las arterias cerebrales medias, el índice de pulsatilidad se calculó promediando las dos arterias (a menos que el sujeto tenga solamente una ventana permeable) y el índice de pulsatilidad vertebrobasilar se calculó promediando el de la arteria basilar y ambas vertebrales.(32)
Para comenzar, no hubo diferencias en el índice de pulsatilidad de la arteria cerebral media y la izquierda (1.14 ± 0.22 versus 1.13 ± 0.19, p=0.774), ni entre los índices de pulsatilidad de la arteria vertebral derecha, la izquierda y la arteria basilar (1.19 ± 0.29 versus 1.2 ± 0.28 versus 1.15 ± 0.26, respectivamente; p=0.529). Si bien los análisis univariados mostraron asociación entre los índices de pulsatilidad de las arterias cerebrales medias y vertebrobasilares con la presencia de hiperintensidades moderadas a severas de sustancia blanca, esta asociación desapareció en las regresiones multivariadas, sugiriendo que, al menos en nuestra población, el TCD no es de utilidad para predecir la presencia de enfermedad difusa de pequeño vaso (Tabla 2).(33) Estos resultados negativos se deben, aparentemente, a que el índice de pulsatilidad no solamente refleja la resistencia cerebrovascular distal (como en la enfermedad de pequeño vaso), sino también puede resultar de rigidez de arterias de mediano calibre o de factores hemodinámicos.(34)
Tabla 2 Correlación entre los índices de pulsatilidad de las arterias cerebrales medias y vertebrobasilares de acuerdo con las diferentes categorías de hiperintensidades de substancia blanca (HSB), en modelos univariados y en multivariados (ajustados por variables demográficas y factores de riesgo cardiovasculares). Es notoria la pérdida de significancia en los modelos multivariados, sugiriendo ausencia de relación independiente entre las dos variables principales.
| Serie total | HSB ausentes o leves | HSB moderadas o severas | Análisis univariado | Modelo linear generalizado | |
| Índice de pulsatilidad promedio en arteria cerebral media (n=44) | 1.15 ± 0.21 | 1.10 ± 0,16 | 1.22 ± 0.24 | p = 0.053 | β: 0.065 95% C.I.: -0.084 - 0.177 p = 0.474 |
| Índice de pulsatilidad promedio en arterias vertebrobasilares (n=70) | 1.18 ± 0.23 | 1.11 ± 0.16 | 1.29 ± 0.27 | p = 0.001 | β: 0.066 95% C.I.: -0.024 - 0.156 p = 0.146 |
COMENTARIO
Como se mencionó previamente, es fundamental encontrar un biomarcador de bajo costo y universalmente disponible, para detectar con precisión las personas que necesitan estudios de neuroimagen en regiones donde esta tecnología no se encuentra disponible. >en el Proyecto Atahualpa, hemos encontrado algunos marcadores razonablemente aceptables, pero no óptimos, por lo que la búsqueda debe continuar, por lo menos para la identificación de personas en riesgo de sufrir eventos cerebrovasculares catastróficos.