Introducción.
La Organización Mundial de la Salud (OMS) y la Organizacion Panamericana de la Salud (OPS) definen al Virus del Papiloma Humano (VPH) como una infección predominantemente por contacto sexual, siendo una de las cuatro patologías infecciosas más común (Organización Mundial de la Salud [OMS], 2017; Organización Panamericana de la Salud [OPS], 2020). El VPH es uno de los principales causantes de lesiones malignas en cabeza, cuello y orofaringe (Hanna et al., 2020; Mirghani, Amen, Moreau y Lacau, 2015). El cáncer orofaríngeo a nivel mundial incrementó su incidencia y mortalidad. Existen más de 100 tipos virales de VPH y 40 genotipos se asocian hasta la fecha con las infecciones anales, genitales y orales. Según la Sociedad Epidemiológica de Cáncer se clasifican en tres tipos. Alto riesgo: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68,73, y 82. Mediano riesgo: 26, 53 y 66. Bajo riesgo: 6, 11, 40, 42, 43, 44 y 70. El VPH de mayor frecuencia es el 16 en un 75% y el 18 en un 30% en las lesiones malignas de células escamosas de la orofaringe, mundialmente (Alveiro, 2016; Piotto, Kerkhoff Utzig, Shigueyasu Yamada y Cunha Prates, 2020; Wagner et al., 2017). Por otro lado, como describe el Centro Global de Estadísticas en el año 2018 el Carcinoma de Células Escamonas de Cabeza y Cuello (CCSCC) fue la séptima neoplasia maligna más común en el mundo con 890.000 nuevos casos y 450.000 muertes (Bray et al., 2018).
Desde la perspectiva de la International Agency of for Research (IARC, 2019) la incidencia de VPH es mayor en hombres sexualmente activos, aunque pacientes masculinos y femeninos que llevan una vida sexual activa tienen una infección por VPH. Las primeras investigaciones realizadas en pacientes con cáncer oral y de orofaringe se encontró la presencia de VPH, por lo que en 1976 se consideraba que era el iniciador de la carcinogénesis en estos tejidos (Contreras y Venegas, 2015). No obstante, en el 2010 los expertos de la Asociación Dental Americana (ADA) reconocieron oficialmente al VPH como un factor de riesgo determinante en el desarrollo del cáncer orofaríngeo (Association American Dental, 2012). Ante lo expuesto, el objetivo de este artículo es describir el Virus del Papiloma Humano, la prevención de la infección, los medios de contagio y su relación con el cáncer orofaríngeo.
Metodología.
El presente artículo, de enfoque cualitativo y de tipo descriptivo, está basado en la técnica de revisión bibliográfica, a través de la revisión de artículos académicos publicados en revistas científicas, por lo que se analizaron las bases de datos de: PubMed, SciELO, International Journal of Dentistry y el European Journal of Oral Sciences; y, el metabuscador: Google académico (inglés y español). Adicionalmente, se toma en cuenta páginas oficiales en el área de salud, tales como: la Organización Mundial de la Salud (OMS), la Organización Panamericana de Salud (OPS), la Asociación Dental Americana (ADA), el Ministerio de Salud Pública del Ecuador (MSP) y la Sociedad de Lucha Contra el Cáncer (SOLCA). La búsqueda de las publicaciones se realizó a partir del año 2002 hasta el 2021; las palabras clave que se emplearon para la investigación son: carcinoma de células escamosas; neoplasias de cabeza y cuello; neoplasias de la boca; neoplasias de la orofaringe; pruebas de ADN del papilloma virus humano. En la búsqueda bibliográfica se seleccionaron 280 documentos, de los cuales 107 fueron tomados en cuenta para la investigación, 29 casos clinicos (25%), 24 revisiones bibliograficas (22%), 29 documentos de páginas oficiales en el área de la salud (27%), 6 estudios descriptivos y transversales (6%), 3 revisiones sistematicas (3%), 3 estudios retrospectivos (3%), 13 documentos como: informes, analisis de casos clinicos, estudios cohorte, estudios prospectivos y observacionales (12%). Para el desarrollo de la investigación se incluyeron ensayos y casos clínicos de pacientes tanto masculinos como femeninos que proporcionaron información acerca del Virus del Papiloma Humano y la relación con cáncer orofaríngeo. No se consideraron artículos basados en estudios de mujeres embarazadas, asociación del Virus del Papiloma Humano con enfermedades cardiacas, metabólicas, pulmonares o renales y pacientes pediátricos que se hayan infectado con el virus al momento del parto.
Resultados.
Desde el punto de vista de Natunen, Söderlund, Petäjä, Eriksson, y Jokiranta (2017); Montero (2018); Salazar Ruales et al. (2018), la clasificación del VPH es variada, aproximadamente 120 tipos de VPH son capaces de infectar al ser humano, de los cuales el VPH 13-32-31-1 tiene mayor incidencia bucal; aquellos con mayor riesgo oncogénico son VPH 16-18. Las lesiones malignas a nivel oral son: el carcinoma de células escamosas, la eritroplasia, la eritroleucoplasia y la leucoplasia; en pacientes cuyas edades oscilan entre los 30 a 70 años. Mientras que las lesiones benignas mayormente encontradas son el papiloma bucal, la verruga vulgar, el condiloma acuminado y la hiperplasia epitelial.
Historia del virus del papiloma humano.
El Virus del Papiloma Humano (VPH) pertenece a la familia Papïllomaviridae, descrito por primera vez a finales del siglo XX. Los papilomavirus se encuentran distribuidos en la naturaleza e infectan a la mayor parte de los mamíferos y los reptiles (Rodríguez, Osorio y García Perdomo, 2020). Además, este virus tiene un tropismo bastante determinado por las células cutáneas del epitelio escamoso estratificado y de la mucosa (Lopez y Ezquerra, 2019). Respecto a su historia evolutiva se presume que puede tener aproximadamente 300 millones de años (Burk et al., 2011). Cabe señalar que, el VPH tiene un tamaño de (50nm); no encapsulados muestran una simetría icosaédrica, con 72 capsómeros y una doble cadena circular de ácido desoxirribonucleico (ADN) de unos 8.000 pares de bases (Doorbar, Egawa, Griffin, Kranjec y Murakami, 2015). En el año 2002 había 100 variantes del virus (Rivera, 2002), en el año 2015 aumentó a 120 subtipos (Cháirez et al., 2015); mientras que, para el año 2018 se habían detectado 300 variantes del virus, de los cuales 120 son capaces de infectar al ser humano (Montero, 2018).
Criterios de clasificación del VPH.
El Virus del Papiloma Humano se puede clasificar según la capacidad de causar lesiones, según el tejido afectado y tipo de lesión que provoca. En primer lugar, en aquellos que ocasionan lesiones en los tejidos cutáneos, en este grupo se considera el VPH B, G, M, N-PV. En segundo lugar, aquellos que causan lesiones a nivel de la mucosa, considerando el PV-A (López y Ezquerra, 2019). En tercer lugar, los que poseen la capacidad de desencadenar displasias y procesos neoplásicos. Por último, según el riesgo oncogénico: de alto riesgo, de mediano riesgo y de bajo riesgo (Galindez Costa y Gilligan, 2020).
Alpha Papillomaviridae (Alfa - PV): Suele afectar al epitelio cutáneo y mucoso del tracto anogenital y oral causando verrugas y lesiones neoplásicas (Farreras, 2019). En esta clasificación se consideran los tipos: Alfa - PV: 2-4-7-9. Aunque también se asocian: Alfa - PV: 12-11-6-5-10- 8-1-13-3-14-1-4 Virus Taxonomy ( ICTV, 2019).
Beta Papïllomaviridae (Beta-Pv): Pueden causar infecciones latentes que suelen tener importancia clínica en pacientes inmunológicamente comprometidos (Farreras, 2019). Con base en el estudio realizado por (Pfister, 2015) el VPH con ADN Beta-Pv fue: 8-20-36-38.
Gamma Papïllomaviridae (Gamma-Pv): Causan papilomas y verrugas cutáneas, en este grupo se incluyen: VPH: 13-1-8-0-3 (Farreras, 2019).
De acuerdo con Doorbar et al. (2015) el VPH beta y gamma evolucionaron al punto de ocasionar infecciones crónicas inaparentes, produciendo viriones en ausencia de patología aparente. Mientras que los Alfa - PV han desarrollado tácticas de inmunoevasión que les permiten provocar papilomas visibles persistentes.
Mu - Nu Papïllomaviridae (Mu-Pv): se incluyen a todos los tipos de VPH causantes de lesiones papilomatosas y cutáneas (Farreras, 2019).
Contagio e infección por VPH.
Por lo que se refiere a la transmisión del VPH, este virus se transmite con frecuencia durante el contacto sexual directo (Schiffman et al., 2016). Una vez que el virus entra en el organismo causa cambios intraepiteliales influyendo el tejido para su proliferación (Montero, 2018). Como mencionan Berman y Schiller (2017), en la orofarínge el epitelio naturalmente discontinuo es susceptible a traumas mecánicos; por lo que, las células basales infectadas se diferencian para llenar el área alterada, dando como resultado una infección activa. Lo que explicaría, por qué el epitelio escamoso que reviste el anillo de Waldeyer es más susceptible a la infección por VPH. Dicho de otro modo, es más fácil para el virus introducirse e infectar a las células basales de la mucosa de las amígdalas por la discontinuidad del propio epitelio (Pennacchiotti, Sáez, Martínez, Cárcamo y Montes, 2016). Todo esto parece confirmar que, las células infectadas podrían ser responsables del cáncer en diferentes sitios anatómicos de la boca (Landy y Chaturvedi, 2021).
En relación con los factores etiológicos, la infección por VPH puede darse por diferentes medios. Las Infecciones de Transmisión Sexual (ITS) son las primeras vías de contagio del virus. Siendo más comunes las de VPH con 50 millones de casos en Latinoamérica y 250.000 millones a nivel mundial (Alvarez Arroyo, 2020; Bustamante Ramos, Martínez Sánchez, Tenahua Quitl, Jiménez y López Mendoza, 2015). Es importante mencionar que el VPH no solo se transmite a través del coito, sino mediante otros comportamientos sexuales sin necesidad de penetración (Lupiani y Jiménez, 2019). Aunque se debe agregar que las partículas víricas infectocontagiosas deben de estar expuestas a micro lesiones o micro abrasiones del tejido para que haya una infección (Syrjanen, 2018).
Factores que influyen en la infección de VPH: según Bustamante et al. (2015), cietos factores tales como a la educación, las condiciones socioeconómicas, la poca higiene, la vida sexual a temprana edad, las relaciones íntimas sin protección, las múltiples parejas sexuales favorecen a una infección por VPH. Además, el uso de sustancias toxicas que alteran al funcionamiento normal del organismo como las drogas, el alcohol y el tabaco.
Coexistencia de infecciones: los pacientes que viven con ciertas infecciones recurrentes como el herpes tipo 2, la clamidia, la vaginosis bacteriana, la candidiasis, los pacientes con el Virus de Inmunodeficiencia Humana (VIH). En estos pacientes que tienen un sistema inmunológico comprometido se genera una deficiente respuesta del sistema inmune. Que condiciona al paciente a una infección por VPH (Espinoza et al., 2015).
Factores condicionantes y conductuales: existen dos aspectos importantes acerca de los factores conductuales y condicionantes. Primero, los anticonceptivos orales influyen en los factores hormonales que actúan en la transcripción del ADN del VPH. Segundo, los pacientes fumadores de tabaco tienen un 2% mayor de incidencia de VPH16 (Fakhry Gillison y D’Souza, 2014). Por consiguiente, Torres y Madrid (2015) mencionan que el tabaco disminuye la acción y cantidad de las células Langerhans, que son las responsables de la activación de la inmunidad celular local.
Contagio por contacto no sexual: la infección por contacto no sexual puede ser atreves de fómites. Los denominados fómites ayudan a extender la enfermedad mediante la contaminación de los dedos, boca o piel que no involucre contacto sexual (Torres y Madrid, 2015). Como mencionan Mendoza et al. (2020) y Nyitray (2020) el VPH es muy resistente al calor. Por lo que posee características de termo estabilidad, lo mismo ocurre con ciertos agentes como el éter. Estas capacidades de resistencia le confieren al VPH la ventaja de permanecer en ambientes secos, lugares médicos y no médicos durante días. También, Dumitrascu et al. (2020) informan que después de haber pasado 7 días el virus en deshidratación aún posee el 30% de infectividad. Por lo que, al permanecer el VPH sobre las superficiescies, favorece a que las personas se infecten a través de fómites contaminados (Boccardo, 2021).
Carcinogénesis del VPH.
Referente a la carcinogénesis las proteínas que se sintetizan en etapas tempranas de la infección se denominan proteínas tempranas o E (Early). Mientas que las que se sintetizan en las etapas tardías son llamadas tardías o L (Late). Las proteínas E son las encargadas de la regulación, replicación viral y de la capacidad carcinogénica (Prado Peláez, Hernández Pacheco, Ruvalcaba Ledezma y Ceruelos Hernández, 2021). Durante la replicación del ADN se sintetizan proteínas E desde la E1-E7 y dos proteínas tardías L1-L2 (Berman y Schiller, 2017). Las oncoproteínas virales que actúan sobre la oncogénesis son la E6 y E7, las cuales causan la inmortalización de las células. La proteína E6 actúa directamente sobre el suspensor tumoral p53, afectando a la apoptosis celular. Simultáneamente, la proteína E7 actúa sobre la inactivación de la retinoblastoma, que tiene la activad suspensora tumoral (Valls et al., 2019). Conviene mencionar que los prótidos oncogénicos del E6 y E7 se encuentran independientemente del estado de integración del virus en la célula (Mata Rocha, 2019). Por lo que las propiedades oncogénicas, inmortalizadoras y transformadoras se expresan durante todas las etapas de progresión carcinogénica (Berman y Schiller, 2017).
VPH en boca.
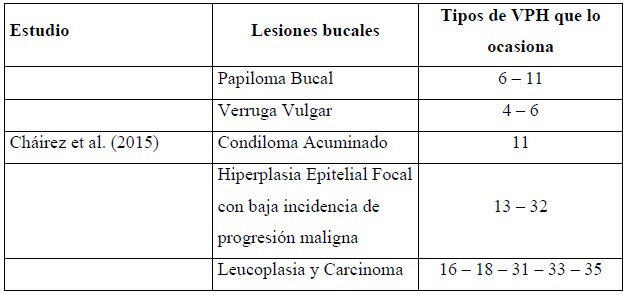
Los tipos de VPH en la cavidad oral, principalmente, son del tipo no oncogénicos. Los tipos VPH que se consideran únicos de la boca son: el VPH 13-32 (Cháirez et al., 2015). Sin embargo, Villagómez et al. (2016) mencionan que el VPH 16-18 son causantes de cáncer oral. Las lesiones benignas y malignas inducidas por VPH se presentan en la tabla 1.
Nota. Los genotipos de VPH que ocasionan lesiones en la boca generalmente son no cancerígenos, aunque si hay lesiones que desencadenan en procesos neoplásicos (Cháirez et al., 2015).
Prevalencia de lesiones malignas.
La Sociedad de Lucha Contra el Cáncer dio a conocer que en el Ecuador desde el año 2006 hasta el año 2010 la prevalencia de cáncer fue de 8.423 casos por cada 100.000 personas, lo que significa que el cáncer de cavidad bucal tuvo una tasa de 34 y 43 casos por cada 100.000 habitantes (Sociedad de Lucha contra el Cáncer [SOLCA], 2014). En Ecuador las investigaciones para determinar la incidencia del cáncer orofaríngeo asociado a VPH son poco concluyentes. Las investigaciones realizadas entre los años 2000 y 2019 son de las principales ciudades de Ecuador: Quito, Guayaquil y Cuenca. Referente a este tema, Batista et al. (2019) realizaron un estudio en el subcentro de salud de Ambato. El estudio incluyó a 99 pacientes mayores a 35 años, a quienes se les detectó lesiones potencialmente malignas asociadas a VPH. Las lesiones malignas encontradas fueron: 8 pacientes con leucoplasia, 4 pacientes con eritroleucoplasia y 3 pacientes con eritroplasia. Mientras que un estudio realizado a 108 pacientes sanos no fumadores en el año 2015 y 2016 en la ciudad de Quito determinó que los pacientes VPH+ tenían micro ARN predisponente a desarrollar carcinoma de células escamosas (Salazar et al., 2018). Ahora bien, en la provincia de Manabí son escasos los datos estadísticos de pacientes con lesiones bucales malignas producidas por VPH. Sin embargo, un estudio realizado en el centro de patología de la Universidad San Gregorio de Portoviejo, donde analizaron muestras en bloque de 37 subtipos de VPH en el año 2019. Dio como resultado 13 casos de pacientes con cáncer de cabeza y cuello orofaríngeas o no orofaríngeas, entre las edades de 13 a 68 años. El 46% de los pacientes presentó genotipo de VPH oncogénico; mientras que en el 54% restante no había presencia del ADN del virus o no era lo suficientemente detectable. El genotipo más común fue: el VPH11-31-61-71. De todos los tipos encontrados, cuatro son de bajo riesgo, dos de riesgo intermedio y uno de riesgo oncogénico (Mendoza et al., 2020).
Prevención y tratamiento del VPH.
En el año 2008 la OPS (2020) recomendó a los gobiernos de América Latina fortalecer de los programas para la prevención contra el VPH. Alvarez (2020) enfatiza que es importante informar a la población acerca de este virus para evitar su propagación.
Prevención primaria: son todas medias que se toman para disminuir evitar y el riesgo de aparición de la enfermedad, mediante el control de factores predisponentes, factores conductuales o condicionales (Prado Peláez et al., 2021). Al afirmar que ciertos agentes ayudan en la desinfección de superficies, lo cual disminuye la posibilidad de contagio, se comprobó que el ortoftalaldehído (OPA), el hipoclorito y el peróxido de hidrógeno son eficaces en la inactivación de partículas de HPV-11-16-31, que pueden permanecer en las superficies (Ozbun et al., 2021; Nagayasu et al., 2021). Aquí vale la pena mencionar que la OMS (2020) indica que las vacunas juegan un rol importante en la prevención primaria, ya que ayudan a detener la propagación del virus, mediante la estimulación de producción de anticuerpos. Las vacunas profilácticas introducidas en el año 2006, previenen efectivamente la infección oral por VPH de tipo 16-18 (Natunen et al., 2017). Por esta situación, las vacunas son la mejor opción para evitar la propagación de la infección. Aunque no hay registros en la disminución en la mortalidad por VPH (Oliveira, Fregnani y Villa 2019), Luciani (2018) indica que el monitoreo de lesiones inducidas por VPH en América Latina es débil.
En este sentido, las vacunas comercializadas son las siguientes:
Vacuna bivalente: el nombre comercial es Cervarix, tiene partículas parecidas a las del virus de tipo 16 -18. Su aplicación es intramuscular en dos dosis con un intervalo de 6 meses (Bermúdez, 2015).
Vacuna tetravalente: el nombre comercial es Gradsil; eficaz ante VPH de tipo 6-11-16-18 Intitulto Nacional de Cancer (INC, 2019). La aplicación se la debe de realizar en 2 dosis a la población de 9 a 13 años y, de 3 dosis a partir de los 14 (Bermúdez, 2015).
Vacuna nonavalente: la vacuna nonavalente ayuda a la prevención de 9 tipos de VPH: 6-11-16-18-31-33-45-52-58 (Naranjo Logroño, Cuzco Macías y Cuzco Macías, 2018). En vista de ello, la U.S Food and Drug (FDA, 2020); European Medicines Agency Science Medicine Health (2020) recomiendan la vacuna a los niños y las niñas desde los 9 años, y en las mujeres hasta 45 años. Esta vacuna se comercializa bajo el nombre de Gradsil 14 (Bermúdez, 2015).
Por otro lado, las vacunas terapéuticas se encuentran en estudios desde el año 2003. Con esta vacuna se busca neutralizar las partículas virales de VPH, eliminar la infección existente, controlar el crecimiento de las células e inducir la regresión de las lesiones preexistentes (Gloria, 2005). En la actualidad, sigue en estudios la efectividad de la vacuna, los ensayos clínicos han dado resultados positivos. Aunque es necesario aclarar que los ensayos se han realizado en mujeres para valorar la efectividad y seguridad de la vacuna ante lesiones neoplásicas cervicales (Asociación Española de Vacunologia [ASV] 2019).
Prevención secundaria: Tal como menciona Prado et al. (2021) la prevención secundaria son todas las medidas para la detección precoz de la enfermedad. En este punto, el tratamiento oportuno tiene un buen pronóstico. La toxicidad en el tratamiento de las lesiones malignas es elevada y hay posibilidad de recibida. La quimioterapia y la radioterapia suelen tener efectos a largo plazo, por lo que algunos pacientes pueden necesitar: sondas para alimentación, traqueotomía, sondas de gastrostomía, ya que la orofaringe cumple funciones básicas para las personas como: el habla, la deglución y la permeabilidad de las vías aéreas (Timbang et al., 2019). En la Actualidad, se han desarrollado técnicas quirúrgicas menos invasivas que han demostrado un gran éxito en el tratamiento de las lesiones en la orofaringe. En el año 2009 se introdujo la técnica quirúrgica transoral dando excelentes resultados. Por lo que en ese año se realizó un 31% más a comparación de la quimio y radioterapia (Chen, Zhu y Fedewa, 2014). A pesar de los datos que demuestran que la técnica quirúrgica transoral es más efectiva, Zabaleta et al. (2020) mencionan que en la actualidad no hay datos que compraren el beneficio de la quimio y radioterapia en con la técnica quirúrgica en carcinomas de orofaringe. Otro rasgo importante de mencionar es el método terapéutico basado en criocirugía. Según Trujillo et al. (2009) y Navarrete y Nelson (2007) manifiestan que la aplicación de esta técnica en lesiones producidas por VPH es exitosa por sus excelentes resultados, ya que evita la vaporización de los tejidos, garantizando la rehabilitación postoperatoria entre 7 a 14 días. Gracias a la variedad de propiedades físicas, químicas, biológicas, antisépticas, cicatrizantes y antiinfecciosas, que permiten el restablecimiento de las funciones del organismo mediante la recuperación y regeneración de las estructuras. Se debe agregar que los tratamientos no solo están dirigidos a la eliminación de las lesiones. Por ejemplo, Reino Unido trabaja en un tratamiento para evitar las lesiones inducidas por VPH mediante la incorporación de anticuerpos contra la oncoproteínas E6. Por lo que se espera que solo una minoría de la población desarrolle neoplasias asociadas a el VPH (Brenner et al., 2020).
Cáncer asociado al VPH.
En lo que se refiere a defunciones por cáncer, en el año 2015 fue la primera causa de muerte antes de los 70 años en 91 países alrededor del mundo. En Ecuador, según el reporte de SOLCA de los años 2011-2015, la incidencia de cáncer fue de 8.043 en los hombres y 10.238 casos en las mujeres. A diferencia de los años 1986-1990 en donde la incidencia de cáncer en los hombres era de 2.406 y 3.411 en las mujeres. En consecuencia, hay un aumento significativo en el número de pacientes con cáncer en 31 años de registro (SOLCA, 2019). Como menciona Delgado Ramos (2018), en Ecuador se registran hasta 446 nuevos casos de Cáncer de Orofaringe (OPC) anualmente. el Instituto Tecnologico Equinoccial (UTEEC, 2018) publicó en el año 2018 un estudio de tendencias de mortalidad en relación con el cáncer oral, tomando como referencia 15 años desde el 2001 al 2016 y personas con edades entre los 30 a 40 años. El estudio dio como resultado que 1.025 muertes se vinculan a esta patología, aunque mencionan que hay un subregistro de pacientes que han muerto a causa del cáncer por las irregularidades en el correcto llenado de las actas de defunción. Aquí vale la pena decir que las personas que fallecen a casusa de lesiones malignas de cavidad oral generalmente no le dan la importancia debida (Núñez, 2018). La American Cancer Society (ACS, 2018) menciona que el cáncer comienza cuando ciertas células del cuerpo empiezan a proliferar y aumenta su tamaño de manera descontrolada formando una masa denominada tumor; no obstante, sólo algunas de las masas son cancerosas. Puede agregarse que, desde el momento de la infección hasta el diagnóstico de cáncer in situ; pueden transcurrir entre 15 y 20 años dando un amplio margen para el desarrollo de la lesión (Soto Fuenzalida et al., 2020). Ahora bien, como menciona la American Society of Clinical Oncology (ASCO, 2019) anatómicamente la orofaringe comprende la parte media de la garganta desde las amígdalas hasta la punta de la laringe. Teniendo en cuenta el Centers for Disease Control and Prevention (CDCP, 2017) el cáncer de orofaringe es más frecuente en el hombre. Un ejemplo de la prevalencia de cáncer de cabeza y cuello como indican Dan y Chow (2020) fue en el año 2018 cuando se estableció como la séptima neoplasia maligna más común a nivel mundial con 890.000 casos nuevos y 450.000 muertes. Un estudio realizado mediante pruebas de Proteina C Reactiva (PCR) a 205 pacientes para determinar la frecuencia del Carcinoma de Células Escamosas de Cabeza y Cuello (CCSCC) y Cáncer Oral (CO) inducido por VPH. Dando como resultado que los tipos mayormente encontrados fueron: VPH 11-16-18-42-52-58-59-72-83, siendo el tipo 16 el más frecuente en la mayoría de los pacientes (Valls et al., 2019). El CCSCC es una de las neoplasias de cabeza y cuello de mayor frecuencia tanto en los hombres como en las mujeres. Con 600.000 casos diagnosticados anualmente (Ferris, Blumenschein Fayette, Guigay Colevas y Geese, 2016) Mientras que otra de las lesiones malignas como el Carcinoma Orofaríngeo de Células Escamosas surge en un 3% en sitios no tonsilares y un 92% en las amígdalas linguales y palatinas (Gelwan et al., 2017). Es importante destacar que la inmunohistoquímica detecta el VPH en pacientes jóvenes, hombres y mujeres. Ya que el virus tiene una predilección anatómica definida, florida y temprana (Quijano Gutiérrez, 2018).
Ubicación de las lesiones malignas.
La localización más frecuente de lesiones maligas por VPH son las encías, la lengua, la mucosa yugal, el suelo de la boca, el labio y el paladar (Valls et al., 2019). La ubicación de las leiones por VPH se muestra en la Tabla 2. Nagaoa y Warnakulasuriyab (2018) argumentan que el cáncer de labio y de cavidad oral es la cuarta neoplasia maligna más común que ocurre en todo el mundo, en un 8,7 por cada 100.000 habitantes en los países en desarrollo.
Tabla 2 Ubicación anatómica las lesiones inducidas por VPH y, genero en el que aparecen con mayor frecuencia.

Fuente (Stojanov y Woo, 2015).
Conclusiones.
La infección por VPH es multifactorial ya que existen varias maneras contraer la infección. Se determina que el cáncer orofaríngeo está directamente relacionado con el Virus del Papiloma Humano. Los tipos de VPH encontrados en boca generalmente no son oncogénicos; las lesiones neoplásicas malignas se localizan con mayor frecuencia en la lengua, las amígdalas y la garganta. Los registros de pacientes con cáncer oral en Manabí son escasos.