Introducción
Las infecciones nosocomiales, que surgen durante la estadía del paciente en el establecimiento sanitario y que no están presentes o en desarrollo a su ingreso, son una de las causas primordiales del incremento de tiempo de hospitalización, elevados costos y muerte de pacientes a nivel mundial (Díaz-Vélez, 2019 ; Maguiña, 2016). Estas infecciones suelen afectar con regularidad heridas quirúrgicas, vías urinarias y respiratorias, además, son más prevalentes en pacientes con enfermedades subyacentes, adultos mayores o que estén bajo tratamientos quimioterápicos (Maguiña, 2016).
Es preciso indicar que, la periodicidad de infecciones nosocomiales fue informada por hospitales de Asia Sudoriental (10 %) y Regiones del Mediterráneo Oriental (11,8 %), mostrando una prevalencia de 7,7 % en países de Europa y de 9 % en regiones del Pacífico Occidental, así también, la Organización Mundial de la Salud (OMS) determinó que en más de 50 hospitales de varios países de Asia Sudoriental, Europa, Pacífico Occidental y Mediterráneo Oriental, el 8,7 % de los usuarios internados presentaban dichas infecciones (Tintin, 2017). En Ecuador, la incidencia de infecciones nosocomiales se asemeja a la de los países latinoamericanos como Colombia, Perú o Brasil, sin embargo, presenta una tasa de mortalidad más alta (Organización Panamericana de la Salud - OPS/OMS, 2007).
Dentro de este contexto, el microorganismo identificado de manera más frecuente como causante de infecciones nosocomiales es el Staphylococcus aureus, particularmente el que presenta resistencia a la meticilina (Arteaga et al., 2015; Haque et al., 2018). En los años 40, se abrieron opciones de tratamiento de infecciones provocadas por estafilococos gracias al descubrimiento de la penicilina, sin embargo, rápidamente surgieron cepas resistentes a esta; de igual manera, en 1960 se sintetizó una nueva alternativa terapéutica, la meticilina, pero con el tiempo también aparecieron microorganismos resistentes, tal como el mencionado S. aureus meticilino resistente, a partir de esto la cantidad de infecciones asociadas a este microorganismo ha aumentado (Acuña et al., 2015). Es importante aclarar que, el gen mecA hace a esta bacteria resistente a la meticilina, ya que codifica para una penicilinasa de 78 kDa con baja afinidad por los β-lactámicos, por ende, en presencia de antibióticos β-lactámicos no se detiene la formación de la capa de peptidoglicano y el microbio subsiste (Cervantes-García, et al., 2014).
El Staphylococcus aureus es un microrganismo que puede colonizar distintas zonas del cuerpo como la nariz, faringe, perineo, axilas y piel con predominio en manos, pecho y abdomen, además el SARM se encuentra presente en las mucosas de individuos sanos entre 1 y 3 % (Martínez-Díaz et al., 2020 ; Moscoso et al., 2018). De esta manera, los factores bacterianos de este microorganismo al igual que los factores del huésped juegan un papel primordial en la colonización, asociándose con infecciones graves de tejidos blandos y mucosas como osteomielitis y neumonía necrotizante (Hernández et al., 2018). De hecho, más de 94000 infecciones potencialmente mortales y al menos 19000 muertes se registraron en Estados Unidos en el 2005 ocasionadas por el SARM (Álvarez y Ponce, 2012). En un estudio realizado por Herrera (2015), en pacientes de un hospital de Quito, Ecuador, se determinó que la tasa de prevalencia de infecciones por SARM fue de 1,03 x 10000 pacientes atendidos, principalmente encontradas en abscesos (66,66 %) y hemocultivos (16,66 %).
Cabe destacar que, la OMS (2017) incluyó al S. Aureus meticilino resistente en su lista de 12 cepas de bacterias de mayor riesgo para la salud de los individuos por ser resistente a múltiples medicamentos antibióticos. Además, se ha evidenciado que la transmisión del SARM en hospitales, del personal de salud a los pacientes y viceversa, es concluyente en el desarrollo de infecciones leves y graves, ya que la colonización a nivel nasal en ambas poblaciones, en general, es un precedente de las infecciones nosocomiales ocasionadas por esta bacteria (Cáceres, 2011).
Por ello, en esta investigación se planteó identificar la prevalencia de portadores nasales de SARM, en profesionales sanitarios de los servicios de Neonatología, Quirófanos, Anexo de Traumatología y Cuidados Intensivos de un Hospital de Especialidades, en el Distrito Metropolitano de Quito, Ecuador, durante el periodo octubre - diciembre 2015, mediante el cultivo microbiológico de muestras de hisopado nasal pertenecientes a la población según el área en la que labora y el tipo de función que realiza en el hospital, para que de esta manera se pueda caracterizar e identificar portadores por cada servicio y promover la incorporación gradual de medidas de control y bioseguridad para evitar su diseminación.
Metodología
En esta investigación se utilizó un diseño observacional, transversal y de nivel descriptivo, por ende, se observaron las variables tal como se presentaban, para posteriormente analizarlas aplicando estadística cuantitativa. El estudio fue aceptado por el comité de ética hospitalario y se siguieron los preceptos de la declaración de Helsinki (Asociación Médica Mundial - AMM, 2017).
Para determinar quiénes serían los participantes del estudio (muestra), se aplicó un muestreo no probabilístico, por conveniencia ya que se buscó analizar al personal de áreas específicas del hospital. De esta forma, se entregó un consentimiento informado a los participantes de cada área investigada. Posteriormente, se aplicó una encuesta con componentes sociales, demográficos y laborales.
La muestra total fue de n = 191 personas, constituida por el personal de salud (Camilleros, Auxiliares de Enfermería, Internos Rotativos, Médicos Clínicos y Cirujanos, Personal de Enfermería y Personal de Aseo) de áreas correspondientes al Anexo de Traumatología, Neonatología, Quirófanos, Cuidados Intensivos de un Hospital de Especialidades de la ciudad de Quito, Ecuador.
La variable dependiente fue el área donde trabajaban los participantes, mientras que la variable independiente fue la presencia de Staphylococcus aureus. En cuanto a las variables sociodemográficas, caracterizaron a la muestra mediante la edad, sexo, área en la que trabaja y cargo que desempeña.
Se tomó una muestra de hisopado nasal utilizando un hisopo de Rayón ® y para conservar las bacterias durante su traslado hasta el Laboratorio Microbiológico del hospital un medio de transporte en gel Stuart ®. Previamente los medios de cultivo se prepararon, Agar Sangre ® (AS), Agar Muller Hilton ® (AMH) y Agar Sal Manitol ® (ASM) al ser medios universales se confeccionaron según las especificaciones, usando adicionalmente concentrados de glóbulos rojos para enriquecer el agar. Posteriormente, se realizó el sembrado de cada muestra en AS., el cual al estar enriquecido garantiza el crecimiento de los estafilococos. Adicionalmente, se efectuó la prueba en ASM., para identificar el agente en estudio. La tipificación de S. aureus, se determinó por medio de las características físicas de las colonias (en el microscopio, se observó las colonias con formas de racimos de uva), que se diferencia claramente de Staphylococcus epidermidis, este resultado se confirmó con la tinción Gram. Una vez que se identificó el patógeno se generó el antibiograma en el AMH, para comprobar su sensibilidad o resistencia a la meticilina.
Finalmente, con los valores determinados la tabulación de datos se realizó en el programa Microsoft Excel ® versión 14 y el análisis de los mismos se efectuó mediante el programa SPSS ® 18 para el cálculo e interpretación de prevalencia puntual del SARM en las cuatro áreas críticas seleccionadas del Hospital de Especialidades.
Resultados
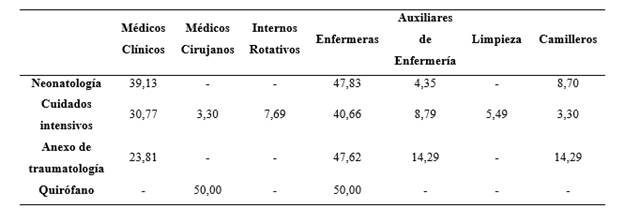
En la población analizada (191 individuos), la media de edad presentada fue 40 años, con mayor frecuencia de participantes de sexo femenino. Los resultados obtenidos de la encuesta epidemiológica aplicada, se expresan en la tabla 1 en porcentajes y se generan al considerar el total de individuos evaluados por área: Unidad de Cuidados Intensivos (91 personas), Quirófanos (56 personas), Neonatología (23 personas) y Anexo de Traumatología (21 personas), ver tabla 1 (en Anexos).
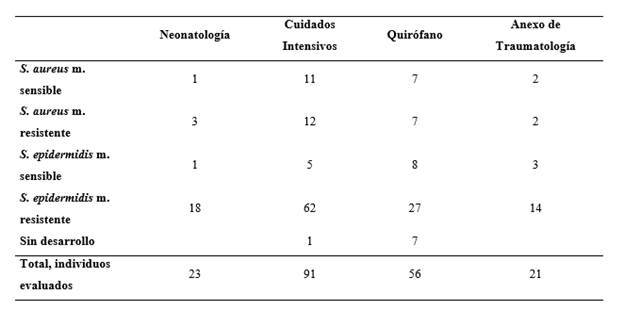
Se sembraron 191 muestras en AS, de las cuales se determinó el crecimiento de laboratorio en 182 de ellas, según las pruebas de identificación de estafilococos establecidas en cultivos de AS, confirmando su presencia en un 95 %. De las 182 muestras, solo 44 resultaron ser S. aureus el resto fueron Staphylococcus epidermidis, esto se determinó al sembrar en el medio de cultivo ASM. Luego se sembró los 44 positivos con S. aureus en AMH, para identificar si eran o no resistentes a meticilina (inoculado la bacteria y colocando a su vez un disco de meticilina, para finalmente medir el halo de resistencia que existe a dicho medicamento por parte de la bacteria), de estas, más de la mitad (55 %), es decir 24 muestras fueron positivas para SARM.
Como se visualiza en la tabla 2, (ver en Anexos) se identificó los gérmenes S. aureus y S. epidermidis, de los cuales la mayor cantidad de gérmenes resistentes a meticilino se concentró en el área de Cuidados Intensivos (13,19 %).
Referente a la distribución del SARM según el cargo que desempeña cada participante, se determinó que el 31 % de portadores corresponde al personal de enfermería, es decir, son los prestadores de salud con más casos S. aureus meticilino resistente. Seguido, el personal Médico Clínico (12 %), Médico Cirujano (4 %) e Interno Rotativo con un porcentaje de 1 %.
Finalmente, utilizando los valores obtenidos en las 4 áreas seleccionadas, se calculó la prevalencia de portadores nasales de SARM, la misma que resulto ser del 12,5 %. Las áreas que representaron el mayor porcentaje de la prevalencia (entre 12,5 y 13 %) fueron Neonatología, Cuidados Intensivos y Quirófano, mientras que el área referente a Traumatología ostentó la menor distribución con el 9,5 %. Cabe destacar que, el 55 % del personal de salud positivo para S. aureus resultaron ser portadores de SARM.
Discusión
Poco tiempo después que los estafilococos aureus denotaron su aparición en 1961 surgieron las cepas resistentes a la meticilina, inicialmente estas cepas eran endémicas de hospitales, pero a finales de 1990 aparecieron las primeras cepas en la comunidad (Cervantes-García et al., 2014 ). Cabe mencionar que, las infecciones hospitalarias representan un problema de relevancia en salud pública conllevando implicaciones epidemiológicas, económicas con tasas de mortalidad y morbilidad altas (Cervantes-García et al., 2014).
El personal de salud comúnmente es portador nasal de S. aureus, siendo una de las infecciones con mayor distribución intrahospitalaria (Maguiña, 2016; Cimera y Pérez, 2010). En la presente investigación, del total de la muestra con resultado positivo a Staphylococcus (182 personas) se identificó una distribución de 24 % para portadores de S. aureus, así como, en México diversos estudios de vigilancia hospitalaria reportan que el rango de infección por el citado microrganismo oscila entre el 8,3 a 36 % (Cervantes-García et al., 2014). De esta manera, en América Latina existen distribuciones similares, 26,7 % en un estudio realizado en Colombia (Arteaga et al., 2015 ), 21,6 % en una publicación elaborada en Cuba (Arbolaez et al., 2016) y 25,7 % en una investigación llevada a cabo en México (Martínez-Medina et al., 2020).
Continuando, se indicó que la resistencia a antibióticos, específicamente a la meticilina fue 55 % entre portadores de S. aureus, asemejándose a diversas investigaciones como la realizada por Fernández et al. (2015) en la cual el 50,6 % fue resistente a la meticilina. De igual forma, Togneri et al. (2017) mencionan que la frecuencia de SARM fue del 50 % y según Martínez et al. (2017) un 55 %, los cuales son valores cercanos al presentado en el personal de salud evaluado.
Subsecuente, en el presente estudio se identificó el 12,5 % de prevalencia del SARM en el personal de salud muestreado. Rodríguez y Jiménez (2015) encontraron una colonización por SARM del 11,1 %, lo que concuerda con los resultados obtenidos. Sin embargo, en otros estudios realizados en diferentes casas asistenciales la prevalencia de Staphylococcus aureus resistente a meticilina varía, tal es el caso del 6,7 % en Medellín (Londoño et al., 2006), 28 % en San Luis Potosí (Rivas et al., 2014), y 25,7 % en la misma ciudad (Martínez-Medina et al., 2020).
Por otra parte, se sabe que las bacterias han desarrollado mecanismos eficaces para combatir la actividad de los péptidos antimicrobianos (Peschel, 2002; Uematsu et al., 2017). Los estafilococos, como los colonizadores bacterianos más importantes en el ser humano para resistir a los efectos de la meticilina pasan por diversas fases de selección natural a través de mutaciones producidas al azar. En este sentido, proliferan los microorganismos que presentan esta mutación natural que anula la acción de la meticilina. Estas bacterias que generaron información genética pueden transferir esta información a través de transferencia horizontal, por intercambio de plásmidos o conversión lisogénica (Otto, 2010). Estos hechos determinan la posibilidad que la transmisión dependa directamente de las medidas de bioseguridad que aplica el personal sanitario.
Al mismo tiempo, se ha evidenciado que determinadas áreas en un hospital poseen mayor cantidad de pacientes SARM positivos (Velázquez-Meza, 2005). Montalvo et al., (2009) mencionan que el área referente a Cuidados Intensivos posee un 17,6 % de prevalencia y 15 % correspondiente al área Atención de Neonatos. Este hecho conjetura que, el estado de portador nasal al parecer es de suma importancia en la infección causada por este microorganismo, enmascarado por la falta de síntomas (Fosch et al., 2012; Thompson et al., 2014).
Por ende, el problema es la creciente cifra que se reporta de nuevos contagios, por su fácil diseminación. Echeverría e Iglesias (2003 ) recalcan que la resistencia a la meticilina conlleva resistencia total a antibióticos ß -lactámicos, cefalosporinas y carbapenem. Este hecho exhorta a actuar de manera preventiva para que los portadores de SARM asintomáticos no propaguen infecciones nosocomiales.
Conclusiones
Se determinó una baja prevalencia de portadores de SARM en las áreas de Neonatología, Anexo de Traumatología, Cuidados Intensivos y Quirófano, sin embargo, se presenta mayor frecuencia en el servicio de Cuidados Intensivos, esto resulta alarmante ya que las infecciones causadas por este patógeno implican un aumento en la morbilidad y mortalidad de pacientes, más aún en esta área que alberga pacientes en estado crítico.
El personal de Enfermería presenta mayor distribución de SARM debido a su actividad directa con portadores asintomáticos.
Los resultados presentados proponen implementar una vigilancia microbiológica y control de las medidas de bioseguridad en el personal de salud para evitar la propagación de SARM en infecciones nosocomiales.