Introducción
Ecuador alberga en su territorio la más alta concentración de ecosistemas, especies biológicas y biodiversidad. La región Amazónica Ecuatoriana representa el 45% del territorio nacional y constituye una de las mayores reservas ecológicas de la humanidad (Myers y col., 2000). Según la Organización del Tratado de Cooperación Amazónica (OTCA), en la región amazónica se encuentra aproximadamente el 80% de la biodiversidad de todo el país, pudiéndose encontrar de 150 a 312 especies de árboles por hectárea, 600 especies de peces y más de 250 especies de anfibios y reptiles (Toro, 2006). La región amazónica tiene una importancia biológica única, seguramente aquí se ubica una carga micróbica nativa muy particular de especies no catastradas de microorganismos. Es importante mencionar que las condiciones topográficas y ambientales de la región, la suma de estas y otras interacciones influyen de manera directa en la biodiversidad de la zona (Alexa, 2010). Sin embargo, las actividades productivas provocan impactos ambientales y el problema de la región amazónica está ligado con la actividad minera y la deforestación. Según el informe de la red amazónica de información socioambiental georreferenciada (RAISG) entre los años 2000 y 2010 el área de bosque de la amazonia latinoamericana se redujo en un (4,5%), unos 240 mil kilómetros cuadrados aproximadamente, Ecuador es uno de los países de la región que presenta el mayor índice de deforestación (2,4%), en este sentido la biodiversidad está bajo creciente presión y amenaza (MAE, 2015).
La actividad minera particularmente relacionada con el oro en la república del Ecuador ha venido ocurriendo desde hace siglos (Equipo MMSD América del Sur, 2002); por lo tanto, la presente investigación sugiere que la expansión de la actividad minera en la zona provoca pérdidas en la biodiversidad. El estudio del ecosistema tuvo como propósito identificar los posibles cambios en el mismo, la fragmentación, abundancia, riqueza, dominancia y diversidad de especies, en definitiva, el objetivo de la investigación es generar datos que a futuro se puedan utilizar y comparar con otros resultados de investigación con el fin de desarrollar estrategias de conservación.
Materiales y métodos
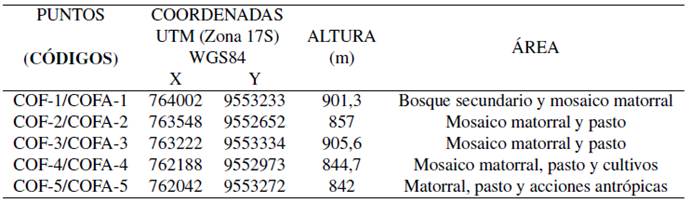
Este estudio se llevó a cabo en la provincia de Zamora Chinchipe, cantón Paquisha, comunidad Congüime, coordenadas UTM: WGS 84,17 m; 762056.24 m E; 9553263.64 m S; 838 m de altitud (Figura 1). En el lugar se ubicaron elevaciones con pendientes pronunciadas que varían entre los 700 m.s.n.m y 2800 m.s.n.m y que conforman la cordillera del Cóndor al Este y en la parte baja el valle del rio Nangaritza que corre de Sur a Norte.
Aleatoriamente y de forma estratégica se ubicaron 5 puntos de muestreo, los mismos se codificaron como: COFA para fauna y COF para flora (Tabla 1).
Flora del área de estudio
Para el estudio se trazaron parcelas de 50 m x 50 m en un área total de 0,25 ha; posteriormente se subdividieron en áreas de 0,25 x 0,25 m. cada una (Arias y col., 2012). Las variables de estudio fueron: área basal, densidad relativa, dominancia relativa, índice de valor de importancia, e índice de dominancia de Simpson. Cuando el rango fue de 0 a 1, los valores más cercanos a (1) se interpretaron como dominancia de una especie sobre la otra según el índice d dominancia de Simpson. Cuando los valores fueron de 0 a 5, los valores cercanos a cero se interpretaron como baja diversidad y viceversa, de acuerdo a índice de diversidad de Shannon (Zamora, 2015).
Avifauna
Los muestreos se hicieron en base a 3 criterios: puntos de censo, caminatas al azar y registros auditivos (Balderrama y col., 2005). Se estudió la diversidad, abundancia y ubicación geográfica, y las referencias se tomaron de la lista de aves del Ecuador continental (Ridgely, Greenfield y Guerrero, 1998). Para estimar la abundancia relativa y diversidad de especies se aplicó el índice de dominancia de Simpson en un rango de 0 a 1. Inferimos que los valores cercanos a (1) son indicadores de dominancia de una especie sobre las demás (Campo y Duval, 2014a). El índice Shannon-Weaner nos sirvió para estimar la diversidad (Zamora, 2015); además, se evaluaron aspectos ecológicos como el gremio trófico y las especies sensibles e indicadoras.
Mastofauna y herpetofauna
El estudio se hizo mediante transectos, avistamientos, conteo, monitoreo indirecto, rastros, presencia de excremento, madrigueras, diámetro de agujeros y encuestas a los moradores de la comunidad (Arévalo, 2001). Se llevaron a cabo 3 recorridos de observación a lo largo de 200, 500 y 1000 m. Además, mediante registros auditivos y encuentros visuales se identificaron: ranas, sapos, salamandras, etc. (Yánez, Reyes y Meza, 2007). La valoración se hizo a través del índice de Shannon.
Macroinvertebrados
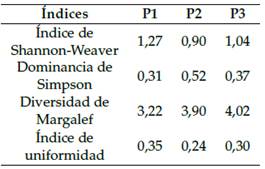
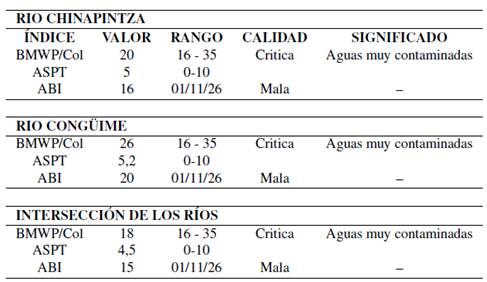
En el lecho del río, mediante una red patada (Carrera y Fierro, 2001) se hizo el muestreo en la quebrada Chinapintza, río Congüime y en la unión de los dos. Los grupos de datos se compararon para determinar riqueza y abundancia de especies. La diver sidad biológica se determinó mediante los índices: Shannon-Weaver (Shannon y Weaver, 1949); dominancia de Simpson (Campo y Duval, 2014b); riqueza de Margalef e índice de uniformidad o equidad. La calidad del agua se estimó a través de los índices EPT (Ephemeroptera, Plecoptera, Trichoptera) (Bispo, Bini y Sousa, 2006) y el índice BMWP/Col (Biological Monitoring Working Party/modificado por Colombia) (Zamora y Alba, 1996).
Resultados y Discusión
Flora del área de estudio
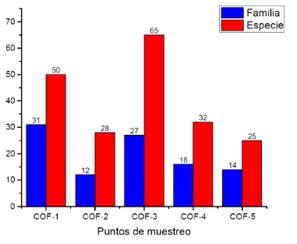
Se registraron 123 especies de plantas y 43 familias. Las especies que presentaron mayor abundancia fueron Araceae y Asteraceae. En el punto (COF-3) se presentó la mayor diversidad de especies, mientras que en el punto (COF-1) se presentó mayor número de familias. Inferimos que los puntos 1 y 3 fueron áreas de menor intervención (Figura 2).
Estimación de diversidad biológica
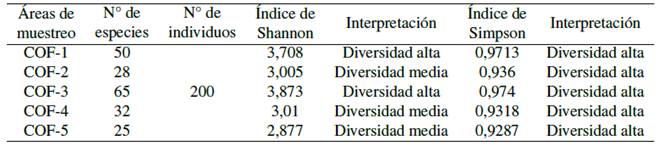
De acuerdo con el índice Shannon-Weaner, los valores (3,708) para (COF-1) y (3,873) para (COF-3), se refieren a una fracción de bosque secundario de alta diversidad. En cuanto a (COF-2) (3,00) (COF-4) (3,01) y (COF-5) (2,87), estos son indicadores de una diversidad media de acuerdo con el índice de Simpson (>0,9). (Tabla 2).
Índice valor de importancia (IVI)
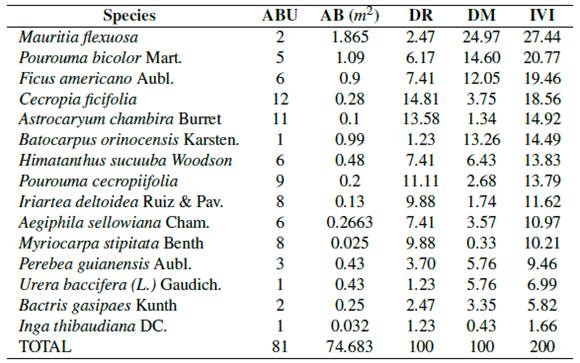
Por la variedad de especies arbóreas y el dosel parcialmente abierto (capa aérea vegetal) se consideró hacer la valoración en (COF-3). Se registraron mayormente dos familias Urticaceae y Arecacea; las especies con mayor (IVI) fueron Mauritia flexuosa L.f. (27.44), Pourouma bicolor Mart. (20.76), Ficus americana Aubl. (19.45), Cecropia ficifolia (18.56) y Astrocaryum chambira Burret (14.91) (Tabla 3).
Hábito de las especies vegetales
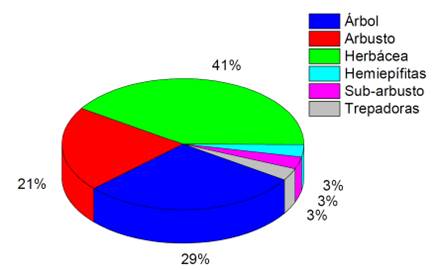
Se encontraron especies herbáceas, árboles y arbustos con el 36%, 29% y 22% respectivamente (Figura 3). Las especies herbáceas corresponden a zonas de mayor intervención (Jørgensen y León-Yánez, 1999).
Estado de conservación
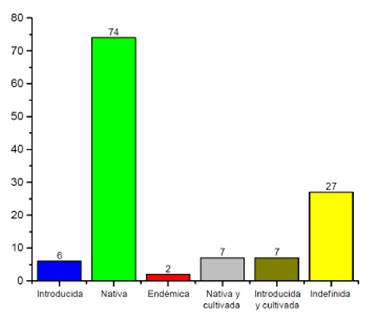
Se registró 74 especies vegetales que se ubicaron como nativas (76,2%); 6 especies introducidas (6,2%); 7 introducidas y cultivas (7,2%) 7 nativas y cultivadas (7,2%) además de 2 especies endémicas (2,05%) (Figura 4).
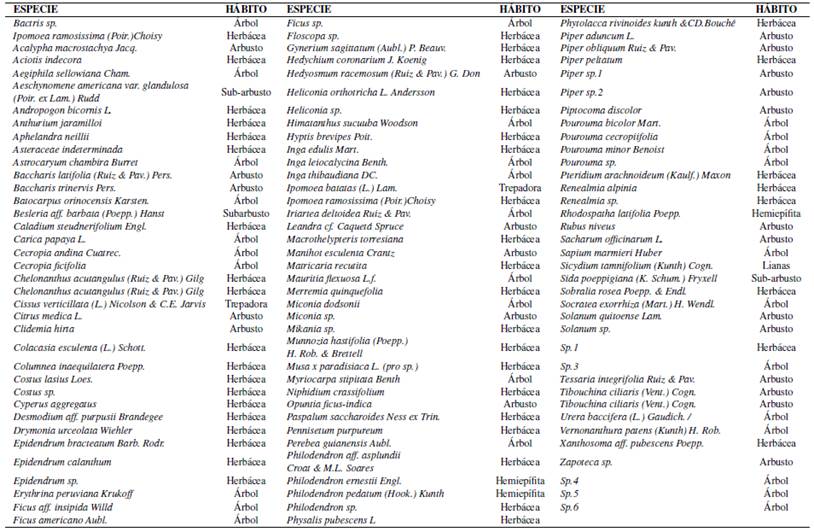
Las especies cultivadas que se catastraron fueron: Carica papaya L. (papaya), Inga edulis Mart. (Guabilla), Ipomoea batatas (L.) Lam. (Camote silvestre), Pourouma cecropiifolia (Uvilla), Renealmia alpinia (Achira del monte), Solanum quitoense Lam. (Naranjilla) y Bactris gasipaes Kunth. (Palmito). Además, las especies nativas: Paspalum saccharoides Ness ex Trin (Yajoch irpa), Sobralia rosea Poepp. Endl (Orquídea), Pourouma minor Benoist (Chumico) y Piper obliquum Ruiz Pav (Matico liso). Igualmente se registró 13 especies vegetales introducidas e introducidas y cultivadas, 2 especies endémicas Anthurium jaramilloi y Miconia dodsonii, especies que se encuentran en categoría vulnerable y en peligro de extinción (León-Yánez y col., 2011; IUCN, 2017) (Ver Tabla 5).
Fauna del área de estudio
Avifauna
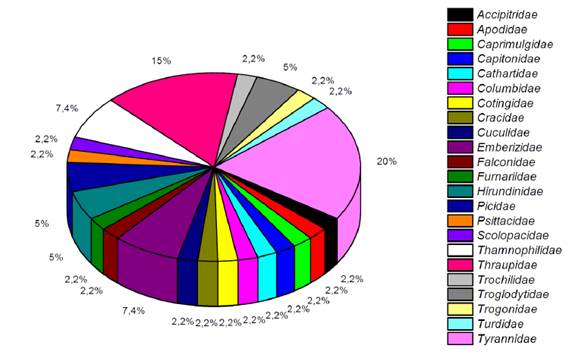
Se registró 42 especies de aves que se ubicaron en 13 órdenes y 22 familias (2.31%) del total de aves registradas en el Ecuador (MAE-SUIA, 2015). Tyrannidae (20%) y Thraupidae (15%) presentaron mayor abundancia (Figura 8).
Ubicación biogeográfica
Se registró 20 especies de aves categorizadas como comunes y 13 como poco comunes (Ridgely, Greenfield y Guerrero, 1998). La dominancia de especies comunes sobre las poco comunes es un indicador del área perturbadas (Velásquez y col., 2003).
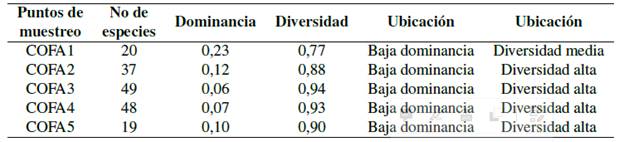
Con mayor abundancia se registró Tyrannus melancholicus (Tirano tropical), Sicalis flaveola (Semillero basto), Ramphocelus carbo (Tangara concha de vino), Oryzoborus angolensis (Semillero menor), Myiozetetes similis (Mosquero social), Doliornis remseni (Cotinga ventricastaña), y Crotophaga ani (Garrapatero piquiliso) (Figura 11). El número total de especies registradas en la zona fue de 42; la mayoría pertenece a la familia Tyrannidae. Un mayor porcentaje de especies se registró en el punto COFA-3; 49 sp. y en menor número en el punto COFA-5 19 sp. Esto se debe principalmente a que el área se encuentra intervenida por actividades mineras.
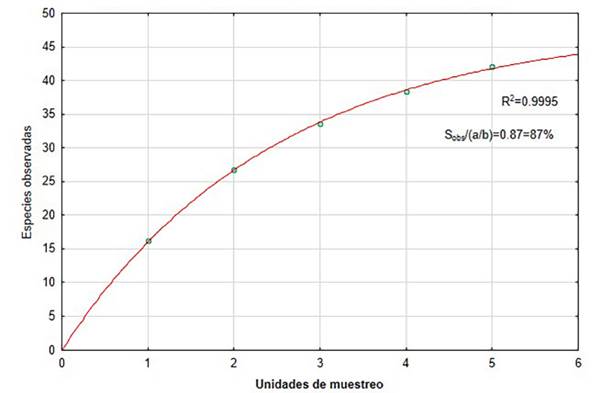
La curva de acumulación de especies para avifauna es un indicador de la tasa a la que nuevas especies se pueden encontrar y cada unidad de esfuerzo consiste en puntos de muestreo realizados en horarios y lugares estratégicos. Se ha establecido el modelo exponencial negativo, para valorar la calidad del muestreo y colecta, obteniéndose un coeficiente de determinación (R 2) de 0.9995, una pendiente de 0.0062 y un esfuerzo de muestreo del 87%, lo que nos indica un buen ajuste del modelo y un muestreo completo y fiable con una buena calidad de inventario (Figura 6).
Estimación de la biodiversidad
De acuerdo con el índice Shannon-Weaner el valor (3.1) para COFA-3; es un indicador de diversidad alta (Zamora, 2015). Mediante la comparación de valores observados y esperados (Índice de Pielou-J) (Moreno, 2001) se valoró la biodiversidad del área. Los resultados se aproximan a (1) por lo que inferimos que las especies son abundantes en los diferentes puntos (Tabla 6).
Tabla 5 Especies introducidas y estatus de conservación según la UICN.
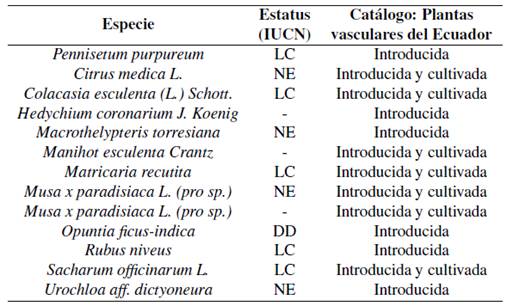
Nomenclatura: LC= Preocupación menor; NE =No Evaluada; DD= Datos Deficientes.
De acuerdo con el índice de Simpson no existen especies dominantes en los puntos de muestreo (Tabla 7).
Aspectos ecológicos
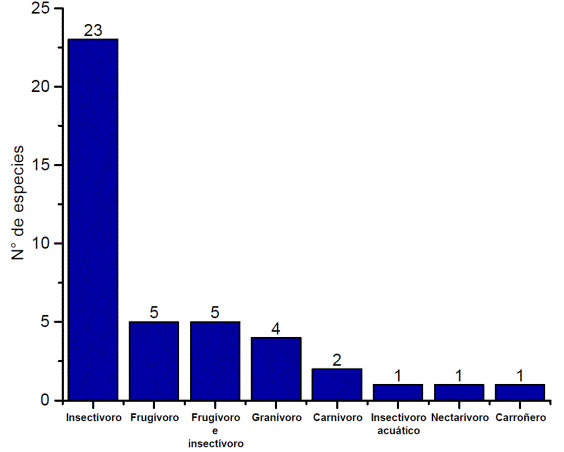
El gremio trófico se clasificó bajo 8 parámetros de acuerdo con el tipo de alimentación o condición (Albuja, 2011). El gremio trófico con mayor representatividad fue el insectívoro (23), el gremio incrementó su frecuencia cuanto más alejado estuvo de las poblaciones y áreas perturbadas (Canaday y Rivadeneyra, 2001) (Figura 7).
Tabla 6 Índice de diversidad-avifauna.
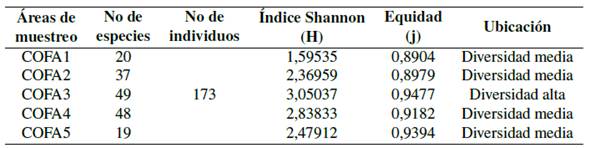
Grupos de datos referentes a los índices de Shannon-Weaner y equidad.
Especies sensibles e indicadoras
Las aves presentan diferente grado de sensibilidad frente a las alteraciones de su entorno (Stotz y col., 1996). Las especies con sensibilidad baja se registraron en mayor número (28 sp); sensibilidad media (13 sp) sensibilidad alta (1sp). La dominancia de especies con sensibilidad baja es un indicador de alteración del ecosistema.
Estado de conservación
La mayoría de especies se ubicaron en la categoría “preocupación menor” (LC) (40 especies); 2 especies en la categoría vulnerable Patagioenas subvinacea (Paloma Rojiza) y Doliornis remseni (Cotinga ventricastaña). Las especies Buteo magnirostris (Gavilán Caminero), Thalurania furcata (Colibrí ninfa tijereta), Amazona ochrocephala (Lora amazona Coroniamarilla) y Daptrius ater (Caraca negra), son especies que no se encuentran en peligro de extinción, pero su comercio debe controlarse (CITES, 2010).
Además, se catastraron 3 especies de aves migratorias, Buteo magnirostris (Gavilán caminero), Coragyps atratusc (Gallinazo negro) y Actitis macularius (Playero coleador) (Apéndice II), especies en estado de conservación desfavorable que requieren de acuerdos internacionales para su conservación (CMS, 2015) (Figura 8).
Presencia de mamíferos
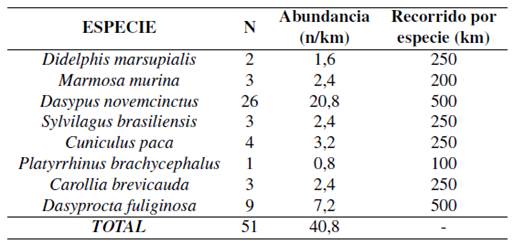
A través de encuestas se registró 16 especies de mamíferos (3,7% del total de mamíferos del Ecuador). El 100% de los encuestados afirmó conocer y haber tenido avistamientos de Dasypus novemcinctus (Armadillo de 9 bandas) y en menor porcentaje (2,2%) Bradypus variegatus (Perezoso) y Leopardus tigrinus (Tigrillo chico).
Registros por métodos indirectos
El índice de abundancia relativa resulta de dividir el número de observaciones para la longitud del recorrido (Zapata, Araguillin y Jorgenson, 2006). Se registró 8 especies de mamíferos en un recorrido de 1 250 metros (Tabla 8).
Estimación de la diversidad
Mediante muestreo indirecto se registró 8 especies de mamíferos, la abundancia relativa se determinó a través del número de huellas, los resultados evidencian un índice de diversidad bajo (1,50) de acuerdo con el índice Shannon-Wiener.
Estado de Conservación
La mayoría de las especies se encontraron en categoría de preocupación menor (LC) excepto Cuniculus paca (Guanta de tierras bajas); Tayassu pecari (Cerdo salvaje); Mazama americana (Venado colorado) y Leopardus tigrinus (Tigrillo chico) que se ubican en las categorías: casi amenazada (NT), en peligro de extinción (EN), casi amenazada (NT) y vulnerable (VU) respectivamente (Cuesta y Tirira, 2011). La mayoría de las especies se encuentran en la categoría de preocupación menor, con excepción de Tayassu pecari (Cerdo salvaje) y Leopardus tigrinus (Tigrillo chico) que están en la categoría vulnerable (VU) (IUCN, 2017).
Se registró 3 especies en el apéndice III. Nasua nasua (Cuchucho); Eira barbara (Cabeza de mate) y Cuniculus paca (Guanta de tierras bajas); 2 especies en el apéndice II, Tayassu pecari (Pecari de labio blanco) y Bradypus variegatus (Perezoso); y Leopardus tigrinus (Tigrillo chico) en el apéndice I (Especie de mayor amenaza) (CITES, 2017).
Análisis gremial trófico de mamíferos
Se valoró los cambios en hábitat y ecosistema, además de la forma en que las especies hacen uso de sus recursos a través del tiempo (Pérez-Irineo y Santos-Moreno, 2013). En el lugar se registró 6 gremios tróficos Carnívoros (1); omnívoros (5); insectívoros (1); frugívoros (6); folívoras (1) y herbívoros (2). Predominan los frugívoros y omnívoros (Segundo nivel trófico) (consumidores secundarios).
Herpetofauna
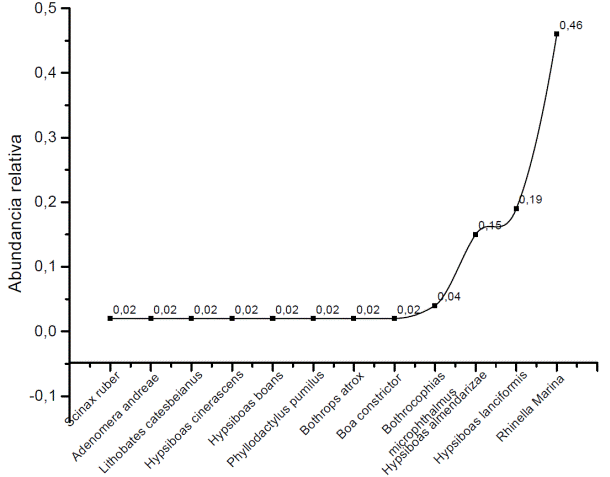
Se registró 52 individuos (47 anfibios y 5 reptiles) 0,96% reptiles y 1,62% anfibios que se ubicaron en 7 familias, mayor abundancia presentó Bufonidae (46%), mientras que Hylidae el (40%); en menor porcentaje Leptodactylidae y Ranidae (2%). Los reptiles en su mayoría pertenecen a la familia Squamata, mayor abundancia presentó Viperidae (6%); mientras que Gekkonidae y Boidae el (2%). En cuanto a anfibios, Rhinella marina (Sapo gigante) (0,46%) fue la más abundante (Figura14), seguido de Hypsiboas lanciformis (Rana arborícola) (0,19%), Hypsiboas almendarizae (Rana arborícola) (0,15%), Bothrocophias microphthalmus (Hoja podrida) (0,04%); las especies restantes representan el (0,02). De acuerdo con el índice de Shannon (1,70) la diversidad es media en el lugar de estudio (Figura 13).
Estado de conservación
Preocupación reviste: Hypsiboas almendarizae (rana arborícola) que se encuentra en la categoría (casi amenazada) (NT). Bothrocophias microphthalmus (Hoja podrida) y Boa constrictor (Boa Mata caballo) en la categoría vulnerable (VU) (Carrillo, Altamirano y Ayala, 2005; CITES, 2017) (Tabla 10). De acuerdo a la UICN la mayoría de las especies se encuentran en la categoría “preocupación menor” (LC). Hypsiboas almendarizae es una especie endémica de acuerdo con la lista roja de anfibios del Ecuador (Coloma, 2005).
Tabla 9 Análisis gremial de mamíferos.
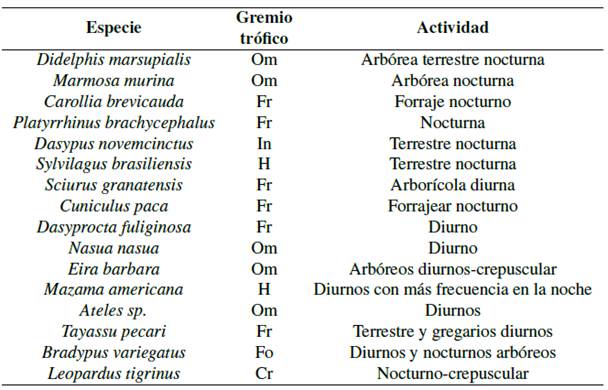
Nomenclatura: Carnívoro (Cr), Frugívoro (Fr), Insectívoro (In), Omnívoro (Om), folívora (Fo), Herbívoro (H). Recopilado de: Vallejo Boada, (2014); Brito, Astua de Moraes, & Lew, (2015); Emmons y Feer, (1999); Tirira, (2007).
Tabla 10 Estado de conservación de las especies de Herpetofauna.
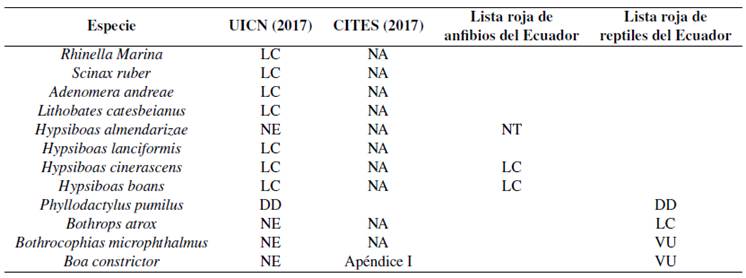
Nomenclatura: DD =Datos Deficientes; LC = Preocupación menor; NT = Casi Amenazada; NE = No Evaluada; VU = Vulnerable
Especies sensibles e indicadoras
La condición “sensibilidad baja” es la más representativa (8 especies); sensibilidad media (3) y sensibilidad alta (1). Las especies indicadoras de ambientes perturbados son: Rhinella marina (Sapo gigante), Scinax ruber (S/n), Hypsiboas lanciformis (Rana arborícola), Lithobates catesbeianus (Rana Toro); Bothrops atrox (Equis); Hypsiboas cinerascens (Rana arborícola) y Hypsiboas boans (Rana arborícola) (IUCN, 2017).
Fauna Acuática
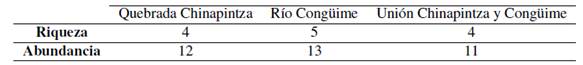
Se colectaron 36 macroinvertebrados acuáticos que se ubicaron en 4 órdenes, 8 familias y 10 géneros (Figura 15). En la quebrada de Chinapintza se colectaron 12 individuos que integran 4 órdenes, 4 familias y 6 géneros. En el río Congüime se colectaron 13 individuos que se integran en 3 órdenes, 5 familias y 5 géneros y en la unión entre estos dos ríos se colectaron 11 individuos que integran 3 órdenes, 4 familias y 4 géneros (Figura 15).
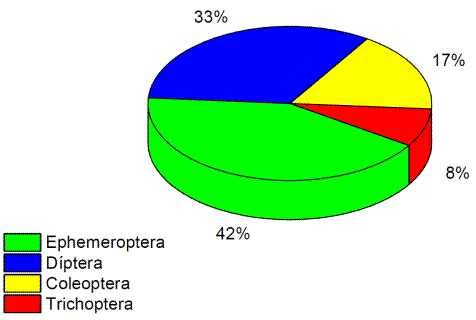
El 42% pertenece a la orden Ephemeroptera y el 33% Diptera que a su vez representa a el mayor número de géneros en los puntos de muestreo (Figura16). En las variables riqueza y abundancia no existe diferencia significativa en los puntos de muestreo, la baja abundancia y riqueza se debe a la contaminación evidente del agua debido a la actividad minera en la zona. (Tabla 11).

Figura 11 Fotos al estereomicroscopio: Macroinvertebrados (A) Orden Díptera -familia Chironomidae, los más abundantes en los puntos de muestreo y tolerantes a altos niveles de contaminación. (B) Orden Coleoptera familia Elmidae -género Cylloepus. (C) Orden Diptera-familia Empididae. (D) Orden Coleoptera- familia Hidrophilidae. (E) Orden Coleoptera- familia Elmidae género Neoelmis. (F) Orden Ephemeroptera- familia Baetidae- género Paracloeodes, son tolerantes a ciertos niveles de contaminación. (G) Orden Diptera- familia Psychodidae. (H) Orden Trichoptera- familia Hydropsichydae- género Smicridea. (I) Orden Ephemeroptera- familia Leptohyphidae- género Trichorytodes, considerados como bioindicadores de la calidad de agua al igual que el orden Trichoptera.
Diversidad y abundancia por familia
Hubo dominancia de Baetidae y Chironomidae, consideradas tolerantes a ciertos niveles de contaminación (Mosquera, 2008). El mayor número se registró en el rio Congüime. Es importante mencionar que Chironomidae se asocia a ambientes con bajos niveles de oxígeno y altos niveles de contaminación (Hahn y col., 2009).
Estimación de la diversidad
De acuerdo con el índice Shannon-Weaver, el lugar se encuentra en un rango de baja diversidad, debido principalmente a la contaminación del agua. El índice de dominancia de Simpson muestra valores medios, con la presencia de cierto número de individuos dominantes en la comunidad. De acuerdo con el índice Margalef en la zona la diversidad es baja, al igual que con el índice de uniformidad, los valores fueron medios y bajos (Tabla 12).
Índices de calidad del agua
Los valores del índice BMWP/Col en los 3 puntos de muestreo son 20%, 26% y 18% respectivamente, se ubican en la clase IV (Aguas muy contaminadas y con calidad crítica) (Zamora y Alba, 1996). En el cálculo ASPT se obtuvieron valores de 5, 5.2 y 4.5 respectivamente, al comparar con los índices BMWP/Col. (Pérez, 1999) (Tabla 13). El cálculo de índice Biótico Andino (ABI) muestra valores de 16, 20 y 15 respectivamente y de acuerdo con estos parámetros inferimos que la calidad del agua es mala con un rango entre 11 y 26 (Loayza, 2016) (Tabla 13).
Conclusiones
El objetivo de esta investigación fue valorar el efecto de la actividad minera sobre la biodiversidad del área de estudio, se estimó los posibles cambios en el ecosistema, con relación a la fragmentación, abundancia, riqueza, dominancia y diversidad de especies. De acuerdo a los resultados podemos concluir que la flora del lugar es de nivel medio, aunque el nivel de dominancia de especies es bajo en todos los puntos de muestreo. En cuanto a fauna, el nivel es medio para avifauna, excepto en el punto COFA-3 que la diversidad es alta, se registraron un total de 42 especies de aves que se ubicaron en 22 familias, mayor abundancia presentó Tyrannidae y Thraupidae, especies consideradas de sensibilidad baja (28 sp). Se registró 16 especies de mamíferos, Cuniculus paca, Tayassu pecari, Mazama americana y Leopardus tigrinus son especies consideradas con alta amenaza, la abundancia relativa para estas especies es baja (1.50). En cuanto a herpetofauna, mayor abundancia presentó Bufonidae (46%) e Hylidae (40%). Los reptiles en su mayoría pertenecen a la familia Viperidae (6%). Rhinella marina (sapo neotropical gigante o sapo marino) fue la especie más común de anfibio, en el lecho del río se identificó 36 macroinvertebrados que se ubicaron en 4 órdenes y 8 familias, predominan Baetidae y Chironomidae, especies consideradas tolerantes a la contaminación del agua.
Conclusión, El área de estudio mostró una diversidad media y dominio de especies con sensibilidad baja, la mayoría generalistas, con dominio del gremio frugívoro y omnívoro e indicadoras de ambientes perturbados, para este caso de estudio debido a la actividad minera, la expansión agrícola, ganadera y la deforestación.