Introducción
En Ecuador existen alrededor de 295 familias de plantas con utilidad medicinal de las cuales 60 a 80 familias son productoras de aceites esenciales, como Asteraceae, Lamiaceae, Lauraceae, Myrtaceae, Rosaceae, Rutaceae, Apiaceae y Pinaceae (Aguirre-Mendoza, Aguirre-Mendoza y Muñoz, 2017). El estudio de la fracción aromática de las especies vegetales es uno de los enfoques de mayor investigación en relación con la gran diversidad de especies vegetales distribuidas en las cuatro regiones del país. Los aceites esenciales son mezclas complejas de metabolitos secundarios principalmente monoterpenos, diterpenos y sesquiterpenos producidos por diferentes partes de las plantas. Son ampliamente utilizados en la industria alimentaria, cosmética y farmacéutica por presentar propiedades antisépticas, antibacterianas, antivirales y antifúngicas (Camus y Trujillo, 2011; Ochoa-Pumaylle y col., 2012; León-Méndez, Osorio-Fortich y Martínez-Useche, 2015; Noriega-Rivera, 2009). Por esta razón el objetivo de la presente investigación fue realizar la identificación química cualitativa y cuantitativa de las fracciones volátiles de cuatro especies amazónicas Critoniopsis pycnantha, Myrcia aliena, Piper macrotrichum y Siparuna schimpffii provenientes del centro shuar Antuash, provincia de Morona Santiago, de las cuales existe escasa información. El análisis químico se realizó mediante cromatografía de gases acoplada a espectrometría de masas y a detector de ionización de llama.
Critoniopsis pycnantha es un arbusto o árbol nativo que crece a una altura entre 1500 a 3000 m.s.n.m. (Missouri Botanical Garden, 2022) y presenta utilidad apícola (Torre y col., 2008). Myrcia aliena es un árbol nativo de la región andina y amazónica que crece a una altura entre 500 a 2500 m.s.n.m. (Missouri Botanical Garden, 2022), conocida localmente como “awapit”, su tallo es maderable y su fruto sirve de alimento a los animales (Torre y col., 2008). Piper macrotrichum es un subarbusto o arbusto nativo encontrado en las provincias de Morona Santiago, Napo, Pastaza a una altura entre 0 a 1000 m.s.n.m. (Missouri Botanical Garden, 2022). Siparuna schimpffii es un arbusto o árbol nativo que se encuentra a una altura entre 0 a 1500 m.s.n.m. en las provincias de Tungurahua, Napo, Pastaza, Morona Santiago y Zamora Chinchipe (Missouri Botanical Garden, 2022), conocido como “chiri wayusa, mal aire panka, ardillón”. Esta especie tiene algunos usos medicinales, empleándose sus hojas en infusión para combatir el cansancio y la corteza para aliviar el dolor general del cuerpo producido por la fiebre. También se usa para limpiar el “mal aire” y su tallo se utiliza como poste para la construcción (Torre y col., 2008). Además, las especies del género Siparuna son utilizadas en la medicina tradicional para el alivio del dolor, inflamación, fiebre e infecciones (Ferreira-Silva, Oliveira y Oliveira, 2021).
Materiales y Métodos
Datos generales
El análisis de los aceites esenciales se realizó en un cromatógrafo de gases Thermo Scientific (Wal-than, MA, USA) Trace 1300 acoplado a un espectrómetro de masas simple cuadrupolo ISQ 7000 (GC-MS siglas en inglés) y a un detector de ionización de llama tradicional (GC-FID siglas en inglés). Se usó una columna apolar DB-5MS con fase estacionaria 5%-fenil-metilpolisiloxano, de 30 m de longitud, 0,25 mm de diámetro interno y 0,25 μm de espesor.
Los solventes y estándares usados fueron de grado analítico con una pureza mayor a 99% y adquiridos en Sigma Aldrich (San Luis, Misuri E.E.U.U). En el caso del caproato de isopropilo fue sintetizado en los laboratorios de la Universidad Técnica Particular de Loja con una pureza de 98,8%, determinada mediante GC-FID.
Recolección de especies
Las cuatro especies amazónicas Critoniopsis pycnantha, Myrcia aliena, Piper macrotrichum y Siparuna schimpffii fueron recolectadas en el centro shuar Antuash-Morona Santiago, con las siguientes coordenadas 02°39’41.74” S 77°42’44.95” O, 02°39’44.74” S 77°42’55.81” O, 02°39’49.87” S 77°43’21.25” O y 02°39’44.52” S 77°43’28.86” O, respectivamente. Las cuatro especies se encontraron en estado de floración y se recolectaron en período de lluvias. El estudio se realizó de acuerdo con el permiso de investigación MAAE-ARSFC-2021-1233, bajo el consentimiento libre, previo e informado, de acceso al conocimiento tradicional, asociado a la biodiversidad (Recursos biológicos y genéticos), y sus alcances, firmado de manera libre y voluntaria entre la UTPL, ProAmazonía y la comunidad de Antuash con el amparo legal del Protocolo de Nagoya y la ley ecuatoriana. Este se suscribió en el Centro Shuar Antuash el 22 de abril de 2022. Las especies fueron ingresadas en el herbario de la Universidad Técnica Particular de Loja (HUTPL), con los siguientes códigos de Váucher 14684 (C. pycnantha), 14685 (M.aliena), 14691 (P. macrotrichum) y 14692 (S. schimpffii).
Obtención y rendimiento de los aceites esenciales
Los aceites esenciales (AE) de las especies antes mencionadas fueron obtenidos de las hojas secas mediante destilación analítica por arrastre de vapor, proceso que tuvo una duración de tres horas. Las hojas fueron secadas a una temperatura de 35°C durante 48 horas. El aceite esencial se recolectó sobre dos mililitros de ciclohexano, el cual a su vez contenía nonano como estándar interno y que se colocó previo a comenzar la destilación. Luego se recuperó y almacenó en viales ámbar en refrigeración a -4 °C. Los rendimientos fueron calculados con la cantidad en volumen de AE destilado en solución de ciclohexano y nonano con respecto al peso de las hojas secas de Critoniopsis pycnantha (61,8 g), Myrcia aliena (81,5 g), Piper macrotrichum (40,6 g) y Siparuna schimpffii (95,5 g).
Preparación de muestras de aceite esencial
Los cuatro aceites esenciales obtenidos se diluyeron para su inyección en el cromatógrafo de gases. Para las especies M. aliena y C. pycnantha se realizó una dilución 1 en 1000 con ciclohexano y para P. macrotrichum y S. schimpffii una dilución 1 en 500 con ciclohexano.
Análisis cualitativo
Método cromatográfico
El método empleado para las inyecciones de los AE en el GC-MS consistió en temperatura del inyector: 200 ºC; modo de inyección: split, con relación de split 10, volumen de inyección: 2 μl para C. pycnantha, P. macrotrichum y S. schimpffii y 1 μL para M. aliena; columna DB-5ms con un flujo de He de 1 mL/min; programa térmico: temperatura del horno 50 °C durante 10 minutos, con una rampa de temperatura de 3 °C/min hasta 250 °C durante 5 minutos. Tiempo total de corrida: 81,66 minutos. Se usó una temperatura de la línea de transferencia del espectrómetro de masas de 200 °C y de la fuente de iones de 230 °C, un rango de masas de 40-400 m/z y dos minutos de espera para el encendido del detector.
Identificación de los compuestos
Con las muestras de aceite esencial y con el mismo método cromatográfico descrito para espectrometría de masas, se inyectó una mezcla de hidrocarburos de la serie C9 a C22 para obtener las ecuaciones que nos permitieron a su vez determinar los índices de Van Den Dool y Kratz de cada compuesto (Van Den Dool y Dec Kratz, 1963). La identificación se realizó en base al espectro de masas y una diferencia no mayor a veinte unidades entre los índices calculados y los índices de retención descritos en Adams (2017).
Análisis cuantitativo
Método cromatográfico
Las inyecciones en GC-FID se realizaron con las siguientes condiciones: temperatura del inyector de 230 °C, modo de inyección split, con radio de split 10 para P. macrotrichum y 40 para C. pycnantha, S. schimpffii y M. aliena, siendo el volumen de inyección 1 μL; columna DB-5ms con flujo de 1 mL/min; programa térmico: temperatura del horno 50 °C durante 10 minutos y rampa de temperatura de 2 °C/min hasta 170 °C y 10 °C/min hasta 230 °C durante 10 minutos. El tiempo total de corrida fue de 83 minutos. La temperatura del detector fue de 230 °C.
Cuantificación
La cuantificación de los compuestos se realizó con el detector FID, conforme al método propuesto por Tissot y col. (2012). Para ello se calculó el factor de respuesta relativo (FRR) de cada compuesto respecto al caproato de isopropilo que se empleó como estándar de cuantificación. Los FRR se basaron en las entalpías de combustión y se determinaron con la fórmula descrita por Tissot y col. (2012). Se usó el nonano como estándar interno y el caproato de isopropilo como estándar de calibración. Se realizó la inyección de cuatro repeticiones por muestra de AE y de seis estándares con las mismas condiciones cromatográficas. Estos estándares se prepararon pesando cantidades constantes de nonano (7,13 mg) y cantidades crecientes de caproato de isopropilo (0,6; 1,4; 4,2; 8,3; 16,4 y 33,6 mg) aforando con ciclohexano. La curva presentó un R2 de 0,9998 y la ecuación obtenida nos permitió obtener los miligramos de cada compuesto. Se consideró un límite de detección de 0,1%, calculando los porcentajes de cada componente en relación a la masa total de AE. Se calculó la media y desviación estándar para cada compuesto.
Resultados y discusión
Critoniopsis pycnantha
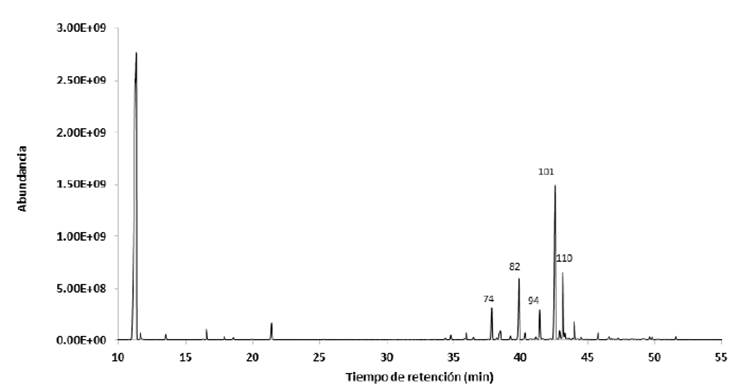
En el aceite esencial de C. pycnantha se identificaron 63 compuestos, siendo los compuestos mayoritarios γ-muuroleno en un 34,45%, biciclogermacreno en un 12,04%, (E)-cariofileno en un 11,05%, α-ylangeno en 5,37% y α-humuleno en 4,68%. Estos compuestos se muestran en el cromatograma de la Figura 1 y se detallan en la Tabla 1.
Piper macrotrichum
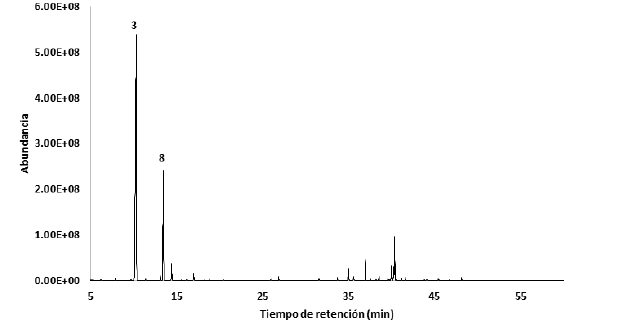
En el aceite esencial de P. macrotrichum se determinaron 66 compuestos correspondientes al 98,71%. Se encontró como compuestos mayoritarios al δ-3-careno (58,21%), eugenol (9,75%) y acetato de chavibetol (7,81%), evidenciándose mayor cantidad de hidrocarburos monoterpenos en un 73,92% del total. Los compuestos identificados se describen en la Tabla 1 y se pueden observar en el cromatograma de la Figura 2.
Myrcia aliena
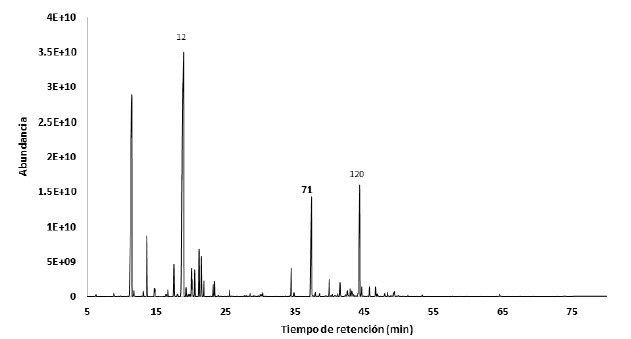
En el aceite esencial de M. aliena se identificó un total de 43 compuestos, lo cual representa el 98,92%, siendo los compuestos mayoritarios dos monoterpenos α-pineno (72,19%) y β-pineno (15,82%). Los compuestos se pueden visualizar en el cromatograma de la Figura 3 y se detallan en la Tabla 1.
Siparuna Schimpffii
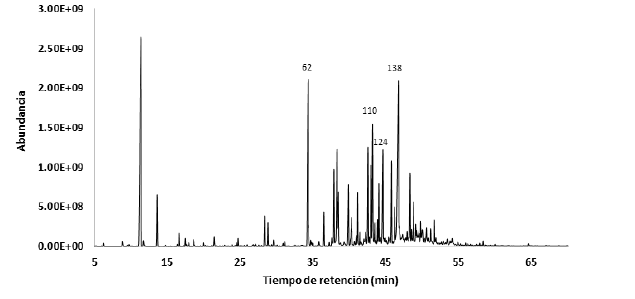
En el aceite esencial de S. schimpffii se encontraron 125 compuestos, los cuales representan el 93,65% del total. Se identificaron como compuestos mayoritarios espatulenol (12,10%), 2-undecanona (10,87%), (E)-isocroweacina (6,41%) y biciclogermacreno (5,84%), los cuales se pueden visualizar en el cromatograma de la Figura 4 y se describen en la Tabla 1.
Tabla 1 Composición química del aceite esencial de Critoniopsis pycnantha, Myrcia aliena, Piper macrotrichum y Siparuna schimpffii en columna DB- 5ms.
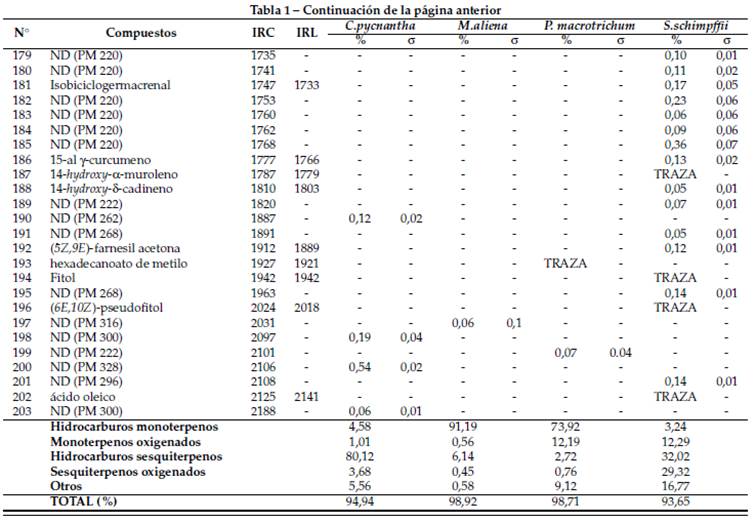






En este estudio se evidenció que el aceite esencial de C. pycnantha está compuesto principalmente por sesquiterpenos, los cuales representan el 80,12% del total de su composición. Tran y Cramer (2014) describen a los terpenos en general como compuestos con gran importancia económica al ser empleados como aromas, saborizantes, especias y fármacos, y ayudan a las especies vegetales atrayendo a los polinizadores (Xu y col., 2017). Los sesquiterpenos son compuestos con actividad antitumoral, antimicrobiana y con efectos sobre el sistema nervioso central de acuerdo a lo referido por Sá, Andrade y De Sousa (2015), quien menciona además que los compuestos mayoritarios son los que por lo general establecen la actividad biológica de un aceite esencial. Dentro de los compuestos mayoritarios se encontró al (E)-cariofileno (11%). Shan, Chen y Lu (2016) lo mencionan como uno de los sesquiterpenos más importantes por poseer propiedades anticancerígenas, antioxidantes, antimicrobianas, antiinflamatorias y acción anestésica local. (E)-cariofileno es empleado también en la industria alimentaria y cosmética como aroma (Montanari y col., 2011).
En relación a especies del género Myrcia,Moraes y col. (2022) y De Cerqueira y col. (2007) mencionan que los aceites esenciales de las hojas de Myrcia paivae O.Berg y Myrcia myrtifolia DC son aceites ricos en monoterpenos con 77,0% y 94,1% del total de su composición, lo cual se observó en el aceite esencial de la especie M. aliena, donde se determinó el 91,19%de estos compuestos. Además, Moraes y col. (2022) y De Cerqueira y col. (2007) describen al α- pineno como uno de los compuestos mayoritarios con 6,39% en el AE de Myrcia paivae O.Berg y en un porcentaje del 61,5 al 90,9% en los aceites esenciales de las hojas, flores y frutos de Myrcia myrtifolia DC. En nuestro estudio el α-pineno se encontró en un 72,2% y el β-pineno en un 15,8%. Ambos compuestos también se describen como mayoritarios en el AE de la especie Myrcia mollis, en la cual se encontraron en 29,2% el α-pineno y 31,3% el β-pineno (Montalván y col., 2019). Los monoterpenos brindan protección a las especies vegetales contra insectos, herbívoros, y mamíferos y tienen funciones alelopáticas al bloquear la germinación de semillas (Thoss, OâReilly-Wapstra y Iason, 2007). Los monoterpenos α-pineno y β-pineno son isómeros estructurales comúnmente encontrados en los aceites esenciales. Presentan actividad antiviral, antifúngica, antimicrobiana, acción anticancerígena, antiespasmódica, antipalúdica, antiinflamatoria y antioxidante (Zieli ´ nska-Błajet y Feder-Kubis, 2020). Además, el a-pineno y β-pineno actúan como agentes bacteriostáticos y fungistáticos (Talebi-Kouyakhi, Naghavi y Alayhs, 2008).
Navickiene y col. (2006) menciona que los aceites esenciales de hojas, tallos y frutos de las especies Piper aduncum, Piper arboreum y Piper tuberculatum comparten ciertos compuestos en común, los cuales son α-pineno, limoneno, mirceno, (E)-ocimeno, (Z)- ocimeno y linalool. En el aceite esencial de Piper macrotrichum se encontraron también estos compuestos a excepción del linalool. Y se determinaron como compuestos mayoritarios δ-3-careno (58,21%), eugenol (9,75%) y acetato de chavibetol (7,81%), de los cuales el eugenol fue encontrado como mayoritario del AE de hojas de Piper divaricatum con 37,5%, y el δ-3-careno con 9,6% y 35,3% en el AE de las hojas de Piper aff. Hispidum y Piper sanctifelicis, respectivamente (Jaramillo-Colorado, Pino-Benitez y González-Coloma, 2019). El δ-3-careno además es uno de los principales compuestos del AE de Piper nigrum con 14,4% (Francois 2009). Arunachalam (2023) describe para el eugenol y linalool actividad anticonvulsiva, mientras que Woo y col. (2019) menciona al δ-3-careno como un compuesto utilizado en perfumería y cosmética, además de presentar actividad antifúngica, antiinflamatoria y sedante.
Noriega-Rivera, Guerrini y Ankuash-Tsamaraint (2014) reportan como compuestos mayoritarios del aceite esencial de Siparuna schimpffii al germacreno D (35,34%), biciclogermacreno (8,73%), γ-muuruleno (7,04%), germacreno B (6,34%) y cadina-1(2), 4-dieno trans (5,16%), de los cuales solo el biciclogermacreno (5,8%) se determinó como uno de los mayoritarios en el aceite esencial analizado de S. schimpffii, juntamente con espatulenol (12,10%), 2-undecanona (10,87%) y (E)-isocroweacina (6,41%). No obstante, se puede observar que en ambos aceites esenciales la composición mayoritaria corresponde a los hidrocarburos sesquiterpenos. Conforme a lo descrito por Durán y col. (2007), Ruiz, Díaz y Rojas (2015) y Silva y col. (2021), las diferencias en la composición de los aceites esenciales pueden deberse a diversos factores bióticos y abióticos como la presencia o ausencia de plagas, lugar de recolección, tipo de suelo, cantidad de humedad y luz, así como las condiciones climáticas en las que se desarrollan las especies. El espatulenol presenta acción antimicobacteriana moderada (Do Nascimento y col., 2018). Silva y col. (2007) menciona actividad antimicrobiana para el biciclogermacreno y actividad fungitóxica para el germacreno B; Xu y col. (2017) detalla algunas funciones del biciclogermacreno, entre estas su actividad antioxidante, fungistática, citotóxica, alelopática e inhibidor de la enzima acetilcolinesterasa. Noriega-Rivera, Guerrini y Ankuash-Tsamaraint (2014) expresan también que S. schimpffii es empleada por las comunidades Shuar del Ecuador como un analgésico.
Conclusiones
Se logró determinar la composición química de los aceites esenciales de las especies amazónicas C. pycnantha, M. aliena, P. macrotrichum y S. schimpffi. Se evidenció mayor concentración de monoterpenos en los AE de M. aliena y P. macrotrichum y mayor contenido en sesquiterpenos en los AE de C. pycnantha y S. schimpffii. Además, se identificaron los compuestos mayoritarios de cada aceite esencial y se describieron bibliográficamente algunas de sus funciones, redireccionando futuros estudios y aplicaciones que los pobladores de Antuash puedan dar a estas especies.