Forma sugerida de citar:
Sinche, M., Jácome, G., Castillo, J., Constante, M.B. y Castro, C. (2023). Cebos para Anastrepha fraterculus con proteína hidrolizada de subproductos agroindustriales pretratados con radiación gamma. La Granja: Revista de Ciencias de la Vida. Vol. 37(1):102-116. http://doi.org/10.17163/lgr.n37.2023.08
1 Introducción
Entre el año 2012 y el 2017, el incremento en la exportación de productos ecuatorianos no tradicionales como pitahaya, mango y granadilla superó al crecimiento de varios productos tradicionales como banano, cacao y café industrializado (Verdugo y Andrade, 2018). Sin embargo, no se ha logrado abrir mercados para otras frutas con alto potencial de exportación, debido a que persiste un manejo inadecuado de la mosca de la fruta (Vilatuña, Sandoval y Trigero, 2010). Entre los mercados internacionales que no admiten el ingreso de frutas sin un tratamiento adecuado, provenientes de países afectados por esta plaga, se encuentran Estados Unidos, Japón y la Unión Europea (Vilatuña y col., 2016; IAEA, 2019). Los requisitos fitosanitarios impuestos por los países importadores buscan impedir el ingreso de esta plaga a zonas consideradas como libres (García-Rosero y col., 2015).
La mosca de la fruta pertenece a la familia Tephritidae del orden Diptera. En Ecuador predominan el género Anastrepha, originario de Centro y Sudamérica, y Ceratitis, un género introducido del Mediterráneo alrededor de 1976 (Vilatuña, Sandoval y Trigero, 2010). Esta es considerada como una de las principales plagas de interés económico a escala mundial, debido a los daños que causa en frutas y cultivos en regiones tropicales y subtropicales (White y Elson-Harris, 1992; Hafsi y col., 2016). La mosca de la fruta tiene la capacidad de adaptarse a diversas condiciones ambientales e infectar frutos en diferentes fases de su maduración. Las hembras son atraídas por ciertos aromas que las frutas emiten al comenzar su maduración, y cuando eso ocurre depositan huevecillos en su interior. Al nacer, las larvas se alimentan de la pulpa y forman galerías que facilitan el ingreso de agentes patógenos como hongos y bacterias, lo que provoca la pudrición de los frutos y su consecuente rechazo para el consumo, la exportación y la agroindustria (INIAP, 2004).
Adicionalmente, la presencia de la mosca de la fruta genera un incremento en los costos de producción porque se debe incurrir en gastos de investigación y aplicación de medidas de monitorización y control (Salcedo-Baca, Lomelí-Flores y Terrazas-González, 2009). Por ejemplo, se ha logrado la exportación de mango ecuatoriano a mercados como el estadounidense (Fundación Mango Ecuador, 2019), pero para ello se necesitan aplicar pesticidas durante el cultivo y el tratamiento hidrotérmico postcosecha de los frutos (AGROCALIDAD, 2016). Gracias a que este y otros cultivos tienen una importancia creciente en el país (MAG-CGINA, 2022), se ha incrementado el interés por controlar esta plaga mediante opciones más ecoamigables.
La Agencia de Regulación y Control Fito y Zoosanitario (AGROCALIDAD) empezó el “Proyecto Nacional de Manejo de Mosca de la Fruta” en el 2014 con el propósito de declarar áreas libres o de baja prevalencia a las zonas destinadas a la producción de frutos, mediante estrategias de manejo integrado en los cultivos hospederos de la mosca (Vilatuña y col., 2016). El manejo integrado requiere del conocimiento de la densidad poblacional de la plaga y de sus variaciones en el tiempo (Vilatuña, Sandoval y Trigero, 2010). Cebos formulados a partir de compuestos orgánicos como la putrescina, acetato de amonio o proteína hidrolizada líquida se han empleado efectivamente como atrayentes en programas para la detección y monitorización de varias especies de moscas de la fruta (Heath y col., 1997; López-Guillén, Toledo y Rojas, 2010). Se utiliza proteína hidrolizada debido al contenido de compuestos nitrogenados asociados con la atracción de las moscas hacia las frutas (Bateman, Morton y Brown, 1981; Mazor, 2009). La presencia de aminoácidos esenciales para los insectos como la metionina (Dadd, 1985), también puede contribuir con el poder atrayente de los cebos (Díaz-Fleischer y Castrejón-Gómez, 2012).
El cebo elegido por el Proyecto Nacional de Manejo de Mosca de la Fruta es un producto comercial que tiene como componente principal proteína vegetal hidrolizada (Vilatuña y col., 2016), es fabricado en Argentina y tiene un precio de 14,60 USD por litro de concentrado (Edifarm, 2016). Por ello, existe la oportunidad de formular un cebo que pueda ser producido en el país a un menor costo, que posea una efectividad similar o mayor y que genere beneficios ambientales y sociales. Bajo esa perspectiva, se pueden emplear subproductos agroindustriales como materia prima que contengan proteína y que posean un bajo valor comercial (Zahari y Alímon, 2005). En el Ecuador, existen tortas de palmiste y de soya provenientes de industrias extractoras de aceite vegetal, así como de suero de leche y sangre bovina, resultantes de la fabricación de queso y faenamiento de ganado, respectivamente. Estos son generados en grandes cantidades y comúnmente son desechados o destinados a la alimentación animal (Figueroa, Zapata y Gutiérrez, 2012).
La inclusión de un pretratamiento de las materias primas (subproductos agroindustriales) puede incrementar el rendimiento de la proteína extraída. Herrero y col. (2009) indican que las radiaciones ionizantes podrían modificar la estructura de las proteínas y provocar, según su intensidad, hasta la desaminación, descarboxilación, reducción de enlaces disulfuro y otros cambios que facilitarían la separación de estas en procesos de extracción. Estas proteínas, luego de la hidrólisis enzimática con proteasas como la bromelina (Guadix y col., 2000), se podrían utilizar para la formulación de los cebos atrayentes (Barrera, 2006), por su amplio contenido de compuestos amoniacales y su alta solubilidad (Benítez, Ibarz y Pagan, 2008). Además, la irradiación a dosis intermedias y altas permite reducir la carga microbiana (Kuan y col., 2013).
El objetivo de esta investigación fue formular cebos atrayentes de mosca de la fruta (Anastrepha fraterculus), a partir de proteína hidrolizada obtenida de los subproductos agroindustriales mencionados, y evaluar su desempeño en la monitorización de la plaga en campo. Además, se determinó el efecto del pretratamiento de las materias primas con irradiación gamma sobre el rendimiento de la extracción de proteína.
2 Materiales y Métodos
2.1 Evaluación de los cebos en campo
2.1.1 Zona de estudio
El ensayo en campo se realizó durante 5 semanas, del 18 de agosto al 22 de septiembre de 2017, en Puéllaro, una parroquia rural del cantón Quito, provincia de Pichincha. Se identificaron 4 zonas cercanas a la cabecera parroquial, denominadas Estadio, La Esperanza, La Merced y Sigsihuayco, en las cuales existen cultivos de chirimoya (Annona cherimola) y de guayaba (Psidium guajava), que son especies hospederas de la mosca de la fruta (Ver Material complementario 1).
2.1.2 Servicio de las trampas
Se emplearon dos trampas tipo McPhail para cada tipo de cebo, las cuales fueron colocadas en los árboles de chirimoya o de guayaba, con una separación mínima de 30 m, sobre puntos de detección determinados con base en las rutas de monitorización manejadas en el “Programa Nacional de la Mosca de la Fruta”. Cada trampa tuvo 250 mL de solución atrayente.
Cada 7 días se cuantificó la capacidad atrayente de cada cebo mediante el índice MTD, que corresponde al número promedio de moscas capturadas por trampa, por día (Imbachi y col., 2012) (Ver Material complementario 2). Luego, se lavaron las trampas y se colocaron 250 mL de la solución atrayente fresca (Asaquibay, Núñez y Gallegos, 2010) para mantenerlas operativas durante el periodo de experimentación (Vilatuña, Sandoval y Trigero, 2010)).
2.1.3 Diseño experimental para la evaluación de los cebos en campo
La evaluación de la efectividad de los cebos descrita correspondió a un diseño de bloques aleatorizado trifactorial 5×5×4, en el que los factores fueron el tipo de cebo (5 niveles), la semana (5 niveles) y el sector (4 niveles), mientras que los bloques correspondieron a subdivisiones realizadas en cada sector. La variable de respuesta fue el índice MTD. Los datos se analizaron con el programa Statgraphics Centurion XVIII, a través de un análisis de varianza (ANOVA) con el 95% de confianza y una prueba de rangos múltiples con el método de Fisher o de diferencia mínima significativa (LSD).
2.2 Diseño del experimento
Las materias primas empleadas para la elaboración de los cebos atrayentes de la mosca de la fruta fueron: torta de soya, torta de palmiste, suero y sangre bovina. También se usó el cebo comercial que actualmente se utiliza en el Ecuador para la monitorización de la mosca de la fruta (Ver Material complementario 3).
Para la extracción proteica, la hidrólisis enzimática y la formulación de los cebos se emplearon los siguientes reactivos: NaOH (JTBaker; 98,5% de pureza), HCl (Riedel de Haen; 37%), bromelina (Sigma-Aldrich; B4882), flavourzima (Granotec), caseína (Merck, 102244, grado analítico), fosfato dibásico de sodio (Sigma; S9763), ácido tricloro acético (Analar; 99% de pureza), seroalbúmina bovina (Sigma; A4503, grado electroforesis), carbonato de sodio (Merck; 99,5% de pureza), sulfato cúprico (Sigma; 99% de pureza), tartrato de sodio y potasio (Merck, 99% de pureza), reactivo de fenol según Folin-Ciocalteu (Sigma; F9252), persulfato de amonio (Promega; 99% de pureza), bórax (grado técnico) y 2-mercaptoetanol (Merck; CAS 60-24-2). Los siguientes reactivos, que fueron empleados para la determinación molecular, fueron de grado electroforesis: acrilamida (Bio-Rad), azul brillante de tetrabromofenol (Sigma), bisacrilamida (Bio-Rad), azul brillante de Coomassie (Merck), dodecil sulfato de sodio (Sigma) y Tris HCl (Sigma-Adrich). El reactivo de Biuret se preparó con sulfato cúprico pentahidratado (Fluka, Biochemika; 99% de pureza), EDTA (J.T. Baker, grado analítico), yoduro de potasio (Panreac; 99% de pureza) y una solución de NaOH 6 N (J.T. Baker; 98,5% de pureza).
2.3 Obtención de extractos proteicos
2.3.1 Torta de soya
La proteína se extrajo a partir de la torta de soya molida. Para ello, se colocó la torta en agua, en una relación 1:5 de sólido a líquido, y se alcalinizó con NaOH 6 N; luego, se hizo una precipitación isoeléctrica de la proteína solubilizada, como se indica en el método descrito por Vioque y col. (2001), que se detalla en Material complementario 4.
2.3.2 Torta de palmiste
Se mezcló la harina de palmiste con una solución 0,03 M de NaOH, en relación 1:30 de sólido a líquido. Esta mezcla se agitó por 45 min a 35°C (Zarei y col., 2012) y se filtró para obtener un sobrenadante libre de sólidos y residuos de grasa. Finalmente, el sobrenadante se secó por 16 h a 50°C y se almacenó en refrigeración (Arifin y col., 2009).
2.3.3 Suero de leche
Muestras de 100 mL de suero se homogeneizaron y se ajustó su pH a 5,2 con una solución 6 N de HCl. Las muestras se centrifugaron a 210×g por 15 min con el fin de separar la grasa del suero; se vertió la fase acuosa en vasos de precipitación y estos se calentaron a 93°C, por 30 min (Ver Material complementario 5). Las muestras fueron enfriadas por 20 min y se filtraron durante 3 h en papel filtro (Vázquez, Villegas y Mosqueda, 2010).
2.3.4 Sangre bovina
Se secaron muestras de 100 mL de sangre irradiada a 110°C, durante 6 h, en una estufa Memert DIN 40 050-IP 20, hasta obtener un concentrado con un 5 a 10% de humedad (Figueroa, Zapata y Gutiérrez, 2012). La concentración de proteína soluble en todas las muestras se determinó mediante el método de Biuret descrito por Fernández y Galván (2010).
2.4 Evaluación de un pretratamiento de las materias primas con radiación gamma
2.4.1 Pretratamiento con radiación gamma
Se evaluó el efecto que tiene la radiación gamma sobre el rendimiento de extracción de proteína para cada materia prima. Las dosis evaluadas para las tortas de soya y de palmiste fueron 15, 20, 25 kGy, mientras que para el suero y la sangre bovina fueron 10, 15 y 20 kGy. En cada caso se determinó el porcentaje de proteína recuperado (Ver Material complementario 6).
En los ensayos de extracción proteica, las unidades experimentales para las tortas de soya y de palmiste fueron bolsas de polietileno con 1 kg de muestra; para el suero y la sangre bovina fueron fundas de 3 L. Las muestras se colocaron a 30 cm de la fuente de cobalto-60, en la cámara de irradiación del Laboratorio de Tecnología de Radiaciones de la Escuela Politécnica Nacional. Las muestras fueron volteadas a la mitad del tiempo de exposición, para asegurar la uniformidad de la dosis (Maity y col., 2009). El experimento tuvo tres réplicas.
2.4.2 Diseño experimental para la evaluación del pretratamiento
Se empleó un diseño completamente aleatorizado para cada materia prima. En cada uno de estos diseños, la variable de diseño fue la dosis de irradiación; sus niveles fueron 15, 20 y 25 kGy para las materias primas de origen vegetal, y de 10, 15 y 20 kGy para las materias primas de origen animal. La variable de respuesta fue la cantidad de proteína recuperada. Se tuvieron tres réplicas. El análisis estadístico se realizó en el programa Statgraphics Centurion XVIII; se hizo un ANOVA con el 95% de confianza y una prueba de rangos múltiples con el método de Fisher.
2.5 Hidrólisis enzimática de los extractos proteicos
Las concentraciones de sustrato y de enzima para los procesos de hidrólisis fueron seleccionadas de forma experimental, como se describe a continuación.
2.5.1 Selección de la concentración de sustrato
Los aislados proteicos fueron solubilizados en tampón fosfato de sodio 0,1 M pH 7,0, en concentraciones de 20, 40, 60, 90, 120, 150 y 200 mg ; las soluciones se agitaron durante 10 min a 900 rpm y posteriormente fueron centrifugadas a 1 698 ×g por 15 min. Luego, 600 μL del sobrenadante se mezclaron con 2 400 μL de tampón fosfato (Cheftel, Cuq y Lorient, 1989) y se determinó la cantidad de proteína soluble mediante el método de Biuret (Fernández y Galván, 2010). Se seleccionó la concentración que permitió obtener la mayor cantidad de proteína soluble para cada sustrato (Ver Material complementario 7).
2.5.2 Selección de la concentración de enzima y el tiempo de hidrólisis
En primer lugar, se verificó que las enzimas bromelina y flavourzima conserven su actividad proteolítica de acuerdo con el método descrito por Castillo y col. (2012) (Ver Material complementario 8). Se prepararon soluciones de 0,020 UA de bromelina, 24,0 LAPU de flavourzima y 10 mg de caseína, para garantizar que la concentración de enzima sea menor a la del sustrato y generar condiciones de saturación (Nelson y Cox, 2013). A 100 μL de cada solución enzimática se añadieron 1 100 μL de caseína y se incubaron por 20 min, a 37°C. Luego, se añadieron 1 800 μL de TCA al 5% a cada mezcla para detener la reacción y precipitar la proteína soluble. Después, las muestras fueron centrifugadas a 2 821 ×g durante 20 min; del sobrenadante se tomaron alícuotas de 1 000 μL y se midió su absorbancia a 280 nm en un espectrofotómetro UV-VIS Hitachi U-19000 (Castillo y col., 2012). Los blancos se prepararon de la misma forma, pero el TCA se adicionó inmediatamente después de mezclar cada solución enzimática con el sustrato. El ensayo se realizó por duplicado.
A continuación, se realizaron ensayos de hidrólisis con diferentes concentraciones de cada enzima. Para cada sustrato se usaron las concentraciones seleccionadas como se indicó en la sección 2.4.1. Se evaluaron las siguientes concentraciones de bromelina: 0,002; 0,006; 0,015; 0,020 y 0,025 UA y de flavourzima: 2,0; 4,7; 6,0; 12,0; 24,0 y 40,0 LAPU . Las condiciones de hidrólisis para la bromelina fueron pH 7,0; 40°C por 1 h y para la flavourzima pH 7,0; 50°C por 5 h (Benítez, Ibarz y Pagan, 2008). Después, se eligió la concentración de enzima que permitió obtener la mayor cantidad de proteína soluble en el menor tiempo para cada materia prima (Ver Material complementario 9).
Se tomaron alícuotas de 200 μL de la mezcla de reacción a diferentes tiempos con el fin de cuantificar la proteína soluble. Para las reacciones con bromelina, se extrajeron alícuotas a 0, 1, 3, 5, 10, 20, 30 y 60 min; mientras que para las reacciones con flavourzima a 0, 15, 30, 60, 120, 180, 240 y 300 min. En cada caso, se añadieron 2 000 μL de TCA (10%) para detener la reacción enzimática. Luego, las muestras fueron centrifugadas a 2 821 ×g durante 15 min, se tomó el sobrenadante de cada muestra y se midió el contenido de proteína soluble por el método de Biuret (Fernández y Galván, 2010).
Finalmente, se realizaron curvas de velocidad de formación de producto en función del tiempo para todas las concentraciones de cada enzima y se seleccionó la enzima que permitió obtener una mayor concentración de hidrolizados proteicos en el menor tiempo de reacción (Ver Material complementario 10 y 11).
2.5.3 Grado de hidrólisis enzimática
El grado de hidrólisis se determinó mediante la Ecuación 1. La cantidad de proteína soluble se determinó durante la hidrólisis de cada aislado proteico a las condiciones previamente indicadas por 1 h. Se tomaron alícuotas de 1 mL a diferentes tiempos (0, 3, 5, 10, 20, 30 y 60 min), se mezcló cada alícuota con 1 mL de TCA al 10% y se centrifugaron a 2 821 ×g durante 10 min (Molina-Ortiz y Wagner, 2002). El contenido de proteína total se determinó mediante la hidrólisis de 0,05 g de cada aislado con 2 mL de HCl 6 N a 110°C, durante 48 h. Los hidrolizados fueron centrifugados a 2 821 ×g durante 10 min (Wilchek y Miron, 2003). Los contenidos de proteína soluble y total se cuantificaron en el sobrenadante mediante el método de Biuret (Ver Material complementario 12).
2.5.4 Determinación del tamaño molecular de los hidrolizados obtenidos mediante electroforesis SDS-PAGE
La determinación de los pesos moleculares para cada materia prima se realizó por electroforesis SDSPAGE (Ver Material complementario 13), se siguió el procedimiento señalado por Laemmli (1970) y modificado por Castillo y col. (2012).
2.6 Formulación de los cebos para mosca de la fruta con proteína hidrolizada
Para formular los cebos atrayentes, se determinó la concentración de proteína soluble en los hidrolizados obtenidos y se caracterizó el cebo comercial (Ver Material complementario 14). Luego, se estableció la cantidad de cada tipo de hidrolizado proteico que se debía colocar en las trampas, de manera que todas las soluciones resultantes tengan la misma cantidad de proteína (Ver Material complementario 15 y 16). La formulación de referencia contiene un 10% del cebo comercial, 3% de bórax y 87% de agua (OIEA, 2005).
3 Resultados
3.1 Evaluación de un pre-tratamiento de las materias primas con radiación gamma
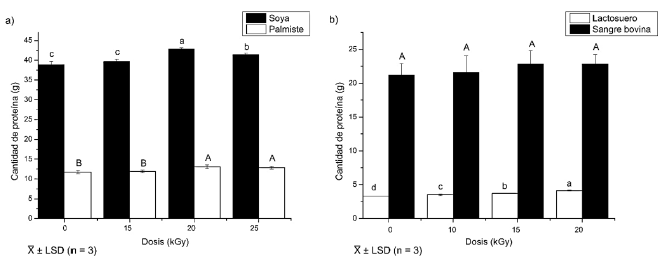
La Figura 1 muestra la cantidad de proteína extraída de las materias primas irradiadas con dosis de 0 (control) a 25 kGy. La irradiación tuvo un efecto significativo (p < 0;05) sobre el proceso de extracción en la torta de soya, de palmiste y suero. A partir de la torta de soya irradiada con la dosis de 20 kGy se obtuvo el mayor rendimiento, que fue 10%superior al conseguido con la muestra control. En la torta de palmiste, se observaron incrementos significativos en los tratamientos con 20 y 25 kGy; a 20 kGy se extrajo un 12% más de proteína en comparación con la muestra control; como se aprecia en el literal a). A la misma dosis, se obtuvo el mayor rendimiento de extracción para el suero, con un 0,82% de incremento con respecto a la muestra control. Las muestras de sangre no presentaron diferencias significativas en comparación con el control, como se evidencia en el literal b). Esto se debería a que el proceso de extracción incluyó un secado de las muestras de sangre, como una forma de concentrar la proteína. Este método no se fundamenta en la desnaturalización y precipitación proteica (Figueroa, Zapata y Gutiérrez, 2012), por ello, no se vio beneficiado por el tratamiento con radiaciones ionizantes que, en cambio, propicia la precipitación (Gaber, 2005).
En consecuencia, la dosis de irradiación seleccionada para todas las materias primas fue la de 20 kGy, porque con ella se obtuvieron mejores rendimientos a partir de la torta de soya y del suero. En el caso de la torta de palmiste, el tratamiento con 20 kGy generaría resultados estadísticamente iguales a los obtenidos con la dosis de 25 kGy, pero representaría un menor tiempo y costo de irradiación. En cuanto a la sangre bovina, no se alcanzarían incrementos en el porcentaje de proteína recuperada, pero se obtendrían otros beneficios, como la descontaminación microbiana.
En general, los tratamientos con radiación aumentaron el rendimiento de extracción de proteína. Consistentemente, Castillo, Mendieta y Sinche (2019) reportaron el incremento del porcentaje de proteína extraída en plumas de pollo expuestas a 25 kGy. Así también, Kuan y col. (2013) señalaron las modificaciones en la estructura secundaria de las proteínas al exponerse a dosis mayores a 10 kGy, lo cual favorece su extracción.
3.2 Hidrólisis enzimática de los extractos proteicos
3.2.1 Concentración de sustrato seleccionada
Se seleccionó la concentración de sustrato de 15% en peso sobre volumen (p/v) para la torta de soya y de palmiste, debido a que produjo la mayor cantidad de proteína soluble. En el caso del suero y sangre bovina, se eligieron 12 y 15% (p/v), ya que la solubilidad de la proteína disminuyó a concentraciones mayores, posiblemente por el exceso de soluto (Cheftel, Cuq y Lorient, 1989).
3.2.2 Concentración de enzima y tiempo de hidrólisis seleccionados
Aunque ambas enzimas presentaron actividad proteolítica para usarse en la hidrólisis de los aislados proteicos, las reacciones catalizadas con flavourzima requirieron mayor tiempo de reacción y concentración de enzima que las reacciones con bromelina, para alcanzar similares concentraciones de proteína soluble en los hidrolizados. Por ello, se seleccionó a la bromelina para los ensayos posteriores. Además, se descartó el uso combinado de bromelina y flavourzima porque no se observaron efectos sinérgicos.
La Figura 2 muestra los gráficos de concentración de proteína soluble en función del tiempo que se obtuvieron al hidrolizar concentrados proteicos de las materias primas con bromelina a concentraciones entre 0,002 y 0,025 UA . Se muestra que con una concentración de 0,025 UA de bromelina se alcanzan los mayores valores de concentración de proteína soluble para todos los sustratos. Esta es una ventaja que presentan los hidrolizados en comparación con la proteína original, pues al romperse en péptidos de menor peso molecular, se incrementa el número de grupos polares, debido al aumento de la exposición de grupos carboxílicos y aminos libres, lo que mejora su solubilidad (Benítez, Ibarz y Pagan, 2008). El tiempo de reacción escogido fue de 30 min, ya que permitió alcanzar concentraciones de proteína de 11,94; 3,23; 7,24 y 8,53 mg para la soya, palmiste, suero y sangre bovina, respectivamente, las cuales fueron cercanas a los valores máximos observados, a los 60 min.
3.2.3 Grado de hidrólisis
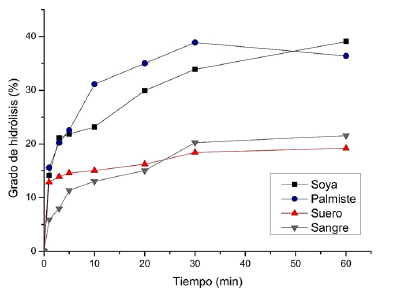
En la Figura 3, se presentan los grados de hidrólisis de los concentrados proteicos correspondientes a cada materia prima, durante 60 min de reacción con 0,025 UA de bromelina, bajo las condiciones de pH y temperatura establecidas.
Se puede observar que a los 30 min de reacción, se alcanzaron porcentajes de hidrólisis del 33,87 para la soya, del 38,89 para el palmiste, 18,42 para el suero y 20,24 para la sangre. Estos hidrolizados son considerados de tipo extensivo y pueden ser utilizados para la formulación de sustancias proteicas líquidas, debido a su alta solubilidad y a que este tipo de hidrolizados son fácilmente absorbidos por los organismos vivos (Vioque y col., 2001). A los 60 min, los valores de grado de hidrólisis no presentaron incrementos que justifiquen un mayor tiempo de reacción; por tal motivo, en las siguientes etapas se trabajó con los hidrolizados correspondientes a 30 min de reacción.
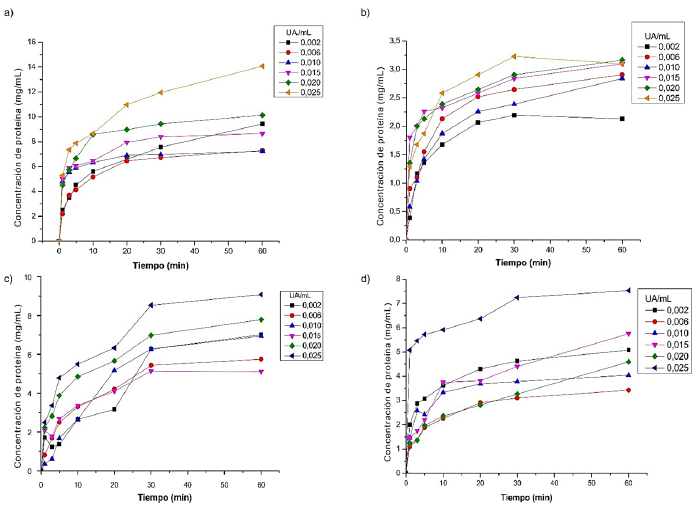
Figura 2. Concentración de proteína soluble según el tiempo de hidrólisis con bromelina a diferentes concentraciones, para a) soya, b) palmiste, c) suero, d) sangre.
3.2.4 Electroforesis SDS-PAGE
En la Figura 4 se muestran los resultados de la caracterización molecular mediante electroforesisSDS-PAGE. En el cebo comercial se identificaron péptidos con pesos moleculares entre 10 y 70 kDa. Los hidrolizados de soya exhibieron bandas correspondientes a pesos moleculares de 10 a 20 kDa y en palmiste, en su mayoría, menores a 15 kDa (Figura 4a). Los péptidos del hidrolizado de sangre tuvieron pesos moleculares de 10 a 70 kDa y el suero de 10 a 15 kDa (Figura 4b). El cebo comercial y los hidrolizados de las materias primas estudiadas presentaron péptidos con tamaños moleculares entre 10 y 15 kDa, fracciones muy digeribles que posibilitarían formular un cebo que pueda reemplazar al que actualmente se importa.
3.3 Evaluación en campo de los cebos para mosca de la fruta
Las soluciones atrayentes colocadas en las trampas para la evaluación en campo fueron formuladas de modo que presenten una concentración de proteína soluble de 12,55 mg igual a la del cebo comercial; es decir que se colocaron distintas cantidades de los extractos proteicos para llegar a una misma cantidad de proteína en cada cebo.
El ANOVA indicó que el tipo de cebo utilizado sí tuvo un efecto significativo (p < 0;05) sobre la cantidad de moscas atrapadas. La Figura 5 presenta el gráfico de medias del índice MTD en función del tipo de cebo. Se observa que el cebo de suero mostró el mayor índice MTD (LSD, 95%). La efectividad de los cebos de palmiste y sangre fue estadísticamente igual a la del cebo comercial. Por ello, se les podría considerar como alternativas para la monitorización y control de la mosca de la fruta en el Ecuador. En tanto que el cebo de soya evidenció un menor índice MTD que el cebo comercial.
La diferencia de efectividad de los cebos se debió, posiblemente, al tamaño molecular y naturaleza de los péptidos obtenidos por la acción proteolítica de la bromelina. Se conoce que la bromelina cataliza la hidrólisis de enlaces peptídicos formados con residuos no polares (Benítez, Ibarz y Pagan, 2008). El diferente resultado obtenido con el cebo de palmiste y el de soya pudo deberse a la variación entre los perfiles de aminoácidos de los extractos proteicos correspondientes, dado que la proteína de palmiste posee 7 de los 8 aminoácidos hidrofóbicos (Alimon, 2004; Nelson y Cox, 2013), mientras que la proteína de soya posee únicamente 5 (Calderón de la Barca, Ruiz-Salazar y Jara-Marini, 2000). La eficiencia del cebo de suero para capturar moscas de la fruta posiblemente se debió a la presencia de péptidos ricos en nitrógeno, con pesos moleculares entre 10 y 15 kDa. Según Canal, Gonzáles y Pérez (2010), las moscas de la fruta perciben y asimilan con facilidad péptidos de cadena corta, con bajo peso molecular. Además, las proteínas del suero tienen abundante presencia de lisina, lo cual proporciona una mayor cantidad de nitrógeno que otras fuentes proteicas (Jovanovi´c, Bara´c y Ma´cej, 2005). El nitrógeno es un factor necesario para el crecimiento del díptero, que le permite alcanzar la madurez sexual (Montoya, Toledo y Hernandez, 2010).
El número de vainas por planta es un componente de rendimiento muy importante que determina la productividad del cultivo. El promedio de NVP varió desde 15,43 en el tratamiento control hasta alcanzar valores de 20,93 con el abono comercial compuesto de gallinaza, caprinaza y residuos de caña de azúcar en la dosis completa (ABOB: 10573,00 kg/ha) y 22,83 con la dosis completa del fertilizante químico triple 15, no encontrando diferencia entre estos dos últimos. A este respecto, Jasem, Atab y Abed (2015) encontraron que tanto la fertilización química como orgánica condujo a un aumento significativo en el número de vainas por planta, la longitud de las vainas y el rendimiento de semillas de las plantas de habas (Visia faba L.).

Figura 5. Índice MTD en función del tipo de cebo, durante las 5 semanas de evaluación en campo (media ± LSD, 95%).
En la Figura 6 se presenta el índice MTD en función del tiempo para cada cebo. En todos los casos, se obtuvieron valores de MTD mayores a 1; por tanto, Puéllaro puede ser considerada como una zona infestada por la mosca de la fruta. Los cebos de palmiste y suero presentaron los valores más altos durante el tiempo evaluado. Los picos de MTD podrían deberse a las primeras lluvias de la temporada previas a la instalación de las trampas. Esto pudo favorecer el desarrollo de las pupas de la plaga y en consecuencia aumentar la incidencia de adultos. Consistentemente, Tucuch-Cauich, Chi-Que y Orona-Castro (2008) señalaron una relación directa entre la presencia de precipitaciones y el aumento en la incidencia de Anastrepha spp. Se presume, que la afinidad de las moscas de la fruta hacia los hidrolizados de proteína utilizados en esta investigación fue influenciada por factores como el clima, estado fenológico de las moscas, tipo de cultivo, la ubicación de la trampa, densidad de trampeo y nivel de población (Canal, Gonzáles y Pérez, 2010).
4 Conclusiones
La aplicación de una dosis de radiación gamma de 20 kGy como pre-tratamiento permitió obtener un mayor rendimiento en la recuperación de proteína para la soya con valores de 67,24%, para el palmiste 60,53% y para el suero 35,7%. Los tratamientos con radiación no evidenciaron diferencias significativas sobre el rendimiento de concentración de proteína para la sangre bovina.
Las condiciones seleccionadas para la hidrólisis enzimática fueron: pH 7,0; 50°C; concentración de sustrato (p/v) 15% (torta de soya, sangre bovina y torta de palmiste) y 12% (suero); 0,025 UA de bromelina y tiempo 30 min. Los porcentajes de hidrólisis fueron de 33,87 para la soya, 38,89 para el palmiste, 24,78 para el suero y 19,94 para la sangre, luego de 30 min de reacción. Se obtuvieron hidrolizados proteicos con pesos moleculares similares a los hallados en el cebo comercial (10 a 50 kDa).
La proteína hidrolizada de suero en primer lugar, o las de palmiste y de sangre bovina como segunda opción, podrían ser una alternativa a la proteína que emplea el cebo comercial, con base en los resultados del índice MTD. Es necesario investigar el desempeño de los cebos propuestos en experimentos de mayor alcance, en distintos cultivos y locaciones del Ecuador en las que se haya detectado la presencia de la mosca de la fruta. Esto se debe a que un tipo de atrayente puede ser efectivo para una especie determinada de mosca de la fruta, pero no para otra, inclusive si pertenecen al mismo género (Aluja y col., 2001).
Contribución de los autores
MS fue el director del proyecto de investigación supervisó el pretratamiento de las materias primas con radiaciones ionizantes, los diseños experimentales y análisis estadísticos, así como la discusión de los resultados. PC supervisó los procesos de obtención de proteína hidrolizada. GJ supervisó la evaluación de los cebos en campo; CC y MC realizaron los ensayos de laboratorio y el servicio de las trampas.