Forma sugerida de citar:
Noriega, P., Idrobo, T., Pintag, M., Vinueza, D. y Larenas, C. (2022). Actividad antiinflamatoria in-vivo de una formulación tópica con principios activos de aceites esenciales de Cannabis sativa L. (cáñamo) y Baccharis latifolia (Ruiz & Pav) per. (chilca). La Granja: Revista de Ciencias de la Vida. Vol. 37(1):23-33. http://doi.org/10.17163/lgr.n37.2023.02
1 Introducción
Los procesos inflamatorios están vinculados a una gran cantidad de patologías como enfermedades autoinmunes (Urakov y Urakova, 2021; Lochhead y col., 2021; Murata, 2018), infecciones diversas (Shah, 2019; Cervilla, Purriños y Moya, 2002); enfermedades cardiovasculares (Golia y col., 2014; Van Eeden y col., 2012) y traumatismos de toda índole (Brown, Worrell y Pariante, 2021; Mortaz y col., 2018). De acuerdo al boletín técnico (INEC, 2020), los politraumatismos son la segunda causa de morbilidad hospitalaria, solo por debajo de las infecciones gastrointestinales, trayendo como consecuencia un alto consumo de medicamentos antiinflamatorios no esteroideos (AINES). La respuesta inflamatoria saludable es benéfica temporalmente, pero tiene un equilibrio precario que puede alterarse, causando daño involuntario al tejido y generar una inflamación anormal o crónica. Este desequilibrio genera un estado “pro inflamatorio” descontrolado y capaz de provocar enfermedades a consecuencia del estrés oxidativo, que a su vez no es más que el resultado del daño originado por las especies reactivas de oxígeno (EROs), lo cual tiene como base de generación a la inflamación (Schewe, 1995).
Muchas plantas medicinales son usadas por sus propiedades antiinflamatorias como parte del conocimiento ancestral de pueblos alrededor del mundo; adicionalmente, existen en varias de estas especies ensayos in vitro e in vivo que comprueban el potencial antiinflamatorio de los principios activos que contienen (Oguntibeju, 2018; Nunes y col., 2020; Tasneem y col., 2019; Yatoo y col., 2018). Dentro de los extractos empleados por su actividad antinflamatoria están los aceites esenciales, y muchas de estas matrices biológicas han demostrado poseer metabolitos secundarios con alta actividad (Miguel, 2010; Pérez y col., 2011; Grassmann y col., 2000). Dentro de las especies promisorias, ya sea por su uso tradicional o por su evidencia científica, están los aceites esenciales de C. sativa (cáñamo) (Orlando y col., 2021; Di Sotto y col., 2022) y el de B. latifolia (chilca) (Abad y Bermejo, 2007; Sequeda-Castañeda, Célis y Luengas-Caicedo, 2015).
En este estudio se analizaron los aceites esenciales provenientes de las dos plantas medicinales como principios activos en una formulación tópica, cuya efectividad fue estudiada in vivo en modelo con animales y comparado con un fármaco comercial de venta libre muy empleado en nuestro medio. De esta manera se propone una alternativa de formulación que use activos naturales con una eficacia alta, con la capacidad de mitigar inflamaciones resultantes de traumatismos o de patologías reumatoideas.
2 Materiales y Métodos
2.1 Extracción de los aceites esenciales
El aceite esencial de cannabis fue adquirido a la empresa Eden Garden Essentials, con sede en San Clemente, EEUU, el producto viene acompañado de su ficha técnica de calidad. Las hojas de chilca (B. latifolia (HUPS-as-011 voucher herbario de los laboratorios de Ciencias de la Vida-UPS). Fueron recolectadas en la ciudad de Riobamba, en la provincia
de Chimborazo en las siguientes coordenadas, latitud: 1°40’26’’ S, longitud: 78°38’37’’ O, altitud: 2752 m.s.n.m. El material fresco se procesó en un destilador de acero inoxidable con 64 litros de capacidad que opera con el sistema conocido como agua y vapor de agua en los laboratorios de Ciencias de la Vida, de la Universidad Politécnica Salesiana, Sede Quito.
2.2 Composición química de los aceites esenciales
La ficha técnica del aceite esencial de cannabis detalla la composición química del mismo. La identificación de compuestos del aceite esencial de chilca se realizó a través de cromatografía de gases acoplada a espectrometría de masas. Para esto se usó un cromatógrafo de gases Trace 1310 acoplado a un espectrómetro de masas ISQ 7000 marca Thermo Fisher Scientific con una columna cromatográfica Termo Scientific TR-5MS, de longitud de 30 m, un espesor de 0,25 mm y un espesor de película de 0,25 μm. La muestra se preparó diluyendo 10 μL de aceite esencial de chilca en 990 μL de diclorometano; el volumen de inyección fue de 1 μL El gas de acarreo fue helio de 99,9999% de pureza, a un flujo de 1 mL min -1 , y un split-ratio de 1:40. La temperatura del inyector fue de 250°C.
La temperatura inicial en la columna fue de 60°C por 5 minutos, hasta alcanzar los 100°C a una velocidad de 2°C /min, posteriormente se sube a los 150°C, a una velocidad de 3°C /min, se alcanzan los 200°C a 5°C /min, y finalmente a los 230°C manteniéndose a esta temperatura por 5 minutos, siendo el tiempo total de análisis de 60 minutos.
Las condiciones del espectrómetro de masas fueron: energía de ionización: 70 eV; corriente de emisión: 10 μAmp; rango de escaneo: 1 scan/s; rango de masas: 40-350 Da; temperatura de la trampa: 230°C; temperatura de la línea de transferencia: 200°C.
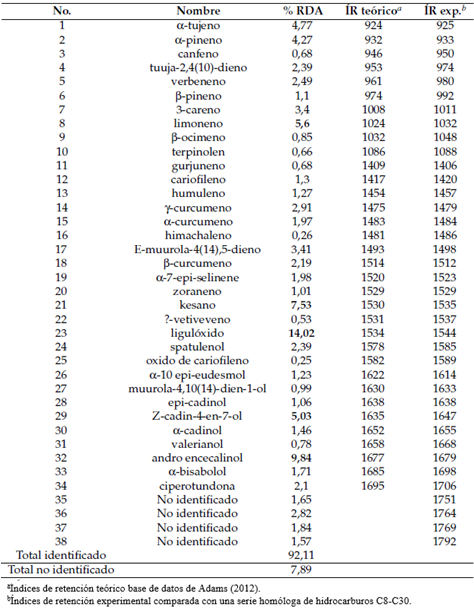
La identificación de las moléculas se realizó a través de la base de datos de espectros de masas NIST 2001. Además, se calculó el índice de retención aritmética (IR), de cada compuesto a través de la comparación con una serie de alcanos C8-C30 y finalmente se contrastó con los índices de retención teóricos de la base de datos de Adams (2012).
2.3 Elaboración de los ungüentos antiinflamatorios
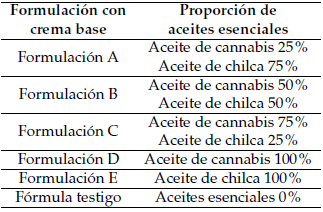
El tipo de formulación fue O/W (aceite en agua), y la formula se describe en la Tabla 1. Se prepararon 5 formulaciones con distintas proporciones de los aceites esenciales y una fórmula testigo sin aceites, en donde el porcentaje de agua fue del 64%. Los porcentajes de cada formulación se describen en la Tabla 2.
2.4 Actividad antiinflamatoria in vivo
Se empleó el método del edema subplantar inducido por inyección de carragenina propuesto por Winter, Risley y Nuss (1962). Se usaron ratas de un peso entre 180 y 220 gramos, de edades entre 4 a 8 semanas, bajo condiciones de alimentación controlados. Los animales de laboratorio fueron ambientados por 2 semanas en grupos de 5 para cada tratamiento: 5 concentraciones, una fórmula testigo y un control positivo. Como control positivo se usó una formulación comercial con 1% de diclofenaco. A cada animal se le inyectó una solución de carragenina al 0,3% en propilenglicol, con un tiempo de espera de 30 minutos para generar el edema. En total se tomaron 5 valores por cada individuo: T antes de la aplicación de la carragenina, To a los 30 minutos, T1 a 1 hora, T2 a las 3 horas y T3 a las 5 horas de aplicación. Los valores se determinaron en unidades de volumen con la ayuda de un pletismómetro. La figura 1 muestra gráficamente el experimento.
2.5 Estadísticas
Al tener siete grupos de datos en diferentes tiempos, incluidos los grupos controles tanto positivo como testigo, el estudio estadístico se realizó en 4 etapas. Mediante el programa R versión 2021 se analizaron los datos, tomando en cuenta como principal parámetro la proporción de inflamación causada al inicio y el nivel de desinflamación en los tres tiempos en que se realizaron las mediciones. Estos parámetros se expresaron en valor neto de inflamación, teniendo de valor el volumen de la pata inflamada menos el volumen de la pata normal. Primero se determinó si los valores presentan normalidad mediante el test de Kolmogorov-Smisnov con el ajuste de Lilliefors, contrastando por tratamiento aplicado y por tiempo de transcurrido después de la aplicación del tratamiento. Seguido se realizó el análisis de Homosedasticidad usando el test de Levene en todos los tiempos de medición de inflamación para determinar que las varianzas sean homogéneas, es decir que no exista una variabilidad muy grande entre los grupos de estudio y poder aplicar un test de Tukey posteriormente.
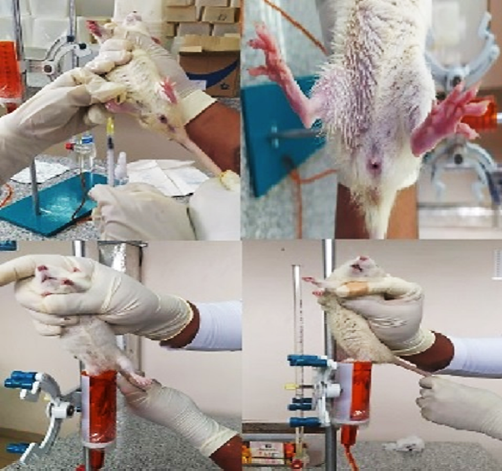
Figura 1. Esquema gráfico del método de edema subplantar inducido por carragenina y medición en un pletismometro manual.
El análisis principal fue el test de Anova. Previamente se hizo un análisis de covarianza para descartar la posibilidad de una interferencia de resultados con una variable que no se toma en cuenta, en este caso una posible interacción con el volumen de la pata de la rata en estado inicial; el análisis se hizo con el test Ancovac. El análisis de Anova se realizó en modelo de una vía para determinar una diferencia significativa entre las medias. Se observaron las diferencias entre cada uno de los grupos frente a otros en los tres tiempos de medición después de colocado el tratamiento para determinar cuál tratamiento es el más efectivo frente a la inflamación, tomando en cuenta los grupos controles testigo y positivo (formulación con diclofenaco al 1%). Posteriormente se hizo un estudio de Anova en modelo lineal para ver el comportamiento de cada uno de los tratamientos como un factor dentro de una ecuación de regresión lineal, contrastando cada uno frente al grupo blanco.
3 Resultados y Discusión
3.1 Composición química de los aceites esenciales
El aceite de cannabis adquirido a la empresa Eden Garden Essentials viene acompañado de un certificado de composición química, misma que se detalla en la Tabla 3.

Tabla 3. Composición química del aceite esencial de C. sativa proporcionado por la empresa Eden Garden Essentials.
Los compuestos más importantes son: Ecariofileno 27,91%, mirceno 21,19%, α-pineno 8,05%, α-humuleno 8,03%, limoneno 7,18%, terpinoleno 7,12% y β-pineno 4,68%. La composición química en el aceite esencial de chilca se observa en la Tabla 4. Como compuestos principales están liguloxido 14,02%, andro encecalinol 9,84%, kesano 7,53%, limoneno 5,6% y Z-cadin-4-en-7-ol con5,03%.
3.2 Evaluación antinflamatoria in-vivo
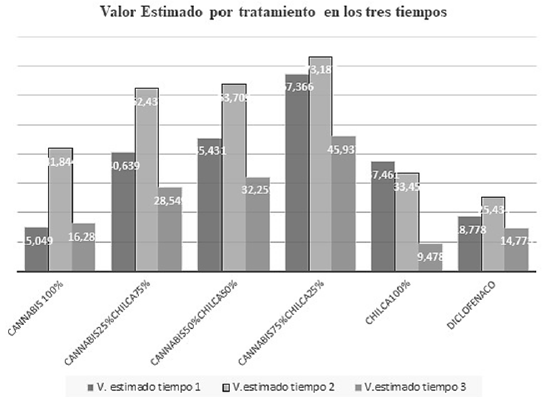
Luego de la homogenización de los tratamientos al aplicar los test de normalidad y homogeneidad, el análisis estadístico test de Anova fue ejecutado relacionando la eficacia antiinflamatoria en volumen para cada uno de los tratamientos, incluyendo a la fórmula testigo (T) sin principios activos, control positivo (CP) con diclofenaco al 1% y las 5 formulaciones con diferentes proporciones de los aceites esenciales al 1%, que son: A (100%A.E. cannabis), B (75% A.E. chilca y 25% A.E. cannabis), C (50% A.E. de chilca y 50% A.E. cannabis), D (25% A.E. chilca y 75% A.E. de cannabis), E (100% A.E. de chilca). Las mediciones se ejecutaron en los 3 tiempos descritos en el ensayo, es decir a 1, 3 y 5 horas luego de la aplicación del producto, la Figura 2 describe los resultados de los 3 ensayos.
En la Figura 3 se observa un análisis comparativo entre las formulaciones con los aceites esenciales y el control positivo con diclofenaco.
4 Conclusiones
La composición química del aceite esencial de cannabis proporcionada en el certificado de análisis de la empresa Eden Garden Essentials contiene como moléculas mayoritarias al cariofileno, mirceno, humuleno, limoneno y pinenos, esto es similar a lo conseguido en la literatura científica (Malingre y col., 1975; Novak y col., 2001). Tanto para cariofileno (Dahham y col., 2015; Bakır y col., 2008), como para mirceno (Surendran y col., 2021), existen estudios que confirman su actividad antiinflamatoria en diversos ensayos.
A diferencia del aceite esencial de cannabis, el de chilca tiene pocos estudios, lo que no permite tener suficientes fuentes de comparación. El estudio realizado por Valarezo y col. (2013), muestra semejanzas y diferencias dentro de la composición química del aceite, lo que podría deberse a las variables ecológicas de los lugares de recolección de la planta. En referencia a los componentes más abundantes en nuestra investigación: ligulóxido, andro encecalinol y kesano, no se tienen estudios de bioactividad, lo que deja abierta la posibilidad de aislar dichas moléculas y verificar sus propiedades medicinales, entre ellas la antiinflamatoria.
Básicamente todas las formulaciones que contienen aceites esenciales individuales o en mezclas al 1% en la formulación muestran actividad, y si consideramos su comparación con el control positivo (formulación comercial con diclofenaco al 1%), son destacables; sin embargo, aquellas fórmulas de mezclas de aceites esenciales con actividad positiva desde el punto de vista de la significancia estadística presentan una mejor bioactividad antiinflamatoria con respecto al control positivo y a los aceites esenciales puros. Las dos formulaciones más efectivas son aquellas con un 25% de aceite de chilca (250 mg en 100 gramos de ungüento) y 75% de aceite de cannabis (750 mg en 100 gramos de ungüento) y la que contiene 50% de aceite de chilca (500 mg en 100 gramos de ungüento) y 50% de aceite de cannabis (500 mg en 100 gramos de ungüento), prácticamente en todos los test (1, 3 y 5 horas). La estadística revela su significancia en comparación con el control positivo, lo que nos llevaría a proponerlas como fórmulas posibles en el mercado de los productos naturales.
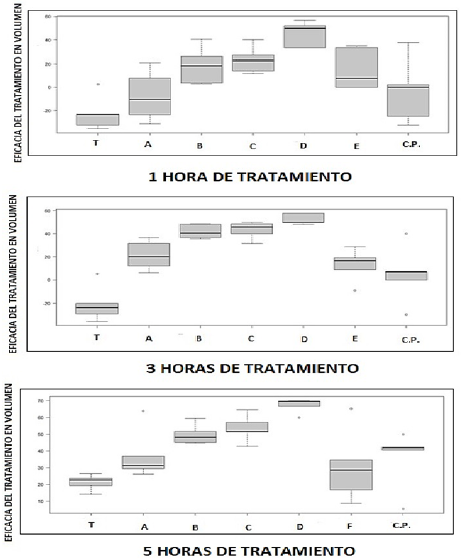
Figura 2. Tratamientos luego de 1 hora, 3 horas, 5 horas: T (muestra testigo), A (100% A.E. cannabis), B (75% A.E. chilca y 25% A.E. cannabis), C (50% A.E. de chilca y 50% A.E. cannabis), D (25% A.E. chilca y 75% A.E. de cannabis), E (100% A.E. de chilca), C.P. (control positivo).
Las cantidades de aceites esenciales empleados son pequeñas, lo que daría como resultado un producto competitivo comercialmente. A esto debemos añadir que la especie B. latifolia es abundante en los Andes del Ecuador y que en el país se empieza a producir cannabis medicinal, en donde los aceites esenciales podrían ser uno de los metabolitos de interés más allá de los canabinoles.