Forma sugerida de citar:
Huanca Mamani, T. (2022). Efecto de factores embriotróficos a diferentes tensiones de oxígeno en cultivo in vitro sobre el desarrollo embrionario de alpacas hasta la etapa de blastocisto. La Granja: Revista de Ciencias de la Vida. Vol. 36(2):113-121. http://doi.org/10.17163/lgr.n36.2022.09
1 Introducción
En Suramérica, la cría de camélidos domésticos como llamas (Lama glama) y alpacas (Vicugna pacos) forma parte de una cultura ancestral, sobre todo en Perú y Bolivia, países que cuentan con el 98,89% de la población total de alpacas (87,9% Perú y 10,9% Bolivia) y el 93,4% del total de llamas (60,8% Bolivia y 32,5% Perú), según cifras reportadas por el Ministerio de Agricultura y Riego del Perú (MINAGRI) (MINAGRI, 2015). En el caso del Perú, se reporta una población de 3 685 516 alpacas y de 1 257 000 llamas, por lo que los estudios genéticos y reproductivos de estas especies son de suma importancia para el país, debido a su gran potencial productivo y comercial, sobre todo de la alpaca, basado en la producción de fibra, carne, piel y estiércol como abono orgánico, además de su uso como animal para recreación y producción de sueros terapéuticos (MINAGRI, 2019). Según el último censo agropecuario del Perú realizado en el año 2012 por el Instituto Nacional de Estadística e Informática (INEI), las regiones con mayor densidad de alpacas son Puno con 39,6%, Cusco con 14,8% y Arequipa con 12,7%; la variedad Huacaya representa el 80,4% de la población total (INEI, 2013).
A pesar de la importancia de las alpacas para el Perú, su reproducción se realiza principalmente por monta natural, sin considerar la variabilidad genética y el mejoramiento de la especie con fines comerciales, lo que ha llevado a una disminución de la calidad genética (Huanca, 2012). Así, la reproducción in vitro se muestra como una alternativa viable para el mejoramiento genético y el aumento de la productividad de la alpaca, ya que esta técnica está altamente desarrollada en bufalinos, bovinos, ovinos y porcinos (Liang y col., 2020; Javvaji y col., 2020; Dubeibe y col., 2019; Gonella Diaza y col., 2013; Rodrigues y col., 2013). Asimismo, se ha reportado la factibilidad de la reproducción de camélidos por inseminación artificial, transferencia de embriones y fertilización in vitro (Ruiz, 2018; Pérez, Zevallos y Perez, 2017; Pacheco, Vélez y Pezo, 2016), siendo necesario el estudio de las condiciones que permitan el desarrollo exitoso de la reproducción de alpacas mediante técnicas in vitro, de suma importancia para la región andina, ya que no existen protocolos específicos para ello.
Puesto que la producción in vitro de embriones es limitada, debido a la reducida sobrevivencia tanto embrionaria como fetal y la elevada frecuencia de anormalidades fetales, placentarias o neonatales, se buscan alternativas que mejoren la producción de embriones con esta técnica, dirigiendo la atención a los factores de crecimiento que, en condiciones in vivo, regulan los procesos de mitogénesis, diferenciación y apoptosis celular (Block, 2007; Kane, Morgan y Coonan, 1997).
Los factores de crecimiento o factores embriotróficos más empleados en estudios experimentales para aumentar la eficacia de maduración de los ovocitos y la producción in vitro de embriones son el factor de crecimiento insulínico (Insulin growth factor, IGF), por sus efectos en el crecimiento, desarrollo y maduración folicular inducida por las gonadotrofinas (Lenz, Benavides y Uribe-Velásquez, 2007) y contribución a la pre-implantación y desarrollo del embrión en bovinos (Lima y col., 2006; Stefanello y col., 2006; Block, 2007), el factor de crecimiento epidérmico (Epidermal growth factor, EGF), que estimula la proliferación y diferenciación celular (Adams, 1999), y que le relaciona con la maduración ovocitaria (Harper y Brackett, 1993), el factor de crecimiento transformador (Transforming growth factor, TGF) y el factor de crecimiento derivado de las plaquetas (Platelet-derived growth factor, PDGF) (Block, 2007).
Por otra parte, los mejores rendimientos de cultivos embrionarios se obtienen con concentraciones de O2 más bajas que la atmosférica, debido al menos parcialmente, a la reducción de la generación de radicales libres de O2, reduciendo su efecto deletéreo (Legge y Sellens, 1991; Noda y col., 1991; Umaoka y col., 1992). Además, la reducida tensión de O2 intrauterina, reportada en estudios in vivo, implicaría una protección a la pre-implantación del blastocisto (Clark y col., 2006). Así, se ha reportado un mejor desarrollo de ovocitos bovinos madurados en 5% de O2 (Hashimoto y col., 2000; Van Blerkom, Antczak y Schrader, 1997).
Con estos antecedentes, se buscó establecer las condiciones idóneas para el desarrollo embrionario de alpacas al evaluar la influencia de los factores embriotróficos EGF e IGF-1 y la tensión de oxígeno al 6% y 20% sobre la tasa de división de ovocitos post primer cultivo embrionario de 48 h en medio KSOMaa, y la tasa blastocistos a partir de ovocitos post siete días de segundo cultivo embrionario en SOFaa.
2 Materiales y Métodos
2.1 Lugar del estudio
La investigación se realizó en el Centro de Investigaciones y Producción (CIP) Quimsachata, de la estación experimental agraria ILLPA – Puno, del Instituto Nacional de Innovación Agraria-INIA – Perú, ubicada entre los distritos de Santa Lucía y Cabanillas de las provincias de Lampa y San Román en la región Puno, 15◦ 440 0000 Latitud Sur y 70◦ 410 0000 Longitud Oeste, en la zona agroecológica denominada puna seca, con una altitud promedio de 4300 msnm, y una temperatura que fluctúa entre 2ºC (mayo a julio) y 15ºC (septiembre a diciembre) (Díaz, 2013).
2.2 Colección de las muestras de ovarios
La recolección de ovarios se realizó a partir de animales beneficiados en el camal del distrito de Nuñoa, con un muestreo aleatorio que no consideró el estado reproductivo de las alpacas. Los ovarios colectados se colocaron y transportaron en un termo, entre 35 y 37 ◦C, sumergidos en solución salina al 0,9% y suplementada con gentamicina (10µL/mL).
2.3 Procesamiento de los ovocitos
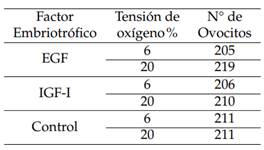
Utilizando el método Slicing modificado (Lorenzo y col., 2015) se colectaron 1051 ovocitos, seleccionados en las categorías I y II. Para su maduración, los ovocitos se colocaron en medio TCM-199, suplementado con piruvato de sodio, glutamina, estradiol (E2), hormona folículo estimulante (FSH), hormona luteinizante (LH), factor embriotrófico (EGF o IGF-1) en concentraciones entre 10 y 50 ng/ml, 5% de suero fetal bovino y gentamicina (10µL/mL) durante 32 horas, a 38,5 ◦C, con 5% de CO2 y humedad relativa mayor de 95%, con tensiones O2 de 6% o 20%. En la tabla 1 se observa la distribución de los ovocitos en función de la inclusión de factores embriotróficos y la tensión de O2.
Posterior a la maduración, los ovocitos fueron trasladados a un medio de fecundación (FER-TALP suplementado con 0.25 mM de piruvato sodio, 6mg/ml de BSA y 50µg/mL de gentamicina), en el que fueron lavados tres veces. Paralelamente se realizaba la capacitación espermática, mediante lavados en Sperm-TALP suplementado con 1,0 mM piruvato de sodio, 3 mg/ml de BSA fracción V y 50µg/mL de gentamicina con 4 µL de heparina y 30 µL de PHE/ (penicilamina, hipotaurina y epinefrina) y centrifugado a 1500 rpm/10 min. El pellet así formado fue resuspendido en 1mL del medio FERT – TALP.
La fecundación in vitro se realizó con espermatozoides provenientes de un macho de probada fertilidad, que luego de capacitados fueron transferidos a gota de 80 µl del medio de fecundación y se colocaron en incubadora durante 10 horas.
2.4 Desarrollo del embrión
Al finalizar el periodo de fecundación, los posibles cigotos fueron retirados de las gotas de fecundación e introducidos a placas multipocillos con 500 µl de medio de cultivo KSOM-AA, donde se adicionaron EGF o IGF-1 (10-50 10 y 50 ng/ml) a 38,5 ◦C, máxima humedad relativa >95%, tensión de CO2 del 5% y 6 o 20% de tensión de O2. La tasa de división de cigotos fue evaluada 48 horas después de la fecundación y luego fueron trasladados al medio de cultivo SOFaa, adicionando EGF o IGF-1 bajo las condiciones ya mencionadas. Al día siete posterior a la fecundación, se observaron los estadios de blastocisto.
2.5 Tratamiento estadístico de los datos
El experimento combinó los factores embriotróficos EGF IGF-1 y un grupo control con dos niveles de tensión de O2 (6 y 20%). Para establecer las diferencias y similitudes de la aplicación conjunta de los tratamientos sobre las tasas de divisiones de ovocitos y de blastocistos obtenidos a partir de ovocitos (blastocistos /ovocitos), se utilizó el análisis de conglomerados por distancia Euclidiana para vecinos más cercanos con un nivel de confianza de 95%. Esta técnica permite la agrupación de las variables de acuerdo a sus distancias, en clústeres entre los que no existe diferencia significativa de acuerdo a lo establecido en el análisis, ya que son excluyentes respecto a los factores que no pertenecen al grupo, no estableciéndose jerarquías, sino grupos diferenciados estadísticamente (Cuadras, 2020). Se utilizó el paquete estadístico InfoStat versión 2018 para todos los análisis estadísticos.
3 Resultados y Discusión
3.1 Tasa de división de ovocitos
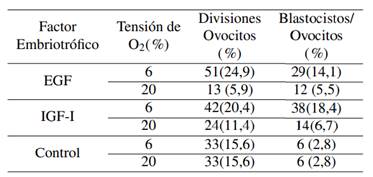
Una vez desarrollado el experimento, se observó que la menor tensión de O2 (6%) produjo la mayor tasa de división de ovocitos y formación de blastocistos por ovocito, en comparación con el grupo control y 20% de O2. (Tabla 2).
Del mismo modo, el porcentaje de divisiones de ovocitos (24,9%) fue mayor con el factor embriotrófico EGF con 6% de O2, menor al reportado por Benavides, Huanca y Quintanilla (2015), quienes, al analizar la influencia de la tensión de oxígeno sobre el desarrollo embrionario bovino, obtuvieron el 69,7% de divisiones de ovocitos con 5% de O2. Sin embargo, estos autores no evalúan el efecto de EGF; en tanto Ahumada (2011), con adición de EGF, obtuvo el 74,15% de clivaje en ovocitos bovinos cultivados a 5% de O2.
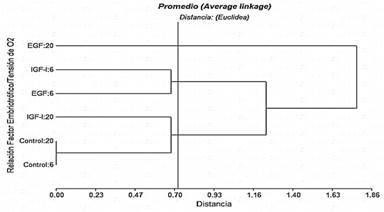
En la figura 1, el dendrograma correspondiente a divisiones de ovocitos presenta tres clústeres como grupos que difieren significativamente cuando se toma el corte de acuerdo al resultado de la distancia cofenética calculada en 0,72. Se destaca un clúster con los tratamientos de EGF e IGF-1 con 6% de O2, que al encontrarse separados del grupo control con diferentes tensiones de O2, indicaría que EGF e IGF-I aumentan significativamente la división de ovocitos, aunque entre los factores embriotróficos no hubo diferencias con dicha tensión de O2. Por otra parte, que el IGF-I con 20% de tensión de O2 forme un clúster con el grupo control, con ambas tensiones de O2 sugeriría que IGF-I, bajo estas condiciones, no afecta la división de ovocitos, mientras que el tratamiento EGF con 20% de O2 ejercería un efecto inhibitorio sobre esta variable.
Estos resultados coinciden con lo reportado por Delgado (2018), que con 2% de O2 observó mayor división de ovocitos y mejora en la calidad de embriones bovinos que con el 5% y 20% de O2 en la atmósfera de cultivo. Del mismo modo, Arias y col. (2007) reporta resultados similares a la investigación actual, aplicado a embriones de bovinos; bajo condiciones de alta (20%) y baja (7%) tensión de O2. Al respecto, estudios en ovinos y porcinos han concluido que la ausencia de O2 promueve la capacidad de activarse y mejora la partenogénesis de los ovocitos en cultivos in vitro (Iwamoto y col., 2005; Loren y col., 2016; Yao y col., 2019).
En contraste, He y col. (2020) reportaron que la tasa de escisión de ovocitos de yak fue significativamente menor (P <0,05) con una concentración de O2 al 5% que con concentraciones de 10% y 20%, mejorando la maduración y la competencia del desarrollo de los ovocitos. Por otra parte, Rodrigues y col. (2013) no observaron que la división de ovocitos caninos sea afectada por tensiones de O2 de 5% o 20%. Las diferencias entre estos resultados probablemente se expliquen, al menos parcialmente, por las características propias del desarrollo embrionario de estas especies.
3.2 Tasa de blastocistos a partir de ovocitos
La figura 2 muestra el dendograma del análisis de conglomerados con cuatro clústeres bien definidos con el corte de acuerdo a la distancia cofenética de 0,48, indicando que existen diferencias significativas entre los tratamientos experimentales y el grupo control con ambas tensiones de O2, es decir que el empleo de EGF e IGF-1 con 6 y 20% de O2 incrementa la formación de blastocistos. Por otra parte, el porcentaje de blastocistos/ovocito obtenido, es superior al 14,0% reportado por Soto-Martínez y col. (2019), también con embriones bovinos evaluados en medio líquido oviductal sintético secuencial, evitando la acumulación de sustancias embriotóxicas a tensión máxima de 5% de O2.
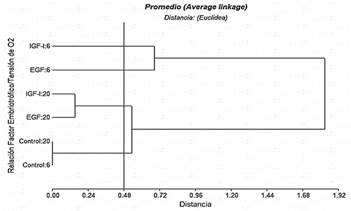
Figura 2. Dendrograma de conglomerados para la variable respuesta número de blastocistos por ovocitos
Ahora bien, el número de blastocistos por ovocitos no fue modificado por EGF e IGF-I al utilizar una tensión de O2 de 20% por lo que se ubicaron en el mismo clúster, mientras que el factor embriotrófico IGF-1 al 6% de tensión de O2 registró el mayor número de blastocistos por ovocitos (18,4%); este resultado es similar al reportado por Sirisathien y Brackett (2003), quienes obtuvieron en bovinos, un mayor número de blastocistos por ovocitos con IGF-1 que con EGF; es decir, proporciones similares de ovocitos activados partenogenéticamente se convirtieron en blastocistos que en los ovocitos inseminados (28,8%). Asimismo, Yong y col. (2017), destacaron la importancia del tratamiento con factores de crecimiento para la maduración in vitro de ovocitos de porcinos, lo que es consistente con los resultados del presente estudio.
En cuanto al efecto del IGF-1, Javvaji y col. (2020) informan que la adición de este factor mejoró significativamente la maduración de ovocitos ovinos en comparación con ovocitos no tratados, al regular la expresión de PI3K/Akt y la señalización de apoptosis, los cuales están relacionados con la activación de los ovocitos en ovinos. Finalmente, la adición del factor de crecimiento epidérmico (EGF) al medio de maduración estimula la maduración de los ovocitos; pero sólo la complementación con EGF incrementa el desarrollo embrionario y de blastocisto; esta evidencia está en concordancia con Richani y Gilchrist (2018), quienes determinaron que la red EGF también domina la traducción de las transcripciones maternas en el ovocito inactivo, una fase que es integral para la competencia del ovocito. Además, hay analogía con el estudio de Salgado, Simanca y Vergara (2013), demostrando que hubo diferencia significativa (p<0,05) de la EGF sobre la proporción de ovocitos, explicando la mayor proporción de ovocitos bajo tratamiento con 50 ng/mL.
4 Conclusiones
La tasa de división in vitro de los ovocitos de alpacas cultivados en medio KSOM-AA y de formación de blastocistos en medio SOFaa, ambos con adición de factores embriotróficos (EGF e IGF-1), se vieron favorecidos por baja tensión de oxígeno (6%), con resultados significativos respecto a los grupos control, observándose mayor porcentaje de divisiones de ovocitos con el tratamiento EGF y en blastocistos por ovocito con el tratamiento IGF-1.
Si bien el uso de los factores embriotróficos EGF e IGF-1 y las bajas tensiones de O2 generó un aumento en el número de divisiones y número de blastocistos por ovocitos, indicando que bajo las condiciones de este estudio pueden emplearse para una mejora en el desarrollo embrionario in vitro en alpacas, es necesario disponer de información adicional que permita dilucidar los mecanismos de acción de los factores embriotróficos, con el fin de optimizar el procedimiento y lograr una reproducción de alpacas in vitro viable que lleve al mejoramiento genético de la especie.