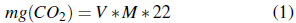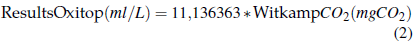Forma sugerida de citar:
Mátyás, B., Lowy, D., Singla, A., Melendez, J.R., y Sándor, Z. (2020). Comparación de los efectos ejercidos por los biofertilizantes, los fertilizantes NPK y los métodos de cultivo sobre la respiración del suelo en el suelo de Chernozem. La Granja: Revista de Ciencias de la Vida. Vol. 32(2):8-18. http://doi.org/10.17163/lgr.n32.2020.01.
1 Introducción
El aumento de las emisiones de CO2 contribuye al cambio climático mundial (Gratani et al., 2016; Ashok et al., 2019). Desafortunadamente, los niveles de dióxido de carbono exceden la tasa de respuesta de la Tierra para asimilar y procesar la emisión dentro del ciclo del carbono (Lajtha et al., 2017). Por lo tanto, se deben abordar un conjunto de desafíos de sostenibilidad tanto en las zonas urbanas (Elmqvist et al., 2019) como en las rurales (Lowy y Mátyás, 2020). Si se considera que más del 50% de la población mundial se concentra en las zonas urbanas, y se espera que para el año 2050 más de dos tercios vivan en ciudades, entonces es necesario reducir la concentración de CO2 en la atmosfera (Gratani et al., 2016). Además, la agricultura debe ser cada vez más productiva para satisfacer las crecientes necesidades alimentarias de las personas que viven en las zonas urbanas. Vermeulen et al. (2012) evaluaron las emisiones de carbono en todas las etapas del sistema alimentario global e informaron que el sistema alimentario (desde la aplicación y el cultivo de fertilizantes hasta el almacenamiento y envasado de alimentos) y es responsable de hasta un tercio de la emisión de gases antropogénicos de efecto invernadero (Thornton, 2012). Por lo tanto, se propusieron alternativas y estrategias viables basadas en materiales absorbentes de la biomasa (Moral et al., 2018) y soluciones agrícolas sostenibles (Rahman et al., 2017).
La concentración atmosférica global de dióxido de carbono (CO2), que oscila entre 278 y 391 ppm, el óxido nitroso (N2O), de 2,5 a 1803 ppb, metano (CH4), de 270 a 342 ppb (IPCC, 2014) y los gases fluorados han mostrado un aumento continuo desde los tiempos preindustriales y contribuyen significativamente al calentamiento global, como lo menciona el Grupo Intergubernamental de Cambio Climático (IPCC). Desafortunadamente, las concentraciones atmosféricas de gas de efecto invernadero (GEI) siguen aumentando, y de estos GEI la concentración de CO2 está aumentando significativamente. Para mantener el calentamiento global por debajo de los 2°C en relación con los niveles preindustriales, para 2050 se deberían reducir las emisiones mundiales antropogénicas de GEI en un 40%, en relación con 2010. Además, se prevé el aumento de las reservas de carbono biológicos existentes para el secuestro de carbono (IPCC, 2014).
Las tendencias globales permiten la implementación de alternativas para mitigar la producción de CO2 y ayudar a convertir la biomasa de las algas en biocombustibles para la sustitución de los combustibles fósiles (Eloka-Eboka e Inam-bao, 2017). Se analizó el secuestro de CO2 en el contexto de los fertilizantes presentes, la carga de NaCl y NaOH, la intensidad de la luz y sus efectos sobre el crecimiento de la biomasa de las algas, la productividad lipídica y el secuestro de CO2, como lo indica Kumar et al. (2018).
La agricultura contribuye a tres emisiones primarias de GEI: CO2, CH4 y N2O. Es importante mencionar que el suelo puede ser considerado como un sumidero para el CO2 a través del secuestro de carbono y su conversión en productos de biomasa y materia orgánica del suelo (Johnson et al., 2007; Fekete et al., 2014). Por ejemplo, se ha propuesto un cambio del uso de prácticas de labranza convencionales a prácticas menos intensivas (por ejemplo, sin labranza) para reducir la emisión de CO2 de los suelos. En las zonas mediterráneas, se observó un aumento de la reserva de carbono en el suelo al reducir o eliminar la labranza (Álvaro-Fuentes y Cantero-Martínez, 2010). Xiao et al. (2020) reportaron los resultados sobre la adición de N en la respiración del suelo (RS) en un 7,1% (P<0.05) en todos los biomas. La respuesta positiva de SR en las tierras de cultivo (27,0%, P<0,05%) fue significativamente mayor que en los biomas de pastizales y bosques, lo que indica que el SR en los ecosistemas antropogénicos podría ser más sensible al enriquecimiento de nitrógeno. Sin embargo, todavía no queda claro si existe un patrón similar en la respuesta de SR y de sus componentes a la deposición de N en los pastizales con un estado de degradación variable (Zeng et al., 2018)
Los experimentos recientes realizados con compuestos de carbonato en suelos calcáreos sintéticos tratados con cenizas de biomasa procedentes de una planta de energía de gasificación, mostraron que se fijaban 16,5 g de CO2 por kg de ceniza de biomasa. Sin cultivo de plantas se fijaron 19,7 g de CO2 por kg de biomasa (López et al., 2018). Esta fijación de carbono orgánico es positiva para el secuestro de carbono.
Otro tema importante en el ciclo del carbono del suelo es el grado de respiración del suelo (Kotroczó et al., 2008; Fekete et al., 2011), que es un indicador fiable de la actividad microbiana en el suelo.
El suelo, la respiración y la descomposición del suelo, las plantas y los animales con el 28,56% de las emisiones naturales de CO2 son la segunda fuente de CO2 después del intercambio atmosférico oceánico. Ambos procesos (respiración y descomposición) liberan dióxido de carbono como subproducto, equivalente a 220 mil millones de toneladas de CO2 liberados por los organismos del suelo durante un año.
Los procesos de respiración del suelo suelen ocurrir en las raíces de los vegetales, en las bacterias, los hongos y los animales terrestres para producir la energía necesaria para su supervivencia. También se considera como respiración del suelo la que va debajo del suelo, es decir, la descomposición de la materia orgánica enterrada (como raíces, hojas y animales). El dióxido de carbono se libera en ambos procesos (Denman et al., 2007).
También se debe tomar en cuenta el aumento de la deposición atmosférica del nitrógeno (N), que afecta al carbono (C) y al ciclo de nutrientes en los ecosistemas forestales. Peng et al. (2020) indican que la alta tasa de N aumentó el contenido de C en la superficie del suelo al reducir la respiración del suelo. Esto ocurrió principalmente por una mejor estabilización de la materia orgánica del suelo, en lugar de una reducción de la biomasa microbiana del suelo.
La investigación llevada a cabo por Chen et al. (2020) estableció que las enzimas extracelulares implicadas en el ciclo C, N y P no respondieron a la adición de N. Las concentraciones de Ca2+ extraíble del suelo se redujeron al añadir N, mientras que los otros cationes extraíbles (Fe3+, Al3+, Mg2+, K+, and Na+) no se vieron afectados. El carbono conferido por la biomasa microbiana y la abundancia total de microbios, bacterias y hongos (ácido graso fosfolípido y PLFA) se redujo por la adición de nitrógeno, pero las enzimas extracelulares involucradas en el ciclo C, N y P no respondieron a la adición de nitrógeno.
En los bosques, la acumulación de residuos microbianos y su relación con la acumulación de carbono orgánico en el suelo se ha visto afectada por la adición de N y P, a lo largo de un plazo de siete años, lo que produjo cambios tanto en la estructura de la comunidad microbiana como en la actividad enzimática inducida por la sedimentación de N y P. Todo esto puede alterar la acumulación y composición de residuos microbianos en los bosques tropicales ricos en nitrógeno. La proporción de hongos también sufrió cambios: la población de bacterias aumentó por la adición de P, o N y P, mientras que la proporción de residuos de hongos, incluyendo los residuos bacterianos, disminuyó al agregar fósforo. Esto último puede estar relacionado con un desequilibrio en el proceso de descomposición de los residuos microbianos.
Li et al. (2020) encontraron que las poblaciones de C y N estaban relacionadas con la profundidad del suelo, la duración de la conversión y la precipitación, mientras que la respuesta de P fue insensible a estos factores. También observaron que las pérdidas de C, N y P estuvieron correlacionadas con las propiedades fisicoquímicas del suelo (pH, arena, limo y arcilla). Los cambios en las relaciones de respuesta de C/N, C/P y N/P indicaron que los suelos C y N eran más sensibles a la conversión de pastizales comparado con el fósforo.
Existen diferentes investigaciones científicas que se centran en las emisiones de GEI, basadas en la evaluación de diferentes factores, como los tipos de suelo, el cultivo, el riego y la gestión de fertilizantes (Glatzel et al., 2004; Kong et al., 2013; Singla e Inubushi, 2014; Singla et al., 2014). Los diferentes usos de la tierra afectan significativamente a la producción y el consumo de GEI (Baldock et al., 2012), incluyendo la temperatura del suelo (Rustad et al., 2001), la humedad del suelo (Inubushi et al., 2005), y la relación carbono/nitrógeno total del suelo (C/N) (Xu et al., 2008). Los cambios de temperatura pueden aumentar la tasa de descomposición del carbono orgánico del suelo, COS (Powlson, 2005; Iqbal et al., 2010). El carbono orgánico del suelo regresa a la atmósfera como CO2 a través de la respiración, mientras que los organismos del suelo utilizan los materiales orgánicos como fuente de energía y nutrientes (Baldock et al., 2012). La SMB que abarca el carbono de biomasa microbiana (CBM) y nitrógeno (NBM) puede servir como un indicador de los cambios en las propiedades del suelo (Glatzel et al., 2004). Debido a que la respiración del suelo es un parámetro importante de la actividad microbiana del suelo, este puede servir como un componente esencial de la agricultura sostenible.
Los objetivos de la agricultura sostenible son asegurar las necesidades alimentarias y textiles actuales de la humanidad, sin comprometer los recursos de las generaciones futuras. Las personas que participan en la agricultura sostenible son los agricultores, los que procesan la comida, los distribuidores, los minoristas y consumidores, y los gestores de residuos. Adicionalmente, los investigadores que trabajan en la agricultura sostenible se guían por un enfoque interdisciplinario, combinando disciplinas que abarcan la biología, la química, la ingeniería, la economía y el desarrollo comunitario, y se basan en la gestión de proyectos y la responsabilidad social corporativa (Melendez et al., 2018a; Melendez et al., 2018b; Melendez y Gracia, 2019c). Todos estos grupos buscan integrar tres objetivos principales en su trabajo: (i) un entorno saludable, (ii) rentabilidad económica, (iii) justicia social y un comercio justo (Francis y Porter, 2011).
Actualmente, existen muchos biofertilizantes microbianos disponibles con uso agrícola que mejoran el crecimiento y la productividad de las plantas; mejoran directamente la fertilidad del suelo al añadir al suelo inoculantes microbianos beneficiosos, e indirectamente, a través de microorganismos estimulantes del suelo (El-Yazeid et al., 2007)
Phylazonit es una marca de biofertilizantes de Phylazonit Ltd., que contiene una relación optima de cepas bacterianas para la inyección del suelo (Bacillus megaterium, Bacillus circulans, y Pseudomonas putida). Bacillus megaterium es una bacteria que vive en un hábitat prolongado, desde el suelo hasta el agua de mar, en sedimentos, arrozales, miel, peces y alimentos secos; puede crecer fácilmente en medios simples y complejos, siendo principalmente grama positivo, es decir, bacterias que forman esporas. B. megaterium se encuentra entre las bacterias de mayor tamaño, con una longitud celular de hasta 4 m y un diámetro de 1,5 m. B. megaterium tiene al menos 100 veces más volumen que Escherichia coli (De Vos et al., 2009; Vary et al., 2007; Bunk et al., 2010). Recientemente, se ha vuelto cada vez más popular en el campo de la biotecnología por su capacidad de producción de proteínas recombinantes.
Estas se construyeron y comercializaron para la síntesis de proteínas intra y extracelulares (MoBiTec GmbH, Alemania). B. megaterium también se utiliza en la industria que produce sustancias biotecnológicas. Estas bacterias crecen en sustratos baratos, y no son patógenos (no producen endotoxinas asociadas con una membrana externa), a diferencia de E. coli. Por lo tanto, B. megaterium abre una vía hacia enfoques biotecnológicos desafiantes (Vary et al., 2007; Bunk et al., 2010).
Bacillus circulans es gram positiva y se moviliza por los flagelos. El tamaño de la célula está en el rango de 2,0-4,2 μm x 0,5-0,8 μm. B. circulans es un organismo anaeróbico facultativo, por lo que puede lograr ATP (trifosfato de adenosina) por respiración aeróbica cuando el oxígeno está presente, pero también puede cambiar a la respiración anaeróbica cuando el oxígeno está ausente. Puede crecer en un pH de 6-9, pero el pH 7 es óptimo para su evolución en un rango de temperatura óptimo de 30-37 °C. Esta bacteria produce endosporas, que permiten a las bacterias permanecer latentes durante largos períodos de tiempo en condiciones de vida adversas, pero en condiciones favorables pueden reactivarse en la etapa vegetativa. Se conoce que las bacterias B. circulans promueven las rizobacterias (Gordon et al., 2015).
Pseudomonas putida es una bacteria gram negativa en forma de varilla flagelada que se encuentra en la mayoría de los hábitats de suelo y agua donde el oxígeno está presente, y crece de forma óptima a 25-30 °C. Debido a que la Pseudomonas putida promueve el desarrollo de plantas, ésta se utiliza en la investigación de bioingeniería para desarrollar biopesticidas y para mejorar la salud vegetal. La rizosfera permite que las bacterias prosperen gracias a los nutrientes de la raíz; P. putida induce el crecimiento de las plantas y protege a las plantas de los patógenos (Espinosa-Urgel et al., 2000).
Recientemente se investigaron los cambios en varios productos físico-químicos (Bautista et al., 2017; Jakab, 2020) y las propiedades del suelo microbiano en la región (Mátyás et al., 2015; Sándor et al., 2020). Mátyás et al. (2016) evaluaron el efecto de diferentes dosis de NPK en la actividad microbiana del suelo y la biomasa microbiana. Sándor et al. (2020) exploraron cómo los diferentes métodos de cultivo afectaron la respiración del suelo y la actividad enzimática.
El objetivo de esta investigación es observar los efectos del biofertilizante Phylazonit en la respiración del suelo y comparar el alcance de la emisión de CO2 causada por los fertilizantes NPK químicos comerciales, biofertilizantes y los diferentes métodos de cultivo.
2 Materiales y métodos
La presente investigación se llevó a cabo en un suelo calcáreo chernozem, en un experimento multifactorial en la Estación Experimental Látókép, Centro de Ciencias Agrícolas, Universidad de Debrecen. Esta estación se encuentra en el este de Hungría, a 15 km de la ciudad de Debrecen. La zona se conoce por los depósitos eólicos de Hajdúsag, siendo sus coordenadas 47° 33′ 55.36″ N; 21° 28′ 12.27″ E.
Las fluctuaciones anuales del rendimiento se determinan principalmente por el contenido de humedad del suelo en el mes de julio, y el suministro de agua en mayo (Brebbia y Bjornlund, 2014). Los experimentos se realizaron de marzo a abril de 2016. El suelo de la zona puede clasificarse como franco y casi neutro. El suministro de fósforo del suelo es medio, mientras que su contenido de potasio es medio o bueno (Brebbia y Bjornlund, 2014).
Las gráficas experimentales se configuraron aleatoriamente en 4 replicaciones por cada medición y en dos grupos. El primer grupo corresponde a las mediciones realizadas el 5 de abril de 2016, y el segundo el 19 de abril de 2016. Se inyectaron 15 L/ha de Phylazonit, de acuerdo con las especificaciones del fabricante. La concentración de bacterias fue de 109/cm3. Phylazonit contiene una proporción optimizada de cepas bacterianas, Bacillus megaterium, Bacillus circulans y Pseudomonas putida.
Se midió gravimétricamente el contenido de humedad del suelo, secando las muestras de suelo a 105 °C durante 24 h, según el protocolo descrito por Klimes-Szmik (1970). El pH se determinó potenciométricamente en el agua destilada, con una relación suelo/agua de 1:2.5 (p/p), según Buzás (1988), mediante el uso de un electrodo de vidrio unido a un medidor de pH portátil de un solo canal avanzado Modelo Seven2Go (Mettler, Toledo), adecuado para mediciones de pH y conductividad. La fracción de limo y arcilla se determinó según Buzás (1988).
El diseño experimental para la respiración del suelo fue completamente aleatorio, y los tratamientos se establecieron en incubadoras a 25 °C durante 180 h, en la oscuridad. Se colocaron botellas de laboratorio (250. mL) equipadas con una tapa de tornillo apretada, 0,1 M NaOH (10 ml), luego se llenó una gasa estéril con la muestra de suelo (10. g), y se colocó dentro de la botella. Una vez transcurridos 2, 3 y 10 días, respectivamente, se determinó la cantidad de CO2 absorbida por la solución alcalina residual mediante la valoración potenciométrica con solución acuosa de 0,1 M HCl, utilizando fenolftaleína como indicador. Se calcularon las salidas de CO2 por medio de la Ecuación 1, como se describe en Witkamp (1966):
Donde mg(CO2) es la masa capturada de CO2capturado (mg), V es el volumen de HCl utilizado en la valoración para la solución KOH saturada(mL), M es la molaridad de HCI (mol L-1). Los resultados se interpretan para la respiración de 100g de muestras de suelo durante un período de 10días, por lo que la unidad en el método Witkampes: mg CO2 (100g)-1 (10 días)-1..
Los factores de multiplicación de humedad de las muestras de control son 1,40 y 1,26 para las muestras tratadas, respectivamente. El factor de la solución KOH fue 1,09, mientras que la solución HCl tuvo un factor de 0.93.
También se utilizó un método inducido, en el que se añadieron 0,10 g de glucosa a las muestras del suelo. Cada tratamiento se replicó en cuadruplicado. Además, se compararon los resultados experimentales con los resultados de estudios previos realizados en la misma estación experimental. En experimentos anteriores, se evaluaron los efectos a largo plazo de las dosis comerciales de fertilizantes de N60P45K45; N120P90K90; N180P135K135; y N240P180K180 N240P180K180 (Mátyás et al., 2015) y de diferentes métodos de cultivo (arado, aflojado, RTK en filas y RTK entre filas) (Sándor et al., 2020) sobre las propiedades físicas, químicas y microbiológicas, en experimentos de fertilización que abarcaron más de 30 años. También se compararon dos métodos para determinar la respiración del suelo, las incubaciones Witkamp y Oxitop (Bautista et al., 2017). La prueba t de Student se utilizó para el análisis estadístico, utilizando SPSS (versión 26) para revelar posibles diferencias en las muestras de control y tratamiento (biofertilizante).
3 Resultados y discusiones
Los métodos inducidos se aplican en estudios relacionados con la actividad microbiana para revelar diferencias entre diversos tratamientos. En este caso, sin método inducido (glucosa agregada) existen diferencias entre el control y las muestras tratadas. Se pueden observar diferencias entre las muestras de control y las tratadas a partir del 2do día de incubación (Tabla 1). Los datos sin procesar (resultados en repeticiones y factores) se proporcionan en la sección de material de soporte. Sin embargo, en las muestras tratadas hay una disminución en la producción de CO2 del suelo, comenzando los días 2 y 3 de incubación. Este agotamiento en la producción de CO2 se evaluó en todos los experimentos, realizándolo por cuadruplicado. Se asume que el fenómeno se origina por la presencia en el suelo de microbios consumidores de CO2 o metanotrofos, que utilizan el CO2 producido periódicamente. Esta suposición es verificada por un estudio previo (Bautista et al., 2017). Sin embargo, este hallazgo es inusual porque tales bacterias están típicamente presentes en el agua de mar y en los suelos de arroz, en lugar de los suelos chernozem bien ventilados con un contenido óptimo de humedad (entre 20,11 y 21,02 wt.%) (Tabla 1).
Los valores aumentaron significativamente del tercer al séptimo día de incubación. Para el día 10, no existen diferencias notables entre las muestras de control y las tratadas (Tabla 1); además, no se encontraron diferencias estadísticamente significativas entre las muestras de control y las tratadas (Phylazonit) (en el nivel de significancia 0.05).
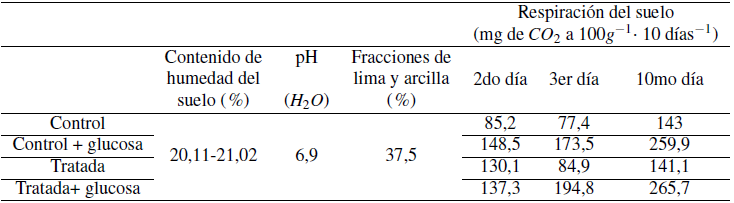
Tabla 1. Resultados medios de la respiración del suelo en la incubación durante 2, 3 y 10 días (mg de CO2 a 100g-1 · 10 días-1). Control =control absoluto que no representa ni el tratamiento biofertilizante ni el método inducido. Control + glucosa = no se añadió ningún biofertilizante pero se aplicó el método inducido. Tratado = se aplicó el biofertilizante. Tratado + glucosa = se añadió el biofertilizante y se aplicó el método inducido.
En la Figura 1 se compararon los resultados sobre la dinámica de emisiones de CO2 obtenidas en esta investigación con los hallazgos reportados anteriormente en la literatura científica. En los estudios anteriores (Bautista et al. 2017; Sándor et al., 2020), los autores recogieron muestras tanto de parcelas irrigadas como no irrigadas. Teniendo en cuenta que el contenido de humedad del suelo afecta fuertemente a la producción de CO2, se asume que los resultados provenientes de estudios previos tuvieron un contenido de humedad del suelo similar al de la presente investigación. El rango de aceptación fue: 19-21 wt.% (dentro del rango óptimo en este tipo de suelo). En un estudio previo (Bautista et al., 2017) examinó el efecto del mismo biofertilizante en la respiración del suelo en la misma estación experimental. Sin embargo, los autores aplicaron un método diferente de absorción alcalina; utilizando botellas de Oxitop, y sus resultados se expresaron en otra unidad, a saber: CO2 mL/L. Para comparar los resultados del estudio obtenidos con diferentes metodologías, se consideró lo siguiente:
(i) la cantidad de CO2 en las botellas de Oxitop se calcula a partir del oxígeno consumido por el proceso de descomposición, en donde el oxígeno, el carbono y el dióxido de carbono participan en el proceso de respiración (manual de Oxitop)
(ii) La formación de una molécula de CO2 requiere un átomo de C y una molécula de O2.
Para comparar los resultados del estudio previo con los de esta investigación, todos los resultados se expresan en mg de CO2 - (100 g)-1 - (10 días)-1 como se muestra en la Ecuación 2.
En los estudios realizados por Mátyás et al. (2015) y Sándor et al. (2020) los valores de CO2 se expresan en mg de CO2 - (100 g)-1 - (10 días)-1, por lo que no hubo necesidad de cambio de unidad. Normalmente la valoración se lleva a cabo sólo después del 10mo día de incubación (comparado a los estudios anteriores antes mencionados). Además, en el presente estudio se midió la producción de CO2 del suelo durante todo el proceso de incubación; esta es la razón por la que los resultados también se muestran para el segundo y tercer día de incubación
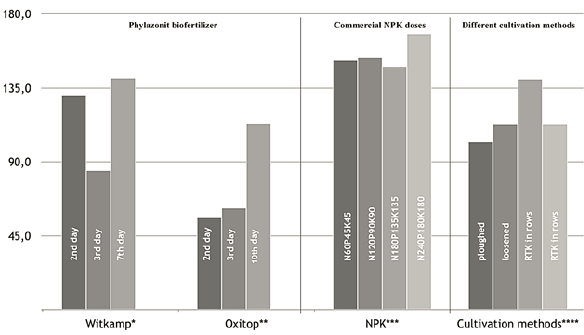
Figura 1. Resultados de la respiración del suelo después de 2, 3 y 10 días de incubación (mg CO2 - (100 g)-1 · (10 day)-1)), tomados de mediciones propias y hallazgos previos del estudio.*resultados propios relacionados con el efecto de Phylazonit en la respiración del suelo por el método Witkamp; **efecto de Phylazonit en la respiración del suelo por las botellas de Oxitop (Bautista y col., 2017); ***fertilizantes comerciales NPK en dosis de N60P45K45; N120P90K90; N180P135K135; y N240P180K180 (Mátyás y col., 2015); ****diferentes métodos de cultivo: arado, aflojado, RTK en filas, y RTK entre filas (Sándor y col., 2020b; Sándor y col., 2020a) en la respiración del suelo.
Se puede afirmar que la dosis más alta de NPK (N240P180K180) causa una mayor respiración del suelo comparada con la aplicación de biofertilizantes o los diferentes métodos de cultivo. Se observan diferencias entre los diferentes métodos de cultivo; los valores más altos de CO2 pertenecen a las muestras de RTK en filas. Los valores de respiración del suelo medidos por los dos métodos (Witkamp y Oxitop) tienen el mismo orden de magnitud, aunque los valores basados en Witkamp ncrementan en cada día de incubación. Aparte de los valores extremadamente altos de CO2 medidos por el método de Witkamp en el segundo día de incubación, el aumento de CO2 desde el día 3 hasta el día 7 es significativo en el marco de ambos métodos: Witkamp y Oxitop. Durante el período de incubación, el aumento de la respiración del suelo fue del 60,17% en el método de Witkamp, y 54,87%, cuando se utilizaron botellas de Oxitop. Este patrón es notable si se considera que los experimentos se realizaron por cuadruplicado, por lo tanto, son estadísticamente relevantes. Estos resultados validan un método moderno (Oxitop) con un método bien establecido y probado (Witkamp).
4 Conclusiones
Este estudio indica una menor tendencia a la respiración del suelo cuando se utilizan biofertilizantes en comparación con los fertilizantes NPK comerciales. Por lo tanto, por medio de biofertilizantes se pueden disminuir las emisiones de CO2 en el ambiente. Sin embargo, se necesitan llevar a cabo experimentos a largo plazo y ensayos de campo para una mejor comprensión y poder revelar diferencias estadísticas entre los biofertilizantes y el suelo tratado con fertilizantes químicos.
Con el cambio unitario en los resultados de CO2 obtenidos en este estudio por dos métodos diferentes basados en la absorción alcalina (Oxitop y Witkamp), se contribuye a mejorar la comparabilidad de los estudios académicos, que aplican diferentes metodologías para determinar la respiración del suelo, lo cual es útil para examinar los cambios en las propiedades microbiológicas del suelo en experimentos de fertilización a largo plazo, donde incluso se están comparando los resultados de 30 años atrás con nuevos hallazgos. El cambio unitario aplicado y discutido en esta investigación permite comparar los estudios basados en diferentes métodos, permitiendo el uso de nuevos métodos ofrecidos por la tecnología en evolución. Los datos adquiridos por los nuevos métodos pueden ser incorporados y corroborados con estudios realizados por métodos tradicionales en las últimas décadas.