Forma sugerida de citar:
Martínez, N. D. y De la Barrera, E. (2020). Ecofisiología de la germinación de tres malezas efímeras periurbanas en Morelia, Michoacán, México. La Granja: Revista de Ciencias de la Vida. Vol. 31(1):47-55. http://doi.org/10.17163/lgr.n31.2020.03.
1 Introducción
La composición de las especies de las comunidades vegetales anuales y efímeras puede cambiar sustancialmente de un año a otro (Cousens y Mortimer, 2009; Chaideftou et al., 2012). Las identidades de las especies observadas en una determinada temporada de crecimiento dependen de las especies que están presentes en el banco de semillas o que tienen estructuras de regeneración latentes en el suelo, pero su aparición se modula en gran medida por sus interacciones con el ambiente.
De hecho, la temperatura prevalente y el agua disponible pueden desencadenar la germinación en varios momentos durante la temporada de crecimiento de un año en particular o a lo largo de varios años (de la Barrera et al., 2009), mediado por características estructurales (como una testa gruesa; Debeaujon et al., 2000; Dübbern de Souza et al., 2001; Rowarth et al., 2007) o rasgos fisiológicos de las semillas (como la necesidad de vernalización en frío; Larcher, 2001; Fenner y Thompson, 2005) que determinan tanto el momento como la tasa de germinación.
En este sentido, las condiciones ambientales creadas en hábitats resultantes de la tala con fines agrícolas, viales, urbanísticos, etc., pueden restringir la persistencia de especies autóctonas en las comunidades vegetales, el establecimiento de especies, nativas o no, que puedan tolerar e incluso prosperar bajo condiciones adversas (Cousens y Mortimer, 2009; Dekker, 2016). De hecho, la modificación del ambiente por acciones humanas es una amenaza importante para la biodiversidad mundial (Sala et al., 2000; Rockström et al., 2009).
Este es un tema de especial preocupación en México, uno de los doce países de mayor diversidad, y el cual está experimentando una rápida pérdida de cobertura vegetal. De hecho, mientras que en 1976 el 62% de la superficie del país contaba con cobertura vegetal, en el 2002 apenas el 38% tenía vegetación (de la Barrera y Andrade, 2005; Challenger y Dirzo, 2009).
Tres especies que se encuentran comúnmente en áreas tan perturbadas en México son las nativas Onagraceae Lopezia racemosa y Ludwigia octovalvis, y las exóticas Polygonaceae Rumex crispus (Calderón y Rzedowski, 2004; Vibrans y Tenorio-Lezama, 2012). Lopezia racemosa se puede conseguir en varios tipos de vegetación, incluyendo bosques de coníferas, robles y bosques nublados, además de pastizales y matorrales de espinas.
Ludwigia octovalvis se limita principalmente a sitios con alta humedad del suelo como ecosistemas ribereños y a lo largo de los canales de riego. A su vez, R. crispus, que es nativa de Eurasia, se ha convertido en una maleza común en todo el mundo, especialmente en las zonas templadas del hemisferio norte. Estas tres especies fueron elementos abundantes y comunes de la flora efímera de nuestro campus universitario (ubicación retenida para revisión a ciegas), durante la temporada de crecimiento de verano de 2009 (observaciones inéditas).
Situado en un sitio periurbano, el campus se construyó en 2005 en una antigua plantación de eucaliptos y ha estado en construcción para albergar diversas entidades académicas, lo que hace de su flora efímera un tema interesante de investigación a medida que cambia a lo largo de los años.
Con el fin de determinar las condiciones ambientales que conducen a la germinación de semillas por L. racemosa, L. octavalvis, y R. crispus, se seleccionaron tres plantas efímeras de un sitio periurbano con diferentes nichos ecológicos, para llevar a cabo una serie de experimentos de ambiente controlado con el propósito de determinar las relaciones de temperatura y la influencia del potencial hídrico en el tiempo y la tasa de germinación.
2 Materiales y Métodos
Se recolectaron las semillas de Lopezia racemosa Cav. (Onagraceae; en adelante denominada Lopezia), Ludwigia octovalvis (Jacq.) Raven (Onagraceae; Ludwigia), y Rumex crispus L. (Polygonaceae; Rumex) durante la temporada de crecimiento de junio-octubre de 2009 de la Universidad Nacional Autónoma de México, Campus (19º 38', 55.9" N; 101º 13' 45" O; 1967 m), donde la falta de construcción y paisajismo permitió el establecimiento de la vegetación.
Se recolectaron las semillas de al menos 7 individuos por especie agitando el tallo principal de las plantas. Las semillas liberadas se colocaron en bolsas de tela y se mezclaron en una muestra compuesta, luego se guardaron en bolsas de papel negro y se almacenaron en el Laboratorio de Ecofisiología Agraria, Instituto de Investigaciones en Ecosistemas y Sustentabilidad, UNAM (en la oscuridad a 23 °C, 40% de humedad relativa) hasta que se utilizaron en un plazo de 6 meses. Las semillas se enjuagaron con agua corriente durante 48 horas inmediatamente antes del comienzo de cada experimento.
La germinación se estudió en unidades experimentales compuestas por 25 semillas colocadas en platos de petri de plástico (55 mm de diámetro, 15 mm de alto) cubiertos con dos capas de papel de filtro estéril como sustrato. Por lo general, se añadieron 5 ml de agua destilada estéril a cada plato de petri, con agua adicional que se añadió en el transcurso de los experimentos para mantener el papel del filtro.
Las cajas petri se colocaron en una cámara de germinación I-35LL equipada con tubos de luz fluorescentes (Percival Scientific, Boone, Iowa, EE.UU.) bajo un fotoperiodo de 12 h, generalmente a una temperatura diurna/noche de 20/10 °C. La germinación, que se registró como semillas con protrusión del radio, se evaluó diariamente hasta que no se produjo ninguna germinación adicional.
Las respuestas de germinación de la estratificación a baja temperatura se evaluaron colocando una muestra de semillas a 8 °C durante 3 meses y su germinación se comparó con la de un control de las semillas no tratadas.
El efecto de la temperatura del aire en la germinación se evaluó para las semillas incubadas bajo temperaturas de aire diurna/noche de 20/10, 25/15, 30/20 o 35/25 °C. A su vez, se evaluó el efecto del potencial hídrico en la germinación para las semillas incubadas bajo potencial de agua de 0,00, –0,01, –0,05 y –0,1 MPa que se crearon con soluciones acuosas de polietilenglicol (PEG; peso molecular de 20.000) de diversas concentraciones que se determinaron siguendo lo expresado por Michel y Radcliffe (1985).
Se utilizaron doce réplicas de 25 semillas cada una para cada medición. Los análisis estadísticos para la aparición de la germinación, es decir, el primer día significativamente superior al 0%, consistieron en una prueba de Mann-Whitney U (alfa 0,05) para la estratificación y una prueba Kruskal-Wallis (alfa 0,05) para la temperatura y el potencial de agua, los cuales se realizaron con Statistica 7.0 (StatSoft Inc., Tulsa, Oklahoma, USA). Además, el proceso de germinación se analizó con una prueba de Friedman, seguida de pruebas post hoc de Tukey (alfa 0,05) realizadas con SigmaStat 3.5 (Systat Software, Richmond, California, EE. UU.).
3 Resultados
3.1 Lopezia racemosa
La estratificación a baja temperatura no tuvo ningún efecto sobre la germinación de Lopezia (Tabla 1; Fig. 1A). Tanto para el control como para las semillas tratadas, el inicio de la germinación promedió de 6,2 a 0,7 días después del inicio del experimento. A su vez, la germinación máxima de esta especie promedió de 78,7 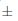 1,6% después de 21 días del inicio del experimento.
1,6% después de 21 días del inicio del experimento.
El régimen de temperatura, a su vez, tuvo un efecto significativo en la germinación de Lopezia (Tabla 1; Fig. 1D). Por ejemplo, el inicio de la germinación se produjo después de un día de haber iniciado el experimento para las semillas incubadas por debajo de 25/15 °C, después de dos días para la temperatura de 30/20 y 35/25 °C, y seis días para desencadenar la germinación de las semillas de L. racemosa incubadas por debajo de 20/10 °C. La germinación final promedió entre 87,7 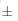 2,7 % para las semillas incubadas por debajo de 25/15 y 30/20 °C y fue de 79,0
2,7 % para las semillas incubadas por debajo de 25/15 y 30/20 °C y fue de 79,0 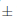 2,0 y 76,0
2,0 y 76,0 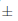 1,3 % menos para las que se encuentran en los extremos de 20/10 y 35/25 °C, respectivamente.
1,3 % menos para las que se encuentran en los extremos de 20/10 y 35/25 °C, respectivamente.
La germinación de Lopezia respondió al potencial hídrico (Tabla 1; Fig. 1G). El inicio de la germinación se produjo 2 días después de haber iniciado el experimento para semillas incubadas bajo 0,0 MPa, al día siguiente para las de 0,01 MPa, y en el día seis para los de –0,05 MPa, mientras que las semillas incubadas por debajo de –0,10 MPa no pudieron germinar. Una germinación final del 91,33 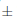 1,69% observada después del 21 d de iniciado el experimento fue mayor para las semillas incubadas por debajo de 0,00 MPa, disminuyendo con un potencial de agua cada vez más negativo hasta obtener un mínimo de 41,67
1,69% observada después del 21 d de iniciado el experimento fue mayor para las semillas incubadas por debajo de 0,00 MPa, disminuyendo con un potencial de agua cada vez más negativo hasta obtener un mínimo de 41,67 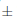 a 1,94 % para las semillas incubadas a –0,05 MPa.
a 1,94 % para las semillas incubadas a –0,05 MPa.
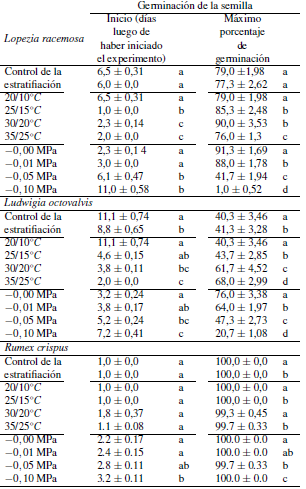
Tabla 1. Parámetros de germinación para las malezas efímeras Lopezia racemosa, Ludwigia octovalvis y Rumex crispus. El inicio de la germinación (primer día estadísticamente diferente a cero) se evaluó con pruebas de Mann-Whitnney U (alfa = 0,05), y los experimentos de la temperatura y potencial de agua con las pruebas de estratificación y Kruskal-Wallis (alfa = 0,05). A su vez, la germinación final se evaluó con pruebas de Tukey después de una prueba de medidas repetidas de Friedman. Los datos se muestran como medias ± S.E. (n =12 platos de petri con 25 semillas cada uno).
3.2 Ludwigia octovalvis
La estratificación a baja temperatura mejoró la germinación de Ludwigia (Tabla 1; Fig. 1B). De hecho, el inicio de la germinación se produjo entre 11,1 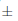 0,7 días después del inicio del experimento para el control, mientras que las semillas tratadas germinaron 2,3 días antes. Además, mientras que la germinación final después de 21 días de incubación fue similar para ambos grupos de semillas, ésta ocurrió a un ritmo más rápido para las semillas estratificadas.
0,7 días después del inicio del experimento para el control, mientras que las semillas tratadas germinaron 2,3 días antes. Además, mientras que la germinación final después de 21 días de incubación fue similar para ambos grupos de semillas, ésta ocurrió a un ritmo más rápido para las semillas estratificadas.
El régimen de temperatura tuvo un efecto significativo en la germinación de Ludwigia (Tabla 1; Fig. 1E). En particular, el inicio de la germinación aumentó con la temperatura del aire y osciló entre 2,0 ± 0,0 días después de iniciado el experimento para las semillas incubadas a 35/25 °C, y 9 días más tarde para las semillas bajo el régimen de temperatura más baja de 20/10 °C. La germinación final a los 21 días después de iniciado el experimento también fue mayor y se produjo a un ritmo más rápido con el aumento de la temperatura; por ejemplo, el 68,0 ± 3,0% de las semillas germinadas cuando se incuban por debajo de 35/25 °C, mientras que apenas un 40,3 ± 3,5% germinó por debajo de 20/10 °C.
El potencial hídrico afectó significativamente la germinación de Ludwigia (Tabla 1; Fig. 1H). La aparición de la germinación, que se produjo entre 3,5 ± 1,6 en las semillas expuestas a 0,0 o –0,01 MPa, se retrasó hasta 4 días con menor potencial de agua. A su vez, la germinación final a los 21 días posteriores de haber iniciado el experimento también fue más alta y más rápida con menores potenciales de agua, oscilando entre el 76,0 ± 3,4 % para las semillas incubadas por debajo de 0,0 MPa a 20,7 ± 1,1 % para las menores a -0,1 MPa.
3.3 Rumex crispus
La estratificación a baja temperatura retardó la germinación en Rumex (Tabla 1; Fig. 1C). El inicio de la germinación se produjo el primer día de haber iniciado el experimento, independientemente de si las semillas habían estado expuestas o no a una temperatura del aire de 8 °C durante tres meses. La germinación máxima después de 21 días de incubación tampoco se vio afectada, alcanzando el 100,0 ± 0,0 %. Sin embargo, la máxima se alcanzó más rápido en semillas no tratadas.
La temperatura de incubación no afectó a la aparición de la germinación de Rumex, que se produjo entre 1,2 ± 0,1 días después de iniciado el experimento, independientemente del tratamiento o la germinación final a los 21 días de la incubación, alcanzando el 99,7 ± 0,2 % (Tabla 1; Fig. 1F). Sin embargo, las temperaturas más altas del aire llevaron a una tasa de germinación más rápida, ya que las semillas incubadas a 25/15 y 35/25 °C alcanzaron la máxima de germinación antes que las expuestas a 20/10 °C de temperaturas de aire día/noche.
El inicio de la germinación de Rumex fue de 2,5 ± 0,1 días después de haber iniciado el experimento, y sólo se retrasó significativamente para las semillas incubadas bajo un potencial de agua de –0,1 MPa, demorando hasta un día más (Tabla 1; Fig. 1I). La germinación final de 99,9 ± 0,1 % después de 21 días de incubación tampoco se vio afectada por los potenciales de agua probados, pero la tasa fue más lenta en los potenciales de agua más negativos. Por ejemplo, se necesitaron entre 3 y 5 días para alcanzar la germinación final por semillas expuestas a 0,0 o –0,01 MPa y hasta 12 días para las incubadas por debajo de –0,10 MPa.
4 Discusión
La identidad de las especies que cohabitan en una comunidad sometida a perturbaciones depende de qué especies se encontraban originalmente presentes en el banco de semillas y cómo responden a las nuevas condiciones ambientales. De hecho, es probable que la germinación y las especies con rápida germinación y con preferencia a los sitios abiertos estén favorecidas por la perturbación (Grime, 2006; del-Val et al., 2015; Gorgone-Barbosa et al., 2016).
En el presente estudio, tanto la maleza exótica Rumex como la nativa Lopezia germinaron bajo todas las condiciones experimentales, aunque su germinación se retrasó o disminuyó bajo los tratamientos más extremos. Por el contrario, la germinación de Ludwigia, especialista en ambientes de alta humedad, sólo superó el 50% de las condiciones. Estos comportamientos de las especies pueden proporcionar cierta visión sobre las respuestas de la composición comunitaria después de la perturbación.
Las especies de regiones con marcada estacionalidad, es decir, con estaciones secas y húmedas o con períodos prolongados de sub-congelación, a menudo muestran una latencia embrionaria que puede retrasar el inicio de la germinación hasta la siguiente temporada, favoreciendo el establecimiento de plántulas (Donohue et al., 2010). Para estas plantas, la germinación normalmente se mejora al exponer las semillas a bajas temperaturas durante varias semanas, evitando la germinación durante el invierno cuando las bajas temperaturas pueden ser letales para las plántulas, incluso si se produce alguna precipitación.
Este parece ser el caso de Ludwigia cuyas semillas estratificadas germinaron 2 días más rápido que las semillas no tratadas, de acuerdo con estudios previos con L. alternifolia y L. decurrens (Baskin y Baskin, 1998). Sin embargo, este no fue el caso de Lopezia ni de Rumex, lo que sugiere que carecen de latencia primaria o que se había superado durante el almacenamiento (Totterdell y Roberts, 1979; Chi, 2006; Finch-Savage y Leubner-Metzger, 2006).
Las temperaturas más altas se aceleraron y aumentaron la germinación final de las especies consideradas en el presente trabajo. Sin embargo, la temperatura más alta causó la germinación más baja en Lopezia. Se observó una respuesta similar en las semillas de Ludwigia que eran las más sensibles, donde la germinación mejoró con la temperatura hasta que alcanzó un óptimo seguido de una inhibición de la germinación. A su vez, la exótica Rumex alcanzó la máxima germinación independientemente de la temperatura de incubación, confirmando que muchas malezas son capaces de tolerar e incluso prosperar bajo altas temperaturas, un rasgo ventajoso para la supervivencia condiciones ambientales extremas del suelo desnudo (Dahlquist et al., 2007; Baskin y Baskin, 2014).
La germinación tendió a disminuir a medida que los potenciales de agua de incubación se volvían más negativos, especialmente por debajo de -0,05 MPa, lo que es similar a las respuestas de otras especies como Campsis radicans (Chachalis y Reddy, 2000). Por el contrario, la germinación de Rumex fue máxima, independientemente del potencial hídrico, en comparación con el comportamiento de germinación de R. acetosella, que alcanzó el 90% de germinación por debajo de –0,1 MPa (Fani et al., 2013). Teniendo en cuenta que se requieren grandes cantidades de agua para mantener el alargamiento celular de las plantas después de la germinación, especialmente para las especies que escapan o evitan la sequía completando su ciclo de vida durante la temporada de lluvias, podría resultar ventajoso restringir la germinación a tiempos en que un potencial de agua adecuadamente alto indique que la temporada de lluvias está en marcha o que al menos se almacena suficiente agua en el suelo, lo cual permitirá el desarrollo de la plántula (de la Barrera et al., 2009). Sin embargo, las potencialidades de agua de este estudio corresponden a una cantidad aproximada de 7 días después de suspender el riego en un suelo arenoso-limoso, muy por encima del punto de marchitamiento permanente de –1,5 MPa, que indica la sensibilidad de la germinación (Young y Nobel, 1986; Nobel, 2009)
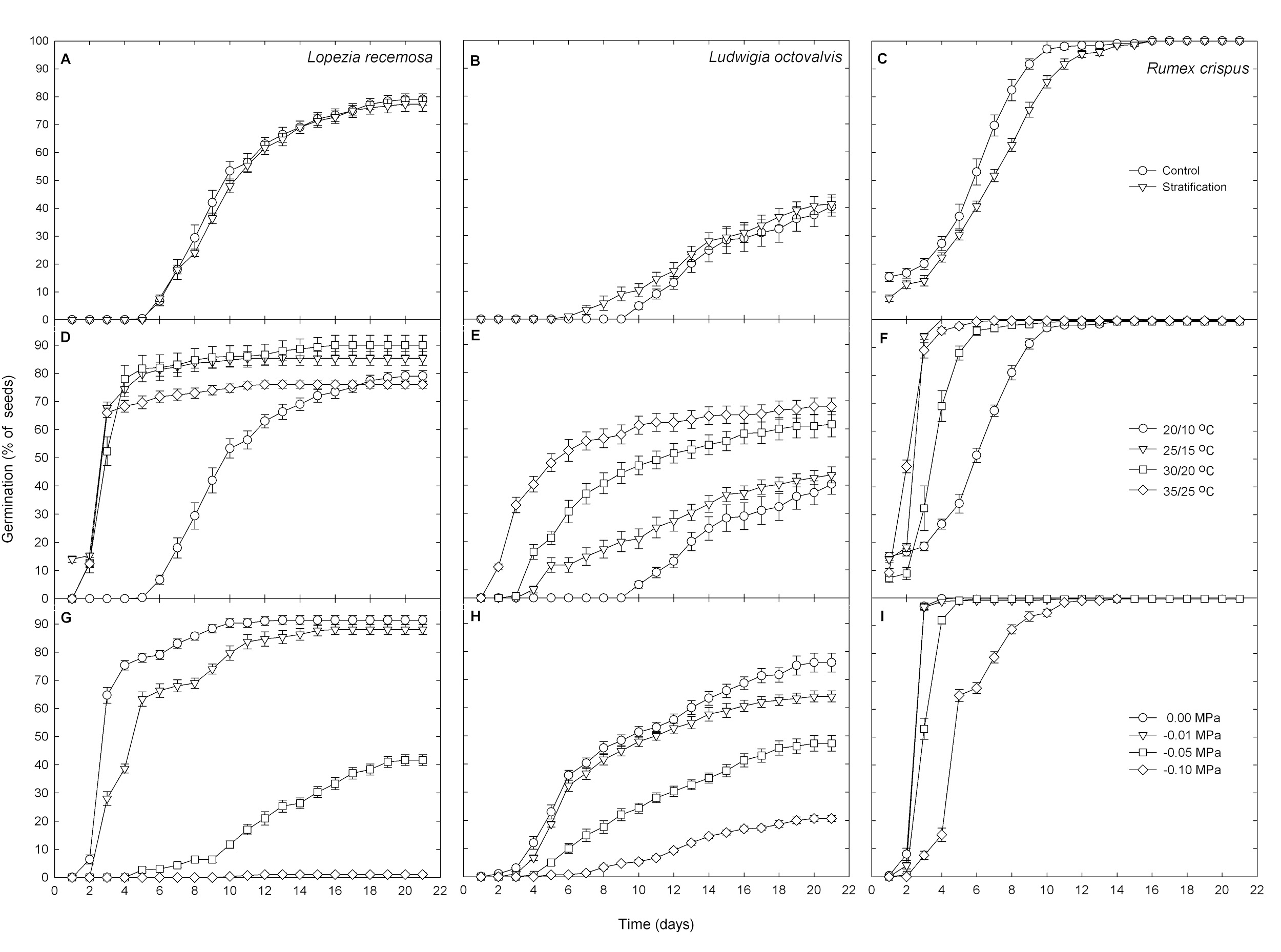
Figura 1. Germinación para las malezas efímeras Lopezia racemosa (A, D, G), Ludwigia octovalvis (B, E, H) y Rumex crispus (C, F, I), en respuesta a la estratificación a baja temperatura (A-C), la temperatura del aire día/noche (D-F) y el potencial del agua (G-I). Los datos se muestran como medias ± SE (n =12 platos de petri con 25 semillas cada uno).
5 Conclusiones
Las características ambientales para la germinación de especies efímeras son a menudo predecibles con aquellos del clima típico de su temporada de crecimiento (de la Barrera y Nobel, 2003; Donohue et al., 2010; Baskin y Baskin, 2014). Sin embargo, las diferencias interespecíficas, por pequeñas que sean, pueden determinar las identidades de las plantas que crecen en una comunidad durante un año determinado, contribuyendo a la alta variación interanual de las especies observadas en las floras efímeras y anuales (Cousens y Mortimer, 2009; Chaideftou et al., 2012; Dekker, 2016; Gorgone-Barbosa et al., 2016). Las respuestas diferenciales encontradas en el presente estudio ilustran estas diferencias interespecíficas y proporcionan información sobre los mecanismos que permiten a las especies exóticas convertirse en dominantes o para que las especies nativas sean desplazadas. La aparición de nuevos ambientes resultantes de las intervenciones humanas supone un riesgo para la prevalencia de floras autóctonas. Se requieren más estudios que consideren subconjuntos comunitarios más grandes o incluso comunidades enteras, incluyendo observaciones a largo plazo, destinadas a caracterizar la velocidad a la que las floras nativas pueden estar cambiando en respuesta a los cambios ambientales antrópicos.















