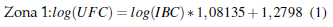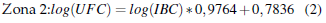Forma sugerida de citar:
Contero, R., Aquino, E.L., Simbaña, P.E., Gallardo, C. y Bueno, R. (2019). Estudio en el Ecuador de la curva de calibración para el conteo total de bacterias por citometría de flujo de leche cruda bovina. La Granja: Revista de Ciencias de la Vida. Vol. 29(1):97-104. http://doi.org/10.17163/lgr.n29.2019.08.
1 Introducción
La producción de leche bovina tiene una función importante en el ámbito económico y social del Ecuador. El incremento en la producción en los últimos 15 años se ha visto favorecida, entre otros factores, por el establecimiento de industrias con nuevas tecnologías, formación de asociaciones de productores y diferentes posibilidades de financiamiento (Cuenca, 2015; CEPAL, 2017). Actualmente, la producción total del país se estima en 5,5 millones de litros de leche por día, con el 73% proveniente de la región central del país (INEC, 2014) y su principal destino es el abastecimiento del mercado interno. La leche, por su composición nutricional, destaca como un alimento completo que contiene proteínas, vitaminas, lípidos y minerales con beneficios biológicos importantes en la etapa de crecimiento y en el mantenimiento óseo del cuerpo (Micinski, 2013; Pereira, 2014). La globalización se presenta como el principal responsable para el aumento del consumo de leche y derivados, influenciado por cambios en los patrones alimenticios, el crecimiento poblacional y la prioridad de la sociedad actual, de disponer de alimentos nutritivos y sanos (Primary Industries, 2015; CEPAL, 2017). En países de América Latina se tiene una previsión de aumento del consumo del 1, 6 % para leche fluida y 2, 8 % para otros derivados lácteos (Hoddinott, Headey y Dereje, 2015; CEPAL, 2017).
Ecuador ofrece un gran potencial para expandir la oferta de alimentos pecuarios como leche y derivados debido a sus recursos naturales (Requelme y Bonifaz, 2012; Cuenca, 2015) y el control de la calidad esencial para garantizar la inocuidad de los alimentos comercializados. Siguiendo la recomendación de organismos internacionales, las entidades vinculadas al control de la salud pública en el Ecuador, han establecido normativas de vigilancia en todas las etapas de producción de la leche, desde la producción, ordeño, procesamiento hasta que llegue al consumidor (FAO e IDF., 2011; INEN, 2012; MAGAP, 2008; MAGAP, 2013).
El conteo total de bacterias (CTB) es el método más utilizado para caracterizar la calidad microbiológica o población de bacterias en los alimentos. El método no diferencia los tipos de bacterias, pero es útil para obtener una información general de la higiene de los productos y las condiciones del proceso (Silva, 2010; Sampaio, 2015).
Para su produccion, la industria requiere leche con conteos bacteriales bajos alrededor de 100000 a 300 000 UFC/ml (Belli, 2013; Botaro, Gameiro y Santos, 2013; MAGAP, 2013), dado que algunas esporas, enzimas y metabolitos bacteriales pueden sobrevivir a procesos térmicos y afectar las características sensoriales de los productos alimenticios como el sabor, textura o reducción de su vida útil (Barbano, Ma y Santos, 2006; Silva, 2010; Gopal, 2015). Además, los altos conteos de bacterias en leche cruda pueden ser alertas de deficiencias en la higiene y desinfección en las áreas de producción y procedimientos de ordeño, en materiales o equipos; así como errores en el control de la temperatura de almacenamiento y la calidad microbiológica del agua utilizada, entre otras (Matsubara, 2011; Ruiz-Cortés y col., 2012; Almeida, 2016; Reyes, 2017).
El conteo en placas microbiológicas es el método de referencia para el análisis del CTB. Su resultado se expresa como unidad formadora de colonias (UFC/mL) y determina la cantidad de bacterias mesófilas presentes en la leche cruda. A pesar de la importancia del análisis para la industria láctea resulta poco práctico, teniendo en cuenta que los resultados se obtienen a las 48 horas de incubada la muestra (Silva, 2010; Cassoli, 2016).
La búsqueda de métodos analíticos alternativos que simplifiquen los procedimientos de laboratorio y aceleren la entrega de resultados ha exigido el desarrollo de tecnologías confiables como la citometría de flujo, la cual permite el conteo de poblaciones bacterianas a través del Conteo Individual de Bacterias (IBC/mL) basadas en la dispersión de luz y fluorescencia de un marcador de ADN bacterial. La citometría de flujo tiene, además, la ventaja de que no requiere la preparación de medios de cultivo, reduciendo la manipulación de muestras de leche y el tiempo de entrega de resultados (Evangelista, 2008; Araujo, 2009; Silva, 2010; Jatobá, 2014; Numthuam, 2017). Este método electrónico es utilizado en el equipo Bactoscan (Foss Analytical Instruments).
El uso de métodos analíticos alternativos requiere el estudio comparativo con métodos referenciales, al igual que la definición de una ecuación de regresión lineal. En países de la Unión Europea, para la aplicación de este método se ha adoptado una sola ecuación de conversión por convención, pero en otros países, como los de América del Sur, se utiliza una ecuación por cada nación (Botaro, Gameiro y Santos, 2013; Cassoli, 2016).
También las regulaciones para los límites máximos permisibles de CBT en leche cruda son diferentes en cada país. Así, en la Unión Europea los valores oscilan entre 100 000 a 500 000 UFC /ml, imponiéndose penalizaciones económicas para leches con conteos superiores (Botaro, Gameiro y Santos, 2013). En el Ecuador, desde el año 2008, el gobierno determinó los requisitos técnicos para el pago por calidad de leche cruda, donde estableció la necesidad de realizar análisis de laboratorio de la materia prima del conteo total de bacterias, antes que pueda ser comercializada y procesada en la industria (INEN, 2012; MAGAP, 2013).
El objetivo del presente este estudio fue determinar la ecuación de regresión lineal y correlación entre el método de referencia por conteo en placas expresado en UFC/mL y la técnica de citometría de flujo expresada en IBC/mL, para la determinación del conteo total de bacterias (CBT) en leche cruda, que permita establecer la curva de calibración entre ambos métodos para la evaluación de la calidad microbiológica de leche cruda bovina en el Ecuador.
2 Materiales y métodos
2.1 Recolección de muestras
Se colectaron 357 muestras de leche para este estudio, entre los años 2013 y 2014, en los meses de enero, febrero, marzo, mayo, septiembre, octubre, noviembre y diciembre. Las muestras fueron colectadas de tanques de refrigeración de productores organizados (49%) y de tanques de refrigeración de productores individuales (51%).
Todos los productores de leche estaban localizados en la región central del país, en el sector de la provincia del Pichincha (0°5´14" N y 78°6´12"O); dentro de esta región fueron considerados dos pisos alti- tudinales, uno en Cayambe (Z1), ubicado a > 3000 msnm, y otro en San Miguel de los Bancos (Z2), a 1050 msnm. Z1 presentó una temperatura anual promedio entre 8 _ 15°C y una humedad relativa del 65%; y Z2 presentó una temperatura promedio de 18 _ 24°C y una humedad relativa del 85% (Laboratorio de Sistemas de Información Geográfica - SIG Universidad Salesiana Ecuador, 2018).
Durante la colecta de muestras de leche se siguieron los procedimientos de referencia, utilizando frascos estériles de 50ml y conservante Azidiol. Las muestras fueron transportadas en refrigeración a 4 _ 7°C al Laboratorio de Calidad de Leche de la Universidad Politécnica Salesiana.
2.2 Análisis de laboratorio
El conteo en placa fue realizado de acuerdo conel procedimiento de referencia del Instituto Nacional Ecuatoriano de Normalización y la Organización Internacional de Estandarización (INEN y ISO, 2014), utilizando 1ml de muestra de leche (previa homogenización) diluido en 9ml de agua estéril peptonada al 0;1% con diluciones seriadas (10 _ 1 a 10 _ 5). Finalmente, 1000μl fueron sembrados en placas Petrifilm para conteos de aerobios (3M, Saint Paul, MN, USA) por duplicado e incubados a 32°C ( 1°C) x 48 h (
1°C) x 48 h ( 3 h) según referencia de AOAC 986.33 para productos lácteos. Para el resultado total fueron seleccionadas placas que tenían entre 25 a 250 colonias de bacterias. Los resultados están expresados como UFC/mL (Cassoli, 2007; Silva, 2010). Todas las muestras fueron analizadas dentro del período de las 48 h de realizada la colecta (INEN, 2006; Cassoli, 2016) y por ambos métodos, analizados al mismo tiempo (máximo de desviación de
3 h) según referencia de AOAC 986.33 para productos lácteos. Para el resultado total fueron seleccionadas placas que tenían entre 25 a 250 colonias de bacterias. Los resultados están expresados como UFC/mL (Cassoli, 2007; Silva, 2010). Todas las muestras fueron analizadas dentro del período de las 48 h de realizada la colecta (INEN, 2006; Cassoli, 2016) y por ambos métodos, analizados al mismo tiempo (máximo de desviación de  1 h) según la norma IDF/ISO-196.
1 h) según la norma IDF/ISO-196.
El método alternativo por análisis del IBC fue realizado utilizando la citometría de flujo, con equipo Bactoscan FC (Foss Analitical Instruments) con capacidad de análisis de 50 muestras/hora. Su principio analítico se basa en la adición de bromuro de etidio (una sustancia colorante) que se intercala en el ADN y ARN bacterial. La muestra inyectada pasa a través de una cámara de flujo donde el sistema óptico detecta partículas teñidas por emisión de fluorescencia. Además de la sustancia colorante, se requiere una solución tampón (buffer) con enzimas proteolíticas. La intensidad y la altura de la emisión de fluorescencia son los parámetros selectivos para la identificación de las bacterias de interés. Los resultados fueron expresados en IBC/ml (Jatobá, 2014; Numthuam, 2017).
2.3 Análisis estadístico
En el análisis estadístico fue utilizado el programa SAS versión 9.3 (Statistical Analysis System). Para la verificación de la distribución normal de los datos todos los resultados, tanto de UFC/mL como IBC/mL, fueron transformados en logaritmos de base 10. La regresión lineal fue evaluada para verificar la correlación entre el método referencial y el método alternativo. El método de referencia fue considerado como variable dependiente y el método alternativo por citometría de flujo como variable independiente. El modelo lineal propuesto fue 100Y = ax + b. Donde Y es la variable dependiente en log (UFC), x es la variable independiente en log (IBC), a es la pendiente de la curva, b el intercepto o coeficiente lineal. Adicionalmente, debido a las diferencias en las condiciones ambientales de temperatura y humedad relativa, los resultados de las zonas Z1 y Z2 fueron analizados por separado.
3 Resultados y Discusión
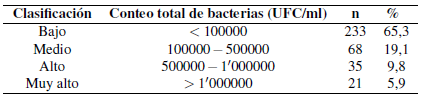
Para este estudio, la distribución de muestras de mesófilos aerobios se presenta en la Tabla 1. De un total de 357 muestras de leche analizadas, 34, 7% indicaron presencia de bacterias entre los rangos de clasificación de medio a muy alto. El 65,3 % correspondió a rangos menores a los 100000 UFC/ml.
Las muestras provinieron de ganado con un mayor porcentaje de vacas Holstein, Brown Swiss y Jersey presentes en las zonas evaluadas (Requelme y Bonifaz, 2012) y para cada una de ellas fue analizada la correlación y ecuación de regresión lineal.
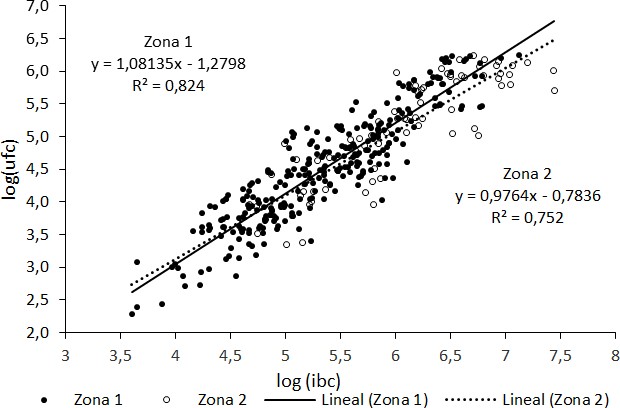
En la Figura 1 se muestra el análisis de regresión para el método alternativo expresado en log(UFC) frente al método alternativo log(IBC) para cada zona investigada; 80% (n = 286) de las muestras analizadas correspondieron a Z1 y 20 % (n = 71) a Z2.
En el análisis de residuos no se encontraronmuestras consideradas atípicas en la población deestudio, ni patrones que indicasen heterogeneidad de diferencia. Con referencia al coeficiente de variación que sugiere la calidad de los datos, los resultados obtenidos en este estudio fueron inferiores al 10%, sugiriendo que los métodos son reproducibles y confiables para el análisis microbiológico realizado (Sampaio, 2015). La probabilidad de que los conteos en cada una de las técnicas tengan un nivel de significación del 95% se determinó con el valor de p; se concluyó que no había diferencias estadísticamente significativas (p > 0;05) entre las técnicas en estudio.
El efecto de las zonas Z1 y Z2 no fue considerado en el método de análisis debido a que las diferencias observadas no fueron significativas estadísticamente (Figura 2). Así, fue definida una única ecuación: log(UFC) = log(IBC) 1, 03466 1, 05124.
Los estudios realizados por Cassoli, (2007) indicaronla importancia de considerar la citometría deflujo como método alternativo para el conteo debacterias en leche y la determinación de la calidad higiénica en la leche cruda antes de su comercialización. Un conteo elevado de microorganismos mesófilos aeróbicos puede estar relacionado con diferentes fuentes de contaminación al momento del ordeño y transporte de la leche, así como con variaciones en la temperatura de almacenamiento (Matsubara, 2011; Martins, 2017). La normativa ecuatoriana para mesófilos aerobios define un límite máximo de 1,5 millones de UFC/mL; sin embargo, las regulaciones industriales penalizan al productor en el pago por litro de leche para conteos superiores a 300000 UFC/mL. Los conteos superiores a 700000 UFC/mL fueron observados en el 6,1% al 10 % de muestras de leche provenientes de tanques de refrigeración de asociaciones de productores (Almeida, 2014; Neppas, 2014), demostrando la necesidad de mayor control en la higiene durante el ordeño. De ahí la importancia de definir una ecuación de correlación con rangos entre 100000 y 1, 5 millones de UFC/mL.
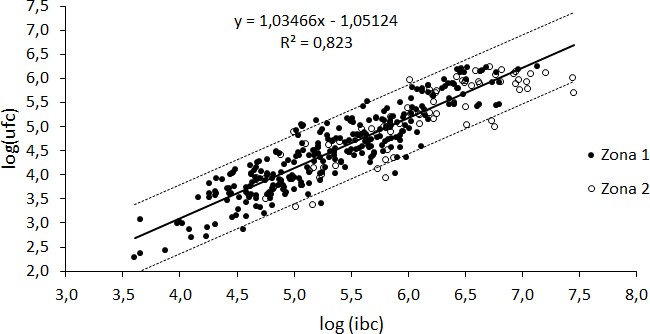
Figura 2. Distribución, línea de regresión e intervalo de predicción (95 %) log(IBC/mL) y log(UFC/mL).
Aunque en países como Noruega, Canadá y Reino Unido se ha adoptado la expresión de resultados como IBC/mL directamente (sin conversión) a UFC/mL, el método de referencia en las normativas internacionales y nacionales exige su expresión como UFC/mL (ISO, 2006; Cassoli, 2007). La transformación de los resultados analíticos obtenidos por equipos de conteo electrónico basados en la citometría de flujo también se utiliza en otros países, junto con el uso de la curva de calibración y regresión lineal, como Brasil, Uruguay y Colombia (INEN, 2012; Ruiz-Cortés y col., 2012; Cassoli, 2016). En este estudio, el análisis estadístico mostró una correlación significativa entre la técnica estándar y la técnica de citometría de flujo (r = 0, 91), resultado similar al de trabajos previos que reportan un valorentre 0,80 a 0,93 (Cassoli, 2007; Jatobá, 2014). Sampaio,(2015) indicaron que la correlación entre ambos métodos puede ser afectada por el tamaño, laforma de las células bacterianas o su forma de agrupación.
La implementación de sistemas de gestión y control de calidad entre laboratorios permite actualmente comparar ecuaciones y verificar discrepancias. Además, otra ventaja importante de la citometría de flujo es el precio de este análisis: en el Ecuador representa una diferencia de 3 a 4 veces menor en comparación al precio del método referencial, posicionándolo como una herramienta útil en los programas de monitoreo y control de calidad de alta demanda.
4 Conclusiones
Ya que la demanda por análisis de muestras de leche en Ecuador es cada vez frecuente y no se observaron diferencias significativas para las zonas (> 2900 msnm y 1050 msnm) como las evaluadas en este estudio, es posible utilizar una única ecuación de regresión lineal para la determinación del CBT por el método alternativo de citometría de flujo utilizando el equipo Bactoscan FC.