1. Introducción
Las hidromedusas forman parte del plancton gelatinoso, son regularmente pequeñas (0,5-6,0 cm de diámetro) y son altamente eficientes como depredadores, siendo parte de los niveles superiores de la cadena trófica. Son considerados organismos de remarcada importancia pues impactan en la dinámica y estructura del zooplancton (Kitamura, Tanaka, & Ishimaru, 2003).
La capacidad de depredación de las medusas está vinculada con el tamaño, razón que le permite su amplio espectro trófico en el ecosistema marino, abarcando organismos de importancia comercial como crustáceos, peces y moluscos (Segura, Celis, & Chiaverano, 2009). También pueden formar densas agregaciones que cubren áreas extensas en los océanos, originando pérdidas económicas en diferentes regiones (Alvarez, Mianzan, & Madirolas, 2003). Es de mencionar que las medusas afectan en el ámbito turístico por su capacidad urticante, en la parte pesquera por sus hábitos depredadores y en el sector industrial durante sus explosiones demográficas (Purcell, Uye, & Lo, 2007; Purcell, 1985; Schiariti, 2008). Por otro lado, su importancia y función en el ambiente marino radica en que varias especies de medusas han sido determinadas como indicadores biológicos de masas de agua (Raskoff, 2001). Tienen una amplia distribución que se extiende desde las aguas polares hasta las tropicales y verticalmente pueden extenderse desde la superficie hasta las profundidades, habitando en diferentes condiciones ambientales (Zamponi, Suarez, & Gasca, 1990).
Los sifonóforos son hidrozoarios mayoritariamente holoplanctónicos, poseen el mayor nivel de polimorfismo y la más compleja organización colonial del reino animal (Dunn, 2005). Biológicamente se definen como colonias formadas por zooides asexuados genéticamente idénticos, estructuralmente distintos y funcionalmente especializados (Gasca, 2002). Son importantes dentro del ecosistema marino debido a su capacidad y eficiencia como depredadores, influyendo en la dinámica de las comunidades macrozooplanctónicas y eventualmente en las densidades poblacionales de sus presas (Purcell, 1982). Se distribuyen en todos los océanos, mares y bahías, a lo largo de la columna de agua, no obstante, cada especie puede estar a diferentes intervalos de profundidad y muchas de ellas son específicas de aguas cálidas superficiales (Pugh,1996). La mayoría habita el cinturón trópico-ecuatorial, ciertas especies presentan una amplia distribución, y otras son específicas de altas latitudes (Alvariño, 1981).
Los representantes de este grupo pueden relacionarse directamente con las características de masas de aguas (Graham, Pagès, & Hamner, 2001). De hecho son organismos considerados bioindicadores de condiciones hidrológicas asociadas a las principales regiones climáticas y masas de agua (Véliz, 1981).
A pesar de su importancia ecológica, las medusas y sifonóforos pertenecen a uno de los grupos del zooplancton gelatinoso menos conocidos que habitan en la región costera del Ecuador, la información sobre la dinámica de las poblaciones, su composición, densidad y distribución en aguas ecuatorianas, así como las variaciones que sufren a causa de cambios en las condiciones ambientales es escasa.
Se han publicado trabajos sobre medusas en el Pacífico Tropical Oriental, entre ellos destacan los de (Agassiz, 1902; Alvariño, 1972, 1975, 1977; Bigelow, 1909; Kramp, 1968; Mayer, 1910; Segura, 1984) los cuales aportan listado de especies, descripción y distribución de estos grupos. Alvariño (1971) estudia los sifonóforos y su distribución en el Pacífico y realiza comparaciones con la distribución mundial. Mientras que en Ecuador se realizaron investigaciones en el Pacífico ecuatorial sobre medusas y sifonóforos desde el margen costero hasta las Islas Galápagos, registrando estos los de (Andrade, 2010, 2012, 2014a, 2014b; Muñoz 2015; Andrade, 2016) no existiendo información de estos organismos gelatinosos para la zona de estudio.
Con el objetivo de conocer la composición abundancia y diversidad de las medusas y sifonóforos, así como de estimar las posibles variaciones poblacionales durante la época húmeda y la influencia de las variables ambientales en su distribución, se determinó un programa de monitoreos en el sector marino costero de Ancón, Anconcito y Punta Carnero, Provincia de Santa Elena, para aportar al conocimiento de las estructuras comunitarias de los Cnidarios (medusas y sifonóforos) que habitan un sector marino costero del Ecuador.
2. Materiales y Métodos
Las colectas de zooplancton se obtuvieron mediante muestreos mensuales desde diciembre del 2015 a mayo del 2016, correspondiente a la época húmeda de la región, en seis estaciones distribuidas en la zona marino costera de Ancón, Anconcito y Punta Carnero (Figura 1), georeferenciadas mediante el uso de un GPS marca Garmin, modelo Montana 650 (Tabla 1).
El área de estudio abarca zonas en las cuales se realizan actividades pesqueras y turísticas creando estas influencias de carácter antropogénico, presentando un clima tropical debido a la interacción de aguas marinas tropicales y subtropicales, donde las aguas frías ricas en nutrientes son trasportadas desde el sur por la corriente de Humboldt del sistema de Afloramientos del Perú y de la corriente cálida de aguas tropicales superficiales trasportadas desde la bahía de Panamá (Andrade, 2012).
Se llevaron a cabo 36 arrastres superficiales con una red cónica simple WP-2, con abertura de malla de 335 µm, con boca de red de 0.30 m de diámetro y 1 metro de longitud, con un tiempo de duración de cinco minutos a dos nudos de velocidad en horas de la mañana; y 15 arrastres verticales en las estaciones más alejadas de la costa siendo estas E2, E3 y E4, desde los 10 m de profundidad hacia la superficie durante dos minutos. El volumen de agua filtrada se determinó a través de un flujómetro Hydro-Bios modelo 438-115, equipado al centro del aro de la red.

Fig. 1 Área de estudio y ubicación de estaciones de muestreo en la Zona Marino Costera de Ancón, Anconcito y Punta Carnero.
En cada estación de muestreo se hicieron mediciones de temperatura (TSM) con un termómetro de mercurio de apreciación 1°C, salinidad (UPS) con un refractómetro BIO-MARINE modelo ABMTC con de 1UPS, se determinó la visibilidad del agua mediante la utilización del disco Secchi para registrar la visibilidad del agua. Las muestras fueron fijadas con formalina al 4%, neutralizadas con tetraborato de sodio hasta obtener un pH de 7.5 a 8 (Muñoz, 2015). En el laboratorio las muestras fueron vertidas en la cámara de Bogorov donde se realizó el análisis cualitativo y cuantitativo del zooplancton (Boltovskoy, 1981), las medusas y sifonóforos se separaron de cada muestra original, estos últimos se tiñeron con rosa de bengala para facilitar su observación y se identificaron hasta el menor nivel taxonómico posible, utilizando un estereomicroscopio Leica S4E y microscopio Boeco-Germany modelo 21922, siguiendo las descripciones y claves de Kramp (1968), Segura, (1984) y Bouillon et al. (2004) para hidromedusas; Totton & Bargmann (1965), Pagès & Gili (1992) y Marques de Araujo (2012) para sifonóforos. Para estimar la abundancia de las medusas se contabilizaron las muestras totalmente, en el caso de los sifonóforos calicóforos, se contó el número de nectóforos anteriores y posteriores, registrándose el mayor de ambos, mientras que en los fisonectes, cada uno de los nectóforos se consideró un individuo (Pugh, 1984). El número de organismos contabilizados se estandarizó a ind. 100 m-3 estimados a partir del volumen filtrado.
Para el análisis de la comunidad de medusas y sifonóforos, se evaluó la diversidad específica durante la época húmeda mediante el Índice de Shannon- Weaver H’ (Shannon & Weaver, 1963), la dominancia en la comunidad se determinó mediante el Índice de Simpson (Simpson, 1949) y la equidad o grado de uniformidad en la repartición de los individuos entre las especies fue valorada con el índice de equidad (Pielou, 1975). Para establecer las relaciones de afinidad entre las abundancias de las especies y entre las estaciones de muestreo en medusas y sifonóforos a nivel superficial y vertical se empleó el análisis de clasificación Clúster con el algoritmo de Bray Curtis y la afinidad de la media no ponderada (Legendre & Legendre, 1998).
Además, se determinó la relación entre los parámetros abióticos y la abundancia de las especies de medusas y sifonóforos más frecuentes a nivel superficial, mediante el Análisis de Correspondencia Canónica (ter Braak & Verdonschot, 1995). Estableciéndose un intervalo de confianza del 95% y nivel de significancia del 5% para las pruebas estadísticas. La representación gráfica del clúster y de las correspondencias canónicas incluye el nombre de las especies utilizando el código que integra las tres primeras letras del género y de la especie.
3.Resultados
Las temperaturas máximas se registraron en los meses de diciembre y enero (27.3-27.5°C), y los mínimos en abril y mayo (26.1-25.2°C); evidenciando registros de salinidad más elevados en los meses de abril y mayo (35.7-35.8 ups), mientras que los más bajos en diciembre (32.3 ups) (Figura 2), observándose la mayor transparencia en la columna de agua en mayo con 11 m y mínima en marzo con 7 m.
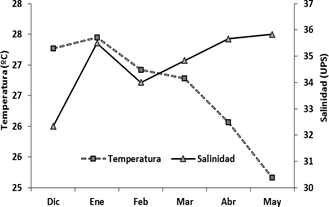
Fig. 2 Variación mensual de la temperatura y salinidad superficial del mar, en la zona de estudio durante diciembre de 2015 a mayo 2016.
3.1. Composición de Medusas
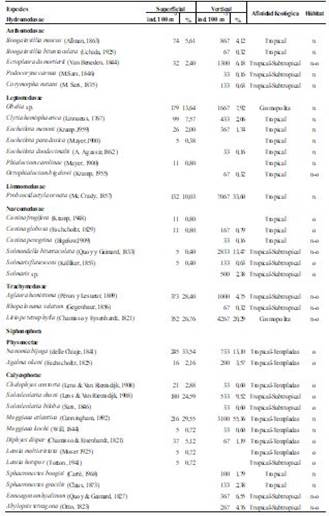
Durante el período de muestreo se recolectaron y analizaron 51 muestras zooplanctónicas, de las cuales 36 corresponden a arrastres superficiales y 15 tomadas a nivel vertical, identificándose un total de 22 especies clasificadas en 5 órdenes, 14 familias y 16 géneros, debido a que en el área de estudio no existe información sobre el grupo, las especies identificadas constituyen los primeros registros.
Tabla 2. Densidad de las especies de medusas y sifonóforos a nivel superficial y vertical.
Simbología: %= abundancia relativa, Hábitat: n=nerítica, o=oceánica, n-o= nerítica y oceánica.
A nivel superficial durante la época húmeda se recolectaron 1315 ind. (100m3)-1 de los cuales se identificaron 14 especies de medusas, distribuidas en 5 órdenes, el de mayor densidad poblacional fue Trachymedusae 55%, seguido de Leptomedusae 24%, Limnomedusae 10%, Anthomedusae 8%, y finalmente Narcomedusae con 2% (Tabla 2). Determinándose la mayor abundancia en febrero con 595 ind. (100m3)-1, presentando mayor densidad de organismos en la estación E3.
Los valores de abundancia por especies fluctuaron entre 5 y 373 ind. (100m3)-1. El máximo poblacional se reportó para Aglaura hemistoma con 373 ind. 100 m-3, seguida de Liriope tetraphylla con 352 ind. (100m3)-1, Obelia sp. con 179 ind. (100m3)-1, Proboscidactyla ornata con 132 ind. (100m3)-1, decreciendo considerablemente la población para las demás especies (Tabla 2).
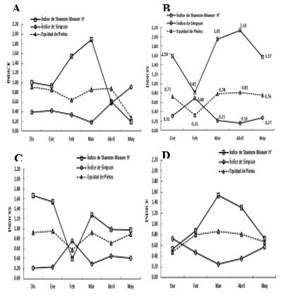
3.2. Variabilidad temporal de los Índices Ecológicos: Shannon-Weaver, Simpson y Pielou en la comunidad de Medusas y Sifonóforos
En el grupo de las medusas a nivel superficial durante la época húmeda el valor máximo de diversidad se evidenció para marzo con un H: 1.89 bits/ind, grado de uniformidad de 0.86 bits/ind y una dominancia mínima de 0.19 bits/ind, en contraste el valor mínimo de diversidad se observó en el mes de mayo con H: 0.19 bits/ind, un grado de uniformidad de 0.28 bits/ind el cual corresponde al valor mínimo durante los meses de estudio y dominancia de 0.91 bits/ind valor máximo registrado para este nivel determinado por la presencia de Liriope tetraphylla (Figuras 3b; 4A).
A nivel vertical, el índice de Shannon registró valores altos en relación al superficial, encontrándose la máxima diversidad para el mes de abril con H: 2.14 bits/ind, uniformidad de 0.81 y una dominancia de 0.16; mientras el valor mínimo de diversidad se reportó para febrero con 0,81 bits/ind, grado de uniformidad de 0.33 bits/ind y dominancia de 0.68 bits/ind, representada por Proboscidactyla ornata (Figuras 3d; 4B).
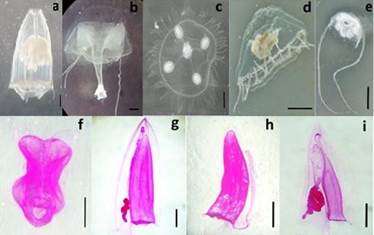
Fig. 3 Medusas y sifonóforos abundantes de los sectores de Ancón, Anconcito y Punta Carnero a) Aglaura hemistoma. b) Liriope tetraphylla. c) Obelia sp. d) Proboscidactyla ornata. e) Solmundella bitentaculata. f) Nanomia bijuga. g) Muggiaea atlantica. h) Sulcu
Los sifonóforos a nivel superficial la diversidad fue mayor que en la columna de agua, registrándose el valor máximo H: 1.67 bits/ind en diciembre, uniformidad de 0.93 bits/ind, con una dominancia de 0.21 bits/ind; el valor mínimo de diversidad se reporta en febrero con H: 0.40 bits/ind, uniformidad de 0.58 bits/ind y una dominancia de 0.76 bits/ind caracterizada por la presencia de Muggiaea atlantica (Figuras 3g; 4C).
Mientras a nivel vertical la mayor diversidad se reportó para el mes de marzo con 1.54 bits/ind, uniformidad de 0.86 bits/ind y un bajo índice de dominancia de 0.25 bits/ind, mientras que la mínima diversidad se evidenció para el mes de enero con H: 0.53 bits/ind; uniformidad de 0.48 bits/ind y una dominancia de 0.73 bits/ind representada por Muggiaea atlantica (Figuras 3g; 4D).
3.3. Dendrograma basado en similitud de Bray Curtis entre especies y estaciones de muestreo
Las medusas a nivel superficial mediante el análisis de conglomerados se identificaron tres Clusters a un nivel de truncamiento de 0.48 en las seis estaciones de muestreo, evidenciando en el primer grupo similitud entre las especies Cunina globosa y Cunina frugifera por su escasa abundancia, un segundo clúster formado por cuatro especies con similitud baja, mientras que el tercer conglomerado formado por siete especies; Clytia hemisphaerica, Obelia sp; Aglaura hemistoma, Provoscdactyla ornata, Liriope tetraphylla y Bougaivilla muscus presentaron similaridad por su máxima abundancia (Figura 5A), a nivel de estaciones E6 y E5 presentan mayor similitud con una moderada abundancia, dentro de esta misma rama se encuentra E2, separándose de estas regiones la estación E3 caracterizada por ser las más abundante por lo tanto presentando disimilitud con las demás estaciones (Figura 5B).
A nivel vertical (0-10m) el conglomerado se registró una perfecta similitud integradas por Eucheilota duodecimalis y Podocoryne carnea debido a su escasa abundancia, un segundo grupo formado por Aglaura hemistoma y Ectopleura dumortieri caracterizadas por una abundancia moderada, seguido de Liriope tetraphylla y Solmundella bitentaculata especies abundantes a este nivel (Figura 5C), en cuanto a estaciones las más afines fueron E3 y E4 con una abundancia moderada, alejándose de esta región la estación 2 debido a su máxima densidad poblacional (Figura 5D).

Fig. 5 Dendrogramas basados en la similitud de Bray-Curtis entre abundancia de especies de medusas y estaciones de muestreo A) Capa Superficial; B) Estaciones; C) Columna de agua; D) Sol.flav: Solmundela flavencis, Sol.bit: Solmundella bitentaculata, Phi. car; Phialicium carolinae, Ect.dum; Ectopleura dumortieri,Cun. glo y Cum flu; Euce men; Eucheilota menoni, Lir. Tet; Liriope tetraphylla, Agl hem; Aglaura hemistona, Pro.om: Provoscidactyla ormata, Cly em. Clytia henisphaerica, Ob. sp; Obelia sp y Bou. Mus; Vougaivilla muscus
En el análisis de conglomerado los sifonóforos a nivel superficial presentan a las especies Muggiaea atlantica y Sulculeolaria chuni como las más afines debido a su porcentaje homogéneo entre ambas, de este grupo sale una rama que integra a Nanomia bijuga, especie abundante junto a las anteriores en este estrato, mientras que el conglomerado formado por Muggiaea kochi y Agalma okeni se determina por su baja similitud (Figura 6A), en cuanto a estaciones existe la formación de dos grupos, el más afín integrado por las estaciones E2, E5 (abundancia moderada) y aumenta progresivamente las densidades poblacionales para las siguientes regiones E4 y E3, presentando disimilitud con éstas, las estaciones E1 y E6 por la baja abundancia de especies (Figura 6B).
A nivel vertical (0-10m) se formó un primer conglomerado con Muggiaea kochi y Sulculeolaria biloba debido a su afinidad perfecta por escasa presencia, un conglomerado que integra a Abylopsis tetragona y Enneagonum hyalinum debido a su similitud en abundancia moderada, un grupo formado por Nanomia bijuga y Sulculeolaria chuni, uniéndose a esta región Muggiaea atlantica, caracterizadas por ser las más abundantes, presentando la mayor disimilitud Chelophyes contorta por su baja densidad (Figura 6C), el conglomerado formado por las estaciones E4 y E3 están representadas por su mayor densidad poblacional, mientras que la E2 se aleja de la región debido a la disimilitud por una menor abundancia (Figura 6D).
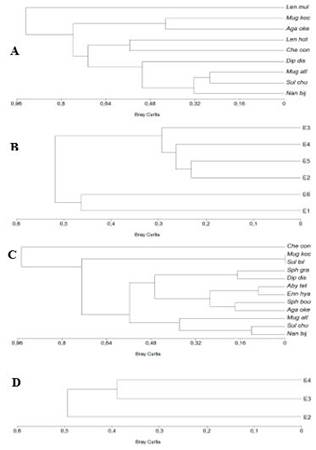
Fig. 6 Dendrogramas basados en la similitud de Bray-Curtis entre abundancia de especies de sifonóforos y estaciones de muestreo A) Capa Superficial; B) Estaciones; C) Columna de agua; D) Estaciones; Len mul; Lensia multicristata, Mug Koc; Muggiaea kochi, Aga oke; Agalma okeni, Len hot; Lensia hotpur, Che con; Chelophyes contorta, Dip dis; Diphyes dispar, Mug atl; Muggiaea atlantica, Sul chu; Sulculeolaria chuni, Nan bij; Nanomia bijuga, Sph gra; Sphaeronectes gracilis, Aby tet; Abylopsis tetragona, Enn hya; Enneagonum hyalinum, Sul bil; Sulculeolaria biloba.
3.4. Análisis de correspondencia canónica
3.4.1. Medusas
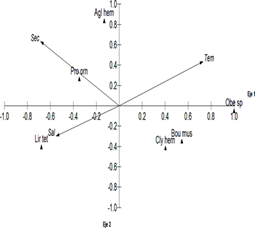
Dentro del grupo de medusas, el análisis ACC entre la abundancia de las especies más frecuentes de medusas y las variables ambientales en la época húmeda a nivel superficial, alcanzó valores propios de 0.343 y 0.213 y varianza de 17.94 y 11.15 para el eje uno y dos respectivamente, estableciéndose el 29.09% de varianza explicada. La correlación en el eje uno fue de 0.77 y para el eje dos de 0.67. Se destaca la relación existente entre la especie Obelia sp. de característica nerítica cosmopolita con la temperatura superficial del mar, al igual que con Bougainvillia muscus y Clytia hemisphaerica aunque más débil, mientras que Liriope tetraphylla presenta correlación con la salinidad, demostrando que está asociada para aguas de afloramientos que son salinas y una relación inversa con la temperatura, observándose que dicha especie se asoció con aguas menos cálidas, Proboscidactyla ornata muestra relación con la visibilidad del agua, seguida de Aglaura hemistoma e inversamente para Bougainvillia muscus y Clytia hemisphaerica (Figura 7).
3.4.2. Sifonóforos
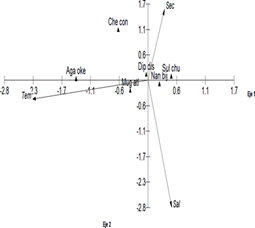
El análisis de correspondencia canónica alcanzó valores propios de 0.191 para el primer eje y 0.078 para el segundo, con una varianza de 8.68 y 3.56 respectivamente, obteniéndose en los 2 ejes del análisis multivariado el 12.24% de la varianza explicada. La correlación entre la abundancia y las variables ambientales a nivel superficial en el eje uno fue de 0.54 y para el eje dos de 0.38. Fue posible registrar la relación que existe entre Muggiaea atlantica y Agalma okeni con la temperatura e inversamente con Nanomia bijuga y Sulculeolaria chuni asociadas a aguas cálidas, Diphyes dispar y Chelophyes contorta muestran relación con la visibilidad del agua e inversamente con la salinidad (Figura 8).
4. Discusión
Los parámetros abióticos: temperatura, salinidad y visibilidad registrados en el presente estudio presentan valores similares con los reportados por Andrade (2010), Andrade (2014b) y Muñoz (2015).
El número de especies consignadas en esta zona es ligeramente mayor (22 hidromedusas y 14 sifonóforos) si se comparan con los trabajos de Andrade (2010) en la Bahía de Santa Elena donde se registraron 24 especies de medusas, Andrade (2012) alrededor de la Isla Santa Clara con 15 especies de sifonóforos, Andrade (2014a) en el estuario del río Mataje-Bahía Ancón de Sardinas con 10 especies de medusas y 4 especies de sifonóforos, Andrade (2014b) en estaciones fijas 10 millas costa afuera durante la época húmeda reportó 14 especies de medusas y 12 especies de sifonóforos en La Libertad, mientras en Manta 11 especies de medusas e igual número para sifonóforos, Muñoz (2015) en las aguas costeras del puerto pesquero de Chanduy registró 18 especies de hidromedusas, evidenciándose diferencias en el número de especies encontradas en esta investigación, lo cual podría atribuirse a la época climática, considerando que en la época de lluvias existe un incremento en el aporte de nutrientes procedentes de cuerpos de agua epicontinentales por lo cual es posible deducir que existe un incremento en los productores primarios y secundarios, especialmente cercano a los sitios de descarga, lo que podría beneficiar a la propagación de una mayor cantidad de especies (D’Croz, Robertson, & Martínez, 1999).
Varias de las especies de medusas y sifonóforos identificadas a nivel superficial y vertical en aguas de Ancón, Anconcito y Punta Carnero coinciden con los registros de Andrade (2010), Andrade (2014b) y Muñoz (2015) e incluso las especies con mayores densidades concuerdan con las más abundantes de las mencionadas investigaciones corroborándose su preponderancia a través del tiempo, tal es el caso de las medusas Obelia sp., Liriope tetraphylla y Aglaura hemistoma, especies cosmopolitas y de amplia distribución, mientras que a nivel de columna de agua Andrade (2014b) identificó como abundantes a Rhopalonema velatum, Cunina globosa, Ectopleura dumortieri y Solmundella bitentaculata especies también encontradas en el área de estudio sin embargo no fueron consideradas las más abundantes a excepción de la última; en cuanto a sifonóforos Nanomia bijuga y Muggiaea atlantica fueron los de mayor densidad poblacional, este último frecuente durante todos los meses de estudio, confirmándose el carácter dominante en la estructura comunitaria de este grupo, siendo de gran dispersión, por ende ubicándose en distintas regiones del Pacífico Tropical (Gasca 2002; Morales & Nowaczyk 2006), a su vez Alvariño (1971), menciona a las especies reportadas como las más abundantes, habitantes comunes en el cinturón trópico-ecuatorial.
De manera general las especies de medusas y sifonóforos identificadas en el presente estudio, tienen amplia distribución en las zonas tropicales (Alvariño & Leira, 1986; Morales & Nowaczyk, 2006; Segura, Franco, Suárez, Gasca, & Godínez, 2010), periodo durante el cual se desarrollaba el evento El Niño 2015- 2016, fenómeno relacionado comúnmente con el incremento de especies tropicales (Aronés & Ayón, 2002). Registrándose a su vez especies de hábitats cosmopolitas, neríticas y oceánicas asociadas a procesos de intrusión marinas.
Segura, Suárez, & Celis, 2003 reconocen que, los ambientes con mayor diversidad de hidromedusas son las regiones epipelágicas o, incluso, las mesopelágicas, por tal razón se sugiere realizar colectas para los próximos estudios en regiones oceánicas y neríticas del Ecuador.
Considerando que la estructura de la comunidad es el reflejo de respuestas específicas de las especies a las condiciones ambientales, el comportamiento de cada una sugiere un cambio en la composición faunística de la comunidad, específicamente durante periodos del año en que las condiciones oceanográficas son diferentes, con respecto a la diversidad de Shannon, Andrade (2010) en el sector de la Bahía de Santa Elena para la comunidad de medusas registró el valor máximo de 2.74 bits/ind, Andrade (2014b) en La Libertad en medusas registra valores de diversidad desde 0.31-2.36 bits/ind y para sifonóforos intervalos de 1.14-1.63 bits/ind, mientras que en Manta cita valores de diversidad para medusas que oscilaron entre 0.94-1.76 bits/ind y para sifonóforos los índices presentaron valores de 1.31-1.63 bits/ind, destacándose mayor diversidad y mejor uniformidad en la distribución de especies en la época húmeda a nivel vertical en medusas, mientras los sifonóforos reportaron mayor diversidad a nivel superficial, resultados que presentan la misma tendencia para el presente estudio; en la zona costera del Puerto Pesquero de Chanduy, Muñoz (2015) ha reportado valores máximos de diversidad para medusas de 2.04 bits/ind, datos que presentan diferencias con respecto al presente estudio, esto atribuido a que se consideraron otras especies, debido a esto la comunidad de medusas y sifonóforos en general durante la época húmeda fue más equitativa, por ende la dominancia fue baja.
La participación de las especies que contribuyen a la formación de los grupos en el análisis de clasificación, así como en la afinidad por estaciones, podría estar determinada por la biología de las especies y por las condiciones ambientales.
Empleándose la correlación de Pearson, Andrade (2010) para Liriope tetraphylla registró el 5% de abundancia con una correlación moderada de 0.68 para la temperatura y correlación negativa débil de -0.36 para la salinidad y Muñoz (2015) para la misma especie reporta el 16% de abundancia en pleamar con una correlación significativa positiva de 0.82 para la temperatura y de una correlación moderada negativa de -0.53 con la salinidad, rangos de correlación que coinciden de manera general con el análisis de correspondencia canónica aplicado a medusas, obteniéndose correlaciones moderadas y significativas, mientras que en sifonóforos se presentaron relaciones débiles y moderadas, demostrando en el presente estudio que las medusas respondieron mejor que los sifonóforos a las variables ambientales, los cuales correlacionaron pero en menor proporción, aceptándose la hipótesis de que la distribución de estos organismos se relaciona con la temperatura y salinidad a nivel superficial planteada en la presente investigación, no obstante se recomienda analizar otras relaciones como interacciones con otros grupos de zooplancton u otras condiciones ambientales.
Los resultados obtenidos permiten ampliar significativamente el conocimiento científico sobre la biodiversidad de los organismos zooplanctónicos gelatinosos en aguas costeras de la Provincia de Santa Elena y el Ecuador, en vista que estos son muy escasos.
Se recomienda el estudio de este grupo a lo largo de la costa Ecuatoriana en ambas épocas estacionales, abarcando zonas epipelágicas y mesopelágicas, realizando arrastres a un nivel determinado a fin de analizar si los patrones encontrados aquí son similares o distintos en las capas más profundas, incluyendo monitoreos nocturnos para observar su distribución y a su vez el comportamiento de estos organismos, estudios de nutrientes en las diferentes épocas del año para conocer la productividad de los nichos ecológicos y análisis moleculares para corroborar su sistemática.
5. Conclusiones
Con los datos obtenidos se da una predicción de la riqueza específica del área por primera vez, que a su vez conlleva a registrar y ampliar la biodiversidad de organismos gelatinosos reportados en el Ecuador y abrir paso a futuras investigaciones sobre el rol ecológico que representa esta taxa dentro de los ecosistemas marinos y los impactos que pueden llegar a tener sobre actividades humanas en el ámbito turístico y pesquero.
Las 22 especies de medusas y 14 especies de sifonóforos identificadas durante la presente investigación constituyen los primeros registros para el área de estudio.
La comunidad de medusas y sifonóforos en la zona marino costera de Ancón, Anconcito y Punta Carnero estuvo compuesta en su mayoría por hidromedusas y sifonóforos de hábitos neríticos, pero también se registró la presencia de especies oceánicas, influenciado por procesos de intrusión de sus aguas.
Las especies de medusas más abundantes fueron Aglaura hemistoma, Liriope tetraphylla, Obelia sp., Proboscidactyla ornata y Solmundella bitentaculata, mientras que en sifonóforos Nanomia bijuga, Muggiaea atlantica, Sulculeolaria chuni y Diphyes dispar.
Los carnívoros gelatinosos presentaron fluctuaciones estacionales de abundancia con máximos a nivel vertical y mínimos en superficie.
La máxima diversidad de medusas se presentó a nivel de columna de agua, mientras que en sifonóforos superficialmente.
El análisis de conglomerados indicó que las estaciones internas presentan mayores densidades poblacionales que las externas.
La salinidad y la temperatura fueron los factores abióticos que se relacionaron con la distribución y abundancia de las especies en el área.












 uBio
uBio