1. Introducción
La producción y conservación de los tubérculos, granos, frutales y forrajes es clave en muchas regiones del mundo, sobre todo en los países en vía de desarrollo, para paliar los desafíos actuales que atraviesa el planeta. En tal sentido, se hace apremiante la búsqueda de soluciones y alternativas que logren dar respuesta a las necesidades básicas en la producción animal (Hoffman et al., 2011). Un método económico y de fácil acceso es el ensilaje, el cual permite conservar productos de rápido deterioro. A su vez, permite aumentar los valores biológicos en los productos obtenidos mediante estas técnicas (Danelon et al., 2010). En las últimas décadas se ha dado lugar el desarrollo de ensilaje con fines de obtener productos en mayores cantidades y con alto valor biológico durante la conservación (Fernández et al., 2013) al reducir la pérdida de nutrientes por rápido deterioro y compensar los costos de producción (Miranda et al., 2014; Ali et al., 2014). El aumento continuo de costos de los alimentos balanceados para animales, en la mayoría de los casos llegando a superar el 80% del costo total de producción (Heguy et al., 2016), ha limitado su uso y minimizado las utilidades para el pequeño y mediano productor.
No obstante, el uso de la planta entera de yuca (hoja, tallo y raíz) mezclada con harina de caupí, a lo cual se adicionan cultivos microbiológicos, pudiera resultar eficiente y económico para obtener ensilajes para la alimentación animal. En este sentido, se ha encontrado en la literatura estudios que utilizan técnicas de ensilaje como un medio idóneo para conservar el contenido nutritivo de los forrajes, tubérculos, granos y frutos (alfalfa, hojas de maíz, sorgo, plátano, yuca, patatas, frijoles forrajeros, pastos, entre otros) (Heguy et al., 2012; Spanghero et al., 2015).
A base de lo anterior, los alimentos alternativos han sido evaluados y utilizados para diferentes especies animales con resultados positivos. Un ejemplo de esto es el aumento de peso y ganancia media diaria de peso de cerdos en la etapa ceba (Kung et al., 2015). En las vacas y cabras lecheras se ha visto mejorar la producción de leche (Danelon et al., 2010; Guglielmo et al., 2015). Unido a esto, Ali et al. (2014), al incluir 50% de ensilaje con enzimas celulolíticas en pruebas “in situ”, observaron mejorar la degradación de alimentos fibrosos. Asimismo, Miranda et al. (2014) reportaron extender el tiempo de conservación sin afectar al contenido nutritivo y con reducción de las partes fibrosas de la yuca al inocular cultivo mixto de bacterias ácido lácticas y levaduras. De igual manera, Hoffman et al. (2011), Dadvar et al. (2013) y Lyncha et al. (2014), con el uso de un cultivo mixto se lograron controlar el crecimiento de microorganismos toxigénicos como clostridium, S. aureus, C. botulinum, Salmonella sp. y Listeria monocytogenes, así como de los microorganismos asociados al deterioro directo del alimento. Si se tiene en cuenta todo lo anterior, el presente estudio tuvo como objetivo evaluar los cambios físicos, químicos, microbiológicos, fibrosos y ácido láctico del ensilaje de yuca con caupí al emplear cultivo microbiano, durante 18 meses de conservación.
2. Materiales y Métodos
Área de estudio: el estudio se realizó en el laboratorio de bromatología, Centro de Investigaciones Agropecuarias (CIAP) y laboratorio de microbiología, Facultad de Ciencias Agropecuarias, Universidad Central “Marta Abreu” de Las Villas, Santa Clara, Cuba.
Material empleado: se emplearon 50 kg de la planta entera (hoja, tallo y raíz) de yuca (Manihot esculenta crantz) fresca, con las siguientes características: 43.43% de materia seca (MS), 4.5% de proteína cruda (PC) y 0,9% ceniza (Cz); 20 kg harina de caupí (Vigna unguiculata) que contenía 85% MS, 26.1% PC, 1.0 % extracto etéreo (EE), y 3.2 Cz, y 5 L de preparado microbiano.
Selección, activación de las cepas y obtención del preparado microbiano: las cepas seleccionadas para la obtención del preparado microbiano fueron Lactobacillus acidophillus, Streptococcus thermophillus y Kluyveromyces fragilis (L-4 UCLV) proveniente del banco de microorganismos de la Universidad Central “Marta Abreu” de Las Villas. Las cepas en formato biomasa fueron activadas en 250 mL leche de soya ácida a 37ºC por 24 h en una estufa con zaranda (Nkubationshaube TH 15, Alemania) a 60 rpm. Una vez activados los microorganismos, se procedió a obtener el preparado microbiano. Se inocularon 150 mg (Balanza Analítica Radwag AS 220/C/2, Suiza) de biomasa anteriormente descrita en una mezcla de 2.5 L de yogur de soya y 600 g de melaza de caña de azúcar a 34 ± 2ºC. La mezcla se incubó a 37ºC durante 24 h. Finalmente se caracterizó de acuerdo con Miranda et al. (2014). El preparado microbiano previamente obtenido contenía 13.35% MS, 3.5% de proteína bruta (PB), 3.9 pH y 9x108 y 9.1x107 (bacterias y levaduras) UFC/mL de concentración microbiana.
Obtención de las variantes: la yuca entera (raíz, tallo, hojas) fue molida utilizando un molino martillo (modelo 301011, España), hasta obtener un tamaño de partículas entre 5-8 mm. Luego, según el tratamiento detallado en la Tabla 1, se mezcló con la harina de caupí, y posteriormente se procedió a inocular el preparado microbiano, en el caso del tratamiento con cultivo microbiano. Todos los tratamientos fueron conservados en frascos de cristal estériles de boca ancha con capacidad de 1 kg, y a una temperatura ambiente de 12 ± 2 ºC.
Caracterización, física y química: el color se evaluó mediante código HTML de acuerdo con Miranda et al. (2017). El aroma, sabor y textura se evaluaron por los sentidos sensoriales del investigador mediante la metodología descrita por Acevedo et al. (2009). La determinación de PC y proteína verdadera (PV) se realizó de acuerdo con Dadvar et al. (2015). Los contenidos de MS, Cz, EE, fibra acida detergente (FAD), lignina y celulosa, se determinaron mediante los métodos de AOAC (2012). El pH se medió con un pHmetro (HANNA® *H 110, USA), calibrado a 4, 7 y 10.
Análisis microbiológico: a 25 g de cada tratamiento se le añadieron 50 mL de suero fisiológico y se incubó a 37ºC por 24 h. A continuación, las muestras se centrifugaron las muestras (centrífuga BD DYNAC™ III) a 600 rpm por 5 minutos. La determinación de ácido láctico se realizó según la técnica "Conway" descrita por Conway (1957). Para el análisis de viabilidad, los tratamientos fueron preparados en las diferentes concentraciones hasta la escala 0,5 del esquema McFarland para la viabilidad. Posteriormente, se cultivaron las muestras y se realizó el recuento celular de número de unidades formadoras de colonias (UFC), según la metodología descrita por Miranda et al. (2017).
Análisis estadístico: la comparación de medias de los tratamientos se realizó mediante la prueba de Duncan (1955), y estos fueron analizados usando el software Statgraphic Plus versión 51.1.
3. Resultados
En la Figura 1 se observa la caracterización organoléptica del ensilaje de yuca (Y100), yuca con caupí (Y+C) y de yuca más caupí y cultivo microbiano (Y+C+BP). El aroma y el sabor fueron de ácido a ácido dulzón; color verde lechoso a marrón; la textura fue semisólida al momento de ensilar para todas las variantes. Dichas características no variaron hasta dos meses de conservado. En la medición a los 12 y 18 meses, se observó diferencias entre los tratamientos, pero el de mejor comportamiento fue la variante Y+C+BP.
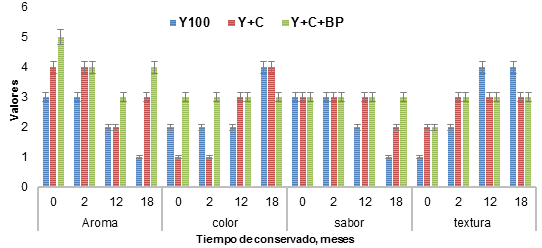
Fig. 1: Características organolépticas de los ensilajes. Y100. Yuca integral (hoja, talla, raíz). Y+C, Yuca más 20% harina de caupí. Y+C+BP. Yuca más 20% harina de caupí y 8% preparado microbiano.
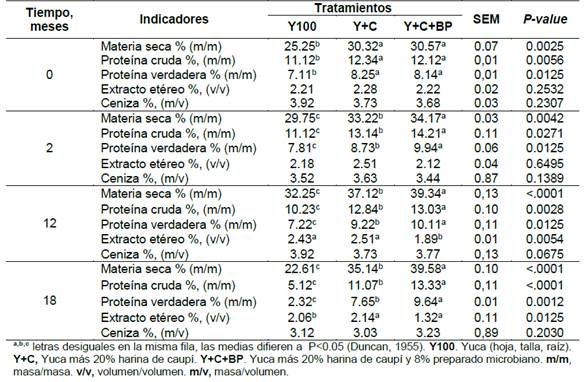
En la Tabla 2 se resumen los valores medios de la composición química básica de los ensilajes. Al momento del ensilar, la MS, PC y PV fue menor (P<0.05) en el tratamiento Y100 en comparación con los otros tratamientos, sin variación entre estos dos últimos. Además, la Cz y EE no difirió entre variantes. A los 2, 12 y 18 meses, el contenido de MS, PC y PV fue mayor (P>0.05) en Y+C+BP que en los otros tratamientos. En cuanto al EE, fue menor (P<0.05) en Y+C+BP frente a Y100y Y+C a los 12 y 18 meses de conservado. Los valores de Cz no defirieron entre tratamientos durante todo el estudio.
Tabla 2 Característica química del ensilado de yuca con caupí, al emplear preparado microbiano durante la conservación.
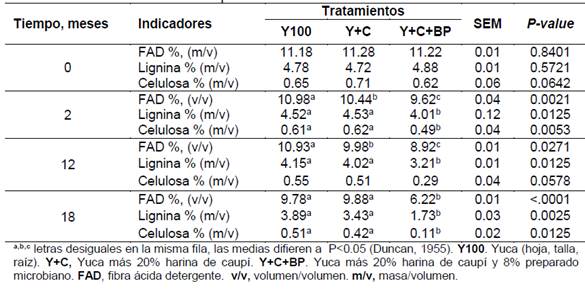
En la Tabla 3 se presentan los valores medios de FAD, lignina y celulosa. Estos no variaron entre tratamientos al momento de ensilar. Tras dos meses de conservado, la FAD fue menor (P=0.0021) en Y+C+BP, en tanto que la lignina y celulosa no variaron entre Y100 y Y+C. A los 12 meses después de ensilar las partes fibrosas se redujeron en todas las variantes, y fue menor (P<0.05) en el Y+C+BP frente a Y100 y Y+C. La lignina no mostró variación entre Y100 y Y+C, en tanto que la celulosa no difirió entre tratamientos. En la medición realizada a los 18 meses después de ensilar fue menor (P<0.05) en Y+C+BP frente a Y100 y Y+C, sin diferencias entre estos últimos.
Tabla 3 Característica de la fibra del ensilado de yuca con caupí, al emplear preparado microbiano en las diferentes etapas de conservación
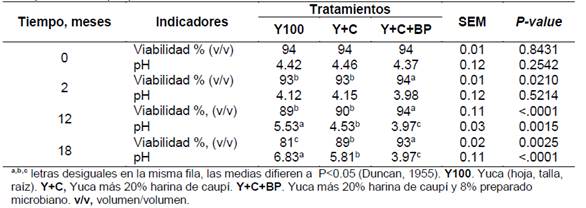
En la Tabla 4 se observa la viabilidad microbiana y los valores de pH del ensilaje. Al momento de ensilar los valores de pH no mostró diferencia entre tratamientos, sin embargo, a partir de dos meses hasta el final del estudio fue menor (P<0.05) en el Y+C+BP frente a los demás tratamientos. En cuanto a la viabilidad microbiana fue mayor (P<0.05) en el Y+C+BP con respecto al Y100 y Y+C a partir de dos meses hasta los 18 meses de conservado.
Tabla 4 Característica microbiológica y los valores de pH del ensilaje de yuca con caupí al incluir preparado microbiano.
En la Figura 2 se observa la concentración de ácido láctico en el ensilaje de yuca con caupí al inocular preparado microbiano. A partir de los 2 y hasta los 18 meses, los valores de ácido láctico fue mayor (P<0.05) en el tratamiento que contenida cultivo microbiano (Y+C+BP) en comparación con Y100 y Y+C.
4. Discusión
Los resultados en cuanto a las características organolépticas en las variantes ensiladas del presente estudio (Figura 1), podrían estar relacionados con las propiedades funcionales que son reflejados atributos intrínsecos de la composición física, así como las posibles interacciones con otros componentes (Ke et al., 2015). En tal sentido, Gugglielmo et al. (2015) reportaron la repercusión de la materia prima utilizada en la característica física de los ensilados. Por su parte, Danelon et al. (2010) observaron efecto ambiental, calidad del material y el valor nutritivo en la característica física del producto final, aunque este depende fundamentalmente de la materia prima, especies y la variedad que se emplea. En tal sentido, Fernández et al. (2013) presumen que el empleo de los microorganismos influye positivamente en las características físicas posiblemente por la acción fermentativa de los microorganismos anaerobios en las primeras 24 horas después de ensilar (Miranda et al., 2014). Los resultados obtenidos en el presente estudio se asemejan con los reportados por Fernández et al. (2013). Por su parte, Lyncha et al. (2014) reportaron pH menor a 4.70 al emplear enzimas fibrolíticas en el ensilaje con alfalfa. Unido a esto, en estudio previo, Miranda et al. (2014) reportaron pH inferior a 4.23 al ensilar yuca más caupí y BIOPRANAL. Sin embargo, Ke et al. (2015) observaron pH con valores superiores a 5.85 y esto repercutía en las características físicas de los ensilajes.
Los resultados en cuanto a los parámetros químicos (Tabla 2) posiblemente fueron debidos al contenido de la materia prima y los microorganismos empleados para obtener ensilajes. Spanhero et al. (2015) observaron la influencia de materia prima sobre la calidad del ensilaje obtenido. Con referencia a lo anterior, Fernández et al. (2013) reportaron, efecto de la materia seca, contenido de compuestos nitrogenados, pérdidas de azúcares, cantidad de minerales y la capacidad de producir ácidos orgánicos del material a ensilar, sobre las características bromatológicas. Por su parte, Kung et al. (2015) observaron proteólisis durante el ensilaje, causado principalmente por los clostridium y esto aumentó sustancialmente los valores de pH hasta lograr la degradación el material ensilado. Mayor porciento de MS obtenido en el estudio podría estar relacionado con la evaporación de agua, unido al mayor desarrollo de microorganismos anaerobios empleado durante el ensilaje, similares valores fueron reportados por Miranda et al. (2014) al incluir BIOPRANAL en el ensilaje de yuca con caupí. Por su parte, Ke et al. (2015) observaron un leve aumento en la composición nutritiva al incluir bacterias ácido lácticas en el ensilaje de hojas de maíz. Un ligero aumento en la composición nutritiva también fue reportado por Ali et al. (2014) en pruebas realizadas “in vitro”. Según el estudio de Hoffman et al. (2011) mejoraron el contenido de PC y PV al inocular biopreparados en el ensilaje de maíz con alta humedad, Sin embargo, Guglielmo et al. (2015) no observaron variación al ensilar sorgo con maíz. A diferencia de lo anterior Danelon et al. (2010) al emplear concentraciones energéticas en alfalfa mejoraron los valores de PC, PV y EE. No obstante, dichos parámetros se encuentran por debajo de los obtenidos en el presente estudio.
Asimismo, los valores obtenidos en cuanto a FAD, lignina y celulosa, son inferiores a los reportados por Heguy et al. (2010). Sin embargo, se asemejan con los reportados por, del Río et al. (2016). Por su parte Lyncha et al. (2004) reportaron efecto de enzimas fibrolíticas sobre la degradación de las partes fibrosas del ensilaje. Del mismo modo, Kung et al. (2015) redujeron la cantidad de lignina en el ensilaje de sorgo con maíz. Por su parte Der Bedrosian et al. (2012) reportaron la reducción de los niveles de la celulosa y lignina al ensilar maíz planta entera. De modo similar Dadvar et al. (2015) observaron al fermentar pulpa de limón con S. cerevisiae. Por su parte, Heguy et al. (2016) mejoraron los índices nutritivos y redujeron los niveles de lignina al emplear enzimas. Mientras que Danelon et al. (2010) observaron la reducción en las fracciones celulósica y esta diferencia podría estar relacionada con el contenido de almidón y microorganismos con actividad fermentativa. Estudios previos fueron realizados por del Río et al. (2016) y Hoffman et al. (2011) al determinar los contenidos de lignina, celulosa y hemicelulosa, antes y después de ensilar con preparados microbianos, pero no informaron los valores obtenidos en dichos estudios.
Sin embargo, existen reportes sobre la asimilación de lactato en algunas especies de levaduras, lo que ayuda a mejorar el crecimiento de los microrganismos anaerobios en el ensilaje (Sourav y Arijit, 2010; Ali et al., 2014). La viabilidad microbiana obtenida en el presente estudio pone de manifiesto que los microorganismos empleados se mantuvieron activos durante 18 meses y esto podría ser principalmente por la acción acidificante generada por las bacterias ácido lácticas (Dadvar et al., 2015); el mismo comportamiento fue observada por Heguy et al. (2010) al emplear biopreparados. Asimismo, Hoffman et al. (2011) reportaron ligero aumento en la viabilidad microbiana en los ensilados al incluir 10% de yogur natural. Unido a esto, Ke et al. (2015) y Spanghero et al. (2015) observaron también mejorar la producción de microorganismos benéficos en los ensilajes al emplear medios biológicos. Por su parte, (Guglielmo et al., 2015) reportaron mayor crecimiento de levaduras ligninolíticas en los ensilajes de maíz con alto grado de humedad. Sin embargo, en los estudios realizados por del Río et al. (2010), Ali et al. (2014) y Heguy et al. (2016) se vio que con el empleo de las enzimas en los ensilajes desarrollados con tallos de tabaco, algodón, girasol y paja de trigo la viabilidad microbiana fue menor a los obtenidos en el presente estudio.
5. Conclusiones y recomendaciones
La inclusión de L. acidophillus, S. thermophillus y K. fragilis (L-4 UCLV) aumentó los valores en la materia seca, proteína cruda y verdadera, ácido láctico y disminuyó el pH en el ensilaje de yuca integral con 20% harina de caupí, por 18 meses de conservado.
Los datos del presente estudio sugieren que la adición de preparado microbiano en el ensilaje de yuca integral con caupí puede solubilizar algunas de las partes de las fibras de fácil digestión de los carbohidratos de la pared celular y, por lo tanto, puede suministrar sustratos para la fermentación de ácido láctico.
Así mismo, la adición de bacterias lácticas y levaduras en el ensilaje podría ser eficaz para mejorar la calidad y mantener sobre los 18 meses de conservado a la yuca integral (hojas, raíz, tallo) con harina de caupí, debido a la disminución en el contenido de azúcar y/o al aumento en la concentración de proteínas.
















