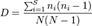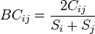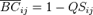1. Introducción
Los ecosistemas de páramo son categorizados como uno de los sitios con mayor biodiversidad del mundo, considerado por algunos como archipiélago biológico (Pauli et-al, 2003), (Azócara, 1981). En el Ecuador la franja altitudinal entre los 3000 hasta los 4500 m s.n.m. contiene casi el 30% de las especies de plantas vasculares (Josse et-al, 2000), esto demuestra la gran representatividad que tiene este ecosistema y la importancia de conocer cuál es su diversidad florística, ya que esta clase de información servirá como punto de partida para el monitoreo del cambio climático y el comportamiento de la flora.
Según Mena y Hofstede ( 2006), el páramo en realidad posee una variedad mucho mayor de lo que la imagen clásica (“lugar yermo desprovisto de árboles”) nos haría pensar. Los páramos, en el Neotrópico, cubren alrededor del 2% de la superficie de los paises de esa región; tiene cerca de 125 familias, 500 géneros y 3400 especies de plantas vasculares. En términos del Ecuador, aún no se conoce el número exacto de especies de plantas que viven en los páramos, pero (León-Yánez, 2000), sugiere que son alrededor de 1.500 especies. También Sklenar et-al. (2005), manifiesta que hasta la fecha, se han registrado para los páramos del Ecuador un total de 1.524 especies, siendo para este ecosistema y en relación a su tamaño, el país con la flora más diversa de la región andina. De las especies registradas para Ecuador, se estima que alrededor de 628 especies de plantas son endémicas, esto equivale al 15% de toda la flora endémica del país y el 4% del total de su flora (Hofstede et-al, 2014). De acuerdo a León-Yánez (2011) el 75% de éstas especies endémicas están amenazadas y apenas el 48% están dentro de áreas protegidas.
En el Ecuador los páramos ocupan una extensión de 1´337.119, que corresponden aproximadamente al 5% de la extensión territorial. La provincia de Chimborazo, con una extensión de 648.124 has, posee más de 236.000 has de ecosistema de páramo, es decir, el 36,9% de la superficie de la provincia y otras 83.800 has son bosque andino y alto andino, es decir, el 13,1% de la superficie de la provincia (Bustamante, Albán, y Arguello, 2011). A nivel nacional, esto representa el 17,7% del total de superficie de páramo en el país (Beltrán et-al, 2009; Beltrán, 2010). Adicionalmente, en la provincia existen dos áreas protegidas del Patrimonio Nacional del Estado (PANE), la Reserva de Producción de Fauna Chimborazo y el Parque Nacional Sangay, entre ellas protegen 91.667 has que representan el 14% del total de la provincia y el 31% del total de los páramos de la provincia. Aunque estas áreas se encuentran bajo un régimen de protección, varias áreas dentro de ellas muestran un alto grado de intervención (Rojas, 2010; Salgado y Cárate 2010).
Las áreas protegidas constituyen el principal instrumento de conservación que salvaguarda en la actualidad el 14% de la superficie terrestre (incluida la Antártida) y el 3,41% de la superficie marina del planeta, a través de 209.428 áreas, en 32´868.673 km2 (Deguignet, y otros, 2014). El objetivo primario que orienta la gestión in situ de éstos espacios es la conservación a largo plazo de la naturaleza, de sus servicios ecosistémicos y sus valores culturales asociados (UICN, 2008). La Reserva de Producción FaunistícaChimborazo es parte de las 51 áreas que conforman el Sistema Nacional de Áreas Protegidas del Ecuador, que representa aproximadamente el 20% del territorio nacional, fue creada con acuerdo Ministerial No. 437 el 26 de octubre de 1987, localizado en las provincias de Chimborazo, Bolívar y Tungurahua (Ministerio de Ambiente, 1995). Su extensión es de 52.683 has; su altitud varía desde los 3650 a 6310 m.s.n.m.; presenta un clima frio andino con temperaturas desde -4.80 C hasta los 11.40 C; registra una precipitación de 809 mm en las zonas menos lluviosas y 1300 mm en las zonas más húmedas, y sus objetos de conservación son los páramos, sistemas hídricos y humedales, bosques y arbustales siempre verdes, y sitos arqueológicos (EcoCiencia, 2014).
Entendiendo este contexto, el objetivo del presente estudio es cuantificar y analizar la diversidad y similitud florística de los páramos en la Reserva de Producción de Fauna Chimborazo.
2. Métodos
2.1. Área de estudio
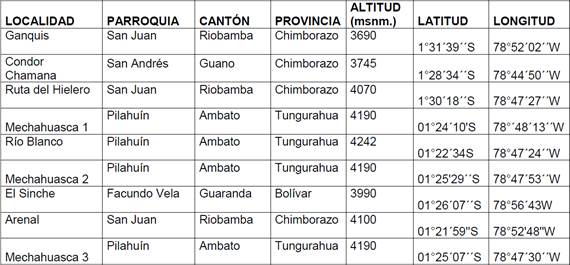
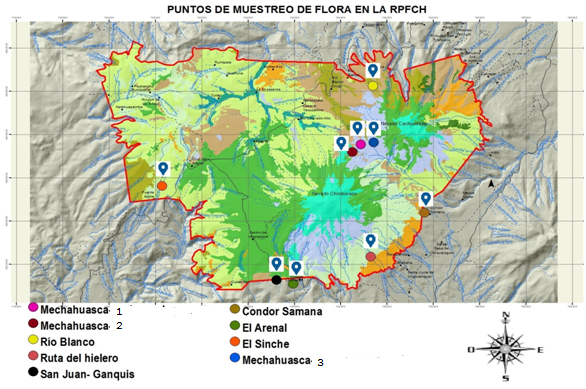
El estudio se realizó en la Reserva de Producción de Fauna Chimborazo, perteneciente a páramos herbáceos (Sierra, 1999) en la cual se identificó 9 zonas de muestreo (Tabla 1 y Figura 1). Estas zonas de muestreo están localizadas en 3 provincias, 4 cantones, y 5 parroquias de la referida área protegida (Figura 1).
2.2. Diseño de muestreo
La metodología utilizada fue la propuesta por (Pauli et-al, 2003), para el proyecto GLORIA en la región europea, razón por la cual se hicieron algunas modificaciones que permitieron adaptarla a los páramos andinos (Suarez et-al, 2012) (Eguiguren et-al, 2010). Las zonas de muestreo se identificaron aplicando criterios de tipo de vegetación, composición vegetal y estado de conservación. En cada zona identificada se instaló un cuadrante de 5×5 m, que se utilizó para el muestreo de la vegetación. Cada cuadrante se subdividió en parcelas de 1 x 1 m., las observaciones de vegetación se llevó a cabo únicamente en las cuatro parcelas de las esquinas o extremos, ya que los otros pueden quedar alterados por el pisoteo de los investigadores a lo largo del muestreo. Cada uno de las parcelas de 1x1 m. se subdividieron en cuadriculas de 0.1 x 0.1m, para ello se utilizó un armazón de tubería PVC con un enrejado formado por hilos finos que delimitan 100 celdillas de 0,1 x 0,1 m., de acuerdo a la metodología del manual GLORIA adaptado por (Rodríguez, 2011) y (Caranqui et-al, 2013), esto permitió obtener la mayor cantidad de información para su posterior análisis.
Dentro de las parcelas se registró información referente al número de especies y la cobertura de cada una de ellas, esto sirvió para determinar la diversidad por familia, densidad, e índice de diversidad. Para mayor información de las especies monitoreadas se revisó en (Jorgensen & Yánez, 1999) y la actualización se consultó en Missouri Botanical Garden (2015)
2.3. Análisis de datos
Se generó un listado de especies con sus respectivas coberturas en cada una de las parcelas, con los cuales se obtuvo: riqueza, diversidad (índice de Simpson), similitud (índice de Bray Curtis), calculados en el software estadístico PAST.
Según (Golicher, 2012), la fórmula para el índice de Simpson es:
Donde S es el número de especies, N es el total de organismos presentes (o unidades cuadradas) y n es el número de ejemplares por especie.
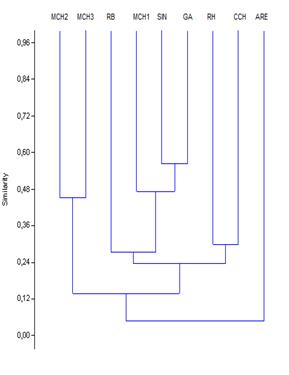
Enla ecologíayla biología, la disimilitud Bray-Curtis (1957), es una estadística que se usa para cuantificar la disimilitud en la composición entre dos sitios diferentes, basadas en conteos en cada sitio. Según la definición de Bray y Curtis, el índice de similitud:
Donde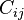 es la suma del valor menor para únicamente aquellas especies en común entre ambos sitios.
es la suma del valor menor para únicamente aquellas especies en común entre ambos sitios.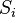 , y
, y son el número total de especímenes contados en ambos sitios.El índice se reduce a 2C / 2 = C, donde la abundancia en cada sitio se expresan como un porcentaje. El tratamiento adicional se puede encontrar en Legendre y Legendre. La disimilitud de Bray-Curtis está directamente relacionada con elíndice de similitud de Sørensen
son el número total de especímenes contados en ambos sitios.El índice se reduce a 2C / 2 = C, donde la abundancia en cada sitio se expresan como un porcentaje. El tratamiento adicional se puede encontrar en Legendre y Legendre. La disimilitud de Bray-Curtis está directamente relacionada con elíndice de similitud de Sørensen
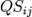 entre los mismos sitios:
entre los mismos sitios:
La disimilitud de Bray-Curtis está obligado entre 0 y 1, donde 1 significa que los dos sitios tienen la misma composición (es decir que comparten todas las especies), y 0 significa que los dos sitios no comparten ninguna especie. En los sitios con donde AC es intermedia (por ejemplo, AC = 0,5) este índice se diferencia de otros índices comúnmente utilizados.
3. Resultados
3.1. Riqueza Florística y Cobertura
Se encontró en total 20 familias, 36 géneros y 46 especies distribuidas en las 9 zonas de muestreo de la RPF Chimborazo (Figura 1). Las familias con mayor número de especies son Asteraceae (9), Poaceae y Geraniaceae con 5; la mayoría de géneros corresponden a una sola especie a excepción de Geranium y Lachemilla.
Calamagrostis intermedia tiene presencia en las 8 de las 9 zonas de muestreo y sus coberturas en 3 zonas superan la mitad de la cobertura total, Phyllactis rigida y Eryngium humile tienen presencia en 5 de las 9 zonas, sin embargo Phyllactis rigida tiene mayor cobertura.
Hypochaeris sessiliflora se encuentra en 4 de las 9 zonas de muestreo pero en menor cobertura. El resto de especies tienen presencias y coberturas quen son de menor representatividad (Tabla 2).
Tabla 2 Listado de especies más representativas con sus respectivas coberturas (400%) en las 22 parcelas.
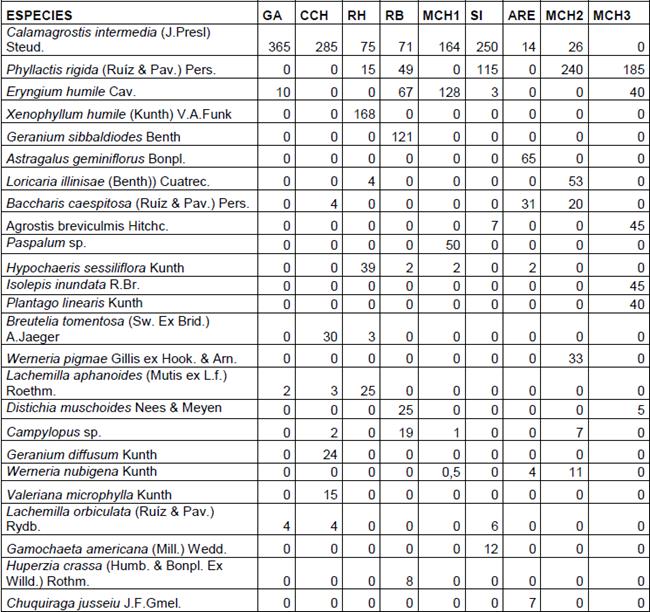
GA: Ganquis; CCH: Cóndor Chamana; RH: Ruta del hielero; RB: Río Blanco; MCH1: Mechahuasca pajonal; SI: El Sinche; ARE: Arenal; MCH2: Mechahuasca mosaico; MCH3:Mechahuasca humedal.
3.2. Diversidad
El listado de especies (Tabla 2) se ingresó en el programa PAST generándose el índice de diversidad de Simpson que fluctúa de 0.17- 0.79 (tabla 2), el cual resulta que los valores varían de bajo a medio en base al número de especies y cobertura (%) en cada parcela ya que todos los valores no se acercan a 1, el valor más próximo a 1 es Río Blanco con 0,79; el resto no supera 0,61 . El número de especies varía de 8 a 12 especies y correspondientemente las que tienen la mayor cantidad de especies tienen alto índice de diversidad como son Río Blanco (RB) y Ruta del Hielero (RH). Hay índices bajos de diversidad en algunas zonas de muestreo, especialmente en Ganquis (GA) se obtuvo 0.169 y probablemente se deba a la fuerte dominancia de Calamagrostis intermedia, y que además presenta una tendencia similar en el resto de zona.
GA: Ganquis; CCH: Cóndor Chamana; RH: Ruta del hielero; RB: Río Blanco; MCH1: Mechahuasca pajonal; SI: El Sinche; ARE: Arenal; MCH2: Mechahuasca mosaico; MCH3:Mechahuasca humedal.
3.3. Similitud
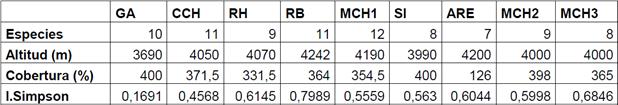
Los clusters, presentados en la Figura 2, generaron 3 grupos, el primero corresponde a Mechahusca 2 (MCH2) y Mechahusca 3 (MCH3) que corresponde a una mezcla de especies de almohadillas con especies de húmedales con una dominancia de Phyllactis rigida y ausencia o presencia menor de Calamagrostis intermedia; el segundo grupo está Río Blanco (RB), Mechahusca Pajonal (MCH1), El Sinche (SIN), y Ganquis (GA) donde hay presencia de Calamagrostis intermedia y por tal razón existen subgrupos como el que forman Río Blanco (RB) con un menor porcentaje de Calamagrostis intermedia; Mechahusca Pajonal (MCH1) con un porcentaje intermedio y finalmente El Sinche (SIN) y Ganquis (GA) que tienen los mayores porcenatjes de cobertura de la Poaceae. Y el tercero Arenal (ARE) a super páramo que si bien tiene menor cobertura que el resto su distribución de especies es mas homogenea.
4. Discusión
Las Familias más representativas en este estudio fueron Poaceae, Asteraceae y Geraniaceae que tuvieron la mayor cantidad de especies; además Poaceae contiene a Calamagrostis intermedia que fue la especie que tuvo los mayores valores cuantitativos en la mayoría de zonas de muestreo, seguido de Caprifoliaceae con Phyllactis rigida que fue la segunda con mayores valores.
GA: Ganquis; CCH: Cóndor Chamana; RH: Ruta del hielero; RB: Río Blanco; MCH1: Mechahuasca pajonal; SI: El Sinche; ARE: Arenal; MCH2: Mechahuasca mosaico; MCH3:Mechahuasca humedal.
De los pocos estudios que se han realizado en la RPF Chimborazo existe información cualitativa (Familias y especies) y la cuantitativa (abundancia/ riqueza) varía en la metodología utilizada (Salgado et-al, 2011); (Salgado y Cárate, 2010) y (Beltrán, 2009), por tanto, mal podríamos tratar de comparar. Sin embargo, en cuanto a los resultados cualitativos del Ministerio de Ambiente (2013) y (EcoCiencia, 2012), estos hacen referencia a las familias y taxones citados también en este trabajo y coinciden de forma general.
De las nueve zonas de muestreo, en ocho hay presencia de Calamagrostis intermedia y en la que mayor porcentaje se encuentra es en el sector de Ganquis, este resultado coincide con el estudio de Caranqui (2013), en cuanto a la presencia característica de la especie en la RPF Chimborazo y la representatividad de la Familia Poaceae en este tipo de formaciones vegetales.
El índice de diversidad de Simpson (Tabla 3) indica la relación entre riqueza o número de especies y la abundancia o número de individuos por especies en cualquier sitio dado (Smith & Smith, 2001). En el presente estudio se encontraron hasta 12 especies por zona de muestreo. Este resultado conjuntamente con los ya mencionados evidencian que la diversidad florística es media a baja, lo cual coinciden con algunos estudios realizados en la provincia como el de Caranqui et-al(2013).
Podríamos decir que, la presencia de un mayor o menor número de especies está influenciado tal vez por el estado de conservación de los páramos o por el grado de intervención de estos tipos de vegetación. La mayoría de los páramos de pajonal son quemados anualmente, o por lo menos cada ciertos años, por incendios producidos deliberadamente por los pobladores, con el fin de obtener pastizales para el ganado vacuno y ovejero. Por lo tanto, todos los taxones de plantas del páramo, poseen adaptaciones que les permite sobrevivir los frecuentes incendios (Laaegard, 1992). Éstas adaptaciones deben haber evolucionado mucho antes que los incendios antropogénicos tuvieran un impacto en los páramos, más o menos dentro de los últimos 10.000 años. Las características morfológicas y fisiológicas que permiten a las plantas del páramo sobrevivir los frecuentes incendios probablemente evolucionaron como adaptaciones a otros factores como la sequía y las fluctuaciones de temperaturas diurnas.
Además de factores bióticos, se suma el aspecto antrópico, el cual en la provincia de Chimborazo ha tenido un papel muy importante en los cambios y transformaciones sobre la estructura y composición de este ecosistema andino. La mayoría de autores están de acuerdo que el páramo de pajonal está sumamente influenciado por las actividades humanas, en particular por los incendios causados por el hombre (Laaegard, 1992). Entonces podríamos inferir que los valores bajos de diversidad y la mayor presencia de familias como Poaceae y especies como Calamagrostis intermedia se deberían a lo explicado en los párrafos anteriores.
5. Conclusiones y Recomendaciones
La mayoría de parcelas según el índice de diversidad de Simpson tienen en su mayoría valores de medio a bajo que fluctúa de: 0.17-0.79. Los valores bajos que se obtuvieron se presume que es a la alta dominancia que se encontró en la mayoría de parcelas por parte de Calamagrostis intermedia.
Con los resultados presentados la familia Poaceae y Asteraceae tienen los mayores valores y número de especies y coinciden con los estudios cualitativos de este tipo de ecosistema. Y además inferimos que son los grupos botánicos que mas resisten a las condiciones climáticas adversas y a los procesos de degradación del páramo en la Reserva.
Se recomienda que se respeten los procesos naturales de regeneración que se producen en el Páramo y que se haga campañas para evitar las actividades antropogénicas especialmente la quema del pajonal que es el problema más grave en la RFPCH.