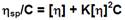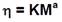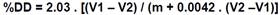1. Introducción
La contaminación del suelo y principalmente del agua a nivel global por hidrocarburos ha dejado consecuencias negativas para el medioambiente. En ciertos casos de derrames de hidrocarburos, como en West Falmouth, los sedimentos muestran que luego de más de 30 años la presencia de hidrocarburos continúa y continuará indefinidamente (Reddy et al., 2002). El Ecuador, siendo un país petrolero no está alejado de esta realidad y varios incidentes han sido reportados en las diferentes etapas de procesamiento y comercialización del mismo, en donde se muestra el nivel de contaminación que ha dejado como por ejemplo en la costa Ecuatoriana (5-50 mg/l TPH) y que en algunos casos se mantiene presente (Da Ros, 1995). En base a esta problemática, a nivel mundial se han desarrollado mecanismos de remediación de hidrocarburos tanto físicos, químicos electroquímicos, bilógicos, entre otros; siendo el uso de biocoagulantes como el quitosano una alternativa efectiva para remover hidrocarburos y demás contaminantes en los cuerpos de agua producto de la actividad petrolera y diferentes actividades industriales, debido a sus características biodegradables, no tóxicas y biocompatibles (Rodríguez, 2011); (Caldera et al., 2009); (Renault et al., 2009); (Abu Hassan, 2009); (Sastre, Ruiz, Guibal, & Szygula, 2010).
Además del valor que representa el camarón como alimento, el residuo del camarón también contiene, entre otros componentes, alrededor de 52% de proteína, 24% de minerales y 18% de quitina, los cuales han sido desechados en el Ecuador, en su mayoría sin darle valor agregado. La quitina es el elemento más abundante en la naturaleza después de la celulosa y el elemento de sostén de los invertebrados y ha sido investigada por más de un siglo, obteniéndose muchos usos que le dan valor agregado como la obtención de quitosano por desacetilación de la quitina (Agulló et al., 2004). En este sentido, el Ecuador es uno de los principales productores de camarón en el mundo ocupando el séptimo lugar y a nivel regional es el primero (Varela, 2011), representando el 25.19% de toda América Latina. Adicionalmente, para el 2013 existió una evolución destacada de las exportaciones con un aumento del 25.63%, pasando de $443,3 millones a 565,8 millones ().
El objetivo de este estudio es poder determinar el efecto que tiene el quitosano, pH y método de agitación en el proceso de clarificación de aguas contaminadas con hidrocarburos, además de demostrar la capacidad de remoción del quitosano como agente biocoagulante bajo las mejores condiciones de aplicación a una muestra con altos niveles de contaminación.
2. Metodología
2.1. Obtención de quitosano
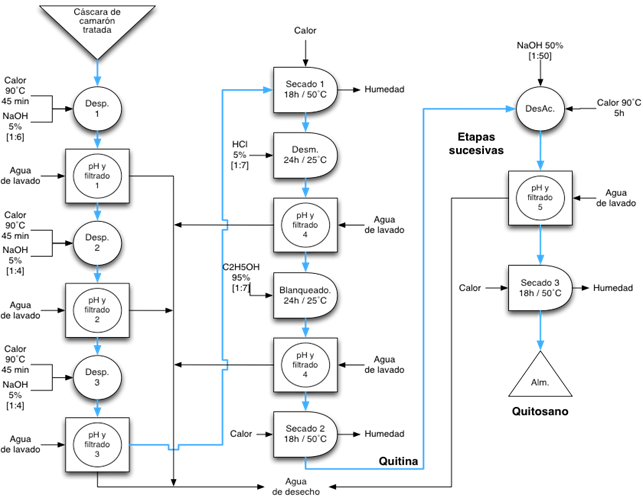
En el proceso de obtención se utilizó el residuo del empacado de camarón facilitado por la empresa Dufer ubicada en Bahía de Caráquez en la costa Ecuatoriana. El exoesqueleto de cola de camarón fue procesado de acuerdo al diagrama de la Figura 1. con el objeto de remover proteínas, minerales, pigmentos y demás impurezas por medios químicos para obtener como producto final la quitina, mediante el método propuesto por Pinelli Saavedra, Toledo Guillen, Esquerra Brauer, Luviano Silva, and Higuera Ciapara (1998). Seguidamente, se utilizaron etapas sucesivas para desacetilar la quitina con NaOH 50% p/p 90˚C por 1.5 h a una proporción solvente:soluto de 50:1 v/p en agitación constante de acuerdo a Yaghobi and Mirzadeh (2004) en presencia de aire atmosférico.
2.2. Caracterización de quitosano
2.2.1. Peso molecular promedio (M)
Se utilizó el método viscosimétrico, en donde se empleó un viscosímetro capilar Cannon-Fenske 150 Y137 (ASTM D445) con baño termostático a 25 ˚C. En el viscosímetro se corrieron las muestras de quitosano disueltas en ácido acético 0,1 M y cloruro de sodio 0.2 M con diferentes concentraciones, determinando el tiempo de caída de las diluciones de quitosano (t) y una de referencia con nula concentración (to) (Paz et al., 2013) para determinar los parámetros viscosimétricos como se establece en la Tabla 1.
Tabla 1 Datos viscosimétricos utilizados en la determinación del peso molecular promedio por viscosimetría intrínseca.

Los parámetros citados se emplearon para la determinación de la viscosidad intrínseca [(] mediante el método gráfico, empleando la ecuación de Huggings (Ec. 1).
Esta fórmula relaciona la viscosidad reducida ((sp / C) con la concentración del polímero y se utiliza para determinar el peso molecular promedio (M) de acuerdo a la ecuación de Mark-Houwink-Sakurada (Ec. 2).
En donde las constantes de la ecuación para tal medio son: K=1.81x10-3 cm3g y ( = 0.93 de acuerdo a Roberts and Domszy (1982)
2.2.2. Grado de desacetilación %DD
Para el ensayo se disolvieron 0.2 g de quitosano seco en 20 cm3 de ácido clorhídrico 0.1 M y 25 cm3 de agua desionizada, se los dejó en agitación continua por 30 minutos y luego se agregó 25 cm3 más de agua y se agitó por 30 minutos más. Una vez que el quitosano se disolvió completamente se procedió a titular la solución con hidróxido de sodio, con una concentración de 0.1 M, utilizando una micropipeta Eppendorf (1000 (l) añadiendo 500 (l de NaOH cada vez y anotando el cambio en el pH con un potenciómetro con electrodo de vidrio marca OAKTON pH 700. Una vez alcanzado un pH de alrededor de 11, se tabularon los resultados en una hoja de cálculo para ver el comportamiento del pH y su derivada en función del volumen de NaOH utilizado; mediante este gráfico se determinaron los puntos de inflexión (V1 y V2) (Czechowska-Biskup, Jarosińska, Rokita, Ulański, & Rosiak, 2012). El grado de desacetilación %DD se calculó usando la fórmula:
En donde:
m = masa de la muestra (g)
V1, V2 = Volúmenes de la solución de hidróxido de sodio 0.1 mol/dm3 correspondientes a los puntos de deflexión.
2.03 = Es el coeficiente resultante del peso molecular de la unidad de monómero de la quitina.
0.0042 = Coeficiente resultante de la diferencia entre el peso molecular de la unidades de los monómeros de quitina y quitosano.
2.3. Caracterización del agua contaminada con derivados petroleros
Las muestras de agua contaminada fueron proporcionadas por una estación de servicio de la ciudad de Portoviejo en Manabí. Para el diseño experimental se recogió muestra suficiente para llevar a cabo los 32 experimentos. Las muestras se tomaron de la primera de las tres trampas de grasa que recolecta los residuos líquidos resultantes del expendio de los derivados del petróleo antes de ser eliminada por los gestores ambientales. En lo que respecta al procedimiento de toma de muestras, para realizar análisis de TPH en el laboratorio acreditado, se siguió la norma NTE INEN 2 169:98 (Agua, calidad de agua, muestreo, manejo y conservación de muestras). Adicionalmente, en el laboratorio de Aguas y Medio Ambiente de la Universidad Técnica de Manabí se realizaron las pruebas de: turbidez (NTU) en un turbidímetro marca HACH, demanda química de oxígeno DQO (mg/l)(Método del dicromato de potasio) y color (Unidades Pt-Co)(Método estándar Platino-Cobalto) en un espectrofotómetro UV-Vis marca HACH 2700. Adicionalmente, se procedió a enviar muestra suficiente al laboratorio acreditado Grupo Químico Marcos para la determinación de Hidrocarburos Totales de Petróleo, Cromo, Vanadio, Bario y Plomo.
2.4. Aplicación de quitosano en la muestra contaminada
2.4.1. Preparación de soluciones de quitosano
El quitosano obtenido fue disuelto en ácido acético 0.1M en agitación constante por 24h a temperatura ambiente para obtener una solución de quitosano al 0,5% aproximadamente, la cual fue filtrada con el propósito de eliminar cualquier material insoluble (Paz et al., 2012). El quitosano se aplicó con micropipetas marca Eppendorf (1000 (l, 200 (l y 20 (l) en la prueba de jarras.
2.4.2. Proceso de clarificación de muestras contaminadas
Este proceso consta de dos etapas: primero, se planteó un diseño experimental (DOE) utilizando una muestra (Mc1) con el objeto de determinar las variables que influyen en el proceso de clarificación y a su vez establecer un modelo de comportamiento estadístico de las variables evaluadas en función de el porcentaje de remoción de turbiedad. Seguidamente, estos resultados se emplearon para clarificar una muestra con altos niveles de contaminación (Mc2) la cual fue caracterizada antes y después del tratamiento en turbiedad, DQO, color, TPH y metales pesados.
2.4.3.1. Planteamiento del diseño experimental
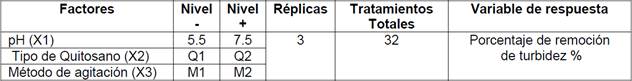
Se planteó un diseño experimental completo, aleatorio, de dos niveles (Tabla 2), con el objeto de evaluar el efecto que tienen: el pH de la muestra, el tipo de quitosano empleado y el método de agitación del test de jarras en el proceso de clarificación de la muestra utilizada. Este proceso se lo realizó en un test de jarras, teniendo como variable de respuesta al porcentaje de remoción de turbiedad para un volumen de muestra de 1 L.
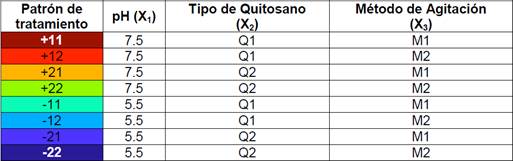
Tanto el diseño experimental como el análisis estadístico fueron desarrollados en el paquete estadístico JMP (9.0.1; 2010 SAS Institute Inc.). En la Tabla 3 se muestra el patrón de diseño a seguir, establecido por el programa con los respectivos niveles de variación.
Donde el método de agitación M1 se dio en las etapas rápidas a 250 rpm por 5 min. y lenta a 40 rpm por 20 min. con un tiempo de reposo de 30 min. Mientras que el método de agitación M2 tuvo una etapa rápida a 150 rpm por 7 min. y lenta a 25 rpm por 30 min. con un tiempo de reposo de 30 min.
2.4.3.2. Determinación de la dosis óptima de quitosano
Se utilizó un equipo de Prueba de Jarras marca Phipps & Bird de cuatro posiciones para llevar a cabo el proceso de clarificación de la muestra contaminada. Inicialmente, se probaron concentraciones de 0.2, 0.4, 0.6 y 0.8 mg/L, para la muestra Mc1, obteniéndose el mejor resultado para la dosis de 0.8 mg/L. Mientras que para la muestra Mc2 las dosis probadas fueron de 0.5, 1, 1.5 y 2 mg/L resultando la dosis de 2 mg/L la mejor dosis.
2.4.3.3. Tratamiento de agua residual contaminada con derivados del petróleo
Se caracterizó la muestra Mc2 antes y después del tratamiento en el laboratorio de Aguas y Medioambiente de la UTM y enviando muestras a el laboratorio acreditado Grupo Químico Marcos. Utilizando los resultados del análisis estadístico, se plantearon las mejores condiciones para el proceso de clarificación de esta muestra, es decir, pH 5.5, quitosano Q2 y método de agitación M1. El proceso se lo realizó en el test de jarras por triplicado utilizando un volumen de 2L y una concentración de quitosano de 2 mg/L como se explica en la Figura 2.

Fig. 2: Proceso de clarificación de la muestra Mc2 contaminada con derivados del petróleo. En donde A revela el estado de la muestra desde la fuente de origen, B el nivel cualitativo de contaminación antes del tratamiento con quitosano, C clarificación de la muestra contaminada después del tratamiento y D se observan los flóculos flotantes formados en el proceso de clarificación.
3. Resultados
3.1. Rendimientos en la obtención de quitosano
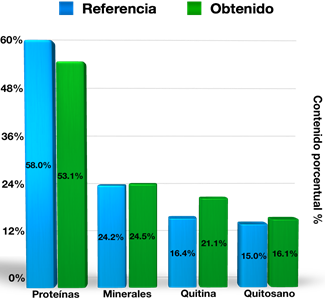
La Figura 3 representa las cantidades promedio extraídas en masa de proteínas 53.1% y minerales 24.5% además de destacar el contenido de quitina 21.1% y de quitosano 16.1% con respecto a la materia prima utilizada y en comparación con lo establecido por Agulló et al. (2004).
3.2. Caracterización del quitosano obtenido
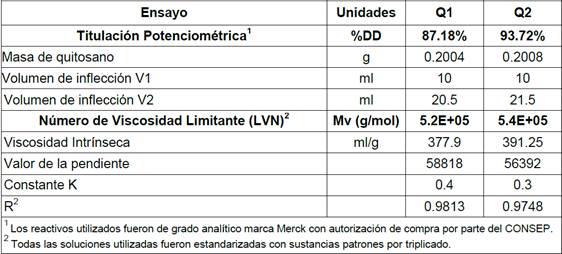
En la Tabla 4 se muestran los datos obtenidos para calcular el porcentaje de desacetilación (%DD) por el método de titulación potenciométrica y el peso molecular promedio (Mv) por viscosimetría intrínseca, para los dos tipos de quitosano Q1 y Q2.
3.2. Tratamiento de la muestra contaminada con quitosano
3.2.1. Remoción de turbidez
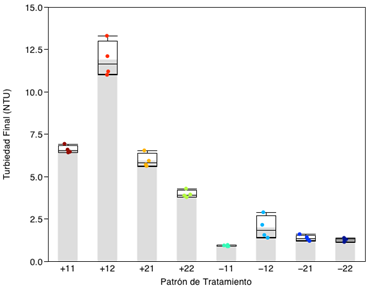
Los resultados del diseño experimental se presentan en la Figura 4, en donde la turbiedad final está en NTU para cada patrón de tratamiento con sus respectivas réplicas, para una muestra Mc1 con 80.3 NTU de turbidez.
3.2.1. Ajuste por mínimos cuadrados
El modelo de comportamiento de las variables estudiadas (Figura 5) presenta una correlación lineal con un R2=0.94 y un factor de probabilidad de P<0.0001 lo que indica que el modelo se ajusta de buena manera y que por lo menos existe un factor de regresión estadísticamente significante para dicho modelo.
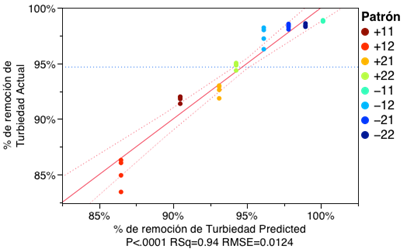
Fig. 5: Ajuste por mínimos cuadrados para datos reales vs. Modelado para cada patrón de tratamiento.
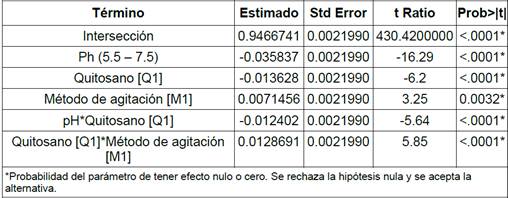
Seguidamente, en la Tabla 5 se presenta la estimación de parámetros de probabilidad para cada uno de los factores estudiados y sus principales interacciones para los cuales se puede notar un factor de probabilidad P<0.0001 principalmente para el pH, quitosano, y uno de P<0.0032 para el método de agitación, lo que indica el rechazo de la hipótesis nula y la aceptación de que existe una diferencia estadísticamente significativa entre los niveles de los factores estudiados ya que todos los valores se encuentran por debajo del P<0.05.
3.2.1. Tratamiento de muestra contaminada Mc2
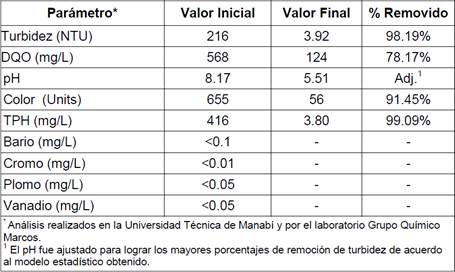
Se probó el quitosano en una muestra, con niveles altos de contaminación Mc2 (proporcionada por una estación de servicio para fines de la investigación) y con un volumen mayor (2 L) que el utilizado en el diseño experimental (1 L). Los análisis realizados a la muestra antes y después del tratamiento de clarificación con quitosano se presentan en la Tabla 6, en donde se muestra el contenido indetectable de Bario, Cromo, Plomo, Vanadio, de acuerdo al laboratorio acreditado.
4. Discusión
Con respecto a la obtención del quitosano, en la Figura 3 se presentan los valores promedio de componentes existentes en la muestra de exoesqueleto de camarón estudiada; ya que en el proceso de desproteinización se removió un 50% de materia para Q1 y 56% para Q2; mientras que la pérdida de masa desde la desproteinización hasta terminar la desmineralización fue de 26% para Q1 y 23 % para Q2; lo que deja como rendimiento en peso para la quitina 23% para Q1 y 19% para Q2. Finalmente, las etapas empleadas en el proceso de desacetilación arrojaron un valor de pérdida de masa de alrededor de 5% por etapa para Q1, mientras que para Q2 fue de alrededor de 1.5% por etapa, dejando como resultado un rendimiento de quitosano en relación a la materia prima de 15.96% para Q1 y de 16.31% para Q2 (base seca) lo que concuerda con estudios relacionados al contenido típico de componentes de la cáscara del camarón (Agulló et al., 2004).
Las características principales del quitosano, como son el grado de desacetilación %DD (87% Q1 y 94% Q2) y el peso molecular promedio (5.2x105 Q1 y 5.4x105 Q2), presentaron valores característicos de quitosanos comercializados en la actualidad, lo que permite establecer su calidad. Adicionalmente, el proceso utilizado para obtener estos dos tipos de quitosano variaron únicamente en la proporción solvente:soluto en cada proceso establecido en la Figura 1, valor que fue mayor para el quitosano Q2 que para Q1. En consecuencia, al usar una mayor proporción solvente:soluto, se utilizaron menos etapas de desacetilación para Q2 en comparación con Q1.
El modelo de correlación estadístico, presentado en la Figura 5 y detallado en la Tabla 5, presenta evidencia estadísticamente significativa del efecto que tienen los factores estudiados, esto es, pH (P<0.0001), tipo de quitosano (P<0.0001) y método de agitación (P<0.0032), en la variable de respuesta, que es el porcentaje de remoción de turbidez. Seguidamente, con el uso de los datos estadísticos se trató la muestra contaminada Mc2 y se observó la formación de flóculos aglomerados en una fase liviana, atribuyendo este comportamiento a la gran cantidad de hidrocarburos (TPH) presentes en la muestra como se muestra en la imagen D de la Figura 2 y en la imagen B de la Figura 6. Finalmente, se obtuvo una remoción positiva para la turbidez 98.19%, DQO 78.17%, color 91.45%, TPH 99.09%, existiendo una presencia no detectable, por los equipos acreditados del Grupo Químico Marcos, de Bario, Cromo, Plomo y Vanadio (Tabla 6).
5. Conclusiones y Recomendaciones
El residuo del empacado de camarón para exportación, así como el proveniente de cualquier otra actividad relacionada, puede ser utilizado en la obtención de quitina y quitosano de muy buena calidad como se presentó en este estudio, dándole un valor comercial a un residuo que constituye un agente contaminante en las zonas de producción del crustáceo en nuestro país.
La metodología utilizada para el uso de quitosano como biocoagulante en la remoción de contaminates de aguas residuales de la comercialización de hidrocarburos, resultó en la determinación del efecto estadístico que tienen los factores estudiados y como consecuencia un modelo estadístico que permitió conocer la mejor combinación aplicación de estos factores para alcanzar la mayor remoción de turbiedad (98%) posible y consigo la remoción de Hidrocarburos Totales de Petróleo (99%) presentes en este tipo de aguas residuales.
Se debería establecer un estudio en cuanto a la biorremediación de los lodos formados en el tratamiento del tipo de aguas residuales presentados. En este sentido, un mayor esfuerzo debe destinarse al desarrollo de sustancias de origen natural que puedan utilizarse en el tratamiento de aguas residuales y de consumo con el fin de preservar y garantizar la salud de los seres vivos además de la fauna y flora de nuestro ambiente.