1. INTRODUCCIÓN
La formación de complejos metálicos con curcumina atrajo mucho interés en los últimos años como uno de los requisitos para el tratamiento de la enfermedad de Alzheimer y actividad antioxidante. Sin embargo, según el reporte obtenido de la revisión de la base de datos: Chambridge Structural Data Base CSDB, revisión 06/2021, Chambridge University (2021), la literatura no reporta las estructuras moleculares de complejos metálicos de cobre, zinc, magnesio y níquel con el ligando curcuminato exclusivamente; aun cuando existe información de algunos complejos metálicos con ligandos mixtos de curcumina y otros ligandos.
Se han reportado importantes investigaciones sobre la estabilización de la curcumina por complejación con cationes divalentes (zinc, magnesio y cobre) en el sistema de glicerol/agua. Estos resultados se soportaron en propuestas estructurales, basados en cálculos experimentales para los complejos metálicos de curcumina estudiados (Zebib et al., 2010 ). En la literatura, se reportan también, algunos compuestos ternarios de curcumina, sintetizados por la reacción de un nitrato metálico M(NO3)2 con curcumina como ligando primario y 1,10-fenantrolina (phen) como ligando de soporte en solución de agua / etanol en atmósfera de nitrógeno. La fórmula general de los complejos es (M(Cur)(fen)) NO3 (M = Ni2+, Co2+, Cu2+ y Zn2+) y los resultados de la actividad biológica indicaron que los complejos metálicos de la curcumina tienen una buena capacidad antibacteriana comparado con la del ligando libre curcumina (Ismail et al., 2014). En la última década, se ha reportado la síntesis de complejos de cobre(II) (6) y del complejo de zinc(II) (Sareen et al., 2016), con la curcumina en la relación estequiométrica metal : ligando 1:1.
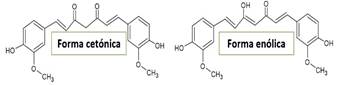
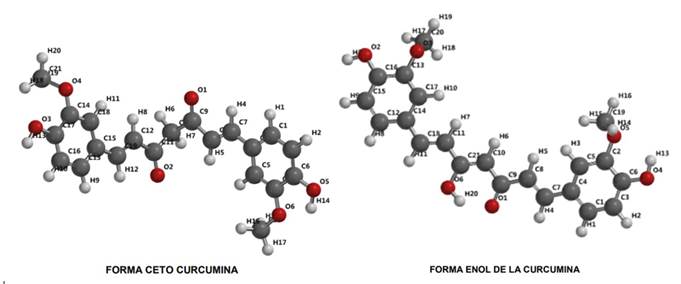
La curcumina es un compuesto que se presenta en dos formas tautomérica: la enólica y la cetónica (Figura 1) tal como lo señala González-Albadalejo et al. (2015). La preparación de los complejos metálicos (zinc, cobre, níquel y magnesio) se realiza por reacción de la curcumina con las sales de los correspondientes iones metálicos y se ve favorecida por la pérdida de un hidrógeno del grupo enólico (OH) y la formación del anillo quelato a través de los oxígenos de los grupos enólico (desprotonado) y cetónico del ligando (González et al., 1986).
Uno de los problemas que presenta la curcumina es su escasa disponibilidad biológica tras su ingesta oral, debido a que se absorbe relativamente poca curcumina y la parte que sí llega al torrente sanguíneo se degrada con rapidez (Prasad et al., 2021; Dulbecco & Savarino, 2013). Para mejorar las propiedades farmacológicas de la curcumina, se sintetizaron complejos de curcumina con los elementos: boro, cobalto, cobre, galio, gadolinio, oro, lantano, manganeso, níquel, hierro, paladio, platino, rutenio, plata, vanadio y zinc. Estos estudios revelaron que los complejos metal-curcumina han demostrado eficacia contra varias enfermedades crónicas, incluyendo cáncer, artritis, osteoporosis y enfermedades neurológicas como el Alzheimer. Estas actividades biológicas de los complejos metal-curcumina fueron asociados con la modulación de mediadores inflamatorios, factores de transcripción, peroxidación lipídica, enzimas antioxidantes y han mostrado utilidad en imágenes biológicas y radio imágenes. El futuro uso de los complejos metálicos de curcumina puede representar un nuevo enfoque en la prevención y tratamiento de enfermedades crónicas (Prasad et al., 2021) y de manera particular de trastornos intestinales inflamatorios y neoplásicos (Dulbecco & Savarino, 2013). La formación de complejos metálicos bioactivos puede conducir a la generación de nuevos metalofármacos con actividades bioquímicas y farmacológicas mejoradas respecto a la curcumina (Halevas et al., 2020).
2. MÉTODOS Y MATERIALES
2.1 Preparación de los complejos metálicos de curcumina
Los complejos ML 2 (M: Cu2+, Zn2+, Ni2+, Mg2+; L: curcumina), fueron preparados mediante una reacción entre la curcumina con las correspondientes sales metálicas (Cu(CH3COO)2, Zn(CH3COO)2, MgCl2, NiCl2). Se pesa 10 mmol de curcumina, se disuelve en 50 mL de etanol en agitación constante a 30°C, luego a temperatura ambiente se agrega 5 mL de NaOH 0,1N para ajustar el pH de la solución de la curcumina a 7,5-9,5 y precipitar los complejos metálicos y finalmente, se agrega gota a gota (5 mmol) de la respectiva sal metálica disuelto en 20 mL de etanol. La mezcla se agita a temperatura ambiente durante 3 horas. El precipitado se filtra y se lava con agua luego con etanol y finalmente el compuesto húmedo se seca a 70-80°C.
El método de las variaciones continuas (Angelici, 1979), nos permite determinar la relación estequiométrica metal: ligando en el complejo preparado, de acuerdo con el procedimiento 3.2 Determinación de la relación metal ligando por el método de Job.
La reacción de formación del complejo es: M + nL ⇆ MLn, donde M: cobre(II), zinc(II), magnesio(II), níquel(II), L es el ligando (L: curcumina). Para aplicar el método de las variaciones continuas se prepararon una serie de soluciones manteniendo constante la concentración total del ligando más el ion metálico:(CT=CM+CL=constante) mientras se varía la fracción molar del ligando (XL = CL/CT) entre 0 y 1, según propone Angelice (1979).
Técnicas de Caracterización
Para conocer la naturaleza del enlace de la curcumina y sus complejos (cobre(II), zinc(II), magnesio(II), níquel(II)), se han utilizado diferentes técnicas espectroscópicas, tales como espectroscopia de absorción UV-Visible en un equipo Genes ys 10S UV/Vis Thermo Fisher Scientific, espectroscopia de resonancia magnética nuclear de la Universidad de Málaga España, utilizando un equipo espectrómetro de RMN 400 Plus Avance III Bruker, (en el caso del complejo de cobre(II) no se utilizó la espectroscopia de resonancia magnética nuclear por tratarse de un complejo paramagnético); ESCA (XPS), en un espectrómetro PHI 5000 Versa Probe II (Universidad de Málaga España), espectroscopia infrarroja marca Shimadzu, modelo IR affinity y los espectros de masas en un equipo acoplado ICPMS/MS Agilent 8900 de la Universidad de Burgos España.
2.3 Ensayo de actividad antibacteriana
Las actividades antibacterianas in vitro de la curcumina y sus complejos de magnesio, zinc, y cobre, fueron estudiados por el método Kirby-Bauer o método de difusión en Agar (Bauer et al., 1966 ) (no se trabajó con níquel por su baja solubilidad en el solvente utilizado). Las cepas elegidas fueron las Escherichia coliG (-) con cepa tipo ATCC 25922, y Staphylococcus aureus G (+) con cepa tipo ATCC 25923. Se prepararon pequeños trozos circulares de papel filtro de 6 mm de diámetro para rodajas bacteriostáticas.
La curcumina y sus complejos se disolvieron en 10 mL de DMSO (1%) para obtener concentraciones de 1x108UFC/mL (UFC: estándares de McFarland). Se tomaron 0.5 mL de las muestras homogenizadas y se impregnó cada disco con la concentración al 100%, 75%, 50% y 25% de curcumina y sus complejos durante 24 horas.
3. RESULTADOS Y DISCUSIÓN
Los complejos se prepararon por reacción etanólica de curcumina con soluciones del correspondiente ion metálico (Cu(CH3COO)2, Zn(CH3COO)2, MgCl2, NiCl2). Cada complejo se preparó en la relación molar 1:2 (metal: ligando) obteniéndose complejos metálicos del tipo ML 2 donde (M: Cu2+, Zn2+, Mg2+, Ni2+, L: curcumina). Los rendimientos obtenidos son buenos: curcumina-cobre 81%, curcumina-zinc 85%, curcumina-níquel 73% y curcumina-magnesio 83%. Todos los complejos son estables a temperatura ambiente y su punto de fusión es mayor a 184°C, todos los complejos son solubles en DMSO y etanol (excepto el complejo de níquel que es parcialmente soluble). Los complejos fueron caracterizados por sus espectros de masas, UV-Visible, Infrarrojo, Resonancia Magnética Nuclear (1H-RMN, 13C-RMN y espectros bidimensionales), espectros XPS C1s, XPS O1s, XPS Zn2p3/2, XPS Ni2p3/2, XPS Mg2p3/2 y XPS Cu2p3/2, que confirman que los complejos tienen una relación metal ligando (1:2) ML 2 .
3.1 Determinación general del máximo de absorción de los complejos de cobre(II), níquel(II), magnesio(II) y zinc(II )
Las soluciones en etanol de los complejos metálicos presentan dos bandas principales de absorción de transición π-π* a 428 y 435nm (níquel); 426 y 449nm (cobre); 429 y 439nm (magnesio); 432 y 441nm (zinc). Si comparamos con el espectro de la curcumina se observa un desplazamiento entre (7 y 23nm), lo que indica la participación del grupo carbonilo de la curcumina en la formación de los diferentes complejos metálicos, la variación del máximo de absorción de curcumina y las dos bandas que presentan los diferentes complejos depende de la naturaleza del ion metálico (Mn+). Estos valores son consistentes con los observados en estudios similares (Subhan et al., 2014).
3.2 Determinación de la relación metal-ligando por el método de Job
Para determinar la relación molar metal-ligando por el método espectrofotométrico de las variaciones continuas de JOB, se siguió el procedimiento propuesto en la literatura (Angelice, 1979), que consiste en realizar las mediciones de las absorbancias de cada una de las mezclas de la serie de soluciones preparadas. Las mediciones se realizaron manteniendo fija la longitud de onda del máximo de absorción de la curcumina (486 nm) y de cada complejo metálico estudiado: curcumina-zinc (λmax = 432 y 441 nm); curcumina-níquel (λmax = 428 y 435 nm); curcumina-magnesio (λmax = 429 y 439 nm) y curcumina-cobre (λmax = 426 y 449 nm), que permitió graficar la absorbancia versus fracción molar del ligando. La relación molar metal: curcumina se obtiene del gráfico Absorbancia (Abs) versus fracción molar de la curcumina (XL), la fracción molar del ion metálico (XM) se obtiene considerando la siguiente ecuación: XM = 1 - XL. Gráficamente se determinó el máximo de absorción del complejo, cuyo valor corresponde al punto donde se cortan las dos pendientes definidas en la curva graficada (Abs versus XL) para cada complejo, la fracción molar de la curcumina que corresponde a esta absorbancia máxima obtenida para cada complejo (M: Cu2+ Zn2+, Mg2+, Ni2+) es XL = 0,67 y XM =0.33 para los iones metálicos. La relación molar ligando/metal (1:2) ML2, se obtiene considerando la relación de fracciones: n=(Xcurc./ XM 2+).
3.3 Espectro FT-IR de los complejos cobre(II), níquel(II), magnesio(II) y zinc(II) con la curcumina
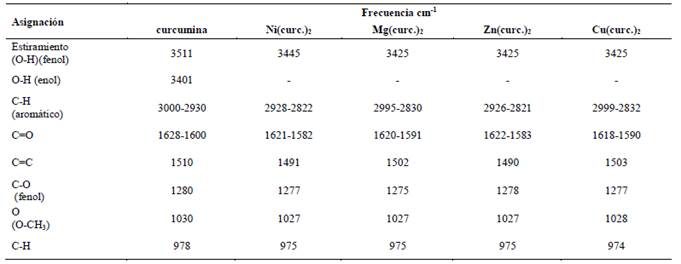
El espectro FT-IR de la curcumina presenta una señal aguda a 3511 cm-1 atribuido al grupo hidroxilo del fenol (Ar-OH) y otra señal más ancha a 3401cm-1, atribuido a la forma enólica (R-OH) de la curcumina. Sin embargo, al comparar estas señales con los espectros de cada complejo, se observan que solo presentan una sola señal de banda ancha que corresponde al grupo hidroxilo del fenol a longitudes de onda más bajas: níquel: Ar-OH 3445 cm-1; cobre, magnesio y zinc: Ar-OH 3425cm-1. La ausencia de la señal (R-OH) en los complejos indica el reemplazo del protón enólico por el metal en la formación del complejo (Nakamoto, 2006). El espectro IR del ligando curcumina mostró señales de estiramiento (C = O) en 1628 cm-1 y la señal de la forma tautomérica enólica (C = C) a 1600 cm-1, estos datos son muy similares a lo encontrado por otros autores (Angulo-Cornejo, 1986). En los espectros de los complejos metálicos, estas señales se muestran con un desplazamiento a menor energía, indicando que estos grupos están involucrados en la unión con el ion metálico: níquel: C=O 1621cm-1, C=C 1582cm-1; cobre: C=O 1618 cm-1, C=C 1590 cm-1; magnesio: C=O 620cm-1, C=C 1591cm-1; zinc: C=O 1622cm-1, C=C 1583cm-1. La señal IR que corresponde al grupo CH=CH, en el ligando se observa a 1510cm-1 y en el caso de los complejos se muestra el desplazamiento de esta señal hacia campos más altos: níquel: 1491cm-1; magnesio: 1502cm-1; zinc: 1490cm-1; cobre: 1503cm-1, debido a que el carácter π del doble enlace disminuye por la influencia del enlace con el metal (L-M).
Esto sugiere que, en la formación de los complejos, el ligando se coordina con los iones metálicos a través del grupo C = O. Los detalles de las principales asignaciones de las absorciones para cada uno de los complejos se resumen en la Tabla 1.
3.4 Espectros de resonancia magnética nuclear ( 1 H-RMN, 13 C-RMN, COSY, HMQC Y DEPT135) de los complejos metálicos de níquel(II), zinc(II) y magnesio(II)
Las señales de 1H-RMN del complejo curcumina-magnesio se observan mucho más desplazados a campos más altos en comparación con la curcumina, se muestran las señales: H1 metino: 5,58ppm; CH3O: 3,8 ppm; Ar-OH: 9,40 ppm.
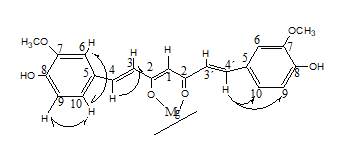
En el espectro COSY del complejo curcumina-magnesio en DMSO deuterado, se observa que el protón H3 está acoplado con el protón H4; (curcumina-magnesio; H3: 6,61ppm / H4: 7,29ppm) lo que confirma que estos son protones vecinos, si lo comparamos con el espectro del ligando (Grabner & Modec, 2019; Payton et al., 2007) en DMSO (curcumina; H3: 6,73ppm / H4: 7,55ppm), se observa el desplazamiento químico de las señales, este comportamiento es coherente con lo encontrado en el espectro IR del complejo para la señal del grupo CH=CH que se desplaza a 1502cm-1 respecto a la señal observada en el ligando 1510cm-1. El protón H9 (6,76ppm) está acoplado con H10 (6,99ppm), lo que indica que H9 y H10 son protones vecinos. En el espectro también se observa que el protón H9 está acoplado a más de un enlace con un protón que está desplazado a 7,44ppm. Posiblemente este protón corresponda al grupo H4', de aquí deducimos que los protones H4 y H4' no son equivalentes tal como se observa en el espectro COSY del complejo con más claridad debido a que son próximos al grupo aromático. Los desplazamientos químicos de los protones H3 y H3' son muy cercanos que no se pueden distinguir y son observados como una señal única.
La señal de H4' es un doblete de menor intensidad que el doblete H4 debido a que el acoplamiento de este protón con H9 está influenciado por la deslocalización de los electrones en el anillo quelato (Figura 2). La señal singlete en el espectro COSY corresponde al acoplamiento a más de un enlace entre los protones H6 (7,19ppm) y H10(6,99ppm), respectivamente. El desplazamiento químico del protón H3, H4, H6, H10 y H1 se encuentran a campos altos debido a la influencia del metal coordinado que forma un anillo quelato de 6 miembros.
En el espectro 1H-RMN del complejo curcumina-níquel, la señal que corresponde al protón H1(5,57ppm, metino), muestra un desplazamiento a campos altos en comparación con lo observado en el ligando (6,07ppm metino), el desplazamiento de la señal es debido al desplazamiento de la densidad electrónica hacia el centro metálico en el complejo, a 3,89ppm se muestra la señal del grupo CH3O, el grupo OH es observado a 9,5ppm. En el espectro COSY del complejo curcumina-níquel en DMSO deuterado se observa que el protón H3(6,67ppm) está acoplado con H4 (7,41pmm), lo que confirma que estos son protones vecinos. Estos desplazamientos químicos son importantes si lo comparamos con el espectro del ligando en DMSO; por ejemplo, el protón H3 que es observado a 6,73 ppm en el ligando se desplaza a 6,67 ppm en el complejo de níquel y la señal del protón H4 que aparece a 7,55ppm en el ligando, es observada a 7,41 ppm en el complejo. Este comportamiento es coherente con lo encontrado en el espectro IR del complejo para la señal del grupo CH=CH que se desplaza a 1491 cm-1 respecto a la señal observada en el ligando 1510cm-1. En el espectro COSY del complejo de níquel las señales de H3 y H4 aparecen superpuestas con H3' y H4' respectivamente, debido a la influencia del anillo quelato que se forma con el metal. La estabilidad del complejo de níquel se ve favorecido por la interacción de los oxígenos (bases duras) con el metal (Angulo-Cornejo & Beyer, 2010).
Los protones aromáticos del complejo curcumina-níquel presentaron un ligero desplazamiento con respecto al espectro de la curcumina. Así por ejemplo los protones H9 (6,77ppm, doblete) que están acoplados con H10 (7,06ppm, doblete), se muestran ligeramente desplazados respecto a la señal de la curcumina H9 (6,8ppm, doblete) y H10 (7,13ppm, doblete).
En el espectro 1H-RMN del complejo curcumina-zinc, la señal que corresponde al protón metino (H1) se observa a 5,57pmm, la señal está desplazada a campos altos porque el zinc genera una modificación química en el complejo, en comparación con la señal observada del protón metino de la curcumina a (6,07ppm). El grupo CH3O se muestra a 3,88ppm y la señal del grupo OH del fenol del complejo curcumina-zinc se observa a 9,5ppm. Estos resultados son muy similares a los reportados para el complejo penta coordinado de zinc(II) con ligandos mixtos carboxilato monodentado y los quelantes curcuminato y 2, 20-bipiridina (Grabner & Modec, 2019).
En el espectro COSY del complejo curcumina-zinc en DMSO deuterado se observa que el protón H3(6,66ppm) está acoplado con H4 (7,40pmm), lo que confirma que estos son protones vecinos. Si lo comparamos con el espectro del ligando en DMSO; por decir el protón H3 que es observado a 6,73 ppm en el ligando se desplaza a 6,66 ppm en el complejo de zinc y la señal del protón H4 que aparece a 7,55ppm en el ligando, es observado a 7,40 ppm en el complejo.
Como en el caso de los otros complejos, este comportamiento es coherente con lo encontrado en el espectro IR del complejo de zinc, para la señal del grupo CH=CH que se desplaza a 1490cm-1 respecto a la observada en el ligando 1510 cm-1. El protón H9 (6,76ppm) está acoplado con H10 (7,05ppm), lo que indica que H9 y H10 son protones vecinos. En el espectro también se observa que el protón H9 está acoplado a más de un enlace con el protón H (7,48ppm, posiblemente este protón corresponda al grupo H4'). Queda claro que el H4 y H4'no son equivalentes, su desplazamiento químico es observado en el espectro COSY del complejo con más claridad debido a que son próximos al grupo aromático, en cambio H3 y H3' tienen un desplazamiento químico muy aproximado.
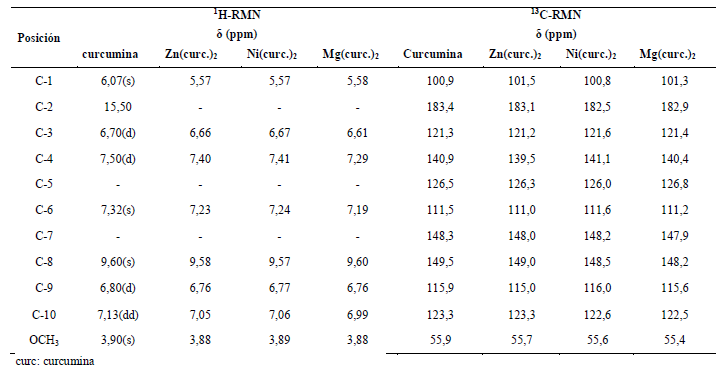
En el espectro de 13C-RMN (Tabla 2) de los complejos, todos los carbonos tuvieron una pequeña variación en comparación con la curcumina. Los valores asignados a cada señal están respaldados por los espectros HMQC al igual que los espectros DEPT-135, demuestran que en la estructura de los complejos no existe el grupo CH2, confirmando de esta manera que los complejos se formaron con el ligando curcumina de estructura enólica (Jiang, et al., 2011). La Tabla 2, resume los resultados obtenidos en los espectros RNM unidimensionales.
Tabla 2 Análisis por RMN Unidimensional de la curcumina y los complejos (níquel, zinc y magnesio). curc: curcumina
3.5 Espectrometría de masas de los complejos metálicos de cobre(II), zinc(II), magnesio(II) y níquel(II)
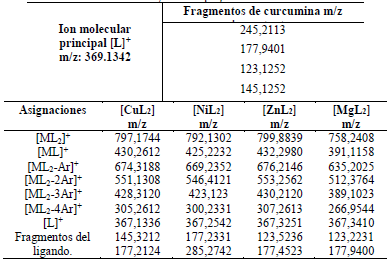
Los complejos metálicos de curcumina fueron caracterizados por sus espectros de masas ESI+ (m/z), los cuales mostraron picos correspondientes a los iones moleculares de cada complejo; ((MgL2)+ = 758,2408uma), ((NiL2)+ = 792,1308uma), ((CuL2)+ = 797,17448uma), ((ZnL2)+ = 799,8839uma) que confirman la formación de cuatro complejos quelatos de la curcumina con cobre(II), níquel(II), magnesio(II) y zinc(II): Bis(curcuminato)cobre(II), Bis(curcuminato)níquel(II), Bis(curcuminato)magnesio(II) y Bis(curcuminato)zinc(II), unidos a través de los dos oxígenos de cada molécula de curcuminato.
También se identificaron picos que corresponden a la eliminación sucesiva de grupos arilo (Ar)+ en los complejos metálicos de cobre, zinc, magnesio y níquel. Así mismo, se han identificado algunos fragmentos derivados del complejo y del ligando. En la Figura 3, se observan los principales fragmentos de masa que han sido identificados, en el espectro de masas del complejo de curcumina-cobre.
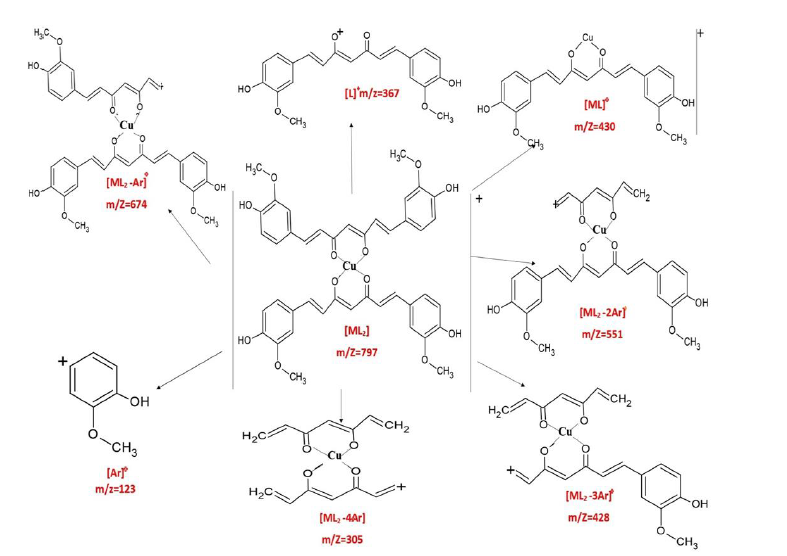
Figura 3 Algunos fragmentos identificados en el espectro de masas ESI+ (m/z) del complejo curcumina-cobre.
3.6 Espectros de rayos-X (XPS) de los complejos de cobre(II), níquel(II), magnesio(II) y zinc(II)
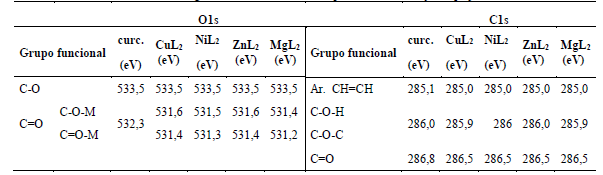
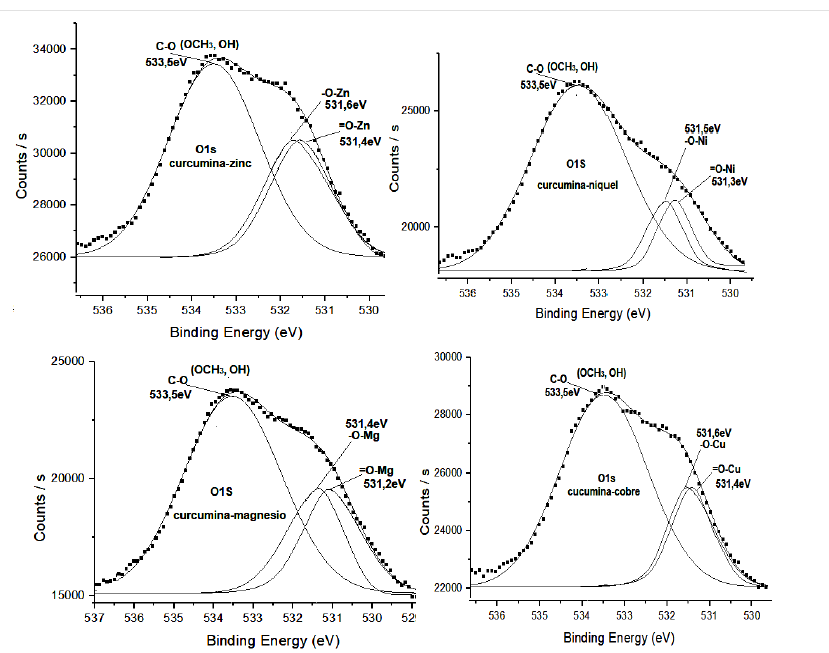
En la Figura 4, se observan los espectros XPS O1s de los complejos de cobre, níquel, magnesio y zinc, en el que se observó una señal intensa a 533,5eV, que corresponde al enlace (C-O) del (OCH3, OH) que es similar a la observada en la curcumina (Tabla 4 ). En los espectros XPS O1s de los complejos metálicos con la curcumina, también se observaron dos señales muy cercanas en energía, una que corresponde al grupo C-O-metal (531,2 eV; curcumina-Mg), (531,3 eV; curcumina-Ni), (531,6 eV; para curcumina-M; M= Cu y Zn) y la otra señal que corresponde al Grupo C=O-metal. (531,4 eV; curcumina-Cu), (531,2 eV; curcumina-Zn), (531,3 eV; para curcumina-M; M= Mg y Ni), estos valores de energía son similares a los observados por otros autores para compuestos similares (Angulo et al., 2000; Moulder et al., 1992; Lino-Pacheco, 2022). En la curcumina solamente se observa una señal a 532,3 eV; lo que indica que en el estado sólido la forma predominante de la curcumina es la forma cetónica, en cambio en el complejo (preparado en solución de etanol) se forma el enlace con el metal a través del oxígeno C-O y C=O, por deprotonación del OH (de la forma enólica).
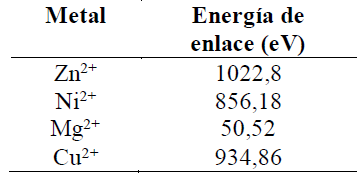
El espectro XPS C1s (Tabla 4) de los complejos de cobre, níquel, magnesio y zinc muestran dos señales muy similares a la encontrada en la curcumina (grupo bencénico y C=C; 285,1eV), (C-O-H, C-O-C; 286,0eV). En los complejos la señal intensa corresponde al enlace (grupo bencénico y C=C) (285,0 eV; para curcumina-M; M= Cu, Zn, Mg y Zn), la otra señal de baja intensidad corresponde al enlace (C-O-H, C-O-C), (285,9 eV; para curcumina-M; M= Cu , Mg), (286,0 eV; para curcumina-M; M= Ni y Zn). No hay cambios significativos en los espectros XPS C1S de los complejos, por tanto, la unión del metal con el ligando no involucra al carbono directamente. La señal de C═O, se observa a 286,5eV para todos los complejos (Cu, Zn, Ni y Mg). Se encontró que la energía del grupo C═O se desplaza alrededor de 0,3eV comparado con la señal del ligando (C=O; 286,8eV), que demuestra la participación del resto C═O en la unión de la curcumina con los metales (Tabla 4). Estudios similares fueron observados en compuestos equivalentes (Angulo et al., 2000). En la Tabla 5, se asignan las energías de enlace (eV) observados en los espectros XPS Cu2p3/2 (934,86eV), XPS Mg 2p3/2 (50,52eV), XPS Ni2p3/2 (856,18eV) y XPS Zn2p3/2 (1022,8eV) que confirma la presencia de los iones metálicos en su estado de oxidación 2+, según de reportes de la literatura similares (Angulo et al., 2000; Moulder et al., 1992; Lino-Pacheco, 2022).
Tabla 5 Energías de enlace obtenidos de los espectros XPS Zn2p3/2, XPS Ni2p3/2, XPS Mg2p3/2 y XPS Cu2p3/.
3.7 Ensayo de actividad antibacteriana de la curcumina y sus complejos de zinc, magnesio y cobre
Las actividades antibacterianas in vitro de la curcumina y sus complejos se estudiaron a través del método Kirby-Bauer (método de difusión en Agar) (Bauer et al., 1966 ). La eficacia antimicrobiana se mide en función del crecimiento en mm de zonas de inhibición alrededor de cada pocillo, utilizando como blanco pocillos de 6mm, como control se utilizó el antibiótico gentamicina un poderoso agente antibacteriano.
Se prepararon diferentes concentraciones (100%, 75%, 50% y 25%) de curcumina para evaluar su actividad contra Escherichia coli (bacteria gramnegativa) con cepa tipo ATCC 25922 y Staphylococcus aureus (bacteria grampositiva) con cepa tipo ATCC 25923. Los resultados mostraron que la curcumina presenta actividad, frente a Escherichia coli a las concentraciones de 100% y 75%, los halos de crecimiento de inhibición fueron: 10mm, 100% y 9mm, 75%, no se observa actividad a 50% y 25%, porque los halos de inhibición se mantienen en 6mm, frente a Staphylococcus aureus la curcumina presenta actividad a las diferentes concentraciones, se observa un crecimiento en el diámetro del área de inhibición de 11mm, 100%; 10mm, 75%; 9mm, 50% y 8mm, 25%, estas propiedades antimicrobianas han sido observadas en otras investigaciones (García et al., 2017).
Se prepararon complejos de curcumina con metales zinc, cobre y magnesio en DMSO a las mismas concentraciones de: 100%, 75%, 50% y 25% para evaluar la actividad antimicrobiana frente a las mismas cepas de bacterias. Escherichia coli, con cepa tipo ATCC 25922, Staphylococcus aureus con cepa tipo ATCC 25923, los resultados mostraron que los complejos metálicos de curcumina no presentan actividad frente a Escherichia coli. No existe formación de halo de inhibición en ninguna de las concentraciones, no hay variación del diámetro del pocillo de los complejos porque se mantiene en 6mm. ContraStaphylococcus aureus a las concentraciones de (100%, 75%, 50% y 25%), el complejo curcumina-cobre presenta actividad frente a Staphylococcus aureus a las concentraciones de: 8mm, 100%; 8mm, 75% y 7mm, 50% en comparación con la curcumina, a la concentración de 25% este complejo no presenta actividad no hay variación del halo de inhibición y se mantiene en 6mm. La actividad antibacteriana del complejo curcumina-magnesio, resulto positiva frente a Staphylococcus aureus a las concentraciones de: 9nm, 100%; 9nm, 75%; 8nm, 50% y 7nm, 25%, la actividad fue menor en comparación con la curcumina. El complejo curcumina-zinc mostró actividad frente a Staphylococcus aureus a las concentraciones de: 11mm, 100%; 10mm, 75%; 11mm, 50% y 10mm, 25% en comparación con la curcumina libre este complejo es mucho más eficaz al 50% y 25%, a las concentraciones de 100% y 75% prácticamente son similares, lo que demuestra que el complejo curcumina-zinc es mucho más eficaz a bajas concentraciones con relación a la curcumina.
3.8 Estudio computacional de la reactividad del ligando curcumina
Los cálculos se realizaron con el programa computacional Gaussian 09. Rev. A02, a nivel DFT, usando como función base 6-31G (d,p), juntamente con el funcional híbrido de correlación e intercambio B3LYP para optimización de la geometría molecular y la determinación de las energías moleculares, energías HOMO y LUMO, así como los descriptores de reactividad globales de dureza (η), blandura (σ), potencial químico electrónico (µ) y electrofilicidad (w).
En la determinación de los sitios con más probabilidad de reacción, se utilizó la función de Fukui que se calcularon a partir de las cargas Hirshfeld que se han usado con éxito para describir estas funciones condensadas (Ayers et al., 2002) partiendo de las estructuras optimizadas anteriormente y usando la función base difusa 6-31G ++(d,p) con el funcional híbrido de correlación e intercambio B3LYP. Se puede observar que tanto en la forma ceto como en la forma enol los puntos de coordinación frente a iones metálicos se encuentra en los átomos de oxígeno según el análisis de FUKUI de ambas formas (Figura 5). Los valores en rojo muestran los átomos más susceptibles a sufrir un ataque electrofílico de los iones metálicos, es decir estos átomos tienen mayor probabilidad de unirse a los cationes metálicos (electrófilos).
Forma enólica: (f+nucleofílica O1:0.318, O2: 0.184, O3: 0.481, O4:0.366, O5: 0.35, O6: 0.356) (f-elecleofílica O1:0.209, O2: 0.123, O3: 0.408, O4:0.349, O5: 0.36, O6: 0.364)
Forma cetólica: (f+nucleofílica O1:0.069, O2: 0.075, O3: 0.024, O4:0.006, O5: 0.26, O6: 0.01) (f-elecleofílica O1:0.044, O2: 0.03, O3: 0.046, O4:0.02, O5: 0.066, O6: 0.033)
Sobre la estabilidad de los tautómeros termodinámicamente, podemos observar que la forma enólica (E=-1263,5640au) es ligeramente más estable que la forma cetónica (E=-1263,5584au). La dureza de la forma ceto es 1,815 eV y la dureza de la forma enol es 1,655 eV, lo que daría a entender que la forma ceto es menos reactiva que la forma enol.
CONCLUSIONES.
Se han preparado complejos de curcumina en la relación estequiométrica metal/ligando (1:2) ML2, con los metales cobre(II), magnesio(II), zinc(II) y níquel(II). En estos complejos, la curcumina actúa en su forma enólica, la que se desprotona para unirse al ion metálico formando cada una un anillo quelato de 6 miembros a través de 2 oxígenos que provienen de la forma enólica.
De acuerdo con los resultados del estudio de resonancia magnética nuclear, se concluye que los complejos de níquel(II), zinc(II) y magnesio(II) son diamagnéticos. El complejo de níquel(II) es consistente con una estructura cuadrada plana de acuerdo con la Teoría del campo de los ligandos (Angulo-Cornejo & Beyer, 2010).
La propuesta computacional del análisis de FUKUY, confirma los resultados experimentales, en el que se evidencia el ataque electrofílico de los iones metálicos a los dos oxígenos de cada curcuminato.
La actividad antimicrobiana de los complejos ha sido evaluada frente a bacterias Escherichia coli (bacteria gramnegativa) y Staphylococcus aureus (bacteria grampositiva), los resultados revelan que todos los complejos presentan actividad antibacteriana frente al Staphylococcus aureus. Se destaca el complejo de curcumina-zinc por presentar mayor actividad biológica frente a esta bacteria a bajas concentraciones (25 y 50%) comparado con los otros complejos y con la curcumina libre.