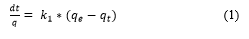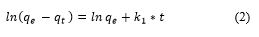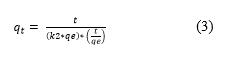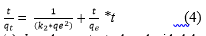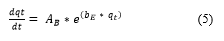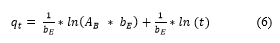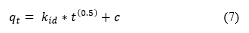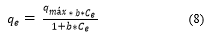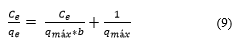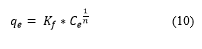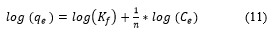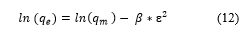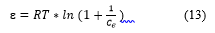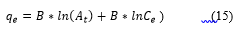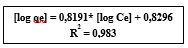El Perú es por excelencia un país minero, y esta actividad económica importante se viene incrementando considerablemente en recientes años debido a ampliaciones de operación y la ejecución de nuevos proyectos. El impacto por contaminación de suelos y aguas se debe principalmente a la presencia de metales pesados originados tanto por el drenaje ácido de la mina como por el agua que se infiltra en la roca estéril en los vertederos de relaves que lixivian los metales pesados que contienen: cobre, mercurio, cadmio, plomo, hierro, etc. Estos elementos se transportan a través de la escorrentía y, en algunos casos; se vuelven a depositar a grandes distancias de la fuente de contaminación. Diversos metales pesados como: mercurio, cromo, cadmio, arsénico, níquel y plomo, se encuentran entre los contaminantes mineros y/o industriales más peligrosos. Su toxicidad, persistencia y acumulación en los organismos vivos tienen un impacto negativo en el medio ambiente y la salud (Kalak et al., 2019).
El plomo viene a ser uno de los metales pesados más comunes y tóxicos en aguas residuales de la industria y/o mineras. Procesos como la minería, galvanización, metalurgia industrial, fabricación de baterías, pinturas, cerámicas, municiones, tuberías de plomo, etc. liberan ingentes cantidades de este metal pesado al medio ambiente (Ahmad et al., 2017). Es conocido los graves efectos sobre el sistema nervioso, reproductivo y circulatorio, los riñones y el hígado en humanos, principalmente en los niños que son los más susceptibles a la intoxicación. Se han desarrollado diferentes tecnologías para minimizar su presencia en aguas que incluyen la precipitación, intercambio iónico, ósmosis inversa, coagulación, electrodiálisis, ultrafiltración, etc. (Jiménez et al., 2017). Sin embargo, muchas de éstas requieren grandes cantidades de energía en su proceso, lo cual los convierte en ineficientes, y, por otro lado, ninguno es capaz de eliminar su presencia por completo (Ullah et al., 2020). La tecnología de la adsorción mediante zeolita de origen natural o sintético para eliminar metales pesados, resulta ser una alternativa viable de gran interés técnico-científico debido a su selectividad, bajo costo, facilidad de uso, y alta eficiencia de adsorción (incluso cuando estos metales están en baja concentración) (Chisti, 2018). Debido a su pequeño tamaño de poro, la zeolita sintética del tipo Gis-NaP; posee una alta capacidad de intercambio catiónico y adsorción y es usada ampliamente en separación de gases, eliminación de metales pesados, amonio, elementos radiactivos, tratamiento de agua de mar, ablandamiento del agua, suavizante de agua en la industria de los detergentes.
El trabajo de investigación actual propone evaluar la capacidad de adsorción de Pb2+ de un material zeolítico sintético del tipo Gis-NaP obtenido como resultado del tratamiento hidrotermal de residuos de ladrillo con soluciones alcalinas de NaOH.
En una primera etapa, el producto zeolítico obtenido será analizado mediante difracción de rayos X para determinar sus fases cristalográficas presentes, los componentes químicos serán cuantificados empleando un espectrómetro de fluorescencia de rayos X (XRF), la capacidad de intercambio catiónico (CIC) será medida utilizando el método de doble intercambio catiónico, la identificación morfológica de los cristales formados serán observados por medio de un microscopio electrónico de barrido (SEM).
En una segunda etapa, se evaluará su capacidad de adsorción en función del tiempo y a concentración variable. Los datos experimentales obtenidos se evaluarán con los modelos cinéticos de Pseudo-primer orden, Pseudo-segundo orden, Evolich y Difusión intrapartícula.
El mecanismo de adsorción será evaluado mediante las isotermas de Langmuir, Freundlich, Dubinin-Radushkevich y Tenmkin.
2. METODOLOGÍA
2.1 Obtención de zeolita Gis-NaP
La obtención de zeolita sintética se realizó mediante tratamiento hidrotermal de residuos de ladrillo molido con un tamaño de partícula igual a 100 micras bajo las siguientes condiciones experimentales: temperatura de activación de 140ºC, tiempo de activación 7 horas, concentración de solución activante 2,0 M NaOH. Según Wang et al. (2017) quienes reportan haber obtenido zeolita NaP utilizando una temperatura superior a 100ºC y tiempo prolongado. Para todas las pruebas se mantuvo una relación sólido/líquido de 10,0 g/125,0 mL. El producto sólido obtenido se lavó varias veces con agua destilada y luego se secó por un periodo de 6 horas a 60ºC.
2.2 Técnicas Experimentales
El análisis de la composición química fue posible empleando un espectrómetro de fluorescencia de rayos X (XRF) S4 Explorer fabricado por Bruker AXS.
Para la identificación de los cristales zeolíticos formados se empleó un difractómetro de rayos X Siemens D 5000. Para el análisis morfológico, se utilizó un Microscopio Electrónico de Barrido (SEM) modelo Phillips XL-20 de FEI Company de alto vacío provisto con detectores de microanálisis SE y BSE.
El análisis cuantitativo de Pb2+ y Na+ se realizó utilizando un espectrómetro de adsorción ICP-OES (inductively coupled plasma optical emission spectometry) OPTIMA-2100-DV fabricado por Perkin Elmer.
2.3 Medición de la Capacidad de Intercambio Catiónico
La capacidad de intercambio catiónico (CIC) fue determinada empleando soluciones de acetato de sodio y acetato de amonio (Bhagwanjee et al., 2011). Una cantidad de material sólido se somete a un doble intercambio, primero con acetato de sodio 1,0N y luego con acetato de amonio 1,0N. La capacidad de intercambio catiónico se determina en base al contenido de Na+ intercambiado y expresado en meq/100g.
2.4 Pruebas de adsorción d Pb 2+
Las soluciones conteniendo cationes Pb2+ se prepararon a partir de Pb(C2H3O2)2.3H2O (99,9%). La cantidad de catión adsorbido por la zeolita se calcula basándose en la diferencia entre el contenido de catión en la solución inicial y final. Durante la realización de las pruebas, se agitaron los recipientes para mejorar el contacto entre la solución y el material de zeolita.
2.4.1 Adsorción en función del tiempo
Se utilizaron recipientes puestos en agitación moderada, que contenían 1 g de zeolita y 150 mL de solución con 1 090 mg/L de Pb2+ (concentración constante) y con un pH de 5,5. La toma de muestras de solución para análisis se llevó a cabo después de que el tiempo de contacto entre el sólido y el líquido fuera de 4, 8, 12 y 24 horas. Una vez completados los tiempos de contacto establecidos, se filtró y se tomaron 100 mL para realizar el análisis de Pb2+. Las pruebas se realizaron a temperatura ambiente.
2.4.2 Adsorción a concentración variable
Evalúa la capacidad de adsorción a altas y bajas concentraciones. En recipientes plásticos de 200 mL de capacidad, se colocaron 150 mL de solución de Pb2+ a concentraciones de 872, 436, 217,97, 109,00, 54,50 mg/L y 1 g de zeolita sintética. El tiempo de contacto se determinó en las pruebas en función del tiempo (8 horas). Al finalizar la prueba, se filtra y se toma 100 mL de solución para analizar contenido de Pb2+.
2.5 Cinética e Isotermas de Adsorción
Los parámetros y constantes de los modelos cinético e isotérmico aplicados se determinan por un método lineal, utilizando los valores de la capacidad de adsorción obtenidos a partir de datos experimentales y calculados mediante modelos Cinéticos: Pseudo-primer orden, Pseudo-segundo orden, Evolich, Difusión intrapartícula. Isotérmicos: Langmuir, Freundlich, Dubinin-Radushkevich y Tenmkin.
3. RESULTADOS Y DISCUSIÓN
Composición Química Zeolita Gis-NaP
En muestras de zeolita sintética, se realizaron análisis de caracterización química, cristalográfica, capacidad de intercambio y morfológica.
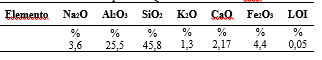
La Tabla 1 muestra los resultados del análisis químico reportado como óxidos presentes.
En comparación con el análisis del ladrillo molido en sus componentes: Na2O = 0,20, Al2O3 = 25,49, SiO2 = 63,89; se hace evidente un enriquecimiento en sodio y una disminución en silicio (Nowak et al., 2021). Un resultado similar en Na2O fue reportado por Ferrarini et al. (2016).
3.2 Difracción de rayos X
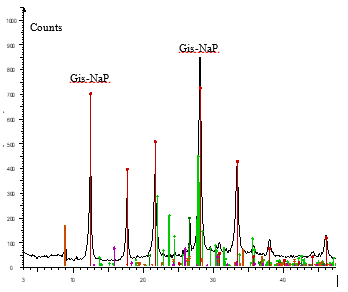
La Figura 1 presenta el espectro de difracción obtenido donde se evidencia picos característicos de formación de zeolita Gis-NaP, y una abundante cristalinidad. Las reflexiones en 2θ se dan a 8,9º, 12,5º, 17,65º, 21,65, 28,1º, 33,4º y 38,0º. Este resultado coincide con lo obtenido por otros autores (Araujo, et al., 2014) quienes reportan valores de 12,4º, 17,7º, 21,8º, 28,2º y 33,5º.
3.3 Capacidad de Intercambio Catiónico (CIC)
La CIC está asociada con la cantidad de zeolita formada y la gran cantidad de sitios de intercambio disponibles en la zeolita. El producto obtenido en condiciones de prueba 140ºC/2M/7 horas, presentó un valor de 163,50 meq/100g., valor superior a lo reportado para zeolita NaP del tipo Gis por tratamiento hidrotermal de zeolita natural (Utami et al., 2019).
3.4 Análisis morfológico por SEM
En la Figura 2, se muestran formaciones de cristales pseudo-esféricos o agregados de cristales con morfología de cactus/repollo de zeolita Gis-NaP (Ali et al., 2015). Se observa también que estas formaciones están constituidas por pequeñas placas con bordes bien definidos producto de una cristalización total.
3.5 Adsorción de cationes Pb 2+
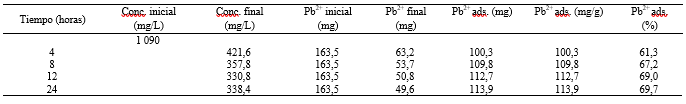
En la Tabla 2, se presenta los resultados de la prueba de adsorción de Pb2+ en función del tiempo.
Se aprecia claramente que después de 8 horas, la cantidad (mg de Pb2+ por gramo de zeolita Gis-NaP) de los cationes adsorbidos prácticamente no cambia.
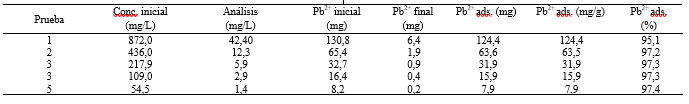
La Tabla 3 muestra los resultados de las pruebas de adsorción de Pb2+ a concentración variable y a un tiempo de contacto constante de 8 horas.
3.6 Cinética de Adsorción de cationes Pb 2+
Para comprender los mecanismos del proceso de adsorción, los datos experimentales obtenidos se evaluaron mediante los modelos cinéticos de Pseudo-primer orden, Pseudo-segundo orden, Evolich y Difusión intrapartícula.
La ecuación de pseudo-primer orden es expresada generalmente por la Ecuación (1):
Donde: q e y q t son la capacidad de adsorción en el equilibrio y a cualquier tiempo t en (mg/g), k 1 es la constante de velocidad de pseudo-primer orden, (min-1), t es el tiempo de adsorción (min). Linealizando queda según la Ecuación (2):
La cinética de pseudo-segundo orden resulta de modificar la ecuación de segundo orden y se puede obtener a partir de la Ecuación (3).
Linealizando resulta según la Ecuación (4):
Donde: q e y q t son la capacidad de adsorción en el equilibrio y a cualquier tiempo t en (mg/g), k 2 es la constante de velocidad de pseudo-segundo orden (g/g.min), t es el tiempo de adsorción (min).
El modelo de Evolich ayuda a simular la cinética de adsorción en fase líquida y se puede representar mediante la siguiente Ecuación (5).
Donde: q t es la capacidad de adsorción en cualquier tiempo t (mg/g), A 𝐵 y b E son los parámetros del modelo. El parámetro A 𝐵 representa la velocidad de adsorción inicial (mg/g·min) y el parámetro b E se relaciona con la superficie cubierta y la energía de activación por quimiadsorción (mg/g), t es el tiempo de adsorción (min). Linealizando resulta la Ecuación (6):
El modelo de difusión intraparticular se puede representar mediante la siguiente Ecuación (7):
Donde: q t es la capacidad de adsorción en cualquier tiempo t (mg/g), K id es la constante de velocidad de difusión intraparticular (mg/g·min-1/2), c es la constante que brinda información sobre el espesor de la capa límite (mg/g), t es el tiempo de adsorción (min).
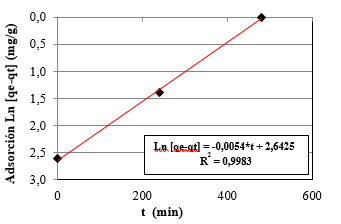
En la Figura 3, se muestra el gráfico correspondiente al modelo cinético de Pseudo-primer orden.
La Tabla 4 presenta los valores de las constantes relacionadas con los modelos cinéticos de adsorción y los respectivos coeficientes de correlación (R2) utilizando los valores experimentales en el equilibrio.
Como se muestra en la Figura 3, los datos experimentales se correlacionan perfectamente con el modelo cinético de pseudo-primer orden con un valor de R2 = 0,9983 describiendo mejor la cinética de adsorción. Para este caso de estudio, la adsorción del Pb2+ sobre la superficie de la zeolita Gis-NaP es muy rápida al principio y alcanza eficiencias de 61,3 y 67,2% en 4 y 8 horas de contacto con una velocidad de 0,012/min. (Tabla 4). Se puede asumir que cada catión de Pb2+ presente en la solución tiene asignado un sitio activo en la superficie de la zeolita sintetizada, y que la transferencia de masa es la etapa que controla el proceso de adsorción; por lo cual la velocidad de adsorción en función del tiempo es directamente proporcional a la diferencia entre la concentración del equilibrio de Pb2+ en solución y la concentración en la superficie de la zeolita (Kobayashi et al., 2020; Sánchez et al., 2018). El modelo pseudo-segundo orden tiene un R2 = 0,9970 pero su velocidad de adsorción (K2 = 0,001 g/mg*min.), es 12 veces menor que la del mecanismo de pseudo-primer orden.
La aplicación del modelo de difusión intraparticular, muestra una linealidad en el proceso de adsorción con un ajuste R2= 0,9800, y un valor de c = 100, 750 mg/g; que indica que existe la formación de una película de líquido gruesa que rodea a la zeolita. El Pb2+ difunde lentamente desde el exterior hacia el interior del adsorbente. El análisis del modelo Evolich evidencia un ajuste R2 = 0,8451 que es todavía una fuerte correlación con los valores experimentales, lo que implica que los sitios de adsorción aumentaron exponencialmente y supone una adsorción multicapa (Ayawei et al., 2017).
3.7 Isotermas de Adsorción
La evaluación de las isotermas de adsorción se centra en el análisis de la relación entre la cantidad de Pb2+ adsorbido por la zeolita Gis-NaP y la concentración en el equilibrio a una temperatura constante. Para el presente estudio, se usaron los modelos de Langmuir, Freundlich, Dubinin-Radushkevich y Tenmkin.
La isoterma de Langmuir se puede representar mediante la siguiente Ecuación (8):
Linealizando la expresión (8) se obtiene la siguiente Ecuación (9):
Donde: q e es el equilibrio alcanzado del adsorbato en el adsorbente (mg/g), q máx es la máxima capacidad de adsorción (mg/g), Ce es la adsorción en equilibrio del adsorbato en solución (mg/L), b energía relativa de adsorción (L/mg).
La isoterma de Freundlich se representa mediante la Ecuación (10):
La isoterma en su forma linealizada queda expresada por la Ecuación (11):
Donde: q e es el equilibrio alcanzado del adsorbato en el adsorbente (mg/g), C e es la adsorción en equilibrio del adsorbato en solución (mg/L), K f capacidad de adsorción del adsorbente (mg/g), n es la intensidad de adsorción.
La isoterma de adsorción de Dubinin-Radushkevich se expresa mediante la Ecuación (12).
Donde: 𝑞𝑚 es la capacidad de adsorción teórica (mg/g), β es la constante del modelo Dubinin-Radushkevich (mol2/kJ2), ε es el potencial de Polanyi con respecto a la concentración de equilibrio y se calcula mediante la Ecuación (13).
Donde: R es la constante universal de los gases (8,314 J/mol/K), T es la temperatura absoluta (K), C e es la adsorción en equilibrio del adsorbato en solución (mg/L).
La Ecuación (14) determina la energía libre E por molécula de adsorbato, y ayuda a distinguir entre la adsorción física y la química. Si el valor de E está entre 8 y 16 kJ/mol, la adsorción ocurre como un intercambio de iones y si E < 8 kJ/mol, el proceso de adsorción es físico.
La ecuación del modelo de Temkin es expresada mediante la Ecuación (15). La costante B puede ser determinada por la Ecuación (16):
Donde: T es la temperatura absoluta en grados Kelvin (K), R es la constante universal de los gases (8,314 J/mol/K), A t es la constante de equilibrio de la isoterma de Temkin (L/g), b T es la constante de la isoterma de Temkin, B es la constante asociada con el calor de adsorción (J/mol) (Hernández Soto del Valle, 2019).
La Figura 4 muestra el gráfico correspondiente al modelo de Freundlich.
En la Figura 4, se puede ver que los datos experimentales están perfectamente correlacionados con la isoterma de Freundlich mostrando un valor de R2 = 0,983. Es posible afirmar que la superficie de la zeolita sintética Gis-NaP presenta una superficie heterogénea y que posee sitios de adsorción con distintas afinidades. Primero, se ocuparán las posiciones de mayor afinidad y luego lo harán las restantes generando la formación de una multicapa (Abatal et al., 2019). Su capacidad máxima de adsorción, considerando su superficie heterogénea; es de 124,4 mg/g cuando se tiene una concentración en el equilibrio de 42,4 mg/L de Pb2+.
La Tabla 5 presenta los valores de las constantes relativas a las isotermas de Langmuir, Freundlich, Dubinin-Radushkevich y Temkin; con los respectivos coeficientes de correlación (R2) para los valores experimentales en el equilibrio.
La Tabla 5 muestra que el valor obtenido de 1/n = 0,82 se encuentra entre 0 y 1, indicando que existe una buena capacidad de adsorción de la zeolita Gis-NaP para el catión Pb2+. La relación entre el exponente de Freundlich (1/n = 0,82) y el factor de separación de Langmuir RL = 0,0004 y 0,00005, para las concentraciones iniciales de 54,5 y 872,0 mg/L de Pb2+ respectivamente, confirman la existencia de una buena afinidad y una naturaleza de adsorción favorable para Pb2+ (Zhang et al., 2020).
Tabla 5 Valores de parámetros de las isotermas de Langmuir, Freundlich, Dubinin- Radushkevich y Temkin y sus correspondientes coeficientes de correlación (R2)
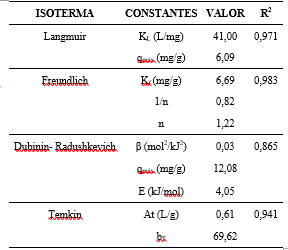
El coeficiente de correlación correspondiente a la isoterma de Temkin R2 = 0,941, indica que la distribución de energía de unión entre la zeolita y los cationes Pb2+ no es constante (Manzoor et al., 2019). La evaluación del comportamiento termodinámico del proceso de adsorción mediante la isoterma de Dubinin-Radushkevich revela un valor de E = 4,05 kJ/mol, indicando que el mecanismo de adsorción es por fisisorción (Lee et al., 2021). Para el caso del catión examinado, la adsorción es influenciada por su densidad de carga, su energía de hidratación y su radio iónico. Dado que el Pb2+ posee un radio iónico hidratado pequeño, ingresa fácilmente en los poros de la zeolita y alcanza los sitios intercambiables disponibles.
4. CONCLUSIONES
En este trabajo, la zeolita Gis-NaP obtenida por tratamiento hidrotermal de residuos de ladrillo con soluciones de NaOH, fue identificada físico-químicamente. La adsorción del material zeolítico por el catión Pb2+ es del orden de 124,4 mg/g (95,1%) para una concentración inicial de 872,0 mg/L, y de 7,9 mg/g (97,4%) para una concentración inicial de 54,5 mg/L. De acuerdo al análisis de los valores experimentales, el modelo de Pseudo-primer orden (R2 = 0,9983) describe mejor la cinética de adsorción. La velocidad de adsorción es proporcional a la diferencia entre las concentraciones de Pb2+ en solución y en la superficie de la zeolita.
El análisis de las isotermas de adsorción pone en evidencia que los resultados se ajustan perfectamente con la isoterma de Freundlich (R2 = 0,983). Por tanto, se puede considerar que esta isoterma es la que gobierna el proceso de adsorción de Pb2+ en la zeolita Gis-NaP. Los sitios activos de la zeolita Gis-NaP son energéticamente heterogéneos y presentan diferentes afinidades. La adsorción se inicia en los sitios activos con mayor afinidad y son ocupados por el catión Pb2+ formando una capa. Sin embargo, los sitios libres restantes interactúan con el Pb2+ por medio de fuerzas de wander walls y dan lugar a la formación de otras capas (multicapas). El valor de la constante 1/𝑛 de 0,82, indica un proceso de adsorción favorable de Pb2+ en la superficie de la zeolita Gis-NaP.