1. INTRODUCCIÓN
A nivel mundial la cobertura boscosa supera los 4 000 millones de ha, lo que es 31 % de la superficie total de la tierra (FAO, 2002; 2011), de los cuales los bosques tropicales representan aproximadamente el 10 %, distribuyéndose por más de 80 países en las zonas ecuatoriales de América, África y Asia (FAO, 1999a y 1999b). Los bosques muy secos tropicales en Venezuela cubren un área de regular extensión y están distribuidos por varios lugares en el norte del país, siendo sus extensiones más grandes, una faja este-oeste en los estados Falcón y Zulia (donde está ubicado el Jardín Botánico de Maracaibo), y al oeste y sur de Barcelona, en el estado Anzoátegui, que se extiende desde el nivel del mar hasta los 600 m de altura (Ewel y Madriz, 1968).
La marcada estacionalidad de las precipitaciones en Venezuela determina un período de sequía que afecta notoriamente la estructura, composición florística y funcionamiento de las comunidades boscosas (González, 2003). Estas comunidades son ampliamente conocidas en la literatura internacional como Bosques Tropicales Estacionalmente Secos o Bosques Secos Tropicales (Murphy y Lugo, 1986).
En el estado Zulia, los estudios florísticos de especies leñosas son pocos, por lo que se requiere la ampliación de dichos estudios a nivel regional y nacional, con la finalidad de obtener información detallada de las especies leñosas del bosque muy seco tropical, que permitan aportar conocimientos para la planificación de uso conservación, preservación y protección de estas especies.
Los bosques nativos de la región zuliana han pasado por procesos de trasformación y pérdida de una gran cantidad de ecosistemas forestales, debido al crecimiento demográfico y anárquico de las ciudades, agrícola, pecuaria, industrial, entre otros, aspectos que han favorecido la deforestación, los cambios en las precipitaciones (cantidad y distribución) y el aumento de la temperatura del ambiente, estos dos últimos asociados al fenómeno de El Niño (Ramírez et al., 2017).
La poca precipitación y el aumento de la temperatura también ocasionan la degradación del suelo y la reducción de la biodiversidad. Cabe destacar que existen pocas investigaciones en este tipo de bosques en Venezuela; es decir que no se cuenta con las bases apropiadas para conocer cómo se desarrollan estos ecosistemas (Figueroa, 2017).
El conocimiento de la estructura y composición florística del ecosistema de un bosque constituye el primer paso hacia el entendimiento de la dinámica ecológica del mismo, lo que a su vez es fundamental para comprender aspectos ecológicos y productivos, que se incluyen en el manejo sostenible de los bosques (Albesiano et al., 2003). Es por ello que, en este trabajo se describen la estructura y composición florística de los componentes leñosos del Bosque muy seco tropical del Jardín Botánico de Maracaibo.
2. MATERIALES Y MÉTODOS
2.1. Zona de estudio
2.1.1. Breve reseña histórica
Con miras de crear un reservorio de vegetación, el 9 de enero de 1973, el Botánico venezolano Dr. Leandro Aristeguieta, apoyado por el maestro paisajista brasilero Roberto Burle Marx, funda el Jardín Botánico de Maracaibo y asume el cargo como primer director, en el mismo año se inicia su construcción (1773-1983). Diseñado sobre la base de un bosque muy seco tropical conformado por especies nativas y exóticas, y conformado por un área típica de climas desérticos; un área con diferentes lagunas para representar la vegetación acuática; un espacio conocido como cuadro filogenético, el cual representa el estado evolutivo de las plantas; una estructura arquitectónica denominada “Orquidiario”; así como árboles de corteza ornamental de gran porte, dispersos en sus espacios paisajísticos y un área de reserva natural de la flora nativa del estado Zulia. En 1999 fue cerrado al público y abandonado en su totalidad. En septiembre de 2011, la junta directiva de la Fundación Jardín Botánico de Maracaibo, con el respaldo de instituciones públicas y privadas, iniciaron los trabajos de la restauración integral. Se logró su reapertura al público el 9 de noviembre de 2013 (Portillo y Pietrangeli, 2014).
2.1.2. Descripción del área de estudio
El estudio se realizó durante el período agosto 2018 - abril 2019, en los terrenos del Jardín Botánico de Maracaibo, ubicado en el municipio San Francisco, parroquia Marcial Hernández, avenida Manuel Belloso, cruce con calle 148 vía La Concepción, Maracaibo, estado Zulia, entre las coordenadas 09° 50’ N; 72° 01’ O y 10° 38’ N; 71° 38’ O.
Los registros de las variables climáticas de precipitación, evaporación y temperatura se obtuvieron de la estación meteorológica Maracaibo-Aeropuerto, por un período de diez años (2003 - 2012); los promedios mensuales aparecen en la Figura 1.
En el sector, el régimen pluviométrico tiene una distribución bimodal durante el año. Los picos máximos de precipitación ocurren desde mediados de abril hasta mayo y desde agosto hasta octubre, siendo periodos muy cortos de disponibilidad de agua en el suelo, mientras que el periodo seco es de casi nueve meses. Las precipitaciones mínimas mensuales promedian 6,4 mm, en febrero, y las máximas 157,6 mm, en octubre.
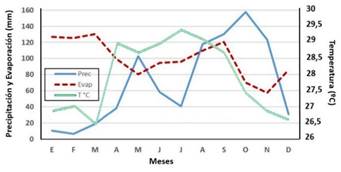
Figura 1 Distribución anual de la precipitación, evaporación y temperatura promedio (2003-2012) en la estación meteorológica Maracaibo-Aeropuerto. Fuente: Estación meteorológica Maracaibo-Aeropuerto (2003-2012)
La precipitación anual es de 835,5 mm, la temperatura varía entre 27,3 ºC y 29,4 ºC, con un promedio de 28,3 ºC. La evaporación promedio anual es de 1 195,1 mm (Figura 2) y la humedad relativa promedio de 76,7 %.
2.2. Métodos de muestreo
Para determinar la estructura y composición florística se aplicó la metodología de Gentry (1982), modificada por Aymard y Cuello (1995); se establecieron 10 parcelas de dimensiones 50 x 20 m (1 000 m2 o 0,1 ha), distribuidas al azar en el área boscosa de los terrenos del Jardín Botánico de Maracaibo. Cada uno de estos rodales, se dividió a su vez en 10 subparcelas de 10 x 10 m (100 m2). El trazado de las parcelas se realizó mediante la apertura de caminerías externas y cada 10 metros se establecieron los límites alineados con ayuda de una brújula, para luego realizar el tendido de cuerdas.
El censo de las especies se realizó dentro de cada subparcela y se midieron, identificaron y registraron todos los individuos leñosos enraizados (árboles, arbustos y lianas), con el perímetro a la altura del pecho (PAP) mayor o igual a 2,5 cm, lo que garantizó la inclusión de la mayor cantidad posible de individuos en la realización del estudio fitosociológico, siguiendo a Gentry (1982 y 1998).
El diámetro a la altura del pecho (DAP) se determinó mediante la relación del perímetro o circunferencia a esta altura (PAP) dividido por Pi (( =3,14159226), según la siguiente fórmula:
DAP = PAP/( (1)
El área basal (AB) se determinó con la ecuación:
AB = ( * (DAP)2 /4 (2)
2.3. Distribución de las parcelas
La distribución de las parcelas se ordenó de acuerdo con la forma del área boscosa y evadiendo las áreas muy intervenidas, de manera equitativa; mientras que la asignación de los nombres o códigos de las mismas se realizó secuencialmente, según el orden de registro, denotándolas como P1, P2, P3, hasta llegar a P10, según se muestra en la Figura 2.
El registro de los parámetros en cada parcela se llevó a cabo con una cinta métrica.
Las muestras botánicas vegetativas y reproductivas se recolectaron en el mismo sitio. Se identificaron las especies conocidas y a las demás se les asignó un código para su posterior identificación en el laboratorio. Los individuos censados en campo de las diferentes especies leñosas no identificadas, se marcaron con cintas de colores, con el objeto de retornar al sitio periódicamente y observar a la especie en periodo de floración y/o fructificación y de esta forma facilitar la identificación.
2.4. Identificación de muestras
El material botánico recolectado se procesó con el apoyo de técnicas clásicas de herborización (Cascante, 2008). La identificación se determinó siguiendo el sistema APG IV hasta el nivel de especie con el soporte de literatura especializada y claves taxonómicas, entre ellas: Catálogo de la Flora Vascular de Venezuela (Hokche et al., 2008), Los bosques secos de la costa oriental del lago de Maracaibo, estado Zulia, Venezuela (Figueroa, 2011), Algunas malezas de potreros en el municipio Machiques de Perijá, estado Zulia, Venezuela (Figueroa et al., 2018), Árboles Tropicales Ornamentales (Hoyos, 1992), Clave de las Familias de las Plantas Superiores de Venezuela (Badillo et al., 1985), Plantas comunes de Venezuela (Schnee, 1984), Florewing Plants of the Neotropics (Smith et al., 2004), Checklist of the Plants of the Guianas (Boggan et al., 1997), Preliminary Check List of the Plants of the Guiana Shield (Hollowel et al., 2001), y Diagnóstico Florístico de la Ciudad Universitaria de LUZ (Figueroa, 1998). También se consultó a especialistas regionales y nacionales, y se hizo una revisión y comparación crítica de las muestras recolectadas con las exsiccata depositadas en los herbarios de la Facultad de Agronomía de la Universidad del Zulia (HERZU) y del Museo de Biología de la Universidad del Zulia (HMBLUZ). Las listas de las especies se ordenaron alfabéticamente por familia y los nombres científicos se actualizaron de acuerdo con las bases de datos The Plant List (2013) y Stevens (2017).
2.5 Variables de estudio
Con los datos de densidad, cobertura y frecuencia absoluta, provenientes del censo del componente leñoso de cada una de las parcelas en estudio, se procedió a calcular las siguientes variables estructurales, según Curtis y Cottam (1962):
Densidad Relativa (abundancia relativa) = (N° de individuos de una especie (densidad absoluta) x 100 /Total de individuos de la muestra o total de la densidad absoluta. (3)
Cobertura Relativa (dominancia relativa) = (Área basal de la especie (cobertura absoluta) x 100 /Total área basal en la muestra o total de la cobertura absoluta. (4)
Frecuencia Relativa = (N° de subparcelas conteniendo la especie (frecuencia absoluta) x 100) /Sumatoria de todas las frecuencias o NI/ha de la especie. (5)
Índice de Valor de Importancia (IVI): (Densidad relativa + Cobertura relativa + Frecuencia relativa). (6)
Los valores de IVI, que oscilan entre 1 y 300, se usaron para determinar las especies de mayor importancia ecológica en cada rodal y comparar las parcelas.
Los valores del IVI se clasificaron según Figueroa (2011) de la siguiente manera: las especies con IVI entre 0 - 3 como especies raras, de 3 - 7 como especies de baja importancia, de 7 - 10 como especies de moderada importancia, 10 - 30 como especies codominantes, 30 - 60 como especies dominantes y >60 como especies muy dominantes.
3. RESULTADOS Y DISCUSIÓN
3.1. Inventario florístico del Jardín Botánico de Maracaibo
Los resultados obtenidos en la muestra de una hectárea de terreno del Jardín Botánico de Maracaibo, clasificado como bosque muy seco tropical, se registraron 50 especies leñosas, 42 géneros y 17 familias, representadas por 1 389 individuos por hectárea, todas del grupo taxonómico de las Dicotiledóneas (Tabla 1).
La familia dominante en el área estudiada fue la Fabaceae, al acumular 10 de las 50 especies (20 %), seguida por las Capparaceae con 8 especies (16 %), Cactaceae con 6 (12 %), Malvaceae con 5 (10 %), Boraginaceae con 4 (8 %), Bignoniaceae con 3 especies (6 %), se completó la población con tres familias con dos y ocho con una especie (Tabla 2).
Fajardo et al. (2005) mencionan que, en los bosques secos de Venezuela, las 10 familias de mayor relevancia son: Bignoniaceae, Boraginaceae, Capparaceae, Euphorbiaceae, Fabaceae, Flacourtiaceae, Malpighiaceae, Rubiaceae, Rutaceae y Sapindaceae. El bosque estudiado comparte nueve de ellas en orden de importancia, aunque cinco agrupan el 67 % de las especies registradas (Fabaceae, Capparaceae, Cactaceae, Malvaceae y Boraginaceae).
Tabla 1 Número de familias, géneros y especies del Jardín Botánico de Maracaibo
| FAMILIA | Géneros | Especies |
|---|---|---|
| Anacardiaceae | 1 | 1 |
| Bignoniaceae | 2 | 3 |
| Bixaceae | 1 | 1 |
| Boraginaceae | 1 | 4 |
| Burseraceae | 1 | 1 |
| Cactaceae | 6 | 6 |
| Capparaceae | 7 | 8 |
| Euphorbiaceae | 2 | 2 |
| Fabaceae | 9 | 10 |
| Malvaceae | 5 | 5 |
| Phytolaccaceae | 1 | 1 |
| Polygonaceae | 1 | 1 |
| Rhamnaceae | 1 | 1 |
| Rubiaceae | 1 | 2 |
| Sapindaceae | 1 | 2 |
| Vitaceae | 1 | 1 |
| Zygophyllaceae | 1 | 1 |
| Total: 17 | 42 | 50 |
Con los resultados obtenidos se evidencia que la zona estudiada tiene un número de especies leñosas muy por debajo de la cota reportada para un bosque seco tropical en Venezuela, que posee entre 110 y 170 especies y de 40 a 50 familias (González, 2003; Fajardo et al., 2005). Sin embargo, está más cercana a la registrada en la zona de protección y defensa del complejo petroquímico “El Tablazo”, donde Pietrangeli et al. (1997) censaron 79 especies, incluidas en 68 géneros y 33 familias, transición entre las zonas de vida bosque muy seco tropical y monte espinoso.
Zambrano y Fuenmayor (1977) identificaron un total de 32 familias incluyendo árboles, arbustos, lianas y especies herbáceas en el área del JBM. Sin embargo, la cota registrada en dicho estudio es superior a la reportada por Portillo y Pietrangeli (2014) en el mismo sistema boscoso, donde registraron cinco especies leñosas forestales agrupadas en cuatro familias: Bignoniaceae, Fabaceae, Cactaceae y Capparaceae; en su estudio establecieron tres parcelas de 0,1 ha y solo tomaron en cuenta las especies arbóreas con un DAP > 10 cm.
Posiblemente, en el trabajo de Portillo y Pietrangeli (2014) hubo una subestimación en el número de especies encontradas, debido a que solo se muestreó en una hectárea y la zona reconocida tiene características climáticas muy particulares, además de presentar fuertes signos de intervención antrópica, de las cuales las más perceptibles son la tala selectiva y los incendios forestales.
Los bosques muy secos tropicales son, en comparación con otro tipo de bosques tropicales, por lo general menos diversos florísticamente. Murphy y Lugo (1986) y Gentry (1995) han indicado que los rangos de riqueza en estos ecosistemas se mantienen entre las 30 y 90 especies por hectárea. Mientras que en Venezuela y particularmente en las comunidades forestales deciduas de la Costa Oriental de Lago de Maracaibo, estos números pueden ascender a 170 especies (Fajardo et al., 2005; Aymard et al., 2009; Figueroa, 2011; Pietrangeli et al., 2011).
Por otra parte, se confirma lo dicho por Gentry (1995), que las Fabaceae corresponden a una de las familias más dominantes en cuanto al número de especies en los bosques secos, incluso en bosques transicionales (húmedos-secos) como refiere Zamora (2010) en Costa Rica; además, que los bosques secos de Venezuela no son tan ricos en especies, géneros y familias en comparación con otros bosques descritos en otras regiones. Por ejemplo, Carrillo et al. (2007) reportaron 60 especies en el bosque seco tropical del cerro Tasajero, San José de Cúcuta, al norte del Departamento de Santander, Colombia.
El 72 % de las especies registradas (36 taxa) está contenida en seis familias: Fabaceae, Capparaceae, Cactaceae, Malvaceae, Boraginaceae y Bignoniaceae, se completa con tres familias con dos especies cada una con un 12 % y el restante 16 % está representado por ocho familias con una especie cada una (Tablas 1 y 2). Estas familias con bajo número de representantes contribuyen considerablemente con la diversidad de estos bosques secos como lo reportan Pietrangeli (2006) y Figueroa (2011).
De los 42 géneros registrados, los que agruparon mayor número de especies fueron: Cordia con 4, de la familia Boraginaceae, seguido de Handroanthus, Cynophalla, Caesalpinia, Randia y Meliccocus con dos especies cada uno, el resto fue representado solo por una especie. Estos resultados demuestran la gran diversidad que presentan estos bosques, producida por el alto número de géneros con bajo número de representantes.
En cuanto al número de géneros por familia, la Fabaceae fue la dominante en el área estudiada, al acumular 9 de los 42 géneros (21 %), seguida por las Cactaceae y Capparaceae con 7 (16 %) y Malvaceae con 5 géneros (12 %) (Tabla 2).
Tabla 2. Lista de especies leñosas del Jardín Botánico de Maracaibo
| FAMILIA | ESPECIE | NOMBRE COMÚN |
|---|---|---|
| Anacardiaceae | Astronium graveolens Jacq. | Gateado |
| Bignoniaceae | Handroanthus billbergii (Bureau & Schum.) Grose | Curarire |
| Handroanthus serratifolius(Vahl) S.O. Grose | Curarí | |
| Roseodendron chryseum(S. F. Blake) Miranda | Alumbre, Cañaguate, Puy | |
| Bixaceae | Cochlospermum vitifolium (Willd) Spreng. | Bototo, Carnaval |
| Cordiaceae | Cordia alba (Jacq.) Roem. & Schult. | Caujaro |
| Cordia alliodora (Ruiz & Pav.) Oken. | Pardillo, Mecoque | |
| Cordia curassavica (Jacq.) Roem. & Schult. | Basura prieta | |
| Cordia thaisiana G. Agostini | Pardillo negro | |
| Burseraceae | Bursera tomentosa (Jacq.) Triana & Planch. | Indio desnudo |
| Cactaceae | Acanthocereus tetragonus(L.) Hummelinck | Pitahaya |
| Cereus hexagonus (L.) Mill. | Cardón | |
| Cylindropuntia caribaea (Britton & Rose) F. M. Knuth. | Tuna guasábara | |
| Stenocereus griseus (Haw.) Buxb. | Cardón de dato | |
| Opuntia caracasana Salm-Dyck. | Tuna blanca | |
| Pereskia guamachoF. A. C. Weber | Guamacho, Suspiro | |
| Capparaceae | Belencita nemorosa (Jacq.) Dugand. | Taparita |
| Capparidastrum elegans(Mart.) Hutch. | ||
| Capparis pittieriStandl. | Limón de montaña | |
| Crateva tapiaL. | Naranjillo, Toco, Parcha | |
| Cynophalla linearis (Jacq.) J. Presl. | Gatillo | |
| Cynophalla flexuosa(L.) J.Presl | Limpiadiente, Arará | |
| Morizonia americana L. | Zorrocloco | |
| Quadrella odoratissima(Jacq.) Hutch. | Olivo | |
| Euphorbiaceae | Cnidoscolus urens(L.) Arthur | Guaritoto, Pringamosa |
| Jatropha gossypiifolia L. | Tuatúa | |
| Fabaceae | Acacia tortuosa (L.) Willd. | Cují torcido, Cují negro |
| Albizia lebbeck (L). Benth | Lara, Samán ruidoso | |
| Caesalpinia coriaria (Jacq.) Willd. | Dividive | |
| Caesalpinia granadillo Pittier. | Ébano, Granadillo | |
| Diphysa americana (Mill.) M.Sousa | Bolsa de gato | |
| Hymenaea courbaril L. | Algarrobo | |
| Lonchocarpus atropurpureus Benth. | Jebe, Nazareno | |
| Parkinsonia praecox(Ruiz & Pav.) Hawkins | Yabo, Espinillo | |
| Pithecellobium dulce (Roxb.) Benth. | Yacure | |
| Prosopis juliflora (Sw.) DC. | Cují yaque, Cují llorón | |
| Malvaceae | Ceiba pentranda (L.) Gaertn. | Ceiba |
| Guazuma ulmifolia Lam. | Guásimo | |
| Pachira quinata (Jacq.) W.S. Alverson. | Castaño, Ceiba roja | |
| Pseudobombax septenatum (Jacq.) Dugand | Sibucara | |
| Sterculia apetala (Jacq.) Karst. | Camoruco, Cacaito | |
| Phytolaccaceae | Seguieria americana L. | Araña gato |
| Polygonaceae | Triplaris caracasana Cham. | Palo maría |
| Rhamnaceae | Ziziphus mairei Dode | Ponsigué, Manzanita |
| Rubiaceae | Randia aculeata L. | Cruceto |
| Randia armata (Sw) DC | Cruceto | |
| Sapindaceae | Meliccocus bijugatus Jacq. | Mamón |
| Melicoccus oliviformisKunth | Cotoperiz | |
| Vitaceae | Cissus siamica Planch | Bejuco de carro |
| Zygophyllaceae | Bulnesi arbórea Jacq. Engler. | Vera |
Figueroa (2011) describió que las 10 familias más importantes en el estudio realizado en el Parque Recreacional Pueblo Viejo, en cuanto al número de especies, fueron las Fabaceae, Capparaceae, Euphorbiaceae, Malpighiaceae, Bignoniaceae, Flacourtiaceae, Rutaceae, Sapindaceae, Anacardiaceae y Cactaceae; el bosque del Jardín Botánico de Maracaibo comparte siete de las familias registradas: Fabaceae, Capparaceae, Cactaceae, Bignoniaceae, Euphorbiaceae, Sapindaceae y Anacardiaceae, las cuales agrupan el 65 % de las especies censadas en este estudio, con 33 taxa.
De acuerdo con Portillo y Pietrangeli (2014), las familias más importantes para este bosque son: Fabaceae, Capparaceae, Cactaceae y Bignoniaceae, pero en este estudio se le suman las familias Malvaceae y Boraginaceae, las cuales serían las 6 familias más importantes en número de especies para este remanente boscoso. Este resultado demuestra la diferencia florística de esta área con respecto a las referidas, probablemente debido a las diferencias en los regímenes pluviométricos que, por ejemplo, para el Jardín Botánico de Maracaibo son menores a los 850 mm anuales y para el Parque Recreacional Pueblo Viejo son mayores a los 1 200 mm anuales (Figueroa, 2011).
3.2. Características estructurales
Con la conformación estructural del bosque estudiado a través de las 10 parcelas, se constató que la comunidad vegetal presenta por lo general dos estratos arbóreos. El estrato alto más o menos continuo con el 47,73 % (663) de los individuos, se encuentra entre los 5 y los 13 m de altura con muy pocos árboles emergentes (5), los cuales pueden alcanzar hasta los 16 m de altura, como es el caso de la Ceiba pentranda (L.) Gaertn, Sterculia apetala (Jacq.) Karst. Handroanthus billbergii (Bureau & Schum.) Grose y Cordia thaisiana G. A gostini; el segundo estrato está conformado por individuos menores a 5 m y presenta la mayor densidad de especies leñosas (51,91 %), en comparación con el estrato superior, pero estos son de menor diámetro (Tabla 3); la comunidad vegetal se completó con la presencia de muy pocas hierbas y epífitas de las familias Annonaceae, Asparagaceae, Bromeliaceae, Commelinaceae, Orchidaceae, Poaceae y Sterculiaceae.
El número de estratos de bosque del JBM difiere a los referidos por González (2003), para los llanos orientales de Venezuela, ya que estos solo presentaron un estrato arbóreo relativamente continuo de 12 m promedio en altura y con taxa como Bourreria cumanensis y Capparis odoratissima. Sin embargo, coinciden con los reportados por Portillo y Pietrangeli (2014) en el Jardín Botánico de Maracaibo, Figueroa (2011) en la costa oriental del lago de Maracaibo y Pietrangeli (2006) en los alrededores de los embalses Socuy y Tulé del estado Zulia.
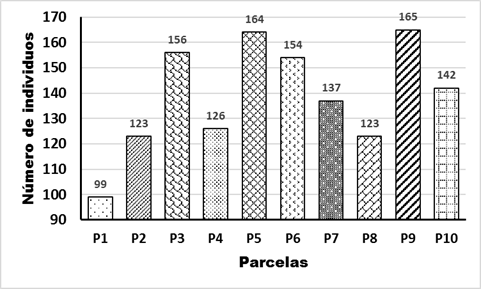
La densidad total en los 10 rodales censados fue de 1 389 individuos, lo que representó una hectárea de muestreo, con una densidad promedio de 138 individuos/parcela. Las densidades máximas encontradas fueron en los rodales P9, P5 y P3 con 165, 164 y 156 individuos respectivamente y las mínimas registradas en las parcelas P1 con 99, P2 y P8 con 123 cada una (Figura 3), lo que evidencia la diversidad de individuos entre parcelas. Esto difiere ampliamente de lo reportado por Figueroa (2011) en los bosques deciduos del parque recreacional Pueblo Viejo de la costa oriental del estado Zulia, donde la densidad total en los 10 rodales censados fue de 2 036 individuos/ha, con una densidad promedio de 203,6 individuos/parcela.
Alrededor del 83 % de las especies son de reducido diámetro a la altura del pecho (DAP < 20 cm) (Figura 4), se destacan las de menor DAP: Cissus siamica Planch, Handroanthus billbergii (Bureau & Schum.) Grose, Cordia thaisiana G.A gostini, Caesalpinia coriaria (Jacq.) Willd y Cnidoscolus urens (L.) Arthur, todas con DAP de 2,50 cm; mientras que las pocas de mayor diámetro fueron: Cereus hexagonus (L.) Mill, Caesalpinia coriaria (Jacq.) Willd., Ceiba pentranda (L.) Gaertn, Handroanthus billbergii (Bureau & Schum.) Grose y Cordia alba (Jacq.) Roem. & Schult., con DAP > 97 cm, tomando en cuenta que la mayoría de ellas alcanzan estas dimensiones porque son individuos multicaules, aunque estos valores son relativamente bajos en comparación con los de otros bosques tropicales (Tabla 4).
Tabla 3. Distribución por estratos de las especies del JBM
| Estrato | NI | Porcentaje (%) |
|---|---|---|
| Sobresaliente (> 13 m) | 5 | 0,36 |
| Alto (5-13 m) | 663 | 47,73 |
| Bajo (< 5 m) | 721 | 51,91 |
| NI= Número de individuos | ||
Tabla 4. Cinco especies con menor y mayor DAP del JBM
| ESPECIE | DAP (cm) | |
|---|---|---|
| Cissus siamica Planch | 2,50 | |
| Handroanthus billbergii (Bureau & Schum.) Grose | 2,50 | |
| Cordia thaisiana G. Agostini | 2,50 | |
| Caesalpinia coriaria (Jacq.) Willd. | 2,50 | |
| Cnidoscolus urens(L.) Arthur | 2,50 | |
| Cordia alba (Jacq.) Roem. & Schult. | 97,40 | |
| Handroanthus billbergii (Bureau & Schum.) Grose | 98,04 | |
| Ceiba pentranda(L.) Gaertn. | 103,71 | |
| Caesalpinia coriaria (Jacq.) Willd. | 106,16 | |
| Cereus hexagonus (L.) Mill. | 108,23 | |
El diámetro promedio de la mayoría de los individuos leñosos, fue menor a 20 cm, hace suponer que se trataría de una serie de bosques relativamente jóvenes, que fueron intervenidos y están en recuperación; adicionalmente, las condiciones edáficas y meteorológicas impiden que los árboles adquieran mayor grosor de tallo (Figura 4).
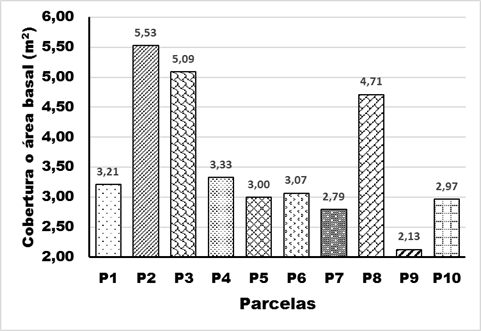
Para el área basal de los componentes leñosos muestreados, se observa que existen dos grupos bien definidos por la diferencia de más de 1 m2, compuestos en primer lugar con los valores mayores en las parcelas P2, P3 y P8 con 5,53; 5,09 y 4,71 m2 respectivamente, luego el segundo grupo lo forman las restantes parcelas con valores comprendidos entre 2,13 y 3,33m2; comportándose muy homogéneos. Resalta que los dos rodales de mayor cobertura son continuos, mientras que la tercera se encuentra entre las de menor área basal de la muestra de una hectárea (Figura 5).
3.3. Índice de valor de importancia (IVI)
Con el IVI encontrado y de acuerdo con Figueroa (2011), el bosque del JBM está compuesto por el 1,45 % de especies raras, presentes solamente en una parcela que coincide con la misma donde no hubo especies muy dominantes; el mayor grupo lo conforman las de baja importancia con 36,26 %, seguido de las codominantes con 31,16 %, las de moderada importancia cubren el 15,94 %, completándose con las especies dominantes y muy dominantes con valores relativos de 7,97 % y 7,25 %, respectivamente.
Handroanthus billbergii (Bureau & Schum.) Grose es la especie que obtuvo el primer lugar con el 100 % de presencia en las parcelas, seguido de Pithecelobium ambiguum Hemsl., con el IVI en nueve parcelas, completándose los primeros lugares de las parcelas restantes con Bulnesia arborea Jacq. Englery Cnidoscolus urens (L.) Arthuren en tres de ellas. En la Tabla 5, se presentan las cinco especies con mayor IVI para cada una de las parcelas.
Tabla 5. Las cinco especies con mayor Índice de Valor de Importancia por parcela
| ESPECIE | NI | IVI | |
|---|---|---|---|
| P1 | Handroanthus billbergii (Bureau & Schum.) Grose | 28 | 93,18 |
| Caesalpinia coriaria (Jacq.) Willd. | 25 | 78,73 | |
| Pereskia guamachoWeber | 21 | 48,25 | |
| Cochlospermum vitifolium (Willd) Spreng. | 9 | 27,39 | |
| Lemairecereus griseus Haw. Bridt. | 4 | 12,41 | |
| P2 | Handroanthus billbergii (Bureau & Schum.) Grose | 40 | 86,55 |
| Caesalpinia coriaria(Jacq.) Willd. | 36 | 64,49 | |
| Pithecelobium ambiguum Hemsl. | 10 | 27,41 | |
| Cereus hexagonus (L.) Mill. | 8 | 24,37 | |
| Lemairecereus griseus Haw. Bridt. | 6 | 23,16 | |
| P3 | Handroanthus billbergii (Bureau & Schum.) Grose | 108 | 117,12 |
| Cordia alba (Jacq.) Roem. & Schult. | 8 | 36,51 | |
| Caesalpinia coriaria (Jacq.) Willd. | 8 | 35,67 | |
| Pithecelobium ambiguum Hemsl. | 9 | 23,47 | |
| Cereus hexagonus(L.) Mill. | 2 | 23,00 | |
| P4 | Handroanthus billbergii (Bureau & Schum.) Grose | 77 | 146,45 |
| Pithecelobium ambiguum Hemsl. | 15 | 54,75 | |
| Opuntia caracasana Salm-Dyck. | 11 | 22,63 | |
| Randia aculeata L. | 3 | 10,41 | |
| Cordia alliodora (Ruiz & Pav.) Oken. | 2 | 10,20 | |
| P5 | Handroanthus billbergii (Bureau & Schum.) Grose | 123 | 171,91 |
| Bulnesia arbórea Jacq. Engler | 11 | 33,53 | |
| Cnidoscolus urens(L.) Arthur | 6 | 14,94 | |
| Pithecelobium ambiguum Hemsl. | 2 | 14,76 | |
| Cochlospermum vitifolium (Willd.) Spreng. | 6 | 13,73 | |
| P6 | Handroanthus billbergii (Bureau & Schum.) Grose | 113 | 170,83 |
| Bulnesia arbórea Jacq. Engler. | 11 | 33,32 | |
| Stenocereus griseus (Haw.) Buxb. | 4 | 15,77 | |
| Cnidoscolus urens(L.) Arthur | 6 | 14,88 | |
| Pithecelobium ambiguum Hemsl. | 2 | 14,53 | |
| P7 | Handroanthus billbergii (Bureau & Schum.) Grose | 97 | 165,47 |
| Bulnesia arbórea Jacq. Engler. | 11 | 38,13 | |
| Stenocereus griseus (Haw.) Buxb. | 4 | 16,32 | |
| Pithecelobium ambiguum Hemsl. | 2 | 15,71 | |
| Cnidoscolus urens(L.) Arthur | 6 | 15,38 | |
| P8 | Handroanthus billbergii (Bureau & Schum.) Grose | 50 | 93,29 |
| Pithecelobium ambiguum Hemsl. | 20 | 50,41 | |
| Cordia thaisiana G. Agostini | 9 | 22,43 | |
| Ceiba pentranda(L.) Gaertn. | 1 | 20,83 | |
| Caesalpinia coriaria (Jacq.) Willd. | 8 | 19,13 | |
| P9 | Handroanthus billbergii (Bureau & Schum.) Grose | 81 | 128,54 |
| Cordia curassavica (Jacq.) Roem. & Schult. | 37 | 44,85 | |
| Caesalpinia coriaria (Jacq.) Willd. | 11 | 33,28 | |
| Acacia tortuosa (L.) Willd. | 6 | 19,64 | |
| Pithecelobium ambiguum Hemsl. | 8 | 14,14 | |
| P10 | Handroanthus billbergii (Bureau & Schum.) Grose | 89 | 122,41 |
| Pithecelobium ambiguum Hemsl. | 11 | 28,14 | |
| Hymenaea courbaril L. | 2 | 24,16 | |
| Caesalpinia coriaria (Jacq.) Willd. | 9 | 23,85 | |
| Handroanthus serratifolius(Vahl) S. O. Grose | 6 | 20,19 | |
La especie Handroanthus billbergii (Bureau & Schum.) Grose ejerce el dominio absoluto del bosque del JBM, con valores de 86,55 ≤ IVI ≤ 171,91; supera en todas las parcelas al resto de las especies. También, se observa que las especies que la secundan están presentes escasamente en tres parcelas, siendo ellas Bulnesia arbórea Jacq. Engler y Pithecelobium ambiguum Hemslcon con 38,13 y 54,75 como valores mayores, respectivamente, en las tres parcelas donde ocupan el segundo lugar; las demás poseen valores de IVI mucho menores que los de las especies antes mencionadas.
De las 50 especies censadas, existen 20 con valores altos de IVI, lo que indica que el bosque del JBM es muy heterogéneo en cuanto a riqueza de especies y estas tienen alta incidencia en el mismo.
4. CONCLUSIONES
El censo florístico del Jardín Botánico de Maracaibo demostró que sus variables florísticas y estructurales fueron muy similares a las de otros bosques deciduos de Venezuela, aunque la diferencia más notable fue el menor número de especies.
El bosque muy seco tropical del Jardín Botánico de Maracaibo posee una composición de familias típica de los bosques secos similares del noroeste de Venezuela, pero con menor cantidad de especies.
La dominancia de Handroanthus billbergii (Bureau & Schum.) Grose (Curarire) fue absoluta ante las demás especies del bosque y fue la única en poseer valores de Índice de Importancia mayores a 100.
Las familias Fabaceae (en sentido amplio), Capparaceae, Cactaceae y Malvaceae predominaron sobre las demás familias presentes en el área de estudio.
La cobertura o área basal fue muy baja, lo que ratifica que el bosque es joven.
La densidad de especies por parcela demostró que existe mucha variación, lo que determina la heterogeneidad del bosque del JBM.
El bosque del JBM presentó la mayoría de los componentes arbóreos con bajo valor de DAP lo que sugiere que es un bosque joven o que atraviesa un proceso sucesional secundario.