1. INTRODUCCIÓN
Desde hace varias décadas, el hombre ha planteado el uso combinado de la tecnología y de los combustibles fósiles para dar paso a otras tecnologías que facilitan y permiten acceder en la actualidad a diferentes servicios, pero lamentablemente tanto el petróleo como el gas natural, entre las fuentes de energía más representativas, son recursos finitos que han llegado a provocar altos niveles de contaminación que afectan al ecosistema y por ende a la humanidad. Ante tales circunstancias, resulta necesario cambiar la base energética actual por nuevas formas de energía que sean accesibles, abundantes, de bajo costo, tratables y que reduzcan la contaminación ambiental. Una de las nuevas fuentes innovadoras de energía es el hidrógeno, caracterizado por ser eficiente, inagotable, seguro, almacenable, transportable y económico de producir. Como elemento químico en condiciones normales de presión y temperatura es un gas diatómico (H2) liviano, incoloro, inodoro, insípido e inflamable. Su átomo se caracteriza por tener un protón y un electrón, además que en la naturaleza se lo encuentra como parte de una gran cantidad de compuestos como el agua, hidrocarburos, proteínas o ácidos. Su molécula es pequeña, ligera, simple y relativamente estable, posee el más alto contenido de energía por unidad de peso que cualquier otro combustible y al combinarse con el oxígeno produce electricidad en procesos electroquímicos mientras que al quemarse con oxígeno produce vapor de agua lo que resulta en una reducción de la contaminación. Finalmente, presenta un margen de explosión bajo, respecto a otros combustibles debido a su densidad.
Uno de los métodos para la obtención de este gas ha sido por mucho tiempo la electrólisis convencional cuyo inconveniente ha llegado a ser su alto consumo de electricidad. En vista de esto, producto de varios estudios, se llega a la conclusión de que la descomposición del agua a altas temperaturas resulta ser más ventajosa, pues con esto parte de la energía total, usada para producir la electrólisis, ahora será suministrada o añadida en forma de calor, para así obtener como resultado una notable mejora en el índice de eficiencia total de energía.
Considerando lo anteriormente mencionado, el presente trabajo busca modelar matemáticamente la producción de hidrógeno en un electrolizador mediante el uso de vapor sobrecalentado de agua a fin de brindar una base teórica que pueda ser aplicada al momento de elegir o diseñar equipos para sistemas de electrólisis que permitan producir hidrógeno de forma óptima con un consumo de energía eficiente; a la vez que se pretende incentivar todo proceso de investigación encaminada al aprovechamiento del hidrógeno como vector energético en el país.
2. MARCO TEÓRICO/METODOLOGÍA
2.1 Características del electrolizador
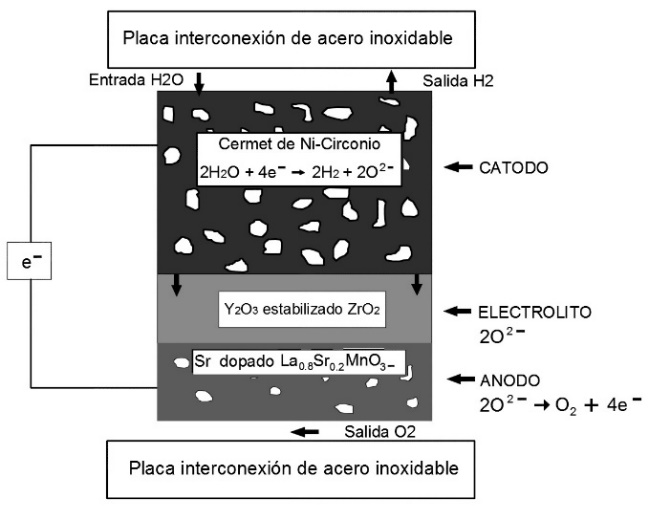
El electrolizador es el dispositivo físico en el cuál se produce la descomposición del vapor de agua, en este caso, en hidrógeno y oxígeno al hacer circular una corriente eléctrica de forma conveniente. La celda simple, configuración del electrolizador a utilizarse, está compuesta por dos electrodos, ánodo y cátodo con un electrólito en medio operado en un ambiente dual. Dicha configuración se presenta a continuación en la Figura 1.
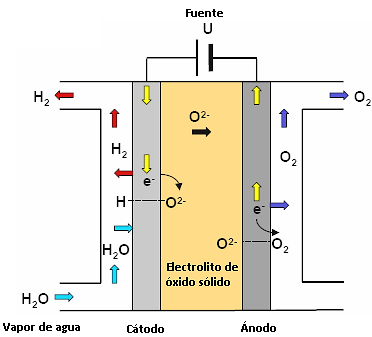
Figura 1. Celda simple de electrolito a base de óxido sólido. Fuente: Annabelle Brisse, J. S. (2008).
En base a las características físicas y químicas con las que deben cumplir los componentes del electrolizador para el trabajo a altas temperaturas, de acuerdo con Alvarado (2013) y Cachadiña, et al. (2001), los materiales del electrolito, cátodo y ánodo seleccionados son YSZ (circonia estabilizada con itrya), Ni-YSZ (níquel circonio estabilizado con escandio.) y LSM (manganito de lantano dopado con estroncio), respectivamente.
2.2 Reacciones químicas
Siendo el agua una de las sustancias más estables de la naturaleza, su disociación, para la producción de hidrógeno y oxígeno moleculares, no es espontánea y posee un alto grado de consumo de energía (Pierre y Capitaine, 2006).
La reacción neta de electrólisis del agua se muestra en la Ecuación (1).
Que indica que, por cada mol de agua ingresada, se obtiene una mol de hidrógeno y medio mol de oxígeno
En una celda electrolítica la energía eléctrica se suministra aplicando una diferencia de potencial entre dos electrodos acoplados con un electrolito. La conversión de la energía eléctrica en energía química tiene lugar en la interfase electrodo-electrolito a través de reacciones de transferencia de carga.
Las reacciones que se producen en cada parte del electrolizador de acuerdo a Brisse et al. (2008) y Nechache et al. (2014) son:
En el cátodo se produce la reacción como se muestra en la Ecuación (2).
En el ánodo la reacción producida se muestra en la Ecuación (3).
En el electrolito la reacción es: 2O2-; circulando de forma constante. Todas estas reacciones se resumen en la Figura 2.
Cabe destacar, que todo el proceso comprende un estado de oxidación mientras esté en funcionamiento, es decir que el compuesto inicial se disgrega por la energía aplicada, en compuestos que tienden a combinarse debido a su inestabilidad (como el oxígeno que circula por el electrolito, hasta combinarse en 2 moléculas de sí mismo para formar el gas de oxígeno).
2.3 Determinación de parámetros y variables que intervienen en el proceso de generación de hidrógeno por electrólisis a partir de vapor sobrecalentado.
Tomando en cuenta lo descrito por Mazloomi et al. (2012), se consideran a continuación las variables que pueden influir directamente en la obtención de hidrógeno a partir de vapor sobrecalentado en una celda electrolítica simple. Dichas variables son:
2.3.1. Temperatura
La temperatura (T) es la variable determinante en la efectividad del proceso pues las características termodinámicas del agua afirman un aumento de la energía cinética de la sustancia que ayuda a reducir drásticamente el uso de la energía eléctrica según Zoulias et al. (2010). Adicionalmente, se conoce también que el calor puede reducir el potencial reversible del agua (conocido también como el equilibrio de voltaje). Un rango de temperatura con el cual se han obtenido buenos resultados de electrólisis al utilizar YSZ como electrolito es según el análisis de Brisse et al. (2008), Cachadiña et al. (2001) y Nechache et al. (2014):
Lo cual indica que el proceso depende principalmente de altas temperaturas, pues es en este rango en donde ocurren las transferencias de electrones óptimos en los electrodos y electrolito.
El valor de la temperatura con la que se trabajará inicialmente para posteriormente proceder a variarla será de 1 123,15 (K).
2.3.2. Área transversal, alineación y espacio entre los electrodos.
Se debe resaltar que el área transversal del electrolito es equivalente al área transversal de los electrodos A (m2) por la estructura de la celda, por lo que en este trabajo el área calculado (A) en las fórmulas del electrolito corresponderá recíprocamente al área transversal de los electrodos, parámetro a considerar y variar dentro del proceso de la producción de hidrógeno.
Se debe tomar en cuenta el área, ya que la impedancia de un elemento depende en gran medida de ella, obteniendo una menor resistencia y un flujo más rápido de los electrones.
Se han observado efectos del vacío entre interfaces, debido a la formación de burbujas de gas (Mazloomi et al., 2012), pero que no alteran de forma significativa el proceso de electrólisis por la naturaleza del vapor. La resistencia a la corriente se reduce si el área sobre la cual actúa es mayor en comparación con su longitud, por lo que la altura de un electrodo (parte superior del electrodo) es un factor poco determinante en el proceso. Además, el poner el electrodo en posición vertical aumenta la eficiencia que puede ser obtenida.
Esto último es causado por la reducida resistencia óhmica que existe en esta zona (Mazloomi et al., 2012).
De acuerdo con Brisse et al. (2008) y Nechache et al. (2014) los valores iniciales de espesor del electrolito (que están relacionados con la separación de los electrodos d) y área transversal de los electrodos para la interfaz cátodo-electrolito ánodo electrólito “A” (m2) correspondientes para una temperatura de 1 123,15 (K) serán:
2.3.3. Voltaje suministrado
Los estudios para una electrólisis a partir de vapor sobrecalentado de agua estable descritos por Brisse et al. (2008) y Nechache et al. (2014) han demostrado una tendencia a los valores pequeños en cuanto se refiere al voltaje suministrado; es así que se tienen los siguientes valores para un rango de 1 073 (K) a 1 272 (K):
A un valor de flujo de carga o densidad de corriente;
De estos valores, el voltaje de entrada de alimentación de la celda VS (V) correspondiente para las condiciones iniciales de la celda electrolítica, que ha permitido lograr una mejor eficiencia del proceso es:
2.3.4. Ciclo de trabajo
Al trabajar con una fuente tipo pulsos a frecuencia de resonancia, se observa que mejora la eficiencia energética del sistema, en lugar de trabajar solo a un valor de fuente DC constante.
Esta frecuencia de resonancia, para este caso, será calculada a partir del modelo del circuito eléctrico equivalente EEC definido para celda electrolítica simple. Adjunto con ello se analiza la variación del ciclo de trabajo dentro del siguiente rango:
2.4 Modelo de una celda electrolítica de óxido sólido simple mediante un ECC
La Espectroscopia de Impedancia Electroquímica, (EIS), es un método ampliamente utilizado para entender los fenómenos que se presentan no sólo en la electrólisis por vapor sobrecalentado, sino, en muchos sistemas en los que no se puede determinar su impedancia por métodos convencionales.
Este método es utilizado en las celdas de electrólisis como una herramienta muy útil, tanto al momento de caracterizar los materiales de los electrodos y del electrolito como al analizar la influencia de parámetros como la temperatura, voltaje, el área transversal y la distancia entre electrodos en el comportamiento de la celda.
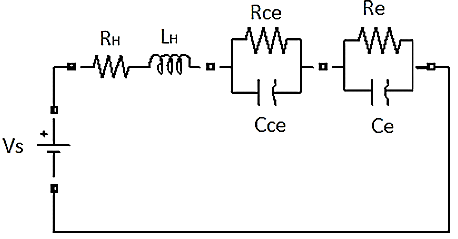
De acuerdo con el análisis de Escobedo y Zamora (2006), Nechache et al. (2014), Orlik. et al. (2012), se pudo encontrar la topología más adecuada para el sistema, es decir, aquella que logra representar cada uno de los fenómenos que en él se presentan. En la Figura 3 se muestra la configuración resultante para el análisis de la producción de hidrógeno a partir de vapor sobrecalentado. Como modelo de circuito eléctrico equivalente EEC, en la Figura 3 se observa lo siguiente:
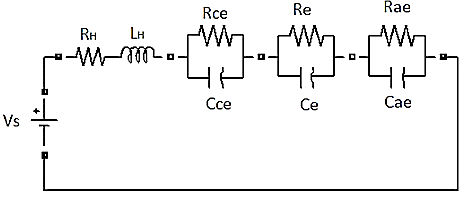
Figura 3. Modelo de circuito eléctrico equivalente EEC para la generación de hidrógeno por electrólisis a partir de vapor sobrecalentado.
La definición de cada elemento se presenta a continuación: LH inductancia asociada al hardware del sistema (H); RH resistencia asociada al hardware del sistema (Ω); Rce resistencia de la interfaz cátodo-electrolito (Ω); Cce capacitancia de doble capa de la interfaz cátodo-electrolito (F);Rae resistencia de la interfaz ánodo-electrolito (Ω);Cae capacitancia de doble capa de la interfaz ánodo-electrolito (F);Re resistencia del electrolito (Ω) y Ce capacitancia del electrolito (F).
Se conoce que en una celda de combustible de óxido sólido SOFC, cuyo comportamiento y modelo EEC es semejante al de la celda de electrólisis de óxido sólido SOEC, conforme aumenta la temperatura la impedancia generada por el ánodo, es menor a la generada por el cátodo el cual tiene mayor influencia sobre las pérdidas en la celda.
Además, de acuerdo al análisis en el dominio de la frecuencia hecho en Escobedo y Zamora (2006); se dice que para el presente trabajo la impedancia del cátodo tiene una influencia importante sobre las pérdidas de la celda mientras que la impedancia del ánodo no, razón por la que la impedancia de este último se considerará despreciable conforme aumenta la temperatura, lo que quiere decir que Rae~0 y Cae~0.
Al ser Ra y Ca insignificantes con respecto a Rc y Cc y más aún a mayor temperatura, es evidente entonces que a 1 123,15 (K) se puede despreciar la impedancia de la interfaz ánodo-electrolito. Con esto finalmente, en la Figura 4, se muestra el EEC que se utilizará para la investigación.
2.5 Análisis de electrolito
De 473 (K) a 1 873 (K) el Y2 O3 estabilizado con ZrO2 sigue una ley de Arrhenius no lineal. Para estudiar el comportamiento de la temperatura en este material es necesario encajar el rango completo de temperaturas contenidas en una función teórica que permita entender los parámetros físicos implicados tales como: entropía, entalpía, energías contenidas y liberadas (Energía libre de Gibbs), entre otros.
Conociendo la fórmula empírica de la entalpía ∆H (J/mol) dependiente de valores locales de temperatura (absoluta) Cachadiña et al. (1998), se puede afirmar como se muestra en la Figura 4 que:
Donde, Ef, Eb, β y Tf son parámetros ajustables, independientes de la temperatura. A la Ecuación 4 se la puede conocer también como función energía de activación. En Cachadiña et al. (2001), se ha logrado simplificar una ecuación que comprende el estudio de la conductividad iónica y parámetros energéticos junto con la entalpía, usando una exponencial para aproximar la curva de energías respecto la temperatura como se muestra en la Figura 5, modelo que ha sido aceptado para diferentes modelos de materiales cerámicos.
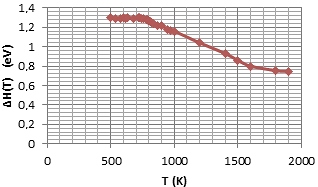
Figura 5. Datos de temperatura vs entalpía obtenidas de las experiencias con el Y2O3 estabilizado con ZrO2. Fuente: Cachadiña, I., & Solier, J. (1993).
Con lo que, la ley de Arrhenius para la conductividad iónica se puede escribir como la Ecuación 5.
Que a su vez corresponde a la conductividad total para el, en donde A (T) es un factor pre-exponencial dependiente de la temperatura y k es la constante de Boltzmann igual a 1,381·10-23 (J/K). Si la admitancia compleja total de la celda de acuerdo con Cachadiña et al. (1995) está representada como en la Ecuación 6.
Donde
El modelo de circuito permite separar la conductividad, el dieléctrico y las contribuciones de la interfase a la admitancia total. Esta se usa para conocer la capacidad de conducción que tiene el electrolito. Ahora es necesario conocer los valores de Re y Ce del modelo descrito para lo cual se tiene que la respuesta dieléctrica másica, permitividad compleja de Havriliak-Nagami ϵ* en (F/m), es como se muestra en la Ecuación 7.
Con Lr como factor que describe la relación entre el área del electrodo y su espesor. Esta ecuación puede ser representada por la ecuación de Havriliak-Negami como la Ecuación 8.
Siendo:
Donde Ed es la energía de activación para la relajación dieléctrica en (eV) y ωpo un factor pre-exponencial obtenido de forma gráfica en (Hz).
Conforme a Escobedo y Zamora (2006); Mazloomi et al. (2012), Macdonald (1992), Cachadiña, et al. (2001) y la topología de celda planteada anteriormente se pueden representar a los elementos internos del proceso electrolítico como una resistencia Re y una capacitancia compleja Ce en paralelo, cuyos valores expresados en términos de las variables que inciden en la producción de hidrógeno, de acuerdo con Cachadiña et al. (2001), como las Ecuaciones 10 y 11 son:
2.6 Análisis de la interface electrodo-electrolito
2.6.1. Sobre-potencial de activación
Como se dijo en un principio, al existir dentro de la celda electrolítica dos tipos de electrodos, ánodo y cátodo, se llegó a tener dos interfaces electrodo-electrolito respectivamente. Conocer detalladamente los procesos que se llevan a cabo dentro de la celda es esencial para el estudio de la producción del gas hidrógeno en un electrolizador a partir de vapor sobrecalentado de agua. Dado que los electrodos son hechos de un material metálico (conductor de electrones) y que el electrolito es un conductor de iones, se produce una separación y acumulación de cargas en ambos lados de cada interfaz, lo cual se conoce como el fenómeno de capacitancia de doble capa; así como también se producen al mismo tiempo, en dichas interfaces, reacciones electroquímicas (Escobedo y Zamora, 2006).
Los electrodos poseen una capa catalítica de tal forma que cuando un electrón cruza esta capa, ya sea para pasar del electrodo a un ión o viceversa, se dice que se produce la transferencia de carga, proceso que genera una corriente en el sistema.
Debe recalcarse, de acuerdo con lo anterior, que tanto si un electrón pasa del electrodo al electrolito en una interfaz, como si lo hace del electrolito al electrodo en la otra, la corriente se produce en el mismo sentido. Este fenómeno se llega a ilustrar en la Figura 6 en la que por ejemplo, si los iones al lado del electrolito aceptan o ceden electrones al electrodo dentro de la reacción, este intercambio modifica la valencia y por tanto se produce un flujo de corriente.
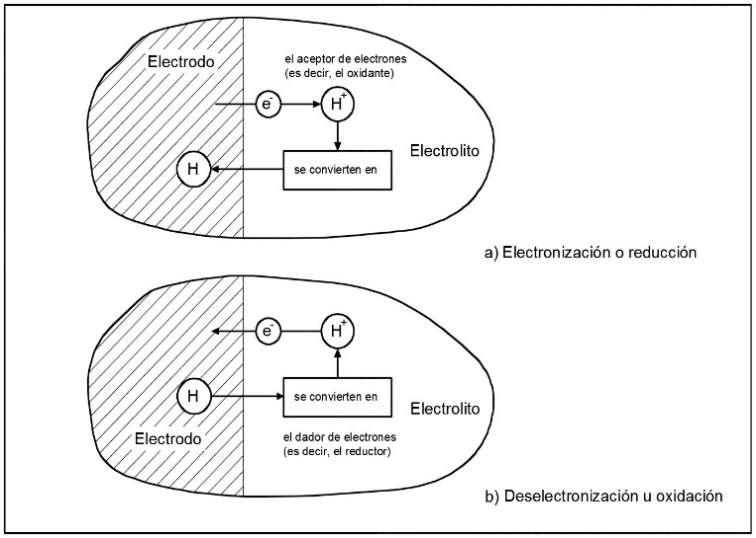
Figura 6. Transferencia de carga en una interfase. Fuente: Escobedo, E., & Zamora, L. (Agosto de 2006).
Se puede distinguir dos tipos en el proceso de transferencia de carga, uno de electronización en el cual un ión acepta un electrón del electrodo, por lo tanto, su estado de valencia disminuye en uno o se reduce (reducción), y un proceso de deselectronización, caso en el que un ión cede un electrón del electrodo, por lo tanto, su estado de valencia aumenta en uno o se aumenta (oxidación).
Cuando un ión se está desplazando a través de la doble capa hasta el electrodo entonces en algún punto de este recorrido se produce la transferencia de carga; en la Figura 7 se muestra la variación de la energía del ión con respecto al recorrido.
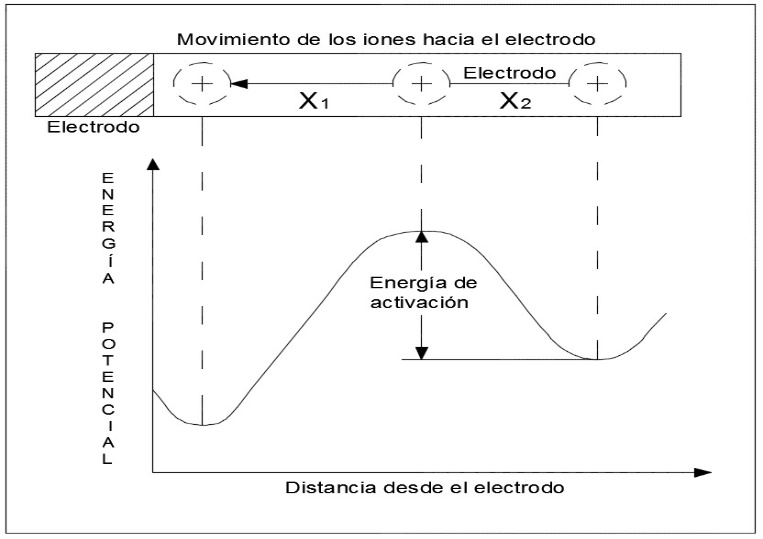
Figura 7. Energía Potencial – Distancia en un ión que atraviesa la doble capa. Fuente: Escobedo, E., & Zamora, L. (Agosto de 2006).
Se puede apreciar entonces que se necesita cierta cantidad de energía para que se produzca la transferencia de carga, a esta energía se le conoce como energía de activación ηact, la cual está representada, de acuerdo con el análisis descrito en Escobedo y Zamora et al. (2006), por la Ecuación 12.
Siendo z el número de iones, α el coeficiente de transferencia de carga, jo densidad de corriente de intercambio, (A/m2), R la constante universal de los gases 8,3143 (J·K-1·mol-1) y F la constante de Faraday 96 485 (C/mol). Dicha energía de activación, conforme con la ecuación anteriormente descrita, también puede ser manifestada como un voltaje requerido para que se produzca el proceso de transferencia de carga o activación el cual le produce pérdidas al potencial de Nernst o potencial reversible (Atkins, 2008).
2.6.2. Sobre-potencial de concentración
A más de las pérdidas debido a la energía necesaria que se tiene que dar a un ión para que ocurra la transferencia de carga o activación (sobrepotencial de activación), existen también fenómenos de transferencia de masa que producen pérdidas adicionales dentro del proceso de electrólisis.
La velocidad de las reacciones químicas que se producen en el ánodo y en el cátodo, es afectada por la concentración de suministro presente en los mismos; debido a que no se puede consumir inmediatamente todo el volumen de suministro, entonces es necesaria una cantidad de energía para mantener esa concentración de suministro.
Para estudiar los efectos de transporte de masa en la presente investigación, se utilizó la aproximación de película de Nernst o Nernstiana, que afirma que la superficie del electrodo está cubierta por una película inactiva uniforme, esto produce una convección suficientemente adecuada para que la concentración se mantenga uniforme en el exterior, por otra parte, se asume que la difusión se da en dirección normal a la superficie de concentración, por lo tanto se puede expresar ∇ci, gradiente de concentración (mol), como una función lineal, esto se ilustra en la Figura 8.
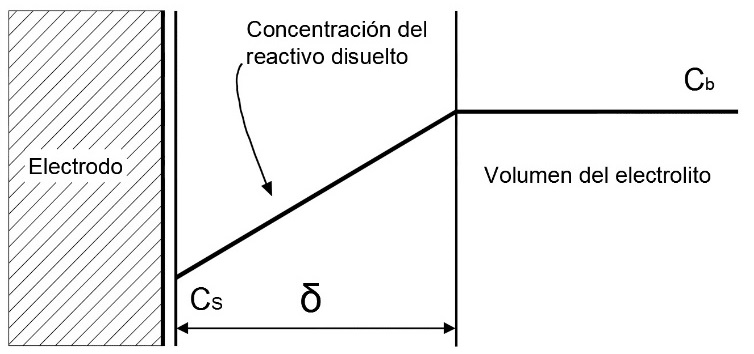
Figura 8. Gradiente de concentración tomado como una función lineal. Fuente: Escobedo, E., & Zamora, L. (Agosto de 2006).
Análogo al sobrepotencial de activación, la energía que permite mantener la concentración de suministro se manifiesta en un voltaje que el sistema toma de sí mismo (y por lo tanto le produce pérdidas), conocido como sobrepotencial de concentración ηconEscobedo y Zamora (2006) como se muestra en la Ecuación 13.
Con jmax igual a la máxima densidad de corriente (A/m2). De todo lo hasta aquí expuesto se define finalmente una resistencia de la interfaz electrodo-electrolito Rce que resulta de la combinación de los potenciales de activación y concentración, producidos en la interfase, divididos para la densidad de corriente como se muestra en la Ecuación 14.
El fenómeno de capacitancia de doble capa producido en la interfaz electrodo-electrolito por razón de separación y acumulación de cargas, explicado anteriormente, puede ser expresado de acuerdo con Escobedo y Zamora (2006), Macdonald (1984), Macdonald (1992) y Fernández et al. (1997) como en la Ecuación 15.
Siendo Yo una constante que depende de la temperatura medida en
2.6.3. Sobre-potencial óhmico
Los electrodos utilizados están hechos de un material conductor cubierto con un electrocatalizador (material que incrementa la velocidad de la reacción que participa en una reacción electroquímica); los cuales presentan una pequeña oposición al flujo de electrones que, como en cualquier conductor, dependerá de la longitud, área y resistividad a su vez dependiente de la temperatura.
Se definirá a esta resistencia inherente, a cualquier conductor, como resistencia electrónica
Así, se define una resistencia total del hardware RH como la de la Ecuación 17.
Por lo que el sobrepotencial óhmico (ηohm) estará determinado por la Ecuación 18.
Es necesario concluir en este punto, que en la investigación se presentaron tres clases de pérdidas, a saber, una pérdida debida a la energía necesaria para transferir carga, una pérdida debida a la energía necesaria para transferir masa y por último una pérdida óhmica debida a la resistencia propia del hardware del sistema.
En este punto se resume a continuación, en la Tabla 1, los valores iniciales óptimos de las variables descritas previamente y que inciden directamente en la producción de hidrógeno. Se asume dichos valores conforme a Brisse et al. (2008), Cachadiña et al. (2001), Mazloomi et al. (2012) y Nechache et al. (2014).
Tabla 1. Rangos y valores iniciales óptimos asumidos para las variables que inciden en la producción de hidrógeno.
| Variable | Descripción | Unidad | Rango | Valor |
|---|---|---|---|---|
| d | Espesor (separación electrodos). | (m) | [0 ; 0,01] |
|
| A | Área transversal electrodos. | (m2) | [0 ; 4,5·10-3] |
|
| Vs | Voltaje de entrada. | (V) | [0 ; 2] | 1,33 |
| D | Ciclo de trabajo (Duty Cycle). | (%) | [0 ; 100] | 50 |
| T | Temperatura | (K) | [773,15 ; 1 873,15] | 1 123,15 |
2.7 Implementación del modelo de ECC.
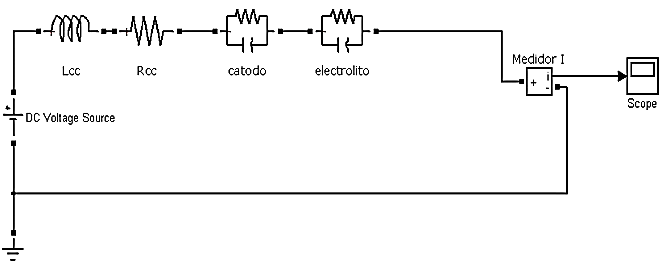
La implementación del modelo de EEC de la celda electrolítica se lo hizo utilizando la herramienta PowerSystemsToolbox de Matlab.
Las celdas para la electrólisis se ilustran esquemáticamente en la Figura 9 para cuando se utiliza una fuente DC y para cuando se utiliza una fuente de voltaje aplicada en forma de pulsos a frecuencia de resonancia.
En este modelo, la inductancia y resistencia de cableado y conexiones así como el equivalente eléctrico del cátodo y del electrolito de la celda asumiendo que la impedancia del ánodo es despreciable.
Para esta última implementación, esquematizada en la Figura 10, se obtiene una fuente de voltaje en forma de pulsos utilizando para ello un MOSFET de ultra baja resistencia, con respecto a los componentes del sistema, que es colocado entre el cátodo y tierra (Mazloomi, et al. 2012). Este dispositivo funciona como un interruptor que conduce y corta el paso de la corriente a través de la celda en un rango determinado de frecuencias 1(Hz) a 1(MHz).
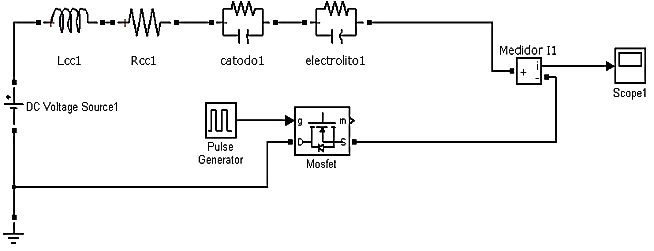
Figura 10. Implementación del modelo de EEC aplicando una fuente de voltaje en forma de pulsos a frecuencia de resonancia.
Las características ideales seleccionadas para este elemento se destacan a continuación: resistencia FET:
2.8 Caudal de hidrógeno
Según las leyes de Faraday para electrólisis (López et al. 2010), se define la función para conocer la producción de hidrógeno sobre la cual intervienen todas las funciones del sistema, con masa molar, M=4,032 (g/mol) y número de valencia (electrones por ion) n=4 como se muestra en la Ecuación 19.
En donde ∅H2(g/s) es el caudal de hidrógeno (flujo másico) que depende de la ley de Faraday con la corriente I (A) en el tiempo de operación t (s).
Finalmente, el desarrollo de las expresiones matemáticas, a partir del modelo por EEC, para la obtención de la resistencia de la interfaz cátodo-electrolito, resistencia del electrolito, capacitancia del electrolito, capacitancia de la interfaz cátodo electrolito, inductancia asociada al hardware del sistema, frecuencia de resonancia y caudal de hidrógeno en función de las variables temperatura, espesor y área de los electrodos, fuente de voltaje y ciclo de trabajo se presenta a continuación:
Partiendo de la ley de Arrhenius para la conductividad iónica (Cachadiña et al. 2001) presentada en la Ecuación 5, la ecuación de Havriliak-Negami, expuesta por la Ecuación 8, así como también la frecuencia de pico de pérdida mostrada en la Ecuación 9, se puede obtener la resistencia de electrolito y la capacitancia de electrolito de la siguiente forma; combinando las Ecuaciones 5 y 10 se obtiene la resistencia del electrolito como se indica en la Ecuación 20.
La combinación de las Ecuaciones 8 y 11 permiten encontrar la capacitancia del electrolito (Ce), mostrada en la Ecuación 21.
Donde:
Conforme Mazloomi et al., (2012) y Savova et al. (1987) se asume una inductancia de cables y conexiones Lcc mostrada en la Ecuación 22.
Las ecuaciones de la resistencia de la interfaz cátodo-electrolito (Rce) y de la capacitancia de la interfaz cátodo-electrolito (Cce) ya se han tratado previamente en las Ecuaciones 15 y 16 respectivamente.
De los valores tomados dentro de rangos de operación considerables (Yong y Moon, 2010), (Cachadiña et al.,2001), (Nechache et al., 2014), se seleccionan los presentados en las Tablas 2, 3, 4, 5, 6 y 7 para las constantes asociadas:
Tabla 2. Rangos y valores asumidos para los parámetros constantes de la Ecuación 8.
|
|
Descripción | Unidad | Rango | Valor |
|---|---|---|---|---|
|
|
Constantes de simetría. | [0 ; 1] | 0,5 | |
|
| ||||
|
|
Permitividad estática dieléctrica. |
|
|
|
|
|
Constante dieléctrica de alta frecuencia. |
|
176,471 | 176,471 |
|
|
Frecuencia del pico perdido. | (Hz) | Depende de otras constantes. |
Tabla 3. Rangos y valores asumidos para los parámetros constantes de la Ecuación 9.
|
|
Descripción | Unidad | Rango | Valor |
|---|---|---|---|---|
|
|
Energía de activación para la relajación dieléctrica | (J) |
|
|
| K | Constante de Botlzmann |
|
|
|
| T | Temperatura variable del proceso |
|
variable | |
|
|
Factor pre-exponencial | (Hz) |
|
Tabla 4. Rangos y valores asumidos para los parámetros constantes de la Ecuación 5.
|
|
Descripción | Unidad | Rango | Valor |
|---|---|---|---|---|
|
|
Parámetros variables independientes de la temperatura. | (eV) | 1,01 | |
|
|
(eV) | 0,29 | ||
|
|
(K) | 3 278 | ||
|
|
(K) | 1 328 | ||
| T | Temperatura del proceso. | (K) | Depende de otras constantes. |
Tabla 5. Rangos y valores asumidos para los parámetros constantes de la Ecuación 12.
|
|
Descripción | Unidad | Rango | Valor |
|---|---|---|---|---|
| R | Constante universal de los gases. |
|
8,3144 | 8,3144 |
| T | Temperatura de operación absoluta. | (K) | 1 073,15 | |
|
|
Coeficiente de transferencia de carga. | [0 ; 1] | 0,5 | |
|
|
Número de electrones implicados en la reacción. | 4 | ||
| F | Constante de Faraday. |
|
96 485 | 96 485 |
|
|
Densidad de corriente del electrodo. |
|
Variable | |
|
|
Densidad de corriente de intercambio |
|
0,35 |
Tabla 6. Rangos y valores asumidos para los parámetros constantes de la Ecuación 13.
|
|
Descripción | Unidad | Rango | Valor |
|---|---|---|---|---|
| R | Constante universal de los gases. |
|
8,3144 | 8,3144 |
| T | Temperatura de operación absoluta. | (K) | 1 073,15 | |
|
|
Número de electrones implicados en la reacción. | 4 | ||
| F | Constante de Faraday. |
|
96 485 | 96 485 |
|
|
Densidad de corriente máxima |
|
2 |
Tabla 7. Rangos y valores asumidos para los parámetros constantes de la Ecuación 16.
|
|
Descripción | Unidad | Rango | Valor |
|---|---|---|---|---|
|
|
Constante dependiente de la temperatura. |
|
1 | |
|
|
Constante geométrica de superficie del electrodo. | 1 |
En cuanto a la resistencia de hardware, RH, ha resultado poco práctico suponer que esta sea mayor que 1 ohmio de acuerdo a Nechache et al. (2014) y Mazloomi et al. (2012), razón por la que se optó por darle el valor presentado en la Ecuación 23.
Para encontrar la frecuencia de resonancia en función de los parámetros conocidos es importante considerar inicialmente la Ecuación 24.
Tras obtener las impedancias individuales del circuito EEC mostrado en la Figura 4, al determinar la impedancia total se obtiene la expresión dada en la Ecuación 25.
Sea la parte imaginaria de la impedancia total de la forma expresada por la Ecuación 26.
Para obtener la frecuencia de resonancia para esta configuración de dos etapas se procede como se muestra en la Ecuación 27.
Siendo entonces la Ecuación 28 la que nos permite obtener la frecuencia de resonancia del sistema.
2.8.1. Caudal de hidrógeno respecto de la temperatura
Dado el valor de Re mostrado en la Ecuación 29:
Dónde:
Del modelo EEC se tendría la Ecuación 30:
De la Tabla 1 se tiene que Vs=1,33 (V).
Al reemplazar los valores de Rce, Cce, Re se obtiene la Ecuación 31:
Empleando las Ecuaciones 31, 32, 33, 34 y 35 se obtiene el valor del caudal de hidrógeno en función de la temperatura, presentado en la Ecuación 36.
2.8.2. Caudal de hidrógeno respecto del área transversal de los electrodos
Considerando las Ecuaciones 30, 37, 38, 39, 40, 41 y 42 se puede obtener el valor del caudal de hidrógeno en función del área expresado por la Ecuación 43. Considerando un área variante:
2.8.3. Caudal de hidrógeno respecto del voltaje de entrada
Considerando la Ecuación 44, Ley de Ohm:
Se tiene el valor de caudal de hidrógeno en función del voltaje, como se indica en la Ecuación 45.
Donde la impedancia puede expresarse mediante las Ecuaciones 46, 47 y 48 como:
Entonces el caudal de hidrógeno en función del voltaje de entrada se puede expresar mediante la Ecuación 49 como:
2.8.4. Caudal de hidrógeno respecto del ancho de pulso
Considerando las Ecuaciones 50, 51 y 52 para posteriormente reemplazarlas en la Ecuación 53, con B representada mediante la Ecuación 54, se puede entonces obtener el caudal de hidrógeno como se muestra en la Ecuación 57 partiendo de la Ecuación 55 y empleando la Ecuación 56.
2.8.5. Caudal de hidrógeno respecto del espesor de electrolito o separación de los electrodos.
Cuando el espesor es variante aplicamos las Ecuaciones 58 y 59.
La impedancia se puede expresar mediante la Ecuación 61, donde X5 y X10 están representados por las Ecuaciones 47 y 60 respectivamente.
Partiendo de la Ecuación 55, tomando en cuenta que s=iω, se puede calcular el caudal de hidrógeno respecto del espesor, Ecuación 63, empleando la Ecuación 62.
Finalmente, los valores de resistencias y capacitancias obtenidos se muestran en la Tabla 8.
3. RESULTADOS Y DISCUSIÓN
Se presenta a continuación de forma gráfica la influencia de algunas de las variables que influyen en la producción de hidrógeno para luego realizar su respectivo análisis.
Para esto, se han seleccionado los valores comunes de éstas variables y otros parámetros en base a las referencias bibliográficas usadas a lo largo de este documento, de tal forma que al analizar la influencia de una de ellas en la producción de hidrógeno el resto permanezca sin modificarse.
3.1 Aplicación de una señal de excitación tipo DC
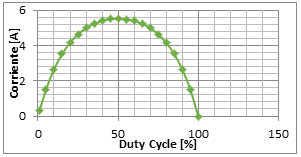
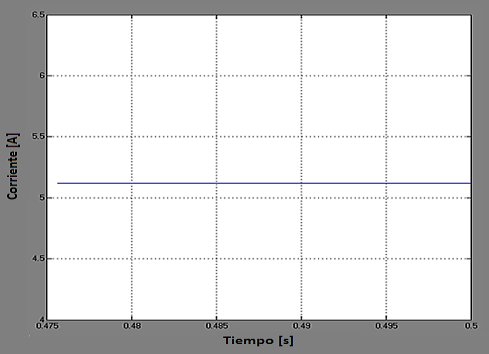
En la Figura 12, la respuesta del sistema de electrólisis por vapor sobrecalentado para una señal de excitación tipo DC de valor 1,33 (V).
La respuesta del sistema en el tiempo, es constante, alcanzando un valor de corriente de aproximadamente 5,12 (A), como se observa en la Figura 12.
3.2 Aplicación de una señal de excitación en forma de pulsos a frecuencia de resonancia
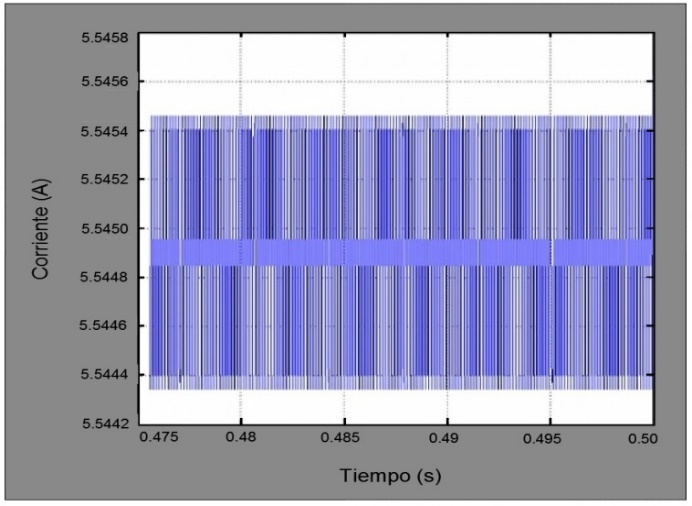
Obtenida la frecuencia de resonancia: fR=6,82131 (kHz), la respuesta del sistema ante una señal de pulsos con frecuencia fR se observa en la Figura 13.
En la Figura 13 se observa que la oscilación de la señal de respuesta del sistema es mínima y por lo tanto se la puede considerar como una señal DC con una amplitud de corriente de 5,5449 (A).
Esto permite demostrar que para una señal de excitación en forma de pulsos a frecuencia de resonancia aumenta la eficiencia del sistema en un 8.2988% como se muestra en la Ecuación 64.
Debido al aumento de eficiencia de la celda, se procede a trabajar con una señal en forma de pulsos a frecuencia de resonancia, lo cual incide de forma positiva en la producción del gas hidrógeno a partir de vapor sobrecalentado de agua.
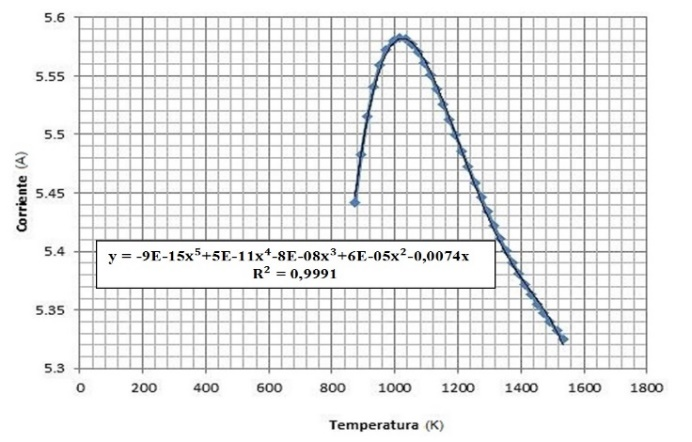
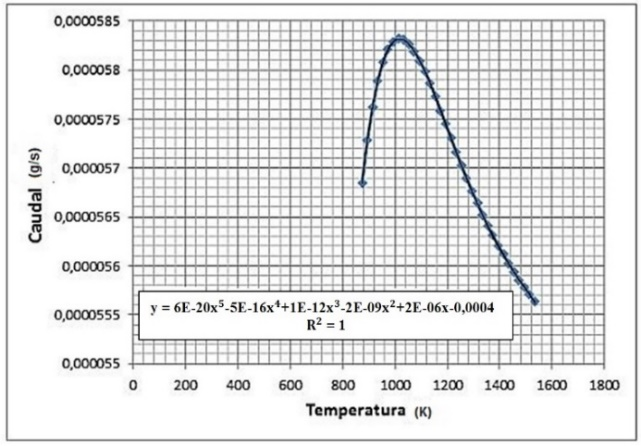
3.3 Influencia de la temperatura en la producción de hidrógeno
Análisis de resultados de las Figuras 14 y 15:
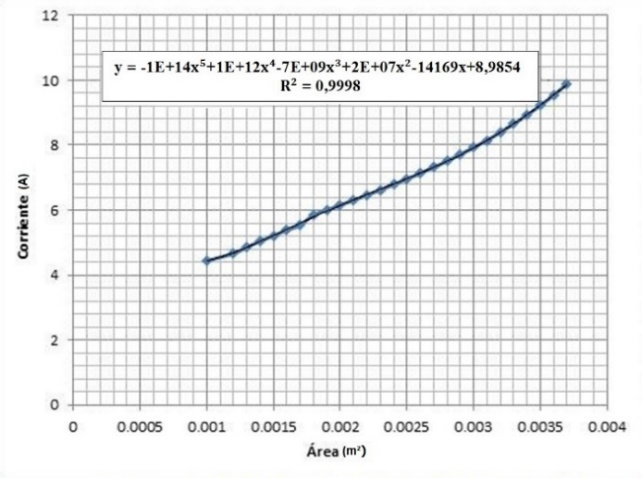
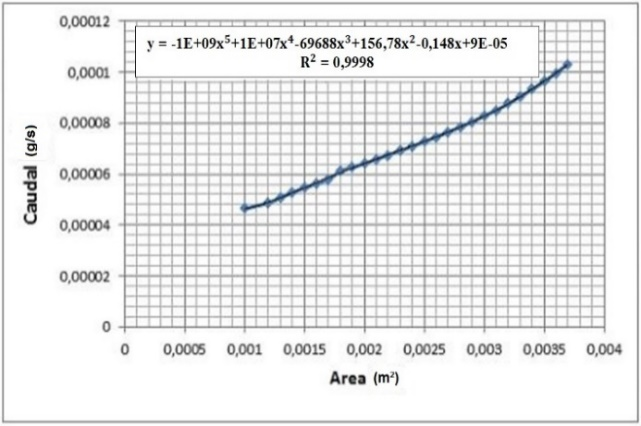
3.4 Influencia del área transversal de los electrodos en la producción de hidrógeno.
Análisis de resultados de las Figuras 16 y 17:
El comportamiento de la celda con respecto al área transversal se puede aproximar a una recta con pendiente positiva, esto implica que, a mayor área, mayor corriente. Sin embargo, aumentar el área transversal de la celda implica un aumento de costos. Ante aquello, se presenta una alternativa que consiste en aumentar el área transversal de la celda dependiendo la aplicación en la que vaya a ser utilizada. Con esto, se calcula el área que se puede ocupar maximizando el rendimiento y evitando las pérdidas tanto monetarias como de recursos.
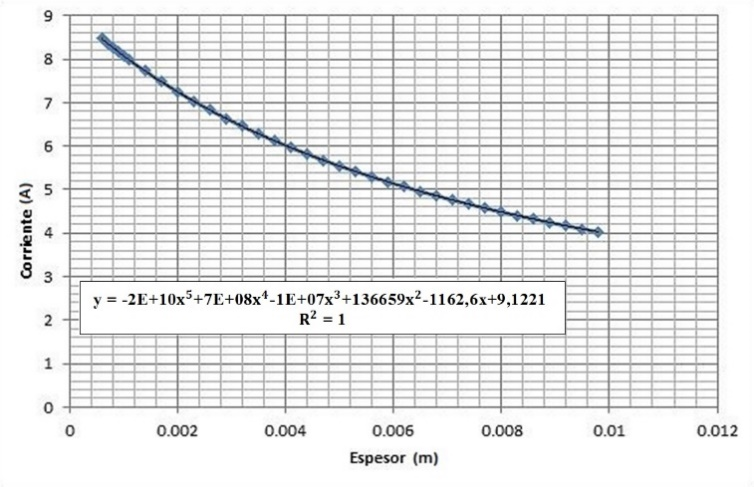
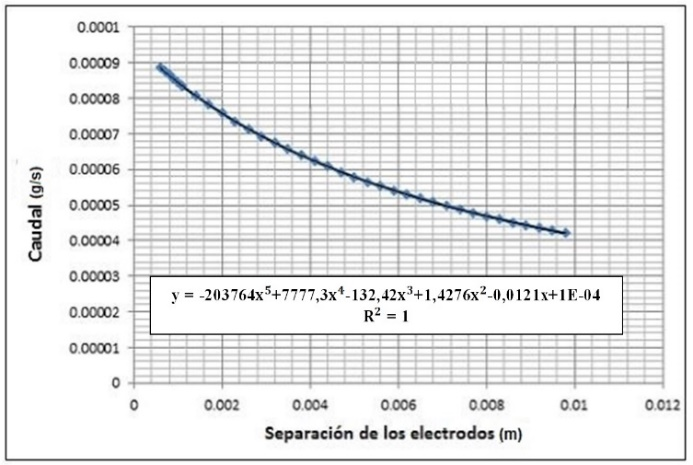
3.5 Influencia del espesor del electrolito (equivalente a la separación de los electrodos) en la producción de hidrógeno.
Análisis de resultados de las Figuras 18 y 19:
-
La caída de la corriente en una celda aumenta a medida que crece la separación de los electrodos, lo que sugiere que para que la electrólisis maximice su producción, las placas deben encontrarse muy cerca una de otra. Esto debido al hecho de que para la corriente eléctrica es más fácil y ventajoso atravesar distancias cortas.
Se recomienda finalmente, tener cuidado en cuanto a la separación electrodo-electrolito se refiere, pues a pesar de que estos deben encontrarse cerca, no pueden estar en contacto, entonces, es necesario usar instrumentos de precisión para acercar dichos materiales.
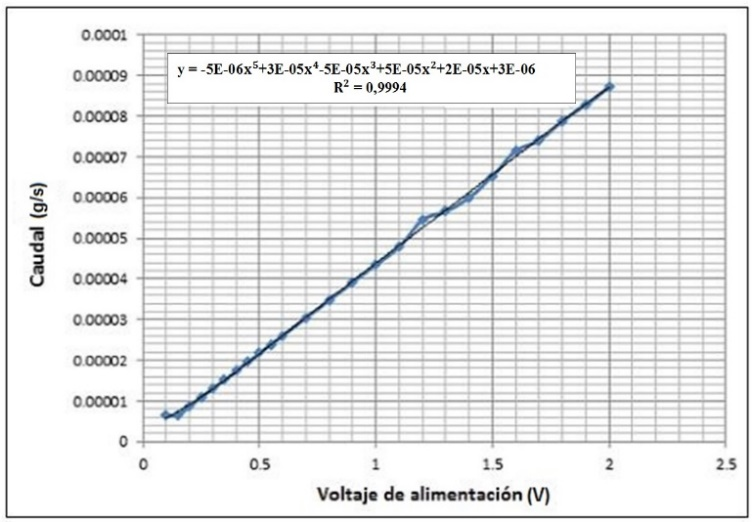
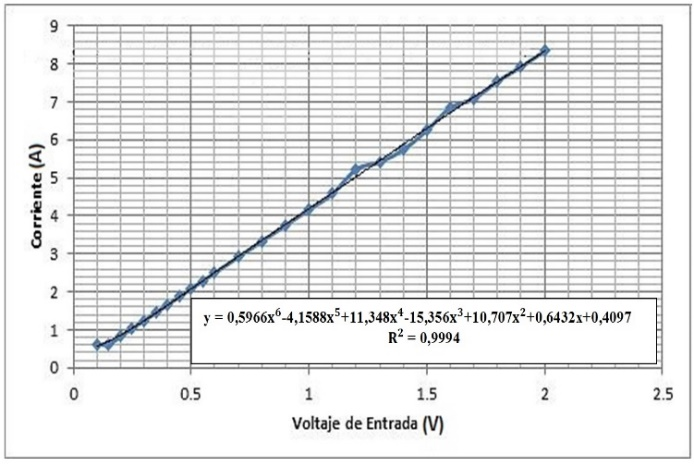
3.6 Influencia del voltaje de entrada en la producción de hidrógeno
Análisis de resultados de las Figuras 20 y 21:
-
A medida que aumenta el voltaje de alimentación de la celda, aumenta la corriente y, por lo tanto, aumenta el caudal de hidrógeno.
Para aumentar la eficiencia del sistema, se debe aumentar el voltaje de alimentación del mismo, sin embargo, la pérdida de energía que se produce debido a la ley de Joule, es un limitante, que produce pérdida de eficiencia. Por encima de cierto valor del voltaje de alimentación la pérdida de eficiencia aumenta progresivamente. Por lo tanto, el voltaje de una celda debe oscilar entre 0,8 y 2,6 (V).
4. CONCLUSIONES
Se ha logrado cumplir con el objetivo de la presente investigación, esto es, modelar la producción de hidrógeno en una celda electrolítica simple usando como entrada vapor sobrecalentado de agua con un consumo de energía eficiente, alcanzada por medio del uso de una señal de excitación en forma de pulsos a frecuencia de resonancia; con el fin de permitir el diseño y dimensionamiento de equipos de electrólisis.
El proceso de producción de hidrógeno mediante electrólisis con vapor sobrecalentado puede ser representado mediante un sencillo circuito eléctrico, en el cual, los valores de los elementos dependen de los fenómenos electroquímicos que se presentan en el sistema.
La representación del proceso mediante un sistema eléctrico facilita significativamente su análisis, puesto que para su comprensión sólo es necesaria la teoría de circuitos.
Algunos de los fenómenos electroquímicos que se presentan en el proceso pueden ser representados de forma aproximada mediante elementos eléctricos no ideales como el capacitor de doble capa.
La eficiencia del sistema aumenta aplicando una señal de excitación de pulsos a frecuencia de resonancia, esto se debe a que a esta frecuencia la parte reactiva de la impedancia se anula y se vuelve puramente resistiva.
La variación de la eficiencia del sistema con respecto a la temperatura es no lineal y presenta su máximo valor en el rango de 773 a 1 873 (K).
La eficiencia del proceso varía de forma aproximadamente lineal respecto el área transversal de los electrodos, esto normalmente implicaría que para un área suficientemente grande la eficiencia del proceso será del 100(%), sin embargo, el aumento del área implica costos, tanto por la cantidad de material como por el tamaño del equipo necesario para despresurizar la celda, lo que limita el valor de la misma.
La eficiencia del proceso varía de forma no lineal e inversa, aproximadamente logarítmica, con respecto a la distancia de separación de los electrodos, esto se debe a que la disminución de la distancia entre electrodos, reduce el valor de la resistencia del electrolito.
La eficiencia del proceso con respecto a la amplitud de la señal de excitación del mismo es máxima para valores de entre 0,8 y 2,66 (V), para valores mayores se pierde energía debido a la ley de Joule.
El caudal de hidrógeno producido varía de forma lineal con la corriente del mismo, esta variación está dada por la ley de Faraday.
Finalmente, la obtención matemática de la función de transferencia o a su vez del modelo en espacio de estados de una celda electrolítica simple, podría ser un tema de mucho interés para futuras investigaciones a fin de dar paso a la aplicación de una teoría de control clásica o moderna que permita elevar aún más, de forma eficiente, la producción de hidrógeno a partir de vapor sobrecalentado de agua. Además, la construcción de una celda electrolítica simple que trabaje a alta temperatura sería conveniente a fin de analizar y comparar los resultados experimentales con los resultados aproximados obtenidos en el presente trabajo.