1. INTRODUCCIÓN
La ingeniería a nanoescala ayuda a entender y a controlar la materia en su nivel más fundamental: a nivel atómico y molecular. En los últimos años, las partículas a nanoescala han atraído mucha atención debido a sus inusuales propiedades electrónicas, ópticas y magnéticas (Mahmoudi et al., 2010). Las partículas magnéticas de tamaño nanométrico (1-100 nm), entre ellas las de óxidos de hierro, han sido utilizadas en varias aplicaciones prometedoras como catálisis, dispositivos electrónicos, almacenamiento de información, sensores, biomedicina, dispositivos de almacenamiento magnético y remediación ambiental. (Mahmoudi et al., 2010), (Mohmood et al., 2013).
Dentro del rango extenso de nanopartículas magnéticas, la magnetita (Fe3O4), ha emergido como un candidato prometedor debido a su biocompatibilidad y sus excelentes propiedades magnéticas. Diferentes técnicas químicas han sido aplicadas para producir nanopartículas de magnetita con propiedades uniformes y una estrecha distribución de tamaños.
Entre las técnicas de obtención se tiene: descomposición térmica, síntesis hidrotérmica, co-precipitacion, oxidación de hidróxido férrico mediante KNO3, etc. (Palanisamy et al., 2014).b Sin embargo, la co-precipitación es el procedimiento químico más comúnmente utilizado debido a su simplicidad, relación costo - efectividad y la facilidad de adaptación de las propiedades de las partículas, además que es un método fácilmente escalable. (Devaraj et al., 2008)
Una dificultad relacionada con la naturaleza de los ferrofluidos es que las nanopartículas, las cuales tienen una gran relación entre área superficial y volumen, tienden a aglomerarse para reducir su energía superficial mediante fuertes atracciones magnéticas dipolo-dipolo (Kim et al., 2001). Un proceso espontáneo, conocido como envejecimiento, tiene lugar en cualquier dispersión coloidal en el transcurso del tiempo, el cual involucra (i) un incremento en el tamaño primario debido a la solubilidad de las partículas sólidas en el líquido; (ii) la aglomeración debido a la adhesión de las partículas coloidales por medio de las fuerzas de Van der Waals en general y en especial la contribución magnética en el caso de la magnetita; (iii) la transformación química de la magnetita (Fe3O4) a maghemita (Fe2O3) debido a la adsorción de moléculas de oxígeno (Tombacz et al., 2006). Por lo tanto, recubrir la superficie de las nanopartículas puede prevenir efectivamente la adhesión de las partículas que se encuentran colisionando durante el movimiento térmico producido en la síntesis. En un medio acuoso, capas de estabilización electrostática estérica pueden evitar la aglomeración de las nanopartículas (Tombacz et al., 2006). Para esto se suele cargar positiva o negativamente a las partículas, mediante el tratamiento con soluciones ácidas o alcalinas; para obtener dispersiones estabilizadas mediante repulsiones electroestáticas (Lefebure et al., 1998). La repulsión electroestática ayudaría a que las nanopartículas posean una mayor superficie específica, debido a la menor aglomeración de las mimas, con lo cual, se beneficiaría la remoción de contaminantes de efluentes líquidos.
Devaraj et al. (2008), lograron mejorar el rendimiento de 69 a 81 % mediante el método de coprecipitación, al aumentar la velocidad de agitación de 500 a 1000 rpm, respectivamente.
En este trabajo se pretendió aumentar la cantidad de nanopartículas de magnetita obtenidas por el método de coprecipitación, disminuir el tamaño y distribución de tamaños de las partículas, mediante la variación de la velocidad de agitación y el tiempo de reacción. Además, se estudió la influencia del pH en la aglomeración de las nanopartículas de magnetita.
2. METODOLOGÍA
Para la síntesis utilizó el equipo presentado en la figura 1. Una dispersión acuosa de nanopartículas de magnetita fue preparada usando el método de co-precipitación, mediante la alcalinización de una mezcla acuosa de sales ferrosas y férricas con NaOH a 50 oC. Se agregó gota a gota 25 mL de una solución 1.28 M de FeCl3·6H2O (99%), 0.64 M FeCl2·4H2O y 0.4 M de HCl (37%) sobre 250 mL de la solución 0.9 M de NaOH (99%) bajo agitación magnética vigorosa (500 y 1000 rpm) por 30 y 45 min a 50 oC bajo un ambiente no oxidante de argón. El polvo negro precipitado se aisló aplicando un campo magnético externo y el sobrenadante se removió del precipitado por decantación. El polvo fue lavado 4 veces con agua destilada. Posteriormente, una solución 0.01 M de HCl fue agregada para neutralizar la carga aniónica de la superficie de las partículas obtenidas.

Figura 1. Esquema del equipo empleado a) Embudo de separación b) Termómetro c) Ingreso de argón d) Balón de tres vías e) Plancha de calentamiento (Marca: Thermo Fisher, Modelo: Cimarec)
Para la caracterización de las nanopartículas de magnetita obtenidas se empleó un equipo de difracción de rayos X (DRX) que permitió determinar la identidad de las muestras. Para obtener los patrones de difracción de rayos X, la muestra fue secada durante 12 horas a 80 oC.
Para la caracterización estructural por difracción de rayos X (DRX) de las nanopartículas de magnetita obtenidas se empleó un difractómetro Empyrean de Panalytical. Para ello, las muestras fueron secadas durante 12 h a 80oC. Para observar el comportamiento de las partículas en solución se empleó el método de dispersión dinámica de luz (DLS) en un analizador Brookhaven 90 Plus. Para determinar el diámetro de las nanopartículas y observar su morfología se empleó microscopía electrónica de transmisión (TEM) con un microscopio Tecnai G2 Spirit Twin de FEI. Los análisis de espectroscopía Raman fueron realizados en un espectrofotómetro Horiba LabRAM HR Evolution. Para la caracterización mediante DDL se dispersó la muestra en agua a pH 1.
Las muestras se identificaron usando la siguiente nomenclatura mg-1 (1 000 rpm y 45 min), mg-2 (1 000 rpm y 30 min), mg-3 (500 rpm y 30 min) y mg-4 (500 rpm y 45 min).
3. RESULTADOS Y DISCUSIÓN
3.1 Composición de fase de las nanopartículas
La figura 2 muestra el patrón de DRX para las nanopartículas de magnetita sintetizadas. Cabe señalar que la longitud de onda empleada fue Cu K-alpha, 0.15418 nm (Bragg-Brentano). Los ángulos de difracción 2θ aparecen en los valores 30; 35,22; 43,33; 53,45; 56,90 y 62,76 con sus correspondientes planos de reflexión 220, 311, 400, 422, 511 y 440, lo cual demuestra que se trata de un compuesto de magnetita, con una estructura cristalina de espinela con arreglo cúbico empaquetado (Kim et al., 2001). Generalmente los picos de difracción en los planos de reflexión 113 y 210, 213 y 210 son característicos de la maghemita y hematita, respectivamente.
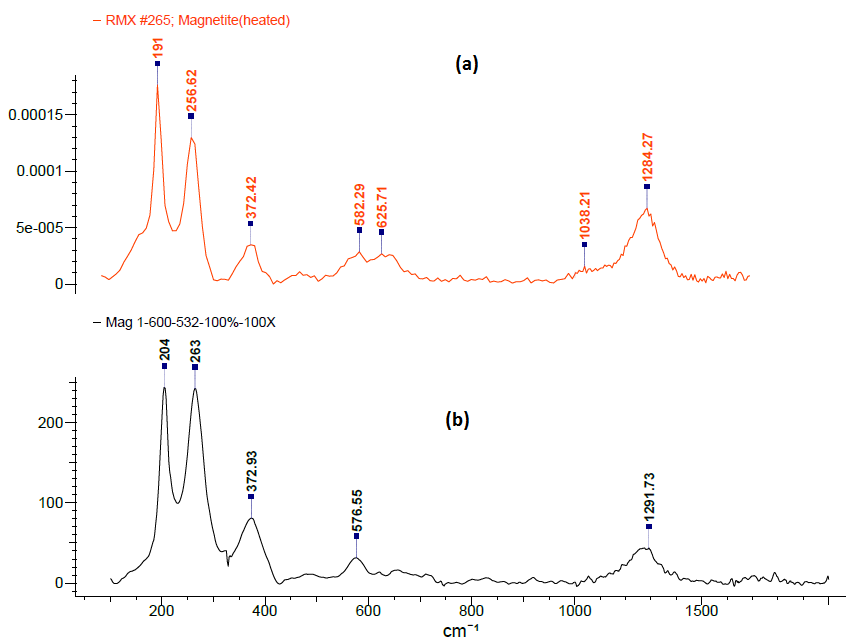
Para corroborar los resultados obtenidos en la difracción de rayos X se realizó el análisis de espectroscopía Raman de la muestra de nanopartículas obtenidas a 45 minutos y 1000 rpm. Este análisis consiste en hacer incidir un haz de luz láser sobre la muestra, una porción de la luz se dispersa inelásticamente y experimenta ligeros cambios de frecuencia característicos de cada material, que se presenta a manera de un espectrograma. En la figura 3 se presentan los espectrogramas correspondientes a la muestra y a la magnetita de acuerdo a la biblioteca Bio-Rad’s HORIBA Edition KnowItAll.
Como se observa en la figura 3, los picos de la muestra mg-1 coinciden con los correspondientes al espectro RMX #265 Magnetite (heated). De esta manera se pudo confirmar la identidad de la muestra. La diferencia en los picos se debe a que la muestra es una mezcla de fases de los óxidos de hierro mencionados anteriormente. Estos resultados confirman que se puede emplear la espectroscopía Raman como una técnica de caracterización alternativa y complementaria a la difracción de rayos X (Faria et al., 1997), (Perez et al., 2009).
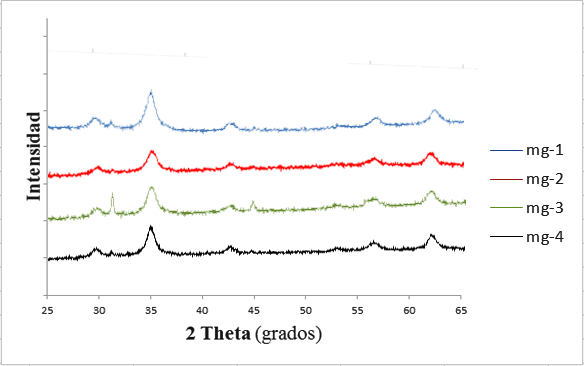
Figura 2. Patrón de difracción de rayos X de las muestras de magnetita mg-1 (1000 rpm; 45 min), mg-2 (1000 rpm; 30 min), mg-3 (500 rpm; 30 min) y mg-4 (500 rpm; 45 min)
3.2 Efecto de tiempo de reacción en el rendimiento de las nanopartículas.
En la Tabla 1 se presenta el porcentaje de rendimiento de la síntesis de nanopartículas de magnetita a diferentes condiciones de trabajo. Se aprecia que el porcentaje de rendimiento de la reacción aumenta al incrementar la velocidad de agitación y el tiempo de reacción. Es decir, la velocidad no solo distribuye mejor las especies reactantes en el medio, sino que además acelera el proceso de precipitación. Se puede pensar que el aumento de la velocidad de agitación ayuda a una mejor formación de núcleos en la solución súper-saturada debido a que más moléculas de las sales ferrosas y férricas se distribuyen de mejor manera en la solución alcalina. Por lo tanto, se observa un aumento de la formación de Fe3O4 en el medio de reacción. También se aprecia que, al aumentar el tiempo de reacción, aumenta el rendimiento de la reacción, por lo que es indispensable que las especies reactantes permanezcan en el licor madre el tiempo suficiente para la formación de nanopartículas de Fe3O4. Este fenómeno va de acuerdo con la teoría de nucleación y crecimiento de cristales, en la cual, al aumentar la velocidad de agitación y el tiempo de reacción, también se incrementa la velocidad de nucleación, por ende, el rendimiento de la reacción.
Existen tres regímenes de la generación de partículas durante el proceso de precipitación:
i. Tiempo de inducción: Se forman unidades de construcción de sólidos (todavía en la solución)
ii. Periodo de nucleación: La nucleación ocurre cuando la concentración de las unidades de construcción alcanza el nivel de saturación
iii. Fase de crecimiento: El crecimiento se da luego del periodo de nucleación hasta que las especies en reacción en la solución alcanzan el equilibrio.
El núcleo generado tiene que alcanzar el radio crítico (R) después del cual es estable y continúa con el subsecuente crecimiento. Las partículas con un radio inferior a R se disolverán dentro del medio de reacción. Se puede decir que, dada cierta concentración de los reactantes, un número máximo de los núcleos van a ser formados si se deja reaccionar el tiempo suficiente en el cual se formen núcleos estables. A cortos tiempos de reacción, no muchos núcleos estables son generados dado que el tiempo de residencia de los núcleos en el licor madre es probablemente muy corto. Así, a bajos tiempos de reacción, el rendimiento de las partículas va a ser corto. Incrementar el tiempo de reacción debería tener un efecto positivo en el rendimiento además que nanopartículas más estables podrían ser generadas. Sin embargo, esto podría ser cierto dentro de un intervalo de tiempo de reacción, ya que procesos secundarios como la maduración de Ostwald podría dominar, causando que partículas más grandes crezcan a expensas de partículas más pequeñas. Esto podría afectar adversamente el rendimiento de la reacción (Devaraj et al., 2008).
3.3 Efecto de la velocidad de agitación en el tamaño y distribución de tamaños de las partículas
Las micrografías MET de las nanopartículas de Fe3O4 mg-1, mg-2, mg-3 y mg-4 se muestran en la figura 4. Los diámetros promedio obtenidos por MET de las muestras fueron 7 ± 4; 8 ± 3; 9 ± 6 y 23 ± 13 nm, para mg-1, mg-2, mg-3 y mg-4, respectivamente. En las micrografías de la figura 4 se observa que las nanopartículas forman agregados. Además, en las nanopartículas sintetizadas al mismo tiempo de reacción, se puede observar una mayor aglomeración en las muestras mg-3 y mg-4, además de una amplia distribución de tamaños. Esto mejora sustancialmente al aumentar la velocidad de agitación en la reacción, como se puede observar en los casos de las muestras mg-1 y mg-2 pero a diferentes velocidades de agitación figura 4 a), 4 d) y figura 4 b), 2 c), el tamaño disminuye en 70 % y 10 %, respectivamente, al aumentar la velocidad de agitación de 500 a 1 000 rpm.

Figura 4. Imágenes TEM de Fe3O4 sintetizada bajo las siguientes condiciones experimentales (a) mg-1, 1 000 rpm, 45 min de agitación, (b) mg-2, 1 000 rpm, 30 min de agitación, (c) mg-3, 500 rpm, 30 min de agitación y (d) mg-4, 500 rpm, 45 min de agitación
Por otra parte, en las partículas obtenidas a 1000 rpm y diferente tiempo de reacción Figura 4 a) y 4 b) no se aprecia cambios significativos en el tamaño y la distribución de tamaños de las partículas, a diferencia de las partículas obtenidas a 500 rpm Figura 4 c) y 4 d), en las cuales se observa una distribución de tamaños menos homogénea y un aumento del 250 % del tamaño de partícula al incrementar el tiempo de reacción de 30 a 45 min.
Probablemente la velocidad de agitación tiene una mayor influencia sobre el tamaño y distribución de tamaños de las nanopartículas que el tiempo de reacción. Esto sería atribuido a que se evita el crecimiento de cristales en la etapa de síntesis al momento de aumentar la velocidad de agitación. Samarghandi et al. (2015) obtuvieron nanopartículas de magnetita con un diámetro de 13 nm mediante el método de coprecipitación a 1 000 min-1 y 80 °C. Dicho diámetro es mayor al obtenido para mg-1 (7,45 nm). Esta diferencia puede ser atribuida a la temperatura de reacción empleada por los autores en la síntesis de las nanopartículas.
Por otra parte, a bajas velocidades de reacción, las partículas tienden a aglomerarse. Una dispersión uniforme completa en todas las partículas no es posible cuando la velocidad de agitación es baja, porque una movilidad acelerada de las partículas en el medio y una dispersión uniforme de las especies nucleadas ocurre cuando existe una alta velocidad que favorece la obtención de partículas más pequeñas y con una estrecha distribución de partículas (Samarghandi et al., 2015). Esto también puede ser corroborado con los diámetros efectivos de cada una de las muestras analizadas. Estos diámetros fueron obtenidos mediante DLS y se resumen en la Tabla 2.
Los diámetros efectivos, índices de polidispersión y porcentajes de partículas mayores y menores a 100 nm, obtenidos mediante DLS para las muestras mg-1, mg-2, mg-3 y mg-4, se presentan en la Tabla 2. En todas las muestras se observa un diámetro efectivo mayor a los 100 nm, lo que confirma lo hallado en las micrografías de la Figura 2, es decir, que las nanopartículas se encuentran aglomeradas, sin embargo, en los histogramas obtenidos mediante DLS se determinó que existen grupos de aglomerados de nanopartículas que superan el rango nanométrico (mayores a 100 nm) y otros que se encuentran dentro del mismo. En la Tabla 2 se nota que, a mayor velocidad de agitación, incrementa la cantidad de agregados que se encuentran dentro del rango nanométrico. Por otra parte, a 1 000 rpm, a mayor tiempo de reacción incrementa la cantidad de aglomerados dentro del rango nanométrico, a diferencia de 500 rpm, que disminuye la cantidad de aglomerados dentro del rango, al incrementar el tiempo de reacción. Se podría decir que, las nanopartículas que poseen mayor diámetro tienden a formar agregados más grandes. Además, el índice de polidispersión en todas las muestras es menor a 0,4, por lo que se trata de una muestra moderadamente polidispersa, es decir, los aglomerados poseen una moderada distribución de tamaños.
Tabla 2. Diámetros efectivos de las muestras obtenidos mediante DLS.
| Muestra | Diámetro efectivo (nm) | Partículas < 100 nm (%) | Partículas > 100 nm (%) | Índice de Polidispersión |
|---|---|---|---|---|
| mg-1 | 162,3 | 43,86 | 56,14 | 0,283 |
| mg-2 | 125,8 | 26,95 | 73,05 | 0,309 |
| mg-3 | 162,9 | 19,02 | 80,98 | 0,207 |
| mg-4 | 161,1 | 12,57 | 87,43 | 0,245 |
Tabla 3. Comparación de los diámetros obtenidos por TEM y DLS para las muestras mg-1, mg-2, mg3 y mg-4
| Muestra | mg-1 | mg-2 | mg-3 | mg-4 |
|---|---|---|---|---|
| Diámetro TEM (nm) | 7 ± 3 | 8 ± 3 | 9 ± 6 | 23 ± 13 |
| Diámetro efectivo DLS (nm) | 162,3 | 128,8 | 162,9 | 161,1 |
En la tabla 3 se presenta los diámetros obtenidos por TEM y DLS, de las muestras mg-1, mg-2, mg-3 y mg-4. De acuerdo a los datos de la tabla 3 se puede evidenciar que existe una gran diferencia entre los diámetros obtenidos mediante TEM y DLS para todas las muestras, debido a que mediante DLS se observa el comportamiento de las nanopartículas cuando estas se encuentran en solución, a diferencia de TEM que nos enseña una micrografía de los aglomerados obtenidos de las nanopartículas. Además, se evidencia que todas las muestras se encuentran aglomeradas.
3.4 Influencia del pH del medio de dispersión en la aglomeración de las nanopartículas
En la tabla 4 se muestran los diámetros efectivos a diferentes pH del medio de dispersión para la muestra mg-1. En la tabla 3 se puede observar que al disminuir el pH de 7 a 1, se reduce el diámetro efectivo en un 60,5 %, demostrando la clara influencia del pH sobre la aglomeración de las nanopartículas.
Las nanopartículas están dispersas en un medio a pH 7, el cual se encuentra cercano al punto cero de carga de la magnetita igual a 7.2. En este punto la partícula, al no tener carga alrededor, tiende a agregarse debido a las interacciones que existen entre las partículas ya sean de carácter magnético o a las fuerzas de Van der Waals. El ajuste del pH ayuda a que las partículas de magnetita, las cuales son sólidos anfóteros, puedan desarrollar cargas en las reacciones de protonación (Fe-OH + H+→Fe-OH2+) o deprotonación (Fe-OH→ Fe-O- + H+) en los sitios del Fe de la superficie de la partícula. Estas reacciones en la superficie pueden ser interpretadas como la adsorción especifica de iones H+- y OH— en la interfaz sólido/agua. El campo electroestático desarrollado alrededor de las partículas de magnetita en condiciones de pH ácidas o alcalinas alejadas del pH del punto cero de carga, puede prevenir la agregación de las partículas próximas debido a la repulsión de las partículas que presentan una misma carga en su superficie. Por ello, una estabilización electroestática puede proveer una estabilidad coloidal en soluciones de magnetita.
Las nanopartículas de magnetita al poseer una gran relación área/volumen, tienen una alta tendencia a agregarse con el objeto de minimizar la alta energía que estas poseen en su superficie. Por ello, la estabilización electroestática no soluciona definitivamente el problema de aglomeración entre nanopartículas. Para esto se podría recubrir la superficie de las nanopartículas para evitar dicho fenómeno.
El tamaño de las partículas también se ve influenciado por las condiciones de síntesis a las que se trabajó, ya que parámetros tales como: la velocidad de agitación, los precursores de hierro usados, concentración de la solución alcalina y la temperatura, pueden afectar al tamaño de las partículas producidas.
Tabla 4. Diámetros efectivos obtenidos mediante DLS para la muestra mg-1 a diferentes pH.
| Muestra | pH | Diámetro efectivo (nm) |
|---|---|---|
| mg-1 | 7 | 411,2 |
| 1 | 162,3 |
Cabe señalar que en este trabajo se obtuvieron nanopartículas empleando una temperatura de síntesis inferior a la empleada por otros autores (Devaraj et al., 2008), lo cual representa un ahorro energético que se vería reflejado en el costo de obtención del material a nivel industrial.
4. CONCLUSIONES
Mediante el aumento de la velocidad de agitación y el tiempo de reacción en la síntesis de nanopartículas de magnetita por coprecipitación fue posible mejorar el rendimiento de la reacción, disminuir el tamaño de partícula y obtener una distribución de tamaños más estrecha. Además, el incremento del tiempo de reacción aumentó el rendimiento de la reacción. Se obtuvieron nanopartículas de magnetita de 7 nm de diámetro promedio a 50 °C, 1 000 min-1 y se consiguió un rendimiento de la reacción del 94%. Además, se pudo observar la clara influencia del pH del medio de dispersión, en la aglomeración de las nanopartículas de magnetita, el diámetro efectivo disminuyó en un 60,5 % al disminuir el pH de 1 a 7.
Las nanopartículas de magnetita sintetizadas serán utilizadas en trabajos posteriores para la remoción de metales pesados de aguas contaminadas. Adicionalmente, se formularán materiales compuestos magnéticos a partir de residuos lignocelulósicos para aplicaciones medioambientales.