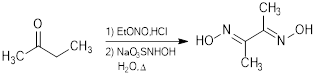1 Introducción
En el área de la química de coordinación (Basolo & Johnson, 1964), los agentes quelantes ocupan un lugar preponderante como ligandos de interés significativo (Kauffman, 2011). Agentes quelantes como el ácido etilendiaminotetracético (EDTA) (Molar, 2013) o los compuestos tipo N,N’-bis(salicilideno)etilendiamina (H2salen) (Contreras & Rojas, 2018), entre otros, han sido muy utilizados en la química analítica como reactivos para las titulaciones complejométricas (complejometría) (West, 1969). Ahora bien, dentro de los quelatos también ocupa un lugar preponderante la dimetilglioxima, un compuesto que por más de cien años (Kolthoff & Elving, 1959) ha ocupado un papel preponderante en el análisis químico cualitativo y cuantitativo (Valcarcel, 2000). La dimetilglioxima, (dmgH2), es el reactivo más utilizado en las “marchas analíticas” para la identificación cualitativa de níquel, por formación del bisdimetilglioximato de níque(II), un sólido de característico color rojo. Esta reacción fue reportada originalmente en 1905 por el químico ruso Lev Aleksandrovich Chugaev (el apellido es traducido también como “Tschugaeff”) (1873-1922), profesor de química de la Universidad de San Petersburgo (Tschugaeff, 1905). Chugaev desarrolló un trabajo pionero en el campo de la química de coordinación (Kauffman, 1973). Desde entonces, la dimetilglioxima goza de una popularidad como un reactivo analítico, no solo para el níquel(II) sino para muchos otros metales de transición, que forman compuestos coloreados, muy adecuados para el desarrollo de métodos colorimétricos (Mitchell, 1945) de identificación y cuantificación. Desde un punto de vista técnico y económico, la dimetilglioxima tienen ventajas, especialmente porque su síntesis consiste en la reacción entre la butanona y el nitrito de etilo, seguida de una reacción con monosulfonato de hidroxilamina (fig. 1).

Figura 2: Estructura del complejo clásico bisdimetilglioximato de metal (II), [M(II)(dmgH)2], M = Ni, Fe, Co, Pd, Pt.
La dimetilglioxima puede formar complejos plano cuadrados, [M(dmgH)2] (fig. 2), u octaédricos, [M(dmgH)2X2], con M = Ni(II), Fe(II)/(III), Co(II)/(III), Pd(II), Pt(II), otros metales de transición (Cotton & Wilkinson, 1988) y algunos lantánidos (Sastri, 2003), una reacción favorecida por el efecto quelato (Hancock, 1992). El propio Chugaev discutió sobre la formación de anillos quelatos con diaminas y niquel(II) (Tschugaeff, 1906). Al momento de coordinar, la dimetilglioxima, o mejor, su base conjugada el dimetilglioximato, (dmgH)1-, adopta una configuración “anti” que favorece el establecimiento de enlaces de hidrógeno entre los protones de las oximas, que le permite formar un anillo quelato de cinco miembros (Lee, 1977), y estabilizar cationes divalentes, en un ambiente plano-cuadrado, con un entorno metálico M(N4) y grupo puntual D2h.
En el presente artículo, se expone una breve revisión sobre la importancia de la dimetilglioxima en el área de la química de coordinación, y algunas otras aplicaciones, que hacen que este ligando no haya perdido su vigencia en los últimos cien años.
2 Metodología
Este artículo desarrolla una investigación cualitativa-documental sobre la dimetilglioxima, su importancia en la química de coordinación y algunas de sus aplicaciones. Se utilizaron bases de datos reconocidas en el área de la química tales como: Chemical Abstracts (SciFinder), SCOPUS, Science Direct, Web of Science (ISI web), utilizando como entrada las siguientes palabras clave: dimethylglyoxime, metallic complexes, coordination chemistry, nickel complexes, entre otras, y combinaciones de ellas. Se empleó el rango de tiempo más amplio permitido por estas bases de datos, usando como punto de partida la publicación de Lev A. Chugaev (Tschugaeff, 1905).
3 Resultados y Discusión
Aspectos generales del ligando dimetilglioxima
Los primeros estudios sistemáticos con el ligando dimetilglioxima fueron publicados por Lev A Chugaev en la revista alemana clásica de química Berichte der Deutschen chemischen Gesellschaf, a partir de 1905. En sus trabajos, Chugaev reportó la actividad quelante de la dimetilglioxima frente a metales de transición, un trabajo fundamental en la historia de la química de coordinación (Kauffman, 2011). A partir de ese momento, la dimetilglioxima adquiere importancia, especialmente por la posibilidad de utilizar los bisdimetilglioximatos de metales en la química analítica, para identificar y cuantificar cationes de metales de transición. De hecho, la dimetilglioxima es históricamente el primer reactivo orgánico específico para pruebas de identificación de níquel (Kaufman, 1963) que, adicionalmente, pudo ser cuantificado, mediante la formación del complejo clásico bis(dimetilglioximato- κ2 N,N´)níquel(II), con un límite de detección del orden de las partes por millón (Willie, 2003). La formación de complejos bisdimetilglioximato metálicos esta favorecida por el efecto quelato y, adicionalmente, por un efecto asociado a los hidroxilos de la oxima. De hecho, la forma más común en que la dimetilglioxima reacciona para coordinar un metal de transición pasa por la pérdida del protón de una de las oximas, para formar el anión (dmgH)1-, bajo esta forma, el ahora dimetilglioximato tiene la posibilidad de formar un enlace de hidrógeno del tipo =N-O•••H-O-N’= (Rovira et al., 2002), que orienta a los dos dimetilglioximatos a ordenarse, casi como un “efecto plantilla”, alrededor del metal de transición, en un anillo heterocíclico (macrociclo) altamente plano, muy similar al ambiente que ofrece un anillo aza-, oxo- o tioporfirínico (Matano, 2017) o el macrociclo cyclam. El cyclam, 1,4,8,11-tetraazaciclotetradecano, y sus compuestos relacionados (Barefield, 2010), constituyen una familia de quelatos muy utilizados para acomplejar niquel(II) (3d 8 , estado fundamental 3 F) y otros metales de transición (Elias, 1999). La estructura del bisdimetilglioximato de níquel confirma el grado de planaridad del sistema, con un níquel(II) que estaría formando enlaces a través de una hibridación dsp2 (dx 2 -y 2) (Parish, 1977), una longitud de enlace Ni-N del orden de 1,85 Å (Williams et al., 1959], y un espectro de infrarrojo característico para un complejo plano cuadrado, [M(II)(dmgH)2], con M = Ni, Cu, Co, Pd, Pt, en una simetría D2h entorno al centro metálico (Bigotto et al., 1970; Orel et al, 1980), y octaédrico, [Co(III)(dmgH)2X(py)], con X = Cl, Br, I, -CH3 y py = piridina, (Rutherford & Thornton, 1978). Es importante señalar que la dimetilglioxima también puede formar un quelato sin perder los protones de la oxima, como en el caso del complejo mixto H2dmg/Hdmg: dicloro(dimetilglioxima-κ2 N,N′)(dimetilglioximato-κ2 N,N′)cobalto(III) (Ramesh et al., 2008). La dimetilglioxima también puede formar con facilidad complejos octaédricos, los cuales tienen un interés particular en otras áreas diferentes a la química de coordinación o analítica, por ejemplo, presentan actividad en reacciones de transformación del grupo funcional o de interés catalítico (Gage & Branchaud, 1996). También se conoce el bis(dimetilglioximato- κ2 N,N´)bis(piridina- κN)metal(II) (fig. 3), que tiene un particular interés debido a la posibilidad de utilizarlos como modelo de metalobiomoléculas.
La dimetilglioxima, CH3C(=NOH)C(=NOH)CH3, un sólido incoloro, con punto de fusión de 240-241 °C, se puede obtener comercialmente con más de un 99% de pureza [número de referencia: (a) Chemical Abstracts (CAS): 95-45-4; (b) Aldrich: 16,257-4; (c) Merck Index: 12,3295]. También está disponible comercialmente su sal disódica CH3C(=NONa)C(=NONa)CH3 [Chemical Abstracts (CAS): 75006-64-3; Aldrich: D16,010-5], y el propio bisdimetilglioximato de níquel, [Ni(dmgH)2] se puede adquirir con un 99% de pureza [Chemical Abstracts (CAS): 13478-93-8; Strem: 93-2815].

Figura 3: Estructura del complejo octaédrico [M(II) (dmgH)2(L2)]. (a) M= Mn y X = L = H2O (Jadhav et al., 2013). (b) M = Fe(II) y X = L = piridina (Pang et al., 1977). (c) M = Co(III), X = Cl, Br, -CH3 y L = piridina o anilina (Schurko & Wasylishen, 2000).
Dimetilgioxima en Química Analítica
Como se ha mencionado, quizá uno de los mayores campos de aplicación de la dimetilglioxima, y por el cual es más conocido a lo largo de la historia de la química, es el de la química analítica. La capacidad de formar quelatos estables con la gran mayoría de los metales de transición, hace que la dimetilglioxima sea, no solo el reactivo analítico por excelencia para la identificación y cuantificación de níquel(II), sino de una gran variedad de otros analitos. En tal sentido, se encuentran suficientemente descritos los procedimientos para las determinaciones cuantitativas de metales de transición con dimetilglioxima en las normas de la American Society for Testing and Materials (ASTM), especialmente la determinación gravimétrica o espectrofotométrica de níquel(II) (realizada a 530 nm), y otros elementos químicos, en matrices típicas como aguas potables o residuales, minerales y aleaciones de bronce o acero, entre otras, descritos, por ejemplo, en los métodos E1473-16, E478-08, E439-17, E352-18, E106-86, E75-76, E35-88, E1938, solo por citar algunos (ASTM, 2016). Los históricos métodos gravimétricos (Bickerdike & Willard, 1952), o las titulaciones complejométricas con dimetilglioxima (Přibil & Chalmers, 2014), o los métodos espectrofotométricos, han sido muy populares a lo largo del siglo XX (Dulski, 1996), así como lo métodos electroquímicos. En este último caso, se han descrito varios métodos polarográficos para la determinación de trazas (partes por millón, ppm) y ultratrazas (partes por billón, ppb) de níquel(II) y cobalto(II), utilizando el electrodo de gota colgante de mercurio (Baxter, 1988; Torrance & Gatford, 1985). Así mismo, un área muy interesante es el desarrollo de electrodos de pasta de carbono modificados (CME por sus siglas en inglés) con dimetilglioxima, utilizados en la determinación de níquel en presencia de Cd, Cu, Co, Pb, Pd, Pt, y Zn (Baldwin et al., 1986; Murray et al., 1987), con buenos límites de detección (ng/L). Las titulaciones conductimétricas para la determinación de níquel(II), cobalto(II), manganeso(II) o plomo(II) con dimetilglioxima en medio amoniacal también han sido desarrollados en la metodología analítica clásica (Hall et al., 1955). Actualmente, se encuentran reportados una gran cantidad de métodos electroanalíticos (Bard & Zoski, 2017) desarrollados sobre la base de la interacción de la dimetilglioxima con metales de transición, en diversas matrices, y con buenos límites de detección (Jiang, 2006).
Dimetilglioxima en síntesis orgánica y catálisis
Una gran variedad de complejos, plano cuadrados y octaédricos, que tiene como base la dimetilglioxima, se han sintetizado a lo largo del tiempo, y muchos han sido utilizados en reacciones de interés para la síntesis orgánica y la catálisis. Por ejemplo, alquil-cobaloximas del tipo [Co(III)(dmgH)2(py)(R)] (R = -CH2(CH2)8CH3 y py = piridina) se han utilizado en reacciones fotoquímicas de acoplamiento de grupos alquilo sobre compuestos heteroaromáticos (Branchaud & Choi, 1988). El ligando R en este tipo de cobaloximas tiene una buena reactividad en reacciones fotolíticas sobre una gran variedad de sustratos heteroaromáticos que tienen aplicaciones en el área de los surfactantes o el campo farmacéutico. La reactividad del enlace C‒Co en este tipo de cobaloximas, tiene similitud a la reacción protagonizada por la enzima metilmalonil-CoA, que posee un prostético tipo 5´ -desoxiadenosilcobalamina (coenzima B12) (Voet & Voet, 1992). El ambiente químico del cobalto en la vitamina B12 es similar a los complejos [Co(III)(dmgH)2(L)(R)], pues el anillo tipo corrina (Gilchrist, 1995), ofrece cuatro nitrógenos en un anillo suficientemente rígido, que permite una importante deslocalización electrónica en plano ecuatorial de este tipo de complejos octaédricos. En esta misma línea de ideas, se han sintetizado complejos octaédricos donde el ligando alquílico es, por ejemplo, un dieno que puede reaccionar con un dienófilo en reacciones de cicloadición. El complejo [Co(II)(dmgH)2(py)(R)] (fig. 4), con R = E-penta-1,3-dieno (Wright et al., 1994), ofrece un dieno que puede reaccionar en una cicloadición [4 + 2] (Richardson & Welker, 1997), con una gran variedad de dienos de interés (fig. 5), que pueden ser aprovechados con fines académicos o en el campo de la química fina.

Figura 4: Estructura del complejo octaédrico [Co(II)(dmgH)2(py)(R)], con R = E-penta-1,3-dieno (Stokes et al., 1996).
Por otro lado, una reacción fotoquímica del [Co(II)(dmgH)2py(R)] con anhídrido maleico y PhSSPh (Slade & Branchaud, 1998), condujo a la adición de un grupo alquil-SPh (Ph = fenilo, -C6H5), como una ruta interesante para generar una gama de compuestos con esqueleto molecular tipo 2,5-dioxifurano, que tienen interés en síntesis orgánica, especialmente como punto de partida de reacciones Diels-Alder (Fringuelli & Taticchi, 2002).
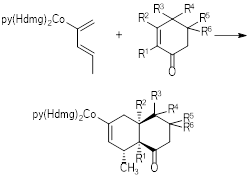
Figura 5: Reacciones de cicloadición [4 + 2] con complejos tipo [Co(II)(dmgH)2(py)(R)], con R = E-penta-1,3-dieno (Wright & Welker, 1996).
Es interesante mencionar que la cobaloxima, vista como un “grupo” sobre el alquilo R en el complejo [Co(II)(dmgH)2(py)(R)], tiene un “efecto superestérico” (Nishikubo & Branchaud). Este grupo, con un ángulo de cono de 180°, tiene un gran efecto estérico en las reacciones de Diels-Alder, haciendo que las reacciones pasen de ser endo-selectivas a exo-selectivas (Richardson & Welker, 1997). Un ejemplo interesante de este efecto se aprecia en la fig. 6, donde es posible observar que el sustituyente R, en este caso una glucopiranosa, gracias al efecto de la cobaloxima, adopta una conformación silla más estable que las otras posibles conformaciones (Yu et al., 2001).

Figura 6: Complejo [Co(II)(dmgH)2(py)(R)], con R = 1-deoxi-2,3,4,6-tetra-O-bencil-α-D-glucopiranosa y Bz = bencilo. La conformación silla del glicósido es inducida por el “efecto superestérico” del grupo cobaloxima.
En otras reacciones se ha utilizado la adición de dimetilglioxima como forma de separar los productos de los complejos metálicos generados como intermediarios en la reacción (demetalización) (fig. 6). En tal sentido, se ha reportado la adición de dimetilglioxima para separar el paladio del complejo π-alilpaladio que se forma en el curso de la reacción de hidrosulfonación regio- y estereoselectiva de dienos, mediante la formación del bisdimetilglioximato de paladio(II) (Tamaru et al., 1981), a fin de obtener el producto de reacción demetalizado.
El esqueleto molecular de la dimetilglioxima ha sido intervenido con interesantes modificaciones estructurales que generan compuestos complejos capaces de participar en reacciones de cicloadición (fig. 7).
Partiendo de los principios de la “economía de hidrógeno” (Ball, 2009), una de las reacciones catalíticas más importantes en las cuales participa complejos los dimetilglioximatos metálicos es la reacción de producción de hidrógeno molecular. El cambio climático global y la crisis energética, consecuencia del inevitable agotamiento de los combustibles fósiles, ha venido impulsando el estudio de fuentes de energía alternativas, limpias o renovables (Andrews & Jelley, 2013). Entre las alternativas planteadas se encuentra el uso de celdas de combustibles, basadas en la generación de energía eléctrica mediante la reacción anódica de oxidación de la molécula de hidrógeno, acoplada a la reacción catódica de reducción de la molécula de oxígeno. Por lo tanto, con este sistema se estaría planteando utilizar hidrógeno como combustible, en sustitución de los hidrocarburos, en una reacción cuyo producto de reacción sería agua en lugar de gases de invernadero. En este orden de ideas, se han utilizado métodos químicos, fotoquímicos y electroquímicos, para explorar la catálisis de reducción de protones, o generación de hidrógeno, mediante complejos de cobaloxima tipo [Co(II)(dmgH)2(L)2] y [Co(II)(dmgBF2)2(L)2] con L = Cl, piridina, P(n-Bu)3 (Jacque et al., 2009; Connolly & Espenson, 1986), utilizando como disolvente agua o acetonitrilo. El mecanismo planteado contempla, en una primera etapa, la reducción del grupo Co(II)(dmgH) hacia una especie de Co(I) que, en una segunda etapa, reacciona con una fuente de protones para producir un hidruro de Co(III), esta fuente de protones podría ser el disolvente, una molécula donadora específica o, inclusive, la propia dimetilglioxima que puede reaccionar intramolecularmente. Finalmente, en una reacción homolítica, dos hidruros de Co(III) reaccionan en un paso bimolecular, para generar el H2 deseado. Por otro lado, la ruta heterolítica plantea la protonación del hidruro de Co(III), produciendo H2 y Co(III) (Dempsey et al., 2009; Rodenberg et al., 2015). La metodología fotoquímica propone acoplar el catalizador cobaloxima con otros complejos de metales de transición fotoactivos y, en tal sentido, se ha estudiado el sistema acoplado renio-cobalto, con participación del complejo fotoactivo [Re(NCS)(CO)3bipy] (bipy = 2,2′-bipiridina) y [Co(dmgH)2], con resultados positivos para la generación de hidrógeno (Probst et al., 2010; Zhang et al., 2012).
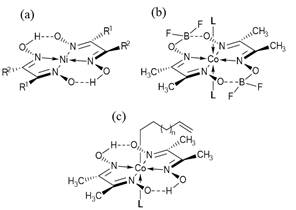
Figura 7: Ejemplos de intervenciones en el esqueleto molecular de la dimetilglioxima. (a) Dimetilglioximatos de níquel(II): (1) Ni(deg)2, R1 = -C2H5 y R2 = -C2H5, bis(2,3-butanodionadioximato)niquel(II); (2) Ni(dbg)2, R1 = -C6H5 y R2 = -C6H5, bis(1,2-difeniletanodionadioximato)niquel(II); (3) Ni(meg)2, R1 = -CH3 y R2 = -C2H5, bis(2,3-pentanodionadioximato)niquel(II); (4) Ni(g)2, R1 = -H y R2 = -H, bis(etanodialdioximato)niquel(II) ; (6) Ni(nox)2, R1 = -C2H2- R2 = -C2H2-, bis(1,2-ciclohexanodionadioximato)niquel(II), (Martin et al., 1998). (b) [Co(dmgBF2)2(L)2], dmgBF2 = difluoroborildimetilglioximato y L = haluros, piridina, acetonitrilo, H2O (Bakac et al., 1986; Bakac & Espenson, 1984; Schrauzer & Windgassen, 1966). (c) [Co(II)(dmgH)2(L)(R)] R = -CH2(CH2)nCH=CH2 n≥2, y L = piridina (Sivaramakrishna et al., 2007; Ashcroft et al., 1980). A los efectos de comprender mejor el mecanismo de la producción catalítica de hidrógeno catalizada por cobaloximas, se han venido realizando estudios de química computacional utilizando la teoría del funcional de la densidad (DFT por sus siglas en inglés) (Chen & Sit, 2019; Chen & Sit, 2017).
Estructura de rayos x de la dimetilglioxima y complejos relacionados
A la fecha, existen por lo menos ciento cincuenta y tres estructuras relacionadas con la dimetilglioxima y publicadas en las revistas de la Unión Internacional de Cristalografía (IUCr por sus siglas en inglés). Destaca la estructura de la propia dimetilglioxima (Merritt & Lanterman, 1952; Craven et al., 1979), el dimetilglioximato de níquel(II) (Godycki & Rundle, 1953), y varios otros compuestos entre los que merece destacar complejos plano cuadrados [M(II)(dmgH)2], M = Pd y Pt (Sakhawat-Hussain et al., 1979), y [Ni(dmgBPh2)2], dmgBPh2 = difenilborildimetilglioximato (Xu et al., 1990); complejos octaédricos de cobalto(III) como el [Co(III)Br(dmgH)2(H2O)] (Meera et al., 2011), [Co(III)(dmgH)2py][FeCl4], py = piridina (Xu et al., 1992), [Co(III)Cl(dmgH)2(anilina)] (Solans et al., 1996), [Co(III)(N3)(dmg)(H2dmg)(H2O)]·H2O (Dong et al., 2003), [CoCl2(H2dmg)(Hdmg)] (Ramesh et al., 2008); complejos octaédricos de rodio(III) del tipo [Rh(III)(dmgH)2(PPh3)(CH3)], PPh3 = trifenilfosfina (Potocnák et al., 1995), [Rh(III)(dmgH)2(PPh3)(CH2CH3)] (Kettmann et al., 1994), [Rh(III)(dmgH)2(PPh3)(CH=CH2)] (Dunaj-Jurčo et al., 1994), [Rh(III)(dmgH)2(PPh3)(1-hexil)] (Pickin et al., 2003), [Rh(III)(dmgH)2(PPh3)(ter-butil)] (Kettmann et al., 1996); un polímero de coordinación de cobre(II) con dimetilglioxima (Zhang et al., 2004), un complejo tetranuclear [Cu4(dmg)2(Hdmg)2(phen)2(H2O)2] con phen = 1,10-fenantrolina (Zhang et al., 2003) y el complejo [Cu(II)(dmgH-κ2 N,N´)2(tiourea-κS)] (Koman et al., 1990); el complejo de níquel(II) acuo(H2dmg-κ2 N,N´)(3,5-dinitro-2-benzoato-κ2 O,O´)niquel(II) [Liu, 2007]; y el complejo de rutenio(II) tipo tris(dimetilglioximato-κ2 N,N´)rutenio(II) (Taqui Khan et al., 1992).
Otras aplicaciones de la dimetilglioxima
En el área de biomimética inorgánica, la dimetilglioxima ha venido ostentado un papel importante a la hora de simular el entorno al sitio metálico de varias metaloenzimas (Lin, 2017). En primer lugar se puede mencionar que, como consecuencia de la similitud del ambiente plano cuadrado, con esfera de coordinación tipo metal-N4, una de las primeras aplicaciones de los complejos Co(III)(dmgH)2 fue la biomimética de la vitamina B12 (Costa et al., 1969). La enzima metilmalonil-CoA, que posee como grupo prostético el 5´-desoxiadenosilcobalamina, coenzima B12(fig. 8), o simplemente vitamina B12 (Abeles & Dolphin, 1976), juega un importante papel en el mecanismo de transferencia de fragmentos monocarbonados. En tal sentido, se han sintetizado compuestos del tipo [CH3Co(III)(dmgH)2py), (Jameson, 1998).
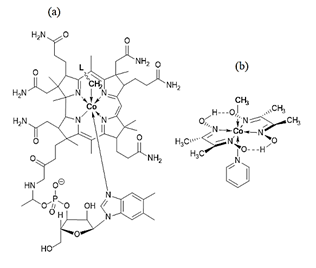
Figura 8: Cobaloximas en biomimética inorgánica. (a) Estructura de la coenzima B12, el ligando -CH2L es el grupo 5´-desoxiadenosilo. (b) Compuesto modelo metilcobaloxima, [Co(III)(dmgH)2(py)(CH3)], py = piridina (Bresciani-Pahor et al., 1985).
Otro caso en el cual se utilizan como modelo las cobaloximas es en la biomimética de las hidrogenasas. Este sistema está relacionado con las aplicaciones catalíticas de los complejos cobaloximas en la producción de hidrógeno, pues las hidrogenasas son las enzimas encargadas de la reducción de protones a hidrógeno molecular. En los estudios desarrollados se utiliza como base el sistema [Co(dmgH)2] o [Co(dmgBF2)2], ampliando la esfera de coordinación del cobalto con diversos ligandos, hasta obtener el respectivo complejo octaédrico, a partir del cual se desarrollan los estudios que tienen como objetivo llegar a desarrollar una “enzima artificial” (Bacchi et al., 2014). En las cobaloximas modelos que se han utilizado como catalizadores en la electrorreducción de protones, tanto en disolvente acuoso como no acuoso, se ha utilizado condiciones suaves y potenciales moderados (Baffert et al., 2007). Muchos de los resultados obtenidos para este tipo de reacciones indican que estos catalizadores son competitivos en comparación con otros catalizadores de metales de transición de la primera serie de transición, los cuales generalmente funcionan a potenciales más negativos o a bajo pH (Razavet et al., 2005). Los estudios por medio de voltamperometría cíclica indican un mecanismo catalítico heterolítico con buenos parámetros catalíticos (Rountree et al., 2016). En la mayoría de los casos, se pone de manifiesto una marcada influencia de la esfera de coordinación del cobalto en la actividad catalítica (Li et al., 2014). Las cobaloximas también se han probado en las reacciones catalíticas de ciclización en presencia de hidrógeno (Li et al., 2012), y eliminación catalítica de cloro de sustancias contaminantes como el percloroetileno y tricloroetileno (McCauley et al., 2002), una reacción de interés para la química verde.
Como se puede apreciar, la dimetilglioxima propiamente, en su calidad de reactivo químico extensamente utilizado para cuantificar en química analítica, y las reacciones catalíticas de los dimetilglioximatos de metales de transición, tienen un positivo impacto en la química verde (Contreras, 2017).
Otro campo en el cual se pueden encontrar estudios sobre la dimetilglioxima es el área biomédica, especialmente con estudios dirigidos a determinar la actividad biológica de los dimetilglioximatos frente a bacterias, hongos y el cáncer. Por ejemplo, dimetilglioximatos de cobre(II) y aminoácidos: [Cu(dmgH2)(Arg)(NO3)], [Cu(dmgH2)2(Glu)(NO3)], [Cu(dmgH2)2(Glu)(SCN)], ([Cu(dmgH2)(Trp)2], [Cu(dmgH2)2(Pro)]2, [Cu(dmgH2)(Val)], con Arg = arginina, Glu = ácido glutámico, Trp = triptófano, Val = valina, presentan actividad contra las bacterias patógenas (Escherichia coli y Bacillus cereus) y hongos (Candida albicans y Aspergillus niger), así como actividad antioxidante (Bougherra et al., 2018). La gran estabilidad de los complejos con dimetilglioxima, y la baja hidrosolubilidad de estos materiales, quizá sean los factores que han jugado en contra del extensivo estudio de aplicaciones biológicas de los dimetilglioximatos, razón por la cual es un campo prometedor para la investigación futura.
4 Conclusiones
Un siglo después de que Lev A. Chugaev (Tschugaeff) reportase el uso de la dimetilglioxima en la reacción de identificación del níquel (II) por formación del quelato bis(dimetilglioximato-κ2 N,N´)níquel(II), este polifacético reactivo analítico sigue ocupando un lugar preponderante en la química de coordinación, la analítica y otras áreas como la catálisis. Las cobaloximas tiene una excelente actividad hacia la producción de hidrógeno molecular, una reacción estratégica en la denominada economía del hidrógeno y en la química verde. A pesar de que se han sintetizado y caracterizado una gran variedad de compuestos relacionados con la dimetilglioxima, y sus dimetilglioximatos metálicos, queda mucho por explorar todavía, especialmente en áreas como la nanoquímica y la nanotecnología, así como en el campo de la biomedicina.