INTRODUCCIÓN
La neuropatía óptica isquémica anterior (NOIA) es la causa más común de enfermedad del nervio óptico no glaucomatosa en el adulto. La NOIA puede ser de causa arterítica (NOIAA), secundaria a vasculitis (principalmente arteritis de células gigantes), o no arterítica (NOIANA). La teoría fisiopatológica más aceptada en la NOIANA consiste en una hipoperfusión de las arterias ciliares posteriores sobre una papila óptica sin apenas excavación, lo que provoca un edema en la cabeza del nervio óptico y la pérdida de visión. Al no existir tratamiento eficaz conocido, el pronóstico visual es infausto(1).
El objetivo de este artículo es hacer una revisión sobre la presentación clínica, su diagnóstico diferencial y actualizar la evidencia de las opciones terapéuticas ensayadas sin éxito y que a día de hoy se siguen usando en la práctica clínica habitual, así como plantear aquellas que se encuentran en fase investigación.
Epidemiología
La NOIANA es la neuropatía óptica aguda no glaucomatosa más común en pacientes mayores de 50 años de edad y se ha calculado que el riesgo se incrementa en un 2% cada año. La edad media de inicio es de 64 ± 9,2 años. No obstante, en algunas series la incidencia en pacientes menores de 50 años puede llegar al 8,3%(2). Es más frecuente en raza caucásica que en raza afroamericana o latinos, siendo ligeramente más frecuente en varones(3). La incidencia anual estimada en Estados Unidos es de 2,3-10,2/100.000 habitantes con 6.000 nuevos casos anuales(4).
PRESENTACIÓN CLÍNICA Y EVOLUCIÓN
La NOIANA se manifiesta como una pérdida de visión súbita monocular, a menudo al despertar, como consecuencia de una disminución de la agudeza visual (AV) y/o un defecto campimétrico, con relativa preservación para la visión de los colores, a menos que predomine una afectación central. Normalmente es una pérdida de visión indolora, aunque en el 8-12% de los individuos afectados se ha reportado alguna molestia periocular(5)(6).
Los pacientes suelen presentan una AV al inicio del episodio por encima de 20/400, generalmente entre 20/40 y 20/400, con hallazgo de un defecto pupilar aferente relativo (DPAR) en la exploración(1). Los defectos en el campo visual (CV), que suele ser definido como “mancha oscura o borrosa”, pueden seguir cualquier patrón relacionado con el daño del nervio óptico; sin embargo, en la mayoría de los casos existe una pérdida altitudinal que respeta el meridiano horizontal.
En cuanto a la evolución, se ha descrito una mejoría espontánea de la de 3 líneas en el Test de Snellen en aproximadamente el 40% de los pacientes a los 3 meses del inicio de la enfermedad(1)(7), siendo menos común la recuperación significativa del defecto campimétrico. En la mayoría de los casos, tras el inicio brusco, la afectación visual puede permanecer estática, presentar alguna fluctuación e incluso continuar con una pérdida progresiva que puede prolongarse durante semanas hasta la estabilización. Después de entonces, generalmente en torno a los 2-3 meses(1)(8), la progresión o la recurrencia en el ojo afecto es extremadamente rara (en torno al 5%) (1)(9), por lo que se deberían evaluar otras causas de neuropatía óptica.
FISIOPATOLOGÍA
La NOIANA se produce como consecuencia de una isquemia de la porción anterior del nervio óptico por afectación de las arterias ciliares posteriores cortas que lo irrigan durante su trayecto prelaminar. La fisiopatología subyacente no está clara, aunque los posibles mecanismos, que pueden actuar de forma aislada o en combinación como consecuencia de un fallo en la autorregulación de flujo a nivel de la cabeza del nervio óptico, serían los siguientes(1):
-Hipoperfusión: secundaria a un bajo gasto total o relacionada con la hipotensión nocturna(10)(11).
-Vasculopatía de tipo aterosclerótico, fundamentalmente por la asociación con factores de riesgo cardiovascular y su afectación microvascular(8).
-Predisposición anatómica: En la literatura anglosajona, se denomina como “disc at risk(7)” a la ratio copa-disco pequeña; el término equivalente en castellano sería la ratio excavación/papila, sin apenas excavación(12). Sin embargo, en estudios recientes se ha comprobado a través de OCT que el área papilar de pacientes con la patología y los controles es la misma, constituyendo el riesgo realmente la disposición más anterior de la lámina cribosa(13)(14).
Así pues, en la NOIANA se produciría una isquemia sobre dicha condición anatómica individual que, además de actuar como predisponente, agravaría el escenario isquémico al favorecer una situación similar a un síndrome compartimental: el espacio limitado para el edema intraneural post-isquémico restringiría el flujo de los capilares antes de su entrada a la lámina cribosa, causando un deterioro secundario tanto de la perfusión vascular como del transporte flujo axoplásmico, dando lugar a un círculo vicioso que perpetuaría la situación y terminaría produciendo un daño axonal severo(1).
FACTORES DE RIESGO
Factores de riesgo vascular
Entre el 60-74% de los pacientes tiene al menos un factor de riesgo vascular, conocido o no, en el primer episodio de NOIANA(8)(5). La hipertensión arterial es el factor más frecuentemente asociado, se ha documentado en el 39-88% de los pacientes, seguida por la diabetes mellitus, la dislipemia y el tabaquismo, que se pueden presentan hasta casi la mitad de los pacientes(3). No se ha demostrado que el control de los factores de riesgo cardiovascular altere el curso de la patología ni se asocie a un menor riesgo de padecer una NOIANA en el ojo contralateral. Existe controversia en cuanto a la consideración de la NOIANA factor de riesgo independiente para ictus, siendo éste más bien consecuencia de los factores de riesgo cardiovascular asociados que por la neuropatía per se(15).
Síndrome de apnea del sueño
El síndrome de apnea obstructiva del sueño (SAOS) está presente en hasta un 89% de los pacientes que desarrollan NOIANA, una prevalencia mucho mayor que en una población de la misma edad y sexo con factores de riesgo vascular similares(16); sin embargo, ya que coexiste con otros factores de riesgo vascular que podrían contribuir a la etiopatogenia, se necesitarían más estudios para vincularlo(17).
Hipotensión sistémica nocturna
La hipotensión arterial nocturna se ha postulado tradicionalmente como causa tras los trabajos de Hayreh et al.(10)(18) en el que demostró que un grupo de pacientes con NOAINA presentaba una tensión arterial sistólica media más baja que los sujetos sanos durante todo el día, haciéndose dicha diferencia más reseñable en la madrugada cerca del despertar(19). Esta situación podría darse en pacientes sometidos a un sobretratamiento antihipertensivo o con fármacos inhibidores de la fosfodiesterasa 5 como sildenafilo, tadalafilo y vardenafilo(20).
Causas oftalmológicas
La oclusión de la vena central de la retina y la degeneración macular asociada a la edad se han establecido como factores de riesgo pero la relación parece no estar clara(2). Las drusas en el disco se han considerado como un posible predisponente desde el punto de vista de la teoría compartimental(21). Algunos autores han relacionado la cirugía de cataratas como precipitante de la NOIANA o que la cirugía de cataratas en un ojo podría aumentar el riesgo para sufrir el evento isquémico en el contraleral(22)(23); sin embargo, otros trabajos recientes desestiman la idea(24). Desde el año 1985 se han reportado varios casos de NOIAN en pacientes glaucoma de ángulo cerrado(25).
Hipercoagulabilidad
Cestari et al.(3) describen que pacientes con estados protrombóticos como el síndrome antifosfolípido, la deficiencia de proteína C o S y la trombofilia secundaria al cáncer, tenían un incremento del riesgo de un 146% (HR= 2,46; IC 95%: 1,51-4). No se relacionó con trombosis venosa profunda o tromboembolismo pulmonar. La hiperhomocisteinemia también se ha señalado en varios trabajos aunque existen resultados en ambos sentidos(26)(27).
INCIDENCIA DE BILATERALIDAD
El riesgo acumulativo descrito de pérdida de visión en el ojo contrario es del 15% en los 5 años siguientes del primer episodio(28). No se han descrito factores predictores claros: Hayreh et al.(29) demostraron que en pacientes con dos episodios de NOIANA, la afectación de la AV o el CV en el primer ojo afecto no tiene capacidad predictiva sobre el ojo contralateral. Preechawat et al.(7) señalan en su cohorte de 169 pacientes menos de 50 años, la tasa de NOIANA secuencial bilateral llega hasta el 41%.
DIAGNÓSTICO
El primer diagnóstico diferencial a tener en cuenta es la NOIAA dado que tiene tratamiento médico eficaz: suelen ser pacientes de mayor edad y con una afectación más severa de la agudeza visual, que asocian síntomas como cefalea, claudicación mandibular, mialgias, cansancio y elevación de reactantes de fase aguda. Para descartarla, se debe solicitar a todo paciente la velocidad de sedimentación globular (VSG), proteína C reactiva (PCR) y hemograma. No se recomienda de forma rutinaria el despistaje de otras vasculitis a menos que existan datos en la historia clínica para ello. Ante su sospecha, se deben iniciar corticoides y se recomienda confirmar el diagnóstico a través de biopsia de la arteria en un plazo de una semana desde el inicio del tratamiento(8)(30).
Además, la NOIANA se debe diferenciar de otras neuropatías ópticas que cursan con edema monocular. En la mayoría de los casos el patrón de pérdida de visión, el carácter del edema del disco óptico y los signos clínicos asociados permiten su diferenciación (Tabla 1).
Tabla 1 Características atípicas y diagnóstico diferencial más frecuente con otras causas de neuropatía óptica.
| Red flags para el diagnóstico de NOIANA | |
| Edad joven Ausencia de factores de riesgo cardiovascular Dolor intenso con los movimientos oculares Mayor afectación de la visión de los colores que del campo visual | Neuritis óptica inflamatoria |
| Presentación simultánea o recurrencia en el mismo ojo | NOAIA Neuropatía óptica tóxica Neuritis óptica inflamatoria (NMO/MOG) |
| Persistencia del edema de disco más allá de 4 semanas o progresión de la pérdida de visión por encima de los 3 meses | Neuropatía óptica por infiltración o compresión |
En la fase aguda, el diagnóstico se basa en la presentación clínica típica junto con la exploración neuro-oftalmológica, en la que existirá una pérdida de visión asociada a DPAR y edema de papila generalizado o sectorial a veces asociado a hemorragias en llama peripapilares en el fondo de ojo. No se requieren pruebas complementarias confirmatorias salvo para realizar el diagnóstico diferencial. La neuroimagen no es necesaria, a menos que el paciente presente un dolor sustancial o siga un curso atípico, como un levantamiento papilar mantenido o una pérdida visual progresiva o recurrente una vez pasados los 3 primeros meses del inicio de la clínica(1). En dicho caso, la RM con gadolinio sería la prueba de elección, donde en el caso de la NOIANA, típicamente no habría realce de contraste pero podríamos ver una señal hiperintensa inespecífica en secuencias T2. En cambio, en la neuritis óptica, habría captación en el nervio en secuencias T1 con contraste por lo que habría que orientar el cuadro a una causa inflamatoria o vasculítica(8).
Al no considerarse una enfermedad embolica ni ateroesclerótica(31), no estaría indicado ni el estudio cardiaco mediante ecocardiografía ni el de arterias extra o intracraneales mediante ecografía-doppler(8). Aunque no forma parte de la práctica clínica habitual, se ha usado la ecografía-doppler transorbitaria para comprobar un descenso de las velocidades flujo en la arteria oftálmica y la arteria central de la retina(32).
La tomografía de Coherencia Óptica (OCT) puede poner de manifiesto un adelgazamiento de la capa de células ganglionares junto con la capa plexiforme interna (CPI) o de la capa de fibras nerviosas como signos precoces así como mostrar edema del disco o subretiniano, con el consecuente engrosamiento de la capa de fibras nerviosas peripapilar(33). Además, se ha demostrado que el grosor mínimo de la capa plexiforme interna a las dos semanas del inicio de la clínica, se correlaciona con la agudeza y el campo visual final del paciente(34). La angio-OCT, alternativa no invasiva a la angiografía fluoresceínica, se ha empezado a usar para estudiar la dinámica de flujo retiniano en la NOIANA(35). (Figura 1)
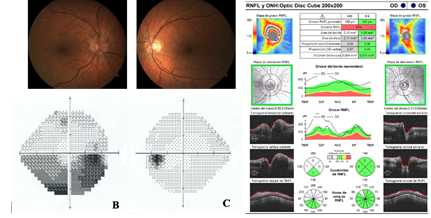
Figura 1 Varón de 55 años con NOIANA en ojo derecho de 24 horas de evolución. a. Retinografía. Papila derecha hiperémica, con bordes borrados por edema de predominio superior y ligera congestión vascular venosa; en este caso no se aprecian hemorragias en llama peripapilares. b. Campo visual 24-2 (central): En campo derecho, escotoma altitudinal inferior sin afectación de campo central. c. OCT de capas de fibras nerviosas de la retina: Engrosamiento sectorial superior de la papila derecha.
TRATAMIENTO
Aunque se han realizado numerosos intentos para encontrar alguna herramienta terapéutica en esta patología, en la actualidad no existe una opción terapéutica eficaz establecida. Tampoco hay tratamiento preventivo que disminuya el riesgo de recurrencia en el ojo contralateral, por lo que las recomendaciones generales se basan en el abordaje de los factores predisponentes, como el riesgo cardiovascular o evitar fármacos que puedan favorecer la hipotensión nocturna(36)(37).
Descompresión quirúrgica de la vaina del nervio óptico
Partiendo de la teoría del síndrome compartimental, se planteó la opción quirúrgica de fenestrar la vaina de mielina del nervio óptico con la idea de reducir la presión subaracnoidea del líquido cefalorraquídeo perineural para disminuir el edema post-isquémico y, por consiguiente, mejorar el flujo sanguíneo y el daño axonal. Para valorar la eficacia de la intervención, se llevó a cabo un ensayo clínico multicéntrico (IONDT: Ischemic Optic Neuropathy Decompression Trial) en EEUU con 119 pacientes tratados y 125 no tratados(38)(39). El grupo de tratamiento mostró un riesgo estadísticamente significativo de empeoramiento en tres líneas o más (23,9% entre los pacientes tratados versus 12,4% en los no tratados) y el 32,6% de los no intervenidos, presentaron una mejoría espontánea de al menos 3 líneas. No obstante, este trabajo permitió obtener muchos datos epidemiológicos y de historia natural de la enfermedad, además de sentar las bases de los criterios de inclusión/exclusión que han permitido homogeneizar el estudio de las opciones ensayadas posteriormente. Dickerson y Li(40) publicaron una revisión Cochrane para para evaluar la seguridad y la eficacia de la cirugía en comparación con otro o ningún tratamiento en pacientes con NOIANA, volviendo a demostrar que esta opción no presenta ningún efecto beneficioso sobre la agudeza visual o el campo visual en pacientes afectos.
Esteroides
Los corticoides se han usado por diferentes vías de administración con idea de reducir el edema producido en la cabeza del nervio óptico por la isquemia.
En cuanto a los corticoides por vía oral, se llevó a cabo un estudio prospectivo no aleatorizado y no enmascarado en el que 312 pacientes con NOIANA de reciente comienzo eligieron tomar prednisona 80mg/día durante dos semanas y se comparó con los 301 que decidieron no tratarse. Aunque demostraron eficacia en los pacientes con mayor afectación visual, los resultados no son consistentes por varios sesgos estadísticos(41)(42). Se probó el mismo esquema terapéutico en un ensayo aleatorizado de 37 pacientes y no mejoraron CV ni AV. Además, hubo una incidencia de un 20% de NOIANA en el ojo contralateral en el grupo tratado mientras que no se presentó ningún caso en el grupo no tratado, comparado con el riesgo del 15% a los 5 años de la historia natural de la enfermedad.
Se llevó a cabo un trabajo para evaluar el efecto de la administración intravenosa con una pauta de metilprednisolona 250m/6h durante 3 días seguida de una pauta oral durante 11 días comparado con un grupo control, sin conseguir mostrar beneficio tras dos años de seguimiento(43)(44).
Los estudios con inyección intravítrea de esteroides, fundamentalmente triamcinolona, han presentado resultados heterogéneos, por lo que no se consideran indicados(45)(46).
Levodopa
La eficacia de la levodopa/carbidopa sigue siendo controvertida en la actualidad y no es un tratamiento con un uso extendido en la práctica clínica. Johnson et al.(47) realizaron un estudio retrospectivo en una serie de 37 pacientes en los que el tratamiento con levodopa se asoció a una mejoría en la agudeza visual. No obstante, en 2005 se publicó un ensayo clínico aleatorizado de 24 pacientes que demostraba que no había efecto terapéutico y los efectos secundarios de la toma de levodopa eran frecuentes(48). En un trabajo reciente de Lyttle et al. llegan a afirmar que la mejoría en el grupo tratado en los primeros 15 días del inicio de la clínica puede llegar a 6 líneas de Snellen, aunque se trata de un estudio retrospectivo y con riesgo de sesgo de autoselección(49).
Aspirina
Aunque hoy día su uso está ampliamente extendido en la práctica clínica, no existe evidencia que respalde la antiagregación con intención terapéutica o como preventivo en la NOINA. En IONDT, la aspirina no demostró eficacia en la fase aguda de la NOINA(39)(40). En cuanto a la capacidad de reducir la probabilidad de afectación del segundo ojo, Beck et al.(50) llevaron a cabo un estudio retrospectivo entre 153 pacientes a los que se les prescribió aspirina y 278 sin tratamiento, sin demostrar diferencias significativas en la tasa de recurrencia a los 5 años (17% vs 20%). Por otro lado, los pacientes que ya toman aspirina por otro motivo antes de la NOIANA, no tienen menor afectación visual(51).
Factor de crecimiento endotelial anti-vascular (Anti-VEGF)
El bevacizumab es agente anti-VEGF de administración intravítrea, usado en el campo de la oftalmología principalmente en la fase húmeda de la degeneración macular asociada a la edad y en la retinopatía diabética. Aunque inicialmente se publicaron varios trabajos usándolo como tratamiento en la NOIANA(52), en un ensayo prospectivo no aleatorizado de 17 pacientes, no consiguió demostrar beneficio y se asoció a recurrencia(53).
Citicolina
La citicolina vía oral ha demostrado en un ensayo clínico publicado recientemente (Clinicaltrials.gov NCT03758118) en el que 36 pacientes se trataron con 500mg/día durante 6 meses respecto a un grupo control con placebo, mejoría de agudeza visual y del campo visual 9 meses después de haber finalizado el tratamiento y tras 3 meses de lavado.(54)
Prostaglandina E1
La prostaglandina E1 (PGE1) es un potente vasodilatador de la microcirculación a través de su acción directa en la musculatura lisa de la pared vascular, además de presentar efectos antiagregantes plaquetarios y antinflamatorios(55). Actualmente, sus principales indicaciones son el mantenimiento de la apertura del ductus arterioso en niños nacidos con anomalías cardiacas y como tratamiento sintomático de enfermedad arterial periférica oclusiva en estadios III y IV de Leriche-Fontaine. Precisamente en el estudio de pacientes con claudicación intermitente, fue donde Steigerwalt et al.(56) demostró por ecografía transorbitaria por primera vez que la administración intravenosa de PGE1 elevaba la velocidad de flujo sistólico en un 40% y la diastólica en un 80% en la arteria oftálmica y central de la retina. Así pues, partiendo de la idea de que pudiera ser útil en patologías que cursaran con isquemia ocular, en 2008 llevaron a cabo un estudio comparativo no aleatorizado con una serie de casos de NOIANA aguda(57): 8 casos consecutivos de NOIANA fueron tratados 40 mg de metilprednisolona y 80 µg de PGE1 administrados vía intravenosa durante dos días y, posteriormente, continuaron con prednisona 25mg/día durante una semana y ácido acetilsalicílico (AAS) 100mg/día durante 2 meses. El grupo control estuvo formado por 7 pacientes con características clínicas similares a los que se trató durante dos semanas con prednisona 25mg/día y AAS 100mg/día durante dos meses. Se realizó un seguimiento de los pacientes a los 7, 21 y 35 días desde el inicio de la terapia con PGE1 y se obtuvo una mejoría significativa en la agudeza visual en el primer grupo (p=0.001). En 2011, este mismo grupo publicó una revisión sobre las entidades neurooftalmológicas en las que se ha probado su uso con resultados a priori esperanzadores dada la ausencia de tratamiento eficaz conocido(58).
Dado que hasta este momento la evidencia positiva del uso de la PGE1 en NOIANA va ligada al uso otros fármacos que en la actualidad se consideran ineficaces, nuestro grupo consideró justificado el diseño de un ensayo clínico para determinar la eficacia de la infusión intravenosa de PGE1. PGNAION (Clinicaltrials.gov NCT03851562) (Tabla 2) pretende estudiar su efecto en AV y CV hasta los 3 meses del episodio y se analizar otras variables como la presión intraocular, el grosor de la capa de fibras nerviosas y de células ganglionares, área papilar e índices hemodinámicos de las arterias oculares por ecografía doppler.
Tabla 2 Revisión de los ensayos clínicos en busca de opciones terapéuticas para la NAION según el registro ClinicalTrials.gov. R: Reclutando; RC: Reclutamiento completado.
| Localización | Estado | Intervención | Diseño | |
| Phase 2/3, Randomized, Double-Masked, Sham-Controlled Trial of QPI-1007 in Subjects With Acute Nonarteritic Anterior Ischemic Optic Neuropathy (NAION) NCT02341560 | Estados Unidos | R | Inyecciones intravítreas de QPI-1007 | Fase 2/3. Aleatorizado, paralelo y doble ciego. -Grupo A: QPI-1007 1,5mg -Grupo B: QPI-1007 3mg -Grupo C: Sham. (n=800) |
| Vision Restoration Therapy (VRT) to Treat Non-Arteritic Anterior Ischemic Optic Neuropathy NCT00140491 | Estados Unidos | RC | Sistema informático VRT, Vision Restoration Therapy | Aleatorizado, paralelo y doble ciego. -Grupo A: VRT. -Grupo B: Placebo. (n=20) |
| Effect of Levodopa-Carbidopa on Visual Function in Patients With Recent-Onset Nonarteritic Anterior Ischemic Optic Neuropathy NCT00432393 | Irán | RC | Levodopa/carbidopa vía oral | Fase 4. Aleatorizado, paralelo y doble ciego. -Grupo A: Levodopa/carbidopa -Grupo B: Placebo (n=25) |
| Efficacy & Safety of RPh201 Treatment in Patients With Previous Nonarteritic Anterior Ischemic Optic Neuropathy (NAION) NCT03547206 | Estados Unidos | R | RPh201 subcutáneo | Fase 3. Aleatorizado, paralelo y doble ciego. -Grupo A: RPh201 -Grupo B: Placebo. (n=234) |
| NAION Treatment With Oral Prednisolone and Erythropoietin Injection NCT03715881 | Irán | R | Prednisona vía oral. Eritropoyetina vía intravenosa. | Fase 2. Aleatorizado, paralelo y doble ciego. -Grupo A: Prednisona 50mg -Grupo B: Eritropoyetina 1000U. (n=99) |
| Safety Assessment of Intravitreal Mesenchymal Stem Cells for Acute Non Arteritic Anterior Ischemic Optic Neuropathy NCT03173638 | España | R | Inyecciones intravítreas de stem cells mesenquimales alogénicas | Fase 2. Único grupo, no aleatorizado, no enmascarado. (n=5) |
| A New Medicine to Treat Nonarteritic Anterior Ischemic Optic Neuropathy (NAION) NCT01975324 | Estados Unidos | RC | Dalfampiridina vía oral | Fase 4. Aleatorizado, cruzado y doble ciego. -Grupo A: Dalfampiridina 10mg. -Grupo B: Placebo. (n=20 pacientes) |
| ENDOTHELION Study Group: Effect of Bosentan in NAION Patients NCT02377271 | Francia | R | Bosentan vía oral | Fase 3. Aleatorizado, paralelo y doble ciego. -Grupo A: Bosentan 125mg -Grupo B: Placebo. |
| Intravenous Infusion of Prostaglandins as Therapy in Patients With Anterior Non-arteritic Ischemic Optic Neuropathy | España | R | PGE1 vía intravenosa | Fase 2b. Aleatorizado, paralelo, doble ciego. -Grupo A: PGE1 (Alprostadil®) 1µg/Kg hasta 60 µg) -Grupo B: Pacebo. (n=24 pacientes) |
Otros tratamientos ensayados
La difenilhidantoína(59), el oxígeno hiperbárico(60), la eritropoyetina transvítrea(61) o sistémica combinada con corticoides(62), la brimonidina tópica(63), la estimulación eléctrica transcorneal(64), la neurotomía óptica transvítrea(65)y la pentoxifilina o la memantina(37) han sido opciones probadas que no han demostrado aún eficacia suficiente como para recomendar su uso.
CONCLUSIONES
A pesar de que la NOIANA es la neuropatía óptica aguda no glaucomatosa más frecuente en pacientes mayores de 50 años de edad con una importante repercusión en la función visual, ningún tratamiento ha demostrado ser eficaz en el manejo de esta patología ni en la prevención de la afectación del ojo contralateral. En nuestra opinión, la investigación sobre la fisiopatología de la enfermedad permitirá establecer una diana más precisa para probar el uso de nuevos agentes terapéuticos (Tabla 2).














