Introducción
La neurogénesis es un complejo proceso biológico que involucra neurotransmisores, cascadas de señalización y mecanismos moleculares finamente regulados para que las neuronas proliferen, se diferencien y puedan integrarse al circuito neuronal existente. Las neuronas originadas participarán en procesos de aprendizaje, de memoria, de miedo condicionado, y de modulación de las emociones.(1)(2) La neurogénesis puede ser influenciada por factores intrínsecos o extrínsecos. Las manipulaciones externas son conocidas por impactar positiva y negativamente los niveles de neurogénesis al largo de la vida de los mamíferos.
Algunos de los reguladores positivos más importantes de la neurogénesis hipocampal son la práctica regular de ejercicios físicos, (3) la dieta y los fármacos antidepresivos. (4)(5) Por otro lado, factores como el estrés crónico y el deterioro cognitivo del envejecimiento, que ocurre en las enfermedades neurodegenerativas, traen daños a la neurogénesis. (6)(7) Así, la modificación de estos elementos comunes de la vida, pueden desempeñar un papel significativo en la manera en que la neurogénesis del hipocampo adulto es regulada.
La práctica regular de ejercicios es capaz de promover cambios fisiológicos, bioquímicos y anatómicos en el cerebro, como el aumento del volumen hipocampal, aumento de la sinaptogénesis y angiogénesis, modulación de los neurotransmisores y síntesis de neurotrofinas. (8)(9)(10)(11)(12) La primera mención de la literatura al respecto de la neurogénesis y el ejercicio, fue el estudio de van Praag y colaboradores (13) donde ratones eran sometidos al ejercicio de rueda de corrida voluntaria, observándose un aumento en la proliferación celular de sus hipocampos después de cuatro semanas de entrenamiento. (13) Desde entonces, los estudios al respecto aumentaron exponencialmente; sin embargo, los mecanismos por los cuales el ejercicio físico beneficia la plasticidad hipocampal, principalmente la neurogénesis hipocampal adulta, no están completamente elucidados. El presente trabajo pretende ayudar, por lo menos en parte, a llenar este vacío recopilando información actualizada sobre la manera en que el ejercicio físico es capaz de favorecer la neurogénesis adulta y consecuentemente mejorar la función hipocampal.
Esta revisión tiene la finalidad de contribuir en los avances de esta línea de investigación y mencionar las futuras direcciones de los mecanismos relativos al efecto pro-neurogénico del ejercicio físico y a la mejora de la cognición y calidad de vida del individuo. En primer lugar, se presentan las definiciones de neurogénesis y ejercicio físico y posteriormente se expone una discusión sobre los posibles mecanismos por los cuales el ejercicio físico promueve la neurogénesis hipocampal adulta. La adecuada comprensión de estos mecanismos facilita la prescripción adecuada del ejercicio físico como adyuvante al tratamiento farmacológico en enfermedades neurodegenerativas, deterioro cognitivo y trastornos neuropsiquiátricos, considerando además su efecto neuroprotector en el proceso natural de envejecimiento. (3)(8)(9)(10)(11)(12)
Neurogénesis
El encéfalo es capaz de adaptarse y modificar circuitos neuronales existentes, agregando nuevas neuronas o a través de la remodelación de sinapsis ya existentes, evento denominado neuroplasticidad. (14) El hipocampo es una estructura encefálica que presenta una capacidad de neuroplasticidad tanto estructural como sináptica. La plasticidad estructural se caracteriza por el proceso de neurogénesis adulta y por alteraciones numéricas y morfológicas de las espinas dendríticas. Por su parte, la plasticidad sináptica se caracteriza por el fortalecimiento, adelgazamiento y/o remodelación de las sinapsis existentes. (15) La neurogénesis hipocampal adulta puede ser definida como el proceso de producción de nuevas neuronas a partir de células madres neurales o células progenitoras. (16)
El hipocampo está ubicado en el lóbulo temporal de cada hemisferio encefálico, en base a la morfología celular y las proyecciones de sus fibras, se subdivide en regiones CA, (del latín Cornu Anmonis; organizada en subregiones denominadas CA1, CA2, CA3 y CA4) y el giro dentado (GD). El GD es una estructura trilaminar dividida en capa molecular (ocupada básicamente por las dendritas de las células granulares y polimórficas), capa granular (capa principal de células que posee cuerpos celulares pequeños y esféricos) y capa polimórfica (también llamada de hilo, donde se encuentran las células musgosas). (17)
Actualmente, es aceptado que la neurogénesis ocurre en dos nichos neurogénicos del cerebro adulto tanto de humanos como de roedores: la zona subgranular (ZSG) en el GD del hipocampo, y la zona subventricular (ZSV) en los ventrículos laterales. (18)(19)(20) La neurogénesis es un proceso dinámico, bien regulado y dividido en fases que lleva alrededor de 4 a 6 semanas para ser completado. Inicia con la proliferación de células (quiescentes), que ocurre en la ZSG del GD, a lo que les sigue la migración (hacia el destino celular), diferenciación y maduración celular. A partir del proceso de diferenciación en la ZSG del GD, las neuronas inmaduras migran hacia la capa granular, maduran y darán origen a las células granulares que posteriormente se integrarán al circuito neuronal existente. (21)
La ZSG del GD es un nicho neurogénico del cerebro adulto de mamíferos que contiene células madre neurales. Estas células progenitoras pueden producir múltiples tipos celulares en el sistema nervioso central (SNC), por ejemplo neuronas, astrocitos, oligodendrocitos o microglía. (22) El GD es una fina capa, que posee un microambiente adecuado para la población de células madre neurales, localizada entre la capa de células granulares y de hilos. Este ambiente permite la proliferación de células madre neurales y a la vez promueve la diferenciación de células neurales granulares. (23)
En el GD de adultos, las células neuronales granulares nacidas pasan por varias etapas consecutivas del desarrollo antes de convertirse en células funcionalmente integradas dentro del circuito hipocampal. Se cree que células del tipo I, también denominadas células del tipo glía radial, representan la población de células madre neurales progenitoras y pueden generar células que mantienen la tasa de autorrenovación (células del tipo IIa) y proliferativas progenitoras intermediarias (células del tipo IIb) con características de amplificación transitoria. Durante la transición de la fase mitótica para la posmitótica, las células del tipo IIb pueden dar origen a los neuroblastos (células del tipo III) que subsecuentemente se diferencian en neuronas granulares maduras del GD. (15)(16)(17)(18)(19)(20)(21)(22)(23) Además de la población de progenitores neurales, esa área contiene otros tipos de células que soportan la neurogénesis, como una red vascular densa que es fuertemente asociada a las células tronco neurales. (21)
La supervivencia celular es predominantemente de fenotipos neuronales siendo de aproximadamente 75%, compuesta principalmente por células granulares glutaminérgicas y también algunas interneuronas ácido gama-butíricas (GABAérgicas). Una pequeña proporción se diferencia en astrocitos (15%), oligodendrocitos o microglía. (24)(25) Así, el GD es un área del cerebro caracterizada por una amplia y densa población de neuronas glutamatérgicas y células granulares. (21)(26)(27) Es una importante región de entrada para el hipocampo y, por lo tanto, se cree que desempeña un papel esencial en las tareas de aprendizaje, de memoria episódica y de navegación espacial asociadas a esa estructura.
Las células madre del GD reciben sus inputs de las fibras de la vía perforante originadas en la capa II de la corteza entorrinal lateral y medial. Además de eso, reciben inputs del hipocampo contralateral, diversos aferentes neuromodulatorios, más particularmente inputs colinérgicos provenientes del septum e inputs dopaminérgicos que vienen del mesencéfalo, (28) feedback que vienen de la región CA3, (29) e input glutamatérgicos de células musgosas, e inhibitorios que vienen de interneuronas del hilus, tanto de las capas granular como molecular.
Durante la maduración de las células madre neuronales, ocurre una transición del neurotransmisor GABA, el cual se convierte de excitatorio en inhibitorio, y de inputs glutamatérgicos aproximadamente 2-3 semanas después del nacimiento. La trayectoria en el desarrollo de una nueva neurona es acompañada por la expresión de marcadores moleculares específicos de cada fase del ciclo celular, los cuales permiten el estudio de la neurogénesis. (30)
La neurogénesis fue descrita por la primera vez por Joseph Altman, en el año 1965, (14) pero fue aceptada por la comunidad científica en el año de 1998 gracias a la publicación del estudio realizado por Eriksson y colaboradores, (31) en tejidos post mortem de pacientes. Los autores procesaron el tejido cerebral de humanos adultos y verificaron que nuevas células estaban proliferando y diferenciándose en neuronas. En este trabajo, los pacientes recibieron una inyección del análogo de la timidina, la bromodeoxiuridina (BrdU), que es incorporado al ácido desoxirribonucleico (DNA) de células precursoras en división y puede ser detectado imunohistológicamente, luego que una neurona positiva de BrdU, originara una célula que sufría división en el momento en que el BrdU había sido administrado. (31) Más tarde, Palmer y colaboradores (32) evidenciaron que células tronco con potencial neurogénico pueden ser aisladas del hipocampo de humanos adultos. (32) Así, a lo largo de los años, varios estudios utilizaron la técnica de inmunohistoquímica para detectar células que expresan marcadores de proliferación celular en tejido post mortem de cerebros humanos. (33)(34)(35)(36)
Mientras que la literatura reporta que cerca de 700 nuevas neuronas son generadas por cada GD del hipocampo de humanos adultos por día, (37) dos estudios recientemente publicados, reavivaron el debate científico sobre la existencia de la neurogénesis adulta en humanos. Sorrells y colaboradores(38) mostraron que la neurogénesis desciende a niveles indetectables en tejidos post mortem de 17 pacientes controles y 12 pacientes posquirúrgicos portadores de epilepsia entre los 18 y 77 años. (38) Ya Boldrini y colaboradores, (39) evaluaron 28 muestras de tejidos post mortem del hipocampo de adultos de entre 14 a 79 años, sin comprometimiento cognitivo o enfermedad neuropsiquiátrica. (39) Estos autores concluyeron que la neurogénesis adulta persiste pero, los beneficios de las nuevas neuronas en la cognición humana estarían siendo sobrevalorados, pues ocurre una disminución tanto en el pool de células madre quiescentes, como en la angiogénesis y neuroplasticidad. Aunque ambos estudios presentan limitaciones, ellos pueden servir de orientación para futuros análisis; para evaluar, por ejemplo, fenotipos celulares y posibles trayectorias de diferenciación acompañando la secuencia de ácido ribonucleico (RNA) de una única célula. (40)
El hipocampo es funcionalmente constituido de dos subregiones: la parte dorsal y ventral. En ratas y en ratones, el hipocampo se extiende a lo largo de un eje rostro caudal y un eje dorso ventral, estando el hipocampo dorsal en el polo septal, mientras que el hipocampo ventral está ubicado en el polo temporal del hipocampo. Las secciones coronales más rostrales del hipocampo de roedores contienen apenas hipocampo dorsal, mientras que secciones coronales más caudales contienen tanto el hipocampo ventral como partes del hipocampo dorsal. En los seres humanos, el polo septal está localizado posteriormente, mientras que el polo temporal está ubicado anteriormente, por lo tanto, el hipocampo anterior en humanos es análogo al hipocampo ventral en roedores, mientras que el hipocampo posterior es análogo del hipocampo dorsal en roedores. (41)(42)43)
El estudio de Fanselow y Dong 44 mostró que la disociación funcional al largo del eje septo-temporal del hipocampo, es más compleja que solamente un simple paradigma de “aprendizaje versus emociones”. Sin embargo, de hecho, un conjunto de evidencias indica que el hipocampo dorsal está involucrado principalmente en el aprendizaje, memoria y navegación espacial, mientras que el hipocampo ventral está más vinculado al comportamiento emocional y la regulación del eje de estrés neuroendocrino. (44) Las alteraciones funcionales y moleculares inducidas por el estrés en el hipocampo ocurren en las principales enfermedades mentales y neurológicas, incluyendo la depresión y demencia. (45)(46) En estudios clínicos, el hipocampo dorsal ha sido relacionado con neurodegeneración y demencia, mientras que existe una asociación íntima del hipocampo ventral con la respuesta al estrés, depresión y otros trastornos mentales. (44)
El hipocampo ventral pose una conectividad más intensa con la amígdala y los núcleos endócrino y autonómico del hipotálamo y se proyecta preferencialmente en los núcleos medial, intercalado y basomedial de la amígdala y en el área de transición de la amígdala-hipocampo. Por el otro lado, el hipocampo dorsal tiene eferencias en las regiones más laterales de la amígdala. Las proyecciones de la corteza infralímbica y pre límbica involucradas en la regulación emocional, parten del hipocampo ventral con vías de entrada hacia las partes ventro mediales de la corteza entorrinal. (47) Por otro lado, la corteza cingulada anterior y la corteza retrosplenial parecen estar involucradas en el procesamiento espacial; debido a sus proyecciones estar relacionada incialmente para el hipocampo dorsal vía partes dorsales y laterales de la corteza entorrinal. La conectividad hipocampal parece presentar una diferencia en la composición de neurotransmisoras a lo largo del eje del hipocampo, siendo la inervación colinérgica y dopaminérgica más densa en el hipocampo dorsal, mientras que las concentraciones de noradrenalina y serotonina son más altas en el hipocampo ventral. (47)
Ejercicio físico
Podemos definir ejercicio físico como la actividad física planeada, estructurada y repetitiva que tiene como objetivo mejorar o mantener la salud física. (48) Cuando se prescriben ejercicios físicos, se consideran los componentes del entrenamiento: 1) frecuencia (número de sesiones semanas); 2) tipo de ejercicio físico (aerobio o anaerobio); 3) intensidad (nivel de esfuerzo exigido en la sesión de entrenamiento); 4) volumen (considera las variables tiempo/velocidad/repeticiones/descanso); 5) duración (tiempo por el cual el entrenamiento puede ser soportado). Estos parámetros determinan la adaptación y los beneficios relacionados a la aptitud física y salud mental. (49) El termino aptitud física engloba componentes relacionados a la salud y habilidades físicas, como la aptitud cardiorrespiratoria, la fuerza muscular y la resistencia, además de la composición corporal, la flexibilidad y de aptitud neuromotora. (50)
El ejercicio físico puede ser clasificado en aerobio y anaerobio según los substratos metabólicos predominantes durante la práctica de la actividad. Son ejemplos de ejercicios físicos aerobios: caminar, correr, andar, ciclismo, nadar, danzar. Dentro de los ejercicios físicos anaerobios están incluidos los ejercicios con pesas, comúnmente conocidos como musculación. (51)
Diferentes vías metabólicas ocurren simultáneamente durante la práctica de ejercicios físicos. Así, el ejercicio físico también puede ser clasificado con base en la duración en: 1) esfuerzos explosivos (duración de hasta 6 s, predominancia de la vía fosfogénica); 2) esfuerzos de alta intensidad; (esfuerzos comprendidos entre > 6 s a 1 min, con predominancia de la vía glicolítica); 3) endurance: esfuerzos intensos (para ejercicios físicos con duración superior 1 min con predominancia de sustratos energéticos viniendo de la fosforilación oxidativa). (50)(52)
El ejercicio físico de endurance, de larga duración o ejercicio físico aerobio, involucra grandes grupos musculares en actividades dinámicas que resultan en aumentos sustanciales de la frecuencia cardíaca y el gasto energético, proporcionando mejoras en el desempeño y en la aptitud física. (50) En el ejercicio físico de endurance ocurren modificaciones celulares y moleculares que resultan en adaptaciones, como un aumento en el consumo de oxígeno por tejidos (VO2), un aumento en la remoción de lactato sanguíneo y alteraciones en el potencial hidrógeno (pH), (53)(54) por lo que estos parámetros son frecuentemente utilizados para medir la intensidad de ejercicios físicos de endurance o aerobios. Este es el tipo de ejercicio más estudiado cuando se busca evaluar la salud del SNC.
Está bien establecido en la literatura que el ejercicio físico puede proporcionar beneficios a múltiples órganos a través de varios mecanismos, incluyendo el aumento de la sensibilidad a la insulina, aumento de la capacidad cardiopulmonar, aumento del flujo sanguíneo cerebral, de la oxigenación cerebral después de una enfermedad cerebrovascular y aumento de la potencia y masa muscular. (55)(56) Las características de esos efectos inducidos por el ejercicio físico no son totalmente comprendidas, pero están íntimamente asociadas a los cambios de los perfiles metabólicos en cada órgano en relación con la actividad física, que son dependientes de moléculas que regulan la homeostasis celular.
Durante el ejercicio físico, los músculos activos precisan de un gran aporte de energía; como resultado, varios órganos se coordinan para mantener un aporte adecuado de ATP para la musculatura esquelética. La contracción de los músculos aumenta transitoriamente el estrés oxidativo. Sin embargo, en el caso de la contracción muscular resultante de la práctica de ejercicio físico regular de una mayor duración (por ejemplo, tres veces por semana durante 6 meses), promueve la alteración del patrón molecular en los músculos esqueléticos a través de mecanismos compensatorios y adaptativos que contribuyen para los beneficios en la salud. (57) Entre los beneficios para la salud promovidos por ejercicio físico se destaca su capacidad de mejorar la salud del encéfalo.
Estudios clínicos y preclínicos muestran que el ejercicio físico aumenta la función cognitiva, mejora conexiones y funciones cerebrales. Datos prospectivos epidemiológicos indican que los niveles más altos de aptitud física están asociados a la reducción del riesgo de demencia. (58) Un metaanálisis de 15 estudios entre individuos sin demencia ha descubierto que altos niveles de actividad física reducirán el riesgo de deterioro cognitivo en 38%, mientras que niveles bajos a moderados de actividad física reducirán el riesgo en 35%. (59) Los resultados de ensayos clínicos aleatorizados confirman la relación entre ejercicio físico regular y la salud del cerebro, demostrando que personas mayores que participan de programas de ejercicios físicos alcanzan mejores resultados en pruebas de desempeño cognitivo. (50)(60)
Cabe resaltar que los estudios de neuroimagen muestran cambios en la estructura y conectividad del cerebro en individuos que participan en programas de ejercicio físico, revelando mayor plasticidad funcional del cerebro. (61)(62) Estos individuos parecen ser menos predispuestos al desarrollo de la depresión (63) e individuos diagnosticados con depresión, tienen la disminución de los síntomas depresivos después de protocolos de ejercicio físico tanto de endurance, cuanto anaerobio, o de las dos intervenciones combinadas. (64)(65) También estudios con roedores demuestran los beneficios de la rueda de corrida voluntaria en el desempeño cognitivo, así como en marcadores de neuroplasticidad en regiones del cerebro involucradas en el aprendizaje y memoria, incluyendo el hipocampo y la corteza prefrontal. (66)(67)
En todo el mundo, se estima que, en el año de 2030, 75,6 millones de personas tendrán demencia y este número se triplicará a 135,5 millones para el año de 2050. (68) Dicha demencia suele ser asociada a enfermedades neurodegenerativas como el Alzheimer, (69) o ser relativa al proceso natural de envejecimiento. (70) La corrida aumenta el número de nuevas neuronas beneficiando las funciones cognitivas, promoviendo cambios cualitativos en la maduración, morfología y conectividad neuronal. El ejercicio físico de corrida puede contribuir con cambios en el ciclo celular, pudiendo amplificar las células progenitoras (71) y acelerar el nacimiento y maduración neuronal no GD hipocampal. (72)(73) En particular estudios con marcadores retrovirales (2)(73) han mostrado que la corrida promueve la formación de espinas dendríticas en la capa molecular de células granulares en dendritas de las nuevas neuronas. (74)
Estos cambios de las espinas dendríticas, también incluyen la longitud dendrítica total en los puntos de ramificación y la densidad de mitocondrias son significativamente mayores en nuevas células neuronales en el GD de ratones (marcadas con retrovirus) después de un protocolo de corrida de 3 semanas. (73)(75) Observaciones semejantes pueden ser verificadas en el protocolo de enriquecimiento ambiental en modelos animales (protocolo experimental que contiene cambios en el ambiente físico, estímulos sensoriales auditivos, visuales, olfativos, táctil y motores) el que esté presente la rueda de corrida voluntaria para los ratones. (21)
El volumen del hipocampo en adultos mayores saludables aumenta con la intervención de ejercicios físicos aeróbicos de intensidad moderada (intensidad llegando a 50-60% de la frecuencia cardíaca máxima) por un año, (76) lo que es asociado a una mejor aptitud aeróbica y aumento del volumen del hipocampo. (9) La mejora funcional y estructural del cerebro promovida por el ejercicio físico está íntimamente ligada al factor que activa las vías de señalización asociadas a la LTP, a la plasticidad sináptica y a la neurogénesis en estudios con animales, mientras que, en humanos, la actividad física aumenta la actividad neural y la red funcional como un todo. (67)
Así, los mecanismos moleculares a través de los cuales eso ocurre no están totalmente comprendidos, mientras que es probable que los efectos positivos de los protocolos de ejercicio físico sean causados por el aumento de la expresión de factores neurotróficos en el SNC, y también de moléculas derivadas de tejidos periféricos. (10)(77)
Discusión
Existen distintas líneas de investigación sobre los posibles mecanismos por los cuales el ejercicio físico estimula la neurogénesis hipocampal adulta. El efecto parece involucrar principalmente neurotransmisores, neurotrofinas y moléculas como hormonas o proteínas provenientes de la periferia y con efectos centrales.(10)(77)
Está bien reportado que el microambiente presente en el nicho neurogénico de la ZSG y de la ZSV, puede tener factores específicos que permiten la diferenciación e incorporación de nuevas neuronas. (78) Células progenitoras adultas derivadas de áreas no neurogénicas exhiben autorrenovación y multipotencialidad, una vez trasplantadas hacia un área neurogénica del encéfalo. A su vez pueden diferenciarse de acuerdo al contexto específico de la región; se sugiere que el microambiente tiene un papel importante en la capacidad de estas células. (79) La ZSG, más allá de progenitores neurales, posee neuronas maduras, astrocitos, oligodendrocitos y células endoteliales (80) que pueden proporcionar algunos de los componentes del nicho neurogénico y contribuir para la regulación de la neurogénesis hipocampal inducida por el ejercicio físico.
Cabe resaltar la importancia de los astrocitos en los mecanismos pro-neurogénicos del ejercicio físico. Los astrocitos son el tipo celular más abundante en el cerebro de los mamíferos, hacen conexiones con las neuronas por medio de las sinapsis tripartitas. (81) Los astrocitos también se relacionan con vasos sanguíneos a través de los pies astrocitarios, lo que hace que las neuronas y los vasos sanguíneos trabajen juntos como unidades funcionales. (82) Por lo tanto, sirven como puentes, transmitiendo información y transportando sustancias entre los vasos sanguíneos y las neuronas. Se sugiere que los astrocitos desempeñan un papel fundamental en la promoción de la diferenciación neuronal de un grupo de células precursoras neurales hipocampales adultas y en la integración de neuronas adultas recién formadas. (83)
Existen evidencias de que el ejercicio físico aumenta significativamente el número de astrocitos en el hipocampo y en otras regiones del encéfalo (84)(85) además de promover el alargamiento de las prolongaciones astrocitarias en el hipocampo. (85) Por otra parte, el ejercicio también puede inducir cambios plásticos en los transportadores de astrocitos, como mejorar la expresión del transportador de glucosa 1 (GLUT1) para soportar la creciente demanda de glucosa con el aumento de la actividad neural. (86)
La vascularización del nicho neurogénico regula el comportamiento de las células madres neurales, proporciona factores que pueden regularlo y está influenciada por la práctica regular de ejercicio físico. (*4)(87) La insuficiencia vascular cerebral, como ocurre en la disminución del suministro sanguíneo o de la integridad microvascular en regiones corticales pueden influenciar en la disminución cognitiva. (87) Así, las células progenitoras neurales y proliferativas presentes en la ZSG están íntimamente asociadas con la vascularización, indicando que factores derivados de la sangre pueden tener un impacto directo sobre los progenitores neurales adultos. (88)
La neurotrofina El VEGF, es un factor que regula la angiogénesis y es secretado por las células endoteliales, estando involucrado en la neurogénesis (77). Promueve la mejoría cognitiva, en parte a través de la señalización del receptor del factor de crecimiento endotelial vascular 2 (VEGFR2)/Flk-1, asociado a la neurogénesis inducida por el ejercicio físico en el hipocampo. (89) Por otro lado, el bloqueo periférico de los receptores de VEGF inhibe la neurogénesis inducida por el ejercicio físico. (90)
Los nichos neurogénicos poseen muchos axones de interneuronas locales y de regiones corticales o subcorticales distantes. (91) La liberación de neurotransmisores y otros factores por estímulos aferentes pueden regular precursores en diferentes etapas de las células madre. (80) Varios neurotransmisores diferentes, como la serotonina, el GABA y el glutamato, desempeñan un papel en la neurogénesis del hipocampo inducida por el ejercicio físico. En la ZSG adulta, el GABA de interneuronas locales, tienen un efecto en la despolarización de las neuronas granulares, lo cual ocurre en el período inicial de la neurogénesis hipocampal. (8)
La actividad mediada por el GABA parece ser importante para la supervivencia y maduración de células granulares del GD a través de la proteína CREB. (92) Se sugiere que el factor de transcripción CREB es activado por el BDNF liberado por el ejercicio físico, promoviendo supervivencia celular por la activación de la señalización mediada por la Akt. (93) La serotonina también tiene un papel importante en la neurogénesis inducida por el ejercicio físico pues interviene en la estimulación del receptor 5-HT3, que promueve la neurogénesis. De modo que, la deficiencia de la subunidad del receptor 5-HT3 resulta en la inhibición de la neurogénesis hipocampal inducida por el ejercicio físico. (94)
Un tipo de receptor glutaminérgico, el N-metil-D-aspartato (NMDA) está involucrado en la LTP inducida por el ejercicio físico. (95) El ejercicio aumenta los niveles de ARNm de NR2B, una subunidad del receptor de NMDA, y a la vez aumenta la expresión de BDNF en el GD, indicando que la elevación de la liberación de glutamato y de BDNF por neuronas locales o neuronas externas al nicho neurogénico pueden contribuir para la regulación positiva del ejercicio físico en la neurogénesis hipocampal adulta. (95) Sin embargo, ninguno de estos aspectos en aislamiento es capaz de explicar como el ejercicio físico actúa en la neurogénesis, pues probablemente un conjunto de eventos desencadene este efecto.
El BDNF y el VEGF son neurotrofinas que sufren una regulación positiva en el encéfalo después de la práctica de ejercicios físicos. (12)(89) Las neurotrofinas son una familia de factores de crecimiento que regulan la supervivencia, proliferación, diferenciación y la manutención de las neuronas tanto en el SNC como, en el sistema nervioso periférico, y tienen una infinidad de funciones celulares, como metabolismo de la glucosa y lípidos, balance energético, síntesis de proteínas, entre otras. (96)(97)
El BDNF, es la neurotrofina más ampliamente expresada en el cerebro, y es sintetizada en áreas con funciones cognitivas como el hipocampo y puede ser transportado retrógradamente hacia regiones distantes del cerebro. (98) Las vías de señalización intracelular favorecen el aumento de esta familia de factores de crecimiento que regulan una variedad de funciones neuronales, incluyendo proliferación, supervivencia, migración y diferenciación. (99)
Estudios apuntan a que el ejercicio físico de endurance promueve aumento de BDNF en el SNC específicamente en regiones límbicas, como el hipocampo (12) tanto en roedores cuanto en humanos, (93)(100) mediando efectos como la neurogénesis hipocampal. (10) Cuando es liberado en la periferia, el BDNF es capaz de cruzar la barrera hematoencefálica bidireccionalmente (101). También puede ser sintetizado por el músculo esquelético y utilizado en la unión neuromuscular, sin embargo, la mayoría de BDNF producido periféricamente es liberado en la circulación, pudiendo ser internalizado y almacenado en plaquetas. (102)(103)(104)
Un estudio de Rasmussen y colaboradores, (105) muestra que durante el ejercicio físico cerca del 70-80% del BDNF circulante es proveniente del cerebro y lo restante deriva de fuentes periféricas; por ejemplo, plaquetas, células T, células B y monocitos. (105) Además, los niveles séricos y centrales de BDNF pueden sufrir una regulación positiva en respuesta a los protocolos de ejercicio físico. (106)(107) De hecho, estudios clínicos y preclínicos confirman que el ejercicio físico de endurance aumenta el BDNF en el SNC, específicamente en el hipocampo (12)(107)(108) y está íntimamente relacionado con la neurogénesis hipocampal promovida por el ejercicio físico. (10)
Conforme a lo mencionado, el GD hipocampal es una de las regiones más vulnerables al envejecimiento y neurodegeneración, y por este motivo, la práctica de ejercicios físicos constituye una estrategia neuroprotectora importante para estimular la neurogénesis en la edad adulta. En este sentido, se especula que este proceso involucra moléculas liberadas por los músculos periféricos durante el ejercicio.
Moléculas (incluyendo hormonas, citocinas, peptídicos y proteínas denominadas miocinas) son sintetizadas y liberadas en la corriente sanguínea por la musculatura esquelética después de la práctica de ejercicio físico, y han sido apuntadas como las responsables de los efectos beneficiosos del ejercicio físico en el cerebro (109)(110)(111)(112)(113)(114) Una de estas moléculas es la capsaicina B, en ratones el ejercicio físico induce al aumento de los niveles sistémicos de esta miocina, que en el hipocampo promueve la expresión de BDNF y estimula la neurogénesis. (115) Otra miocina con potencial neuroprotector es la irisina, que recibe este nombre en homenaje a diosa Iris conocida como la mensajera en la mitología griega, una proteína con 112 residuos de aminoácidos que es derivada de FNDC5. (116)
Después de la práctica del ejercicio físico, el ectodominio extracelular del FNDC5 es cortado y glicosilado originando la irisina (116)(117) Evidencias recientes sugieren que la irisina liberada por los músculos es capaz de cruzar la barrera hematoencefálica, (118)(119) y ejercer su efecto en estructuras límbicas, como el hipocampo, donde desencadena una cascada de señalización intracelular que resulta en la transcripción y traducción de BDNF. (112) Moon y colaboradores120 realizaron un estudio in vitro mostrando que la irisina favorece la neurogénesis y la sinaptogénesis de forma dosis dependiente. (120) Alteraciones en la expresión de FNDC5 del precursor de la irisina en neuronas de Purkinje, pueden estar involucradas en la neurogénesis cerebelar a través de mecanismos que actualmente no están totalmente comprendidos. (121) Cabe resaltar, que los niveles plasmáticos de irisina y BDNF están positivamente correlacionados con la función cognitiva en atletas de resistencia. (122)
Un importante trabajo de Lourenço (119) y colaboradores demostró que los niveles de FNDC5/Irisina están reducidos en líquido cefalorraquídeo de humanos con la enfermedad de Alzheimer. Este trabajo sugiere que el FNDC5/Irisina puede ser un mediador de los efectos benéficos del ejercicio físico en la función sináptica y memoria. En modelos animales de la enfermedad, el FNDC5/Irisina promueve neuroprotección. (119) Además, la irisina afecta la plasticidad sináptica dependiente del GD, por alteraciones en la LTP en ratones. (123) Un estudio in vivo probó que diferentes dosis de irisina micro inyectadas en el GD, proporcionan un aumento del potencial postsináptico excitatorio y la amplitud del potencial sináptico en comparación al grupo que no recibió la inyección de irisina. (123)
Conclusiones
La práctica regular de ejercicio físico puede modular procesos moleculares y celulares promoviendo la mejora de las funciones hipocampales. Como los estudios que evalúan la neurogénesis en humanos in vivo no son metodológicamente viables, la manera en la que el ejercicio físico modula el proceso de neurogénesis hipocampal adulta no está completamente elucidada.
El presente trabajo tiene las limitaciones de una revisión de literatura. Así, no aporta el nivel de evidencia científica de una revisión sistemática, evaluando estudios clínicos aleatorizados. Aquí son presentados los principales estudios detallando los posibles mecanismos por los cuales el ejercicio físico ejerce su efecto pro-neurogénico. En esta revisión se verificó lo mucho que se ha explorado en cuanto a los beneficios del ejercicio físico para la mejoría de las funciones hipocampales, pero aún existen vacíos para ser llenados. Por ejemplo, los mecanismos correspondientes a las respuestas positivas aún no están completamente elucidados. Faltan investigaciones para establecer el protocolo de ejercicio adecuado para obtener los resultados positivos, y faltan estudios direccionados a poblaciones específica (como pacientes diagnosticados con enfermedad de Alzheimer, Parkinson o trastornos neuropsiquiátricos).
Como futuras direcciones se debe considerar la prescripción y/o evaluación de los efectos de la práctica de ejercicios físicos, el tipo (aerobio o anaerobio), la intensidad y volumen (de la sesión), la frecuencia (veces por semana), el tiempo de duración (de la sesión de entrenamiento) y el tiempo que dura el protocolo propuesto. Estos aspectos deben ser evaluados pues dificultan la translación de prescripción de ejercicios al pretender aplicar a estudios de modelos animales para humanos. Todos estos factores influencian directamente la respuesta al entrenamiento y consecuentemente las respuestas en la neurogénesis.
Considerar el ejercicio con sus variables, refuerza el potencial del ejercicio físico en condiciones normales de salud para la manutención de la plasticidad hipocampal (Figura 1) y su posibilidad de alterar el curso de enfermedades neurológicas, trastornos neuropsiquiátricos y daños cognitivos degenerativos propios del envejecimiento asociados a prejuicios en la neuroplasticidad, en particular en la neurogénesis hipocampal adulta, mejorando de esta manera la calidad de vida de los individuos. Así, la práctica de ejercicios físicos en condiciones de enfermedad es un campo que necesita ser más explorado, pero es incontestable el gran número de evidencias que apoyan los beneficios preventivos y protectores del ejercicio físico en el SNC en lo que se refiere a salud.
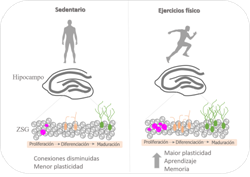
Figura 1 Neurogénesis promovida por el ejercicio físico. La práctica regular de ejercicio físico aumenta el número de células en la zona subgranular (ZSG) del giro dentado hipocampal. El ejercicio físico promueve proliferación, diferenciación y sobrevivencia de neuronas, favoreciendo la cognición y la memoria.














