Introducción
Las cifras asociadas a la distribución epidemiológica de la epilepsia y síndromes relacionados son alarmantes. Se considera que aproximadamente el 3% de la población va a padecer de epilepsia al cumplir los ochenta años y que cerca del 10% ha experimentado un evento convulsivo(1). La epilepsia constituye la tercera causa más común de trastorno neurológico reportado, secundario tan solo a eventos cerebrovasculares y enfermedad de Alzheimer. La epilepsia no se define como una entidad clínica particular sino que es un concepto que se utiliza para designar una serie de patrones convulsivos particulares y cuadros sindrómicos, que si bien tienen etiologías diferentes, comparten de base un proceso patofisiológico común caracterizado por descargas repetitivas de alta frecuencia sincrónicas, DRAFs, que surgen de focos epileptogénicos en clusters neuronales. La forma de manifestación de dichos eventos es variada pudiendo incluir compromiso de la conciencia, alteraciones motoras simples o complejas, patrón de conducta errático transitorio, alucinaciones visuales, entre otros. Por ejemplo, si el foco epileptogénico se encuentra localizado en la corteza motora, la actividad eléctrica resultante podría producir una contracción involuntaria de las extremidades. Si se encuentra en la corteza parietal, occipital o temporal las manifestaciones podrían incluir alucinaciones auditivas complejas, visuales u olfatorias. En determinadas ocasiones resulta sencillo poder determinar la localización del foco epileptogénico guiándose por las manifestaciones asociadas al evento.
Se ha determinado que aproximadamente entre el 70% al 80% de los cuadros convulsivos son controlados exitosamente con monoterapia y aproximadamente el 10-15% con terapia combinada, mientras que cerca del 10% no son controlados con terapia farmacológica solamente(1)
ASPECTOS CLINICOS RELEVANTES AL ABORDAJE
CARACTERISTICAS DE LAS EPILEPSIAS
De forma práctica se puede hacer distinción de las epilepsias en dos categorías: IDIOPATICA y SECUNDARIA. La mayor parte de las epilepsias son categorizadas como idiopática, es decir, no es posible atribuirle causa orgánica o funcional de base. La actividad epiléptica se considera que surge por diferentes causas: áreas focales funcionalmente aberrantes son inducidas a actividad epileptogénica por alteraciones fisiológicas tales como alteración en el patrón de irrigación sanguínea, concentración de glucosa, alteración en pH, composición de gases en sangre, electrolitos; y alteraciones ambientales como estrés, deprivación de sueño, abstinencia aguda del alcohol, entre otros. Si bien estas regiones pueden estar estructuralmente indemnes, avances en técnicas imagenológicas como MRI, PET y SPECT han puesto de manifiesto alteraciones funcionales de base en dichas áreas: desde alteraciones en el patrón de irrigación vascular a concentración anómala de componentes metabólicos y aberración en la utilización de glucosa.
La EPILEPSIA IDIOPATICA es aquella en la que el cuadro convulsivo no es atribuible a una causa orgánica o funcional particular: no es producto de traumatismo craneoencefálico, neoplasia intracraneal, infección, etc. Puede ser hereditaria en determinadas ocasiones. La estrategia terapéutica en dichos casos consiste en el abordaje farmacológico o implantación de un estimulador del nervio vago -VNS- de acuerdo con las características del cuadro.
La EPILEPSIA SECUNDARIA o Sintomática, menos frecuentemente diagnosticada, es atribuida a una causa identificable: meningitis, cuadro febril, neoplasias intracraneales, traumatismo craneoencefálico, aberración de vasos sanguíneos, otros procesos infecciosos, hipotensión transitoria, reacción adversa a fármacos particulares, etc. En dichos casos la estrategia involucra farmacoterapia, implantación de VNS, o cirugía. Sin embargo, si la causa de dicho cuadro convulsivo es identificable y puede ser corregida (ej: reacción adversa a fármaco) no es necesario el abordaje terapéutico de forma crónica.
CLASIFICACIÓN DE CONVULSIÓN
Para poder abordar terapéuticamente los cuadros convulsivos es necesario identificar una serie de características asociadas:
Cuál es la etiología de la epilepsia?
Hay patrón encéfalo gráfico característico?
Cuál es el sitio del foco epileptogénico? y
Cuál es la presentación clínica?
Para ello la ILAE ha clasificado a los cuadros convulsivos en tresgrandes categorías: crisis de inicio focal(con conciencia preservada o alterada), crisis de inicio generalizado (motoras y no-motoras (ausencias) y crisis de inicio desconocido. Para simplificar los aspectos relacionados a esta revisión no se incluyen las estrategias relacionadas a abordaje de síndromes epilépticos complejos o cuadros epileptogénicos atípicos.
Cuando se habla de crisis focales con conciencia preservada se hace referencia a un foco epileptogénico localizado en determinada región en un hemisferio y constituido por un clúster neuronal que exhibe descargas repetitivas de alta frecuencia sincrónicas y cuya actividad permanece aislada a dicha locación, sin propagación. Esto es apreciable a manera de contracciones de grupos musculares en miembros (si el foco es en la corteza motora). Dichos cuadros se asocian a conservación de la conciencia y pueden presentarse a cualquier edad. La actividad del foco sin embargo puede propagarse para progresar a convulsión parcial compleja o a secundariamente generalizada.
Las crisis focales con conciencia alterada se asocian a alteración del estado de conciencia y pueden involucrar desde automatismos motores complejos (como movimientos orolinguales -succión-), micción, dolor gastrointestinal a alucinaciones sensoriales complejas auditivas, visuales u olfatorias dependiendo de la localización del foco epileptogénico. Dichas convulsiones pueden presentarse a cualquier edad. Pueden generalizar con actividad tónico clónica, cuando la propagación de la DRAF comprende ambos hemisferios.
La estrategia farmacológica en estos casos, como se discutirá a continuación, es la misma puesto que los fármacos que se utilizan para el abordaje de epilepsias parciales son eficaces independientemente de su tipo. Resulta sin embargo crítico hacer la distinción del tipo de convulsión generalizada -si es primaria o secundaria- porque en dichas situaciones la terapéutica es diferente.
Las crisis de inicio generalizado por otra parte se caracterizan por compromiso de la conciencia seguidos de fenómeno post-ictal de confusión y agotamiento según el cuadro.
CONVULSIONES TÓNICO CLONICAS: Se caracterizan por compromiso del estado de conciencia asociado a fase tónica (contracción muscular sostenida) seguido de fase clónica (episodios de contracción y relajación muscular repetitivos). Tras el ictus el individuo se manifiesta desorientado y agotado físicamente por el consumo de glucosa y energía.
CONVULSIONES MiOCLóNICAS: Se observan principalmente en la adolescencia o en jóvenes adultos. Lo episodios se aprecian en las mañanas al levantarse y consisten en contracciones musculares de corta duración pero que pueden continuar por varios minutos.
CRISIS DE AUSENCIA TÍPICAS: Se aprecian frecuentemente en niños entre los 3 a los 5 años de edad y se extienden hasta la pubertad, o en ocasiones hasta la edad adulta. Consisten en episodios de compromiso de la conciencia, de 3 a 5 segundos de duración, usualmente asociados a pestañeo rápido y patrón electroencefalográfico característico con espicas y complejos de ondas lentas de 3-4 Hz.
CONVULSIONES FEBRILES: consisten en convulsiones tónico- clónicas asociados a fiebre alta y cuadros infecciosos generalmente en niños pequeños. Sin embargo la presencia solamente del evento convulsivo no lo categoriza como epilepsia. Uno de los fármacos de elección asociados a aquellos cuadros que se extienden por más de 3 minutos es el Diazepam(2).
STATUS EPILEPTICUS: Condición caracterizada por una crisis epiléptica que dura más de cinco minutos o por crisis epilépticas que se suceden sin que haya recuperación del estado de conciencia entre las crisis(3). Dicha constituye una situación de emergencia que debe ser controlada con antiepilépticos.
ESTRATEGIAS RELEVANTES EN LA FARMACOTERAPIA
FÁRMACO DE ELECCIÓN
El abordaje terapéutico consiste en conseguir control de las crisis, inicialmente por medio de medicamentos, y si no es posible se considera una evaluación quirúrgica en la cual el objetivo es encontrar un foco que pueda ser removido quirúrgicamente o si no es posible (profundo, área elocuente, dos focos) modulado con impulsos eléctricos (RNS o Neuropace). Si no se encuentra un foco y por lo tanto la epilepsia es generalizada, las opciones quirúrgicas más comunes son el VNS o callosotomía.
quirúrgica VNS. La estrategia farmacología involucra lo siguiente:
Disminuir la conducción a nivel axonal al bloquear canales de sodio rápidos regulados por voltaje. Para ello se podría utilizar los fármacos convencionales Fenitoína o Carbamazepina.
Aumentar la transducción de estímulos inhibitorios mediados por hiperpolarización a través de canales de cloruro asociados a complejo GABAa: Benzodiazepinas, barbitúricos.
Inhibir la transducción de estímulos excitatorios mediados por glutamato: Lamotrigina, Topiramato (entre otros, bloqueo de receptores AMPA), Felbamato (antagonista a nivel de receptores NMDA).
Disminuir el influjo presináptico de calcio al inhibir canales de calcio regulados por voltaje tipo-T a nivel de neuronas talámicas: Valproato, Etosuximida.
La estrategia farmacológica debe ser adecuada a múltiples componentes: el perfil del cuadro convulsivo (como se había mencionado anteriormente: no es lo mismo abordar una crisis de inicio focal que una de inicio generalizado), el perfil del fármaco (potencial de toxicidad, metabolismo, potencial de interacciones farmacológicas) y el perfil del paciente (edad, comorbilidades, estilo de vida, facilidades económicas, consumo de fármacos concomitantes cuyo metabolismo pueda ser alterado por la administración del anticonvulsivante, entre otros).
Tradicionalmente, se abordaba con farmacoterapia cuando se acude a la consulta por un segundo episodio de convulsión no provocada. Recientemente, también se inicia farmacoterapia en aquellos pacientes que han tenido una crisis no provocada y un riesgo de 60 % de tener otra crisis epiléptica en los siguientes 10 años. Tras haber respondido las preguntas inherentes al perfil del paciente, y haber identificado eltipo de epilepsia, se procede a administrar monoterapia con aquel fármaco que se haya determinado como de elección para el caso. La dosis a administrar debe ser aumentada progresivamente a la máxima tolerada por el paciente y con la que se logre el control adecuado del cuadro epiléptico. Tras ello se debe monitorizar. Si con dicho fármaco recurre el trastorno se debe administrar otro segundo fármaco, aumentando la dosis progresivamente hasta el máximo tolerable y con la cual se controlen las convulsiones. Alrededor de dos tercios de los pacientes con epilepsia logran estar ´libres de crisis epilépticas´ con el tratamiento médico. Si a pesar de usar dos fármacos a dosis adecuadas el paciente no logra estar libre de crisis, la epilepsia se define como resistente al tratamiento médico y el paciente debe ser referido para evaluación quirúrgica. (Tabla 1)
Tabla 1 Fármacos de elección
| CONVULSIONES PARCIALES SIMPLES, COMPLEJAS, SECUNDARIAMENTE GENERALIZADAS |
| Fármacos de ELECCIÓN EN EL DIAGNÓSTICO RECIENTE y si no se trata de paciente mayor: Lamotrigina, Topiramato, Levetiracetam. SEGUNDA LÍNEA: Carbamazepina, Pregabalina, Lacosamida, Zonisamida. TERCERA LÍNEA: Fenitoína, Oxcarbazepina, etc |
| Pacientes mayores: Evidencia respalda la administración de Lamotrigina de entrada en pacientes mayores (buen perfil terapéutico, bien tolerado). Si con ello es insuficiente administrar Gabapentina como terapia adyuvante. Si progresa considerar Carbamazepina. |
| CONVULSIONES GENERALIZADAS |
| MIOCLONICAS Valproato, Levetiracetam |
| AUSENCIA Valproato, Lamotrigina/ Topiramato/ Etosuximida |
| TONICO-CLONICAS Lamotrigina, Topiramato, Levetiracetam/ Valproato |
| STATUS EPILEPTICUS Benzodiazepinas, Fosfenitoina/ Barbitúricos |
| SINDROMES EPILEPTICOS PARTICULARES |
| SINDROME DE WEST (ESPASMOS INFANTILES) Corticotropina, Vigabatrina |
| SINDROME DE LENNOX-GASTAUT Valproato, Lamotrigina, Topiramato/ Rufinamida, Levetiracetam/ Felbamato. |
*Adaptado de HARVEY R, CLARK M, FINKEL R, REY J, WHALEN K. Epilepsy. Pharmacology 5th Edition 2012
Desde 1990 la FDA ha aprobado una serie de fármacos anticonvulsivantes que posiblemente ofrezcan un mejor perfil de tolerancia, menos interacciones farmacológicas y mejor características farmacocinéticas en comparación con los fármacos clásicos: LACOSAMIDA, LAMOTRIGINA, LEVETIRACETAM, OXCARBAZEPINA, VIGABATRINA, TIAGABINA, TOPIRAMATO, RUFINAMIDA, por nombrar algunos. Dichas nuevas intervenciones sin embargo carecen de evidencia sustancial que respalde una posible superioridad respecto a los fármacos tradicionales, pero son preferidos en la consulta por su mejor perfil farmacocinético y tolerabilidad. (Tabla 2) (Figura 1)
Tabla 2 Dosis iniciales y de mantenimiento, efectos adversos importantes en aed de rutina*
| AED | Dosis Inicial en el adulto promedio | Dosis de mantenimiento en el adulto promedio (mg/dia) | Efectos adversos de importancia |
| Carbamazepina (CBZ) | 100 mg BID | 400-1000 | Sedación, mareo, ataxia, rash (ocasionalmente Steven-Johnson), hiponatremia, ganancia de peso, declive del cuadro convulsivo en ciertos síndromes epilépticos |
| Clobazam (CLB) | 10 mg QD (HS) | 10-30 | Sedación, ataxia, somnolencia, irritabilidad, depresión, ganancia de peso, tolerancia (reducción de efecto antiepiléptico) |
| Lamotrigina (LTG) | 25 mg QD (HS) Dosis menor con VPA | 100-300 | Sedación, ataxia, mareo, rash (ocasionalmente Steven-Johnson) |
| Levetiracetam (LEV) | 250 mg BID | 1000-3000 | Somnolencia, mareo, ralentización neurocognitiva, psicosis |
| Oxcarbazepina (OXC) | 150 mg BID | 600-1800 | Sedación, mareo, ataxia, cefalea, hiponatremia, rash |
| Fenobarbital (PB) | 60-90 mg QD (HS) | 60-180 | Sedación, ataxia, depresión, problemas de memoria, rash, hiperactividad en niños |
| Fenitoina (PHT) | 200-300 mg QD (HS) | 200-400 | Ataxia, sedación, hiperplasia gingival, alteración de rasgos faciales, hirsutismo, problemas de memoria, osteomalacia y disminución de densidad ósea, rash |
| Topiramato (TPM) | 25 mg QD | 100-400 | Sedación, somnolencia, deterioro cognitivo, pérdida de peso, anomia, nefrolitiasis, declive de cuadro epiléptico |
| Valproato (VPA) | 200 mg BID | 500-2000 | Anorexia, aumento de peso, nausea, vomito, temblores, alopecia, PCOS (ovario poliquistico), trombocitopenia |
| Zonisamida (ZNS) | 50 mg QD (HS) | 200-500 | Sedación, anorexia, nefrolitiasis, amnesia, rash, pérdida de peso, parestesias distales |
*NOMENCLATURA: QD: Una sola vez al día | BID: Dos veces por día | HS: Administrar por la noche. Adaptado de folleto de la ILAE: “Treatment of Epilepsy”
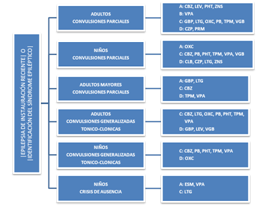
Figura 1 Algoritmo sugerido por la ilae para la seleccion inicial de farmacos anticonvulsivantes en pacientes con epilepsia de instauracion reciente de acuerdo a nivel de evidencia. NOMENCLATURA: CBZ: Carbamazepina | CLB: Clobazam | CZP: Clonazepam | ESM: Etosuximida | GBP: Gabapentina |LEV: Levetiracetam | LTG: Lamotrigina | OXC: Oxcarbazepina | PB: Pregabalina | PHT: Fenitoína | PRM: Primidona | TPM: Topiramato | VGB: Vigabatrina | VPA: Valproato | ZNS: Zonisamida.
A continuación, se listan los fármacos que convencionalmente se usan en el abordaje de las convulsiones, sus mecanismos de acción, características farmacocinéticas relevantes, y efectos adversos de interés.
La elección del antiepiléptico suele basarse en varios factores:
-Comorbilidades del paciente: Varios de los MAE tienen acción terapéutica en otras enfermedades neurológicas o psiquiátricas. Por ejemplo, el topiramato y valproato sirven como agentes profilácticos para la migraña. Este último también se usa en el tratamiento del trastorno afectivo bipolar. Asimismo, la presencia de comorbilidades psiquiátricas sería una contraindicación relativa para usar levetiracetam, ya que este fármaco podría empeorar estas condiciones.
-Grupo etario y género: Este ítem principalmente hace referencia a las mujeres edad reproductiva en las cuales hay que considerar el perfil teratogénico de estos fármacos. Valproato, fenitoína, fenobarbital han demostrado aumentar el riesgo de malformaciones fetales y su uso en esta población no es recomendado. Topiramato y carbamazepina también tienen riesgo aumentado. Las mujeres con epilepsia deben tener un método anticonceptivo confiable. En caso de embarazo, los fármacos preferidos son levetiracetam o lamotrigina.
-Tipo de epilepsia: Ciertos fármacos solo han demostrado ser eficaces en epilepsia focal. Su uso en epilepsias generalizadas lleva a un empeoramiento del cuadro. Estos son carbamazepina, oxcarbazepine, eslicarbazepina, fenitoína, pregabalina, gabapentina, vigabatrina, y tiagabina. Es importante tener en cuenta que el uso de la etosuximida está limitado al tratamiento de crisis de ausencia.
BENZODIAZEPINAS
Actúan como depresores a nivel central, mediando sus acciones a través de la unión a receptores específicos BZ1 en complejos GABAa y potenciando el efecto de GABA: aumentan la afinidad del ligando por su receptor y aumentan la frecuencia de apertura de canales de cloruro asociados a ligando, produciendo hiperpolarización en neuronas postsinapticas e induciendo la transducción de estímulos inhibitorios. Las Benzodiazepinas (Lorazepam, Diazepam) son utilizadas como terapia adyuvante para el abordaje de convulsiones parciales (simples, complejas, secundariamente generalizadas), generalizadas (tónico-clónicas, mioclónicas) y status epilepticus (Lorazepam IV). Si bien el Lorazepam es categorizado como benzodiazepina de acción intermedia (efecto por aproximadamente 10-20 horas) penetra más fácilmente a nivel central que el Diazepam (acción larga, entre 1-3 días). El Diazepam se puede aplicar adicionalmente en preparados por vía rectal para interrumpir convulsiones tónico-clónicas generalizadas en las cuales no se ha logrado establecer un acceso intravenoso. Las benzodiazepinas tienen a usarse únicamente en la parte aguda del tratamiento de status epilepticus, pero no como tratamiento a largo plazo.
CLOBAZAM -CLB- (FRISIUM, ONFI)
Es una benzodiazepina que cuenta con aprobación en Canadá y México desde hace decenios. Su uso potencial en Estados Unidos, no obstante, está siendo fuertemente considerado en el manejo de cuadros refractarios, lo que ha resultado en un interés creciente y muy probable aceptación por la FDA en el 2016.
EFECTOS ADVERSOS DE INTERES son sedación, ataxia, somnolencia, irritabilidad, depresión, aumento de peso, tolerancia (disminución de la efectividad del fármaco con el tiempo).
CARBAMAZEPINA -CBZ- (TEGRETOL, TEGRITAL, ATRETOL)
Actúa bloqueando canales de sodio regulados por voltaje en el estado inactivo previniendo la propagación de descargas repetitivas de alta frecuencia. Tiene utilidad en la en epilepsia focal únicamente. Aumenta la frecuencia de crisis en las epilepsias generalizadas. Adicionalmente es el fármaco de elección en neuralgia del trigémino y se utiliza en el abordaje de trastornos bipolares. En lo referente a la farmacocinética, la Carbamazepina se absorbe de forma errática a nivel gastrointestinal, variando su absorción incluso de genérico a genérico. Es inductor del sistema hepático microsomal, acelerando el metabolismo de múltiples fármacos, incluyendo su propio metabolismo y disminuyendo sus concentraciones eficaces en sangre.
Entre los EFECTOS ADVERSOS que se registran destacan: depresión a nivel central, anemia megaloblástica (por inhibición de folato), aplasia medular, osteomalacia (disminuye niveles de vitamina D), dermatitis exfoliativa y aumento de la secreción de ADH que produce hiponatremia dilucional (causa suficiente para interrumpir el fármaco).
Es teratogénica, asociándose a un aumento de la incidencia de labio leporino y paladar hendido, al igual que espina bífida en productos de madres que consumieron el fármaco. Debe manejarse con cuidado en personas de edad por su perfil de baja tolerancia y farmacocinética, al igual que sus propiedades inductoras.
ETOSUXIMIDA -ESM- (ZARONTIN)
Inhibe el influjo presinaptico de calcio al bloquear canales de calcio regulados por voltaje tipo-T en neuronas talámicas. Su limitada actividad antiepiléptica restringe su uso alas crisis de ausencia, en el cual es la primera línea de tratamiento.
EFECTOS ADVERSOS: Mareo, confusión, insomnio, cefalea, ataxia son comunes. Raramente se reporta psicosis paranoide, exacerbación de depresión y aumento de libido.
FELBAMATO -FLB- (FELBATOL)
Presenta gran actividad anti-epileptogénica. Sus mecanismos de acción se sugiere que son los siguientes: actúa como antagonista a nivel de receptores NMDA, interfiriendo con la transmisión de glutamato y bloqueando la transducción de estímulos excitatorios/ bloquea canales de sodio regulados por voltaje, inhibiendo la conducción axonal y propagación de la descarga/ bloquea canales de calcio regulados por voltaje tipo-T, disminuyendo el influjo presináptico de calcio y la depuración de neurotransmisores a nivel de neuronas talámicas.
A pesar de sus propiedades atractivas es reservado como fármaco para el abordaje de cuadros epilépticos refractarios (como tercera línea en Lennox-Gastaut) dado su perfil de toxicidad (hepatotóxico) y reportes de aplasia medular cada 4000 intervenciones terapéuticas.
FENITOINA -PHT- (DILANTIN, EPAMIN, PHENYTEK)
La Fenitoína actúa bloqueando canales de sodio regulados por voltaje, interfiriendo con la conducción axonal y evitando la propagación de la actividad epileptogénica. A dosis mayores muestra actividad contra el canal de calcio regulado por voltaje tipo-T, y disminuye la depuración de neurotransmisores excitatorios. La Fenitoína es el anticonvulsivante que más comúnmente se receta por su bajo costo, actividad antiepiléptica amplia, y facilidad de acceso, aunque actualmente no es considerado de elección en múltiples protocolos cuando el costo no es problema. Muestra actividad contra convulsiones parciales (simples, complejas, secundariamente generalizadas), generalizadas (tónico-clónicas), status epilepticus (como fosfenitoina).
La Fenitoína muestra absorción errática a nivel gastrointestinal y concentración variable en sangre. Es metabolizada por un mecanismo saturable y sigue una cinética de depuración de orden no linear (indicando que su depuración se da a concentraciones fijas en determinado tiempo, independientemente de su concentración sanguínea). Esto debe tenerse en cuenta ya que puede adquirir niveles tóxicos fácilmente. Por lo tanto, se recomienda obtener niveles séricos frecuentemente. La Fenitoína es un fuerte inductor del sistema hepático microsomal, induciendo el metabolismo de múltiples fármacos.
La dosis usual es entre 200 mg a 400 mg diarios.
EFECTOS ADVERSOS incluyen depresión a nivel central, osteomalacia, anemia megaloblástica, aplasia medular, hiperplasia gingival, hirsutismo. Es teratogénica, asociándose a labio leporino y paladar hendido.
La FOSFENITOÍNA es profármaco de la Fenitoína. Presenta mayor solubilidad en agua, y puede ser administrado por vía IM o IV. Es uno de los fármacos de elección para el tratamiento de status epilépticus y la dosis inicial es de 18 mg/kg La Fenitoína sódica no se debe administrar IM por producir necrosis en el sitio de aplicación.
FENOBARBITAL -PB-
El fenobarbital es un barbitúrico, agente hipnótico y sedativo que media sus efectos al asociarse a receptores particulares en el complejo GABAa en un sitio de unión diferente al de las Benzodiazepinas. Prolonga la acción de GABA al aumentar el tiempo de apertura de los canales de cloro, produciendo hiperpolarización a nivel de neurona postsináptica e induciendo la transducción de estímulos inhibitorios. A dosis elevadas los barbitúricos pueden actuar como GABAmimieticos, produciendo mayor depresión que las Benzodiazepinas a nivel central.
Su tiempo de acción es largo, aproximadamente 1-2 días, y es utilizado en el abordaje de status epilepticus, cuando no es posible tener acceso a benzodiazepinas o a fosfenitoína. Es considerado como de elección para el manejo de convulsiones febriles en niños jóvenes, aunque se asocia a disfunción neurocognitiva.
Es un inductor del citocromo P450, lo cual lleva a disminución en la concentración plasmática de fármacos que son metabolizados por esta vía.
La dosis recomendada es 1 a 2.5 mg/kg/día. Su presentación parenteral está recomendada como segunda línea en las guías de tratamiento de status epilepticus. (neurocritical care society 2012; american epilepsy society 2016) En ese caso se da una dosis inicial de 20 mg por kilogramo.
EFECTOS ADVERSOS: Sedación, ataxia, depresión, problemas de memoria, rash, hiperactividad en niños. Uso a largo plazo produce osteoporosis.
PRIMIDONA
Es un pro-fármaco que es convertido por el hígado a fenobarbital. Su vida media es más corta, siendo de 10 a 15 horas. Al igual que el fenobarbital, también es inductor del citocromo p450. Su uso más común es en el tratamiento del temblor esencial, pero también se usa ocasionalmente para las crisis focales y generalizadas.
La dosis recomendada es 50 mg en la noche al inicio, y puede ser incrementado gradualmente cada semana 50 mg, hasta llegar a 250 mg cada 8 horas.
EFECTOS ADVERSOS: ataxia, mareo, somnolencia.
GABAPENTINA -GBP- (NEURONTIN)
Análogo de GABA que no actúa como gabamimético (no se asocia a receptores en el complejo GABAa), no potencia la acción del GABA y no es metabolizado a GABA. Su mecanismo de acción no es bien comprendido. Ha sido aprobado para el abordaje adyuvante de cuadros convulsivos parciales en pacientes añosos. También muestra actividad en neuralgia postherpética. El fármaco resulta particularmente atractivo al no asociarse a proteínas en sangre ni interferir en el metabolismo de otros fármacos puesto que es depurado sin modificaciones por vía renal. Es bien tolerado en pacientes añosos y sus propiedades farmacocinéticas características lo vuelven una opción atractiva en esa población. Sin embargo, su uso en epilepsia generalizada no está recomendado ya que aumenta la frecuencia de las crisis.
EFECTOS ADVERSOS: mareo, fatiga, letargia, ataxia, edema periférico, nistagmo y temblor. Existen reportes de disfunción sexual. Al igual que otros AEDs existe un riesgo mayor de depresión y suicidio.
LACOSAMIDA -LCM- (VIMPAT)
In vitro la Lacosamida muestra actividad contra canales de sodio regulados por voltaje, interfiriendo con la conducción axonal. En modelos experimentales también ha mostrado actividad contra CRMP-2 (Collapsin response mediator protein 2), proteína que se expresa principalmente a nivel de tejido nervioso y que parece ser critica en la diferenciación neuronal y desarrollo del axón. De qué manera dicha propiedad resulta en actividad anticonvulsivante resulta desconocido. Ha sido aprobada para el tratamiento adyuvante de cuadros epilépticos parciales. Su presentación parenteral se usa en casos de status epilepticus.
EFECTOS ADVERSOS: Comunes (>10% de casos) son vértigo, ataxia, náusea, vómito, mareo, diplopía y visión borrosa. Menos frecuentemente se reporta sensación de tristeza, anorexia, amnesia, agitación y otras manifestaciones neuropsiquiátricas. El efecto adverso más importante a tener en cuenta son alteraciones en la conducción cardiaca y por lo tanto se debe obtener un electrocardiograma antes de iniciar el medicamento y poco después de empezarlo.
LAMOTRIGINA -LTG- (LAMICTAL)
La Lamotrigina muestra gran actividad antiepiléptica. Actúa como bloqueador de canales de sodio regulados por voltaje y disminuye el influjo de calcio presináptico al bloquear canales de calcio regulados por voltaje. Es considerada como fármaco de elección en múltiples cuadros convulsivos ya que tiene actividad contra convulsiones parciales (simples, complejas, secundariamente generalizadas), generalizadas (tónico-clónicas, de ausencia), Lennox-Gastaut y tiene actividad adicional en trastorno bipolar.
La Lamotrigina es metabolizada por glucuronidación hepática. La administración conjunta con Carbamazepina o Fenitoína puede inducir su metabolismo disminuyendo rápidamente sus niveles pico en sangre, mientras que la administración conjunta con Valproato aumenta su concentración por efecto inhibitorio microsomal, requiriéndose en ambas situaciones ajuste de dosis. Esta interacción con el valproato suele ser aprovechada en casos de difícil control, teniendo buenos resultados con dosis más bajas de lamotrigina. Su perfil de toxicidad es aceptable, siendo de preocupación particular el desarrollo posible de Stevens-Johnson. Por esto, tiene a iniciarse a dosis bajas que se van incrementando lentamente.
EFECTOS ADVERSOS: Sedación, ataxia, mareo, rash (ocasionalmente Stevens-Johnson).
LEVETIRACETAM -LEV- (KEPPRA)
El mecanismo de acción del Levetiracetam resulta desconocido, aunque se ha demostrado que se asocia a la proteína SVP (synaptic vesicle protein) sin determinarse una correlación particular con su actividad anticonvulsivante. El Levetiracetam ha sido aprobado para el abordaje de convulsiones parciales (simples, complejas, secundariamente generalizadas), generalizadas (mioclónicas, tónico clónicas), Lennox-Gastaut en niños y en adultos. No interactúa con el sistema hepático microsomal o con mecanismos de glucuronidación involucrando la UDP-glucuroniltransferasa.
EFECTOS ADVERSOS: Somnolencia, mareo, deterioro cognitivo, psicosis e ideación suicida.
OXCARBAZEPINA -OXC- (OXTELLAR, TRILEPTAL)
La Oxcarbazepina es un profármaco metabolizado a MHD (derivado monohidroxi), un metabolito activo que bloquea canales de sodio regulados por voltaje y que modula canales de calcio. Es utilizado como de elección en el abordaje de convulsiones parciales en niños y de tercera línea en adultos.
EFECTOS ADVERSOS: Sedación, mareo, ataxia, cefalea, hiponatremia, rash
PREGABALINA -PGB- (LYRICA)
Actúa bloqueando canales de calcio regulados voltaje para inhibir la movilización de neurotransmisores. La Pregabalina muestra actividad contra convulsiones parciales y es utilizada en el manejo de dolor neuropático como el asociado a neuropatía diabética, neuralgia postherpética o fibromialgia. Es depurado prácticamente sin modificación a nivel renal y no muestra interacción farmacológica con drogas metabolizadas por el sistema hepático microsomal o mediante glucuronidación. Al igual que la gabapentina, no se recomienda su uso en epilepsia generalizada.
RUFINAMIDA -RFM- (BANZEL, INOVELON)
In vitro, la Rufinamida ha mostrado actividad contra canales de sodio regulados por voltaje, y es utilizado como terapia adyuvante en el manejo de Lennox-Gastaut en niños mayores de 4 años y en adultos. Se asocia a acortamiento del QT.
TIAGABINA -TGB- (GABITRIL)
La Tiagabina inhibe la receptación de GABA por neurona presináptica, prolongando su efecto a nivel de receptor. Muestra actividad en la reducción de crisis convulsivas parciales, sin embargo se ha asociado postmarkéting a episodios convulsivos en individuos sanos que reciben el fármaco por otras indicaciones no aprobadas por la FDA.
TOPIRAMATO -TPM- (TOPAMAX)
El Topiramato muestra gran actividad anticonvulsivante, lograda mediante múltiples mecanismos de acción: bloquea canales de sodio rápidos -interfiriendo con la conducción axonal-, bloquea canales de calcio regulados por voltaje tipo L, aumenta la frecuencia de apertura del canal de cloruro al asociarse a receptores GABAa (produciendo hiperpolarización a nivel de neurona postsináptica y potenciando la transducción de estímulos inhibitorios), bloquea canales AMPA (interfiriendo con la transducción de estímulos excitatorios), es inhibidor de la anhidrasa carbónica. Ha sido aprobado para el abordaje de convulsiones parciales, generalizadas (tónico-clónicas), Lennox-Gastaut y en la profilaxis para migrañas.
EFECTOS ADVERSOS derivan del bloqueo múltiple: sedación, nefrolitiasis, glaucoma, oligohidrosis, hipertermia, parestesia, reducción de peso.
VALPROATO/DIVALPROEX -VPA- (DEPAKOTE, DEPAKENE, DEPAKINE, ORFIRIL, VALPORAL, CONVULEX)
El Divalproex consiste en preparado a base de Valproato de sodio y ácido valproico para mejorar su tolerancia gastrointestinal. Muestra gran actividad anticonvulsivante al bloquear canales de sodio regulados por voltaje, canales de calcio regulados por voltaje e inhibir la GABA transaminase, enzima responsable de la degradación de GABA. Es considerado como de elección para el abordaje de convulsiones generalizadas: crisis mioclónicas (con Levetiracetam), ausencia (con Etosuximida y Lamotrigina), Lennox-Gastaut. También tiene uso en convulsiones parciales y generalizadas tónico clónicas. Frecuentemente se usa la formulación parenteral para el tratamiento de status epilepticus.
El Valproato es inhibidor del sistema hepático microsomal y es teratogénico, asociándose a espina bífida y retraso mental, por lo que su uso está contraindicado en el embarazo.
EFECTOS ADVERSOS: Anorexia, aumento de peso, náuseas, vómitos, temblor, alopecia, síndrome de ovario poliquístico, trombocitopenia.
VIGABATRINA -VGA- (SABRIL)
La Vigabatrina es inhibidor de la GABA transaminasa, y ha sido aprobado para el abordaje de espasmos infantiles (Síndrome de West). Tiene uso como agente de tercera línea en el abordaje de convulsiones parciales en niños y adultos, al igual que de última línea en el manejo de convulsiones generalizadas tónico-clónicas en adultos. El fármaco se asocia a EFECTOS ADVERSOS severos, como compromiso de la visión periférica en más del 30% de los pacientes.
ZONISAMIDA -ZNS- (ZONEGRAN)
La Zonisamida es un fármaco categorizado en el grupo de las sulfamidas, no relacionado con ningún otro grupo de AEDs. Si bien se desconoce el mecanismo exacto de su acción antiepiléptica se cree que ejerce su acción principalmente mediante bloqueo de los canales de sodio y de calcio regulados por voltaje tipo-T a nivel neuronal, estabilizando así la membrana y suprimiendo la hipersincronización. Así mismo se ha encontrado que la molécula se une al complejo receptor GABA/benzodiacepina sin producir cambios en el flujo del cloruro(8).
Aprobado por la ILAE en el 2013 mostrando evidencia de clase I para el tratamiento de crisis parciales en el adulto y categoría de nivel A, es decir, con eficacia establecida como monoterapia inicial, comparable con Carbamazepina, Levetiracetam y Fenitoína(7). Sin embargo, la FDA aprueba su uso únicamente como terapia adyuvante a otros fármacos considerados de primera elección en crisis parciales en adultos(9). Si bien la evidencia actual proyecta a la ZNS como agente de monoterapia potencialmente eficaz en el manejo de crisis parciales en pacientes pediátricos, no ha sido aprobado su uso por la FDA en dicha población.
EFECTOS ADVERSOS: Acidosis metabólica, astenia, vómitos, temblores, alteraciones de la marcha, hiperestesia, convulsiones, prurito, aumento de tos, faringitis(8)(9).
CONCLUSIÓN
El estudio de la epilepsia comprende un campo dinámico en constante evolución. El salto impresionante en el desarrollo de nuevos y eficaces principios farmacológicos de abordaje caracterizados por eficacia superior, mejor tolerancia y menor toxicidad, es evidenciado en la significativa mejora clínica de la población con acceso a estas intervenciones: un hecho que se ve reflejado en la batería de fármacos disponible.
Evidencia de este desarrollo vertiginoso se puede derivar de una sobria y muy breve revisión de los primeros reportes de estos agentes: desde el hallazgo de la eficacia del Fenobarbital como agente anticonvulsivante en 1910 -previo al cual el estándar de tratamiento estaba representado por las bromidas, introducidas en 1850 y en una época en la cual se atribuía como causa etiológica de la epilepsia a un impulso sexual exagerado- y los primeros reportes señalando la eficacia de la Fenitoína en 1940, seguido de cerca por el uso de la Etosuximida en el manejo de las crisis de ausencia en 1958 y la aprobación de la Carbamazepina en 1974, concluyendo con el Valproato en el 78 y considerado como estándar de tratamiento por 2 décadas; la lista de nuevos agentes continúa extendiéndose(10). Desde mediados de los 90 y en tan solo 2 décadas se ha logrado expandir el arsenal terapéutico a más de 26 agentes (11) , en comparación con los previos 5 considerados como estándar por más de 50 años.
Es pues, con el conocimiento expuesto en esta revisión, que los autores esperan haber presentado de manera detallada las alternativas en el abordaje actual de cuadros de epilepsia, no en miras de hacer las veces de guía terapéutica, sino más bien con el fin de dotar al médico tratante de herramientas que simplifiquen la selección del fármaco apropiado de acorde a su criterio, circunstancias clínicas y realidad del paciente.














