Introducción
El síndrome de Fahr (SF) es una entidad neurodegenerativa rara, caracterizada por calcificaciones cerebrales principalmente en los ganglios de la base (GB). Aunque su presentación más común son los trastornos del movimiento, cognición, comportamiento y epilepsia, en los últimos años van apareciendo casos de enfermedad cerebrovascular (ECV) relacionados con esta entidad. Se presenta el caso de un paciente joven com SF secundario a hiperparatiroidismo primario con hipovitaminosis D que presentó AITs de repetición y se revisa la asociación del SF a la ECV isquémica (sin inclusión de la enfermedad aneurismática).
Caso Clínico
Paciente masculino de 59 años de edad, previamente autónomo. Presentó 2 accidentes isquémicos transitórios (AITs), el 1º de 5 minutos, de alteración del habla, que pasó desapercibido, y el 2º de 45 minutos, 2 semanas después, de alteración del habla, pérdida de fuerza muscular y sensación de hormigueo en el hemicuerpo izquierdo, sin pérdida de conciencia, ni sintomas autonómicos, ni alteraciones esfinterianas, sin infección previa o antecedentes tóxicos. Antecedentes personales: ex-fumador hasta hace 17 años, dislipidemia, hipotensión arterial y nódulos benignos de tiroides (biopsia). Antecedentes familiares negativos. Medicación habitual: pregabalina 25 mg y atorvastatina 10 mg.
Hemodinámicamente estable: tensión arterial 100/51 mmHg y frecuencia cardiaca 64 lpm. ACP: normal. Abdomen normal e sin edemas en extremidades inferiores.
Examen neurológico normal, MMSE 30, sin parkinsonismo. ABCD2 score 4.
Investigación efectuada: Tomografía computada (TC) y resonancia magnética (RM) craneales (Fig. 1 y 2) sugestivas de SF. Rx tórax normal. (Figura 1)(Figura 2)
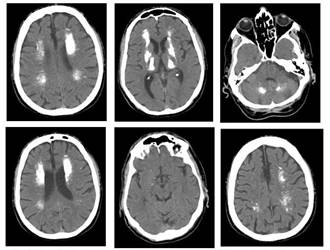
Figura 1. TC craneal: extensas calcificaciones cerecbrales y cerebelosas bilateralmente, simétricas. Localización predominante en los núcleos lenticulares, coronas radiatas, tálamos y núcleos dentados. Imagen sugestiva de Síndrome de Fahr.
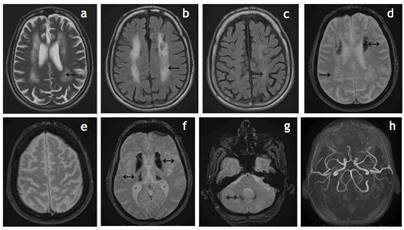
Figura 2. RM craneal: a) T2 axial; b-c) FLAIR axial; d-f) T2 axial supratentorial; g) T2 axial infratentorial; h) Angio-RM 3D. Hiperseñal difuso de la SB a nivel de las coronas radiatas y centros semiovales asociandose también calcificaciones en los ganglios de la base, tálamos y núcleos dentados. En T2 se observan también calcificaciones corticales a nivel frontal y parietal.
Análisis: calcio 10.54 mg/dl (8.8-10), fósforo 2.14 mg/dl (2.3-4.7), PTH 180.7 pg/mL (15-68), vitamina D 12 ng/ml (30-100); urea y creatinina, magnesio, fosfatasa alcalina, transaminasas y proteínas totales: normales. Gasometria normal. Orina: sin hipercalciuria.VSG, PCR, D-dimeros, pruebas de coagulación, proteína S, C y AT III: normales. Marcadores tumorales negativos. Perfil tiroideo y lipídico, vitamina B12, ácido fólico y ácido úrico: normales. Serologia negativa (brucellosis, herpes, Epstein Barr, hepatitis, HIV 1 y 2), excepto TBC (contacto previo). Autoinmunidad negativa. ECG: RS con 69 lpm. Ecocardiograma transtorácico y transesofágico: normales. Doppler carotídeo-vertebral: normal. Holter 24 h: extrasístoles supraventriculares, sin arritmia, sin pausas. Estudio genético negativo (SLC20A2, XPR1, PDGF-b y PDGFR-b).
El paciente fue medicado con omeprazol 20 mg, AAS 100 mg, atorvastatina 10 mg y colecalciferol (vitamina D3) 22.400 UI por mes. A los 3 y 6 meses, no presentó recurrencias vasculares, la vitamina D y PTH normalizaron y la RM craneal estaba sobreponible.
Discusión
Enfermedad de Fahr (EF) y Síndrome de Fahr (SF) son intercambiables. Sin embargo, ha sido argumentado que la EF debería ser reservada para/y, de hecho, quizás reemplazada por Calcificación Cerebral Familiar Primaria (CCFP), mientras el SF debería ser usado únicamente para las causas secundarias (1).
Las causas incluyen: endocrinopatías (hipoparatiroidismo, pseudohipoparatiroidismo, pseudopseudohipoparatiroidismo e hiperparatiroidismo), vasculitis (LES), enfermedad mitocondrial, infecciones (brucellosis, virus Epstein-Barr, HIV), otras enfermedades hereditarias (neuroferritinopatía, osteodisplasia poliquística lipomembranosa con leucoencefalopatia esclerosante, síndrome Cockayne, síndrome Aicardi-Goutieres, proteinosis lipídica), radioterapia, quimioterapia, intoxicación por monóxido de carbono (1)(2).
La forma familiar primaria aparece en un 60 % de los casos siendo incluídas varias mutaciones genéticas (SLC20A2, XPR1, PDGFB) (2).
La presentación clínica es variable, la mayoría de individuos permanecen asintomáticos. Forma severas pueden presentarse tardíamente con psicosis progressiva, demencia, alteraciones de la marcha, enfermedad de los GB, y alteraciones sensitivas. La ECV aunque es más rara, en los últimos años van apareciendo casos en la literatura.
La distribución típica de las calcificaciones es en GB, tálamos, núcleos dentados y substancia blanca subcortical.
Existen 4 criterios diagnósticos para la EF: 1. Alteración genética detectada: herencia AD o AR con historia familiar positiva. 2. Edad de presentación típica 40-60 años. 3. Distribución típica de las calcificaciones cerebrales con progresión. 4. Excluídas causas secundarias (1).
No existe tratamiento específico, salvo en las formas secundarias y el pronóstico es habitualmente bueno. En nuestro caso, no hubo historia familiar, el estudio genético fue negativo, la edad de presentación fue típica, existían calcificaciones cerebrales y cerebelosas típicas y leucoaraiosis grado II Fazekas. La leucoaraiosis también ha sido descrita en la revisión de Elisabetta Savino et al. 2016, aunque los pacientes eran portadores de factores de riesgo vascular. En la revisión de Shafaq Saleem y cols. pueden aparecer lesiones hipertensas en T1 y T2 debido a gliosis reactiva o degeneración tisular dentro de las áreas calcificadas (3). Además en T2 y FLAIR se observan hiperintensidades en los centros semiovales (las cuales no son vistos en la TC craneal) que se correlacionan bien con los hallazgos clínicos. Estas hiperintensidades podrían representar un processo metabólico o inflamatorio subagudo, que podrían conducir a la calcificación a su debido tiempo (4).
En nuestro paciente fue encontrada una causa tratable, hiperparatiroidismo primario con hipovitaminosis D. Fueron normalizadas las alteraciones metabólicas con tratamiento médico aunque la RM cerebral permaneció sobreponible. No existen datos en la literatura sobre la evolución de las calcificaciones en el SF. A pesar del riesgo de infarto cerebral (ABCD2 score 4), el paciente fue tratado a tiempo con antiagregación sin recurrencia vascular.
La patogenia de la sintomatología clínica de nuestro paciente probablemente fue una disminución transitória del flujo sanguíneo cerebral relacionada con la calcificación de vasos sanguíneos que comprometió la elasticidad arterial; en un caso de SF con micro-infartos subcorticales fue asimismo comprometida la respuesta vasomotora observada en el SPECT con acetazolamida (5).
Basado en estudios de anatomía patológica, las calcificaciones de la EF son principalmente observadas en las paredes de los vasos capilares, arteriolas, venas pequeñas y espacios perivasculares (6), predisponiendo a la isquemia en los vasos afectados. Por otra parte, los astrocitos reactivos y microglia acumulados alrededor de los depósitos de calcio, indican un leve proceso inflamatorio contínuo. Asimismo, se observó microangiopatía en la biopsia cutánea de un paciente con mutación PDGFB, que muestra áreas engrosadas y fragmentadas en la lámina basal. Estos cambios pueden contribuir a la estenosis vascular y causar hipoperfusión cerebral, esta última fue detectada en los GB por SPECT así como también fue detectada una reducción masiva del metabolismo de glucosa mediante PET (7).
En relación a la presentación de AITs, uno de los primeros casos publicados fue el trabajo de Bartecki BF et al con presentación de episodios intermitentes de hemiparesia derecha y mutismo en un varón de 39 años con EF (calcificaciones en los GB y cerebelo) (8). Posteriormente en el estudio de Lopes-Villega y col., pudieron correlacionar los hallazgos clínicos con la localización de las calcificaciones y así de 18 pacientes con SF, 4 (22.2%) de ellos tuvieron AIT´s con calcificaciones en el globo pálido (1 mujer de 56 años y 2 mujeres de 65 años), y en el putamen (un varón de 71 años), de causa desconocida (9). Otro caso fue de una disartria transitoria en un paciente varón de 71 años con HTA de inicio reciente, posiblemente por una EF primaria (calcificaciones en los núcleos dentados, tálamos, substancia blanca y córtex) (10).
Respecto al ictus isquémico, hay más casos publicados. Fue diagnosticado un infarto isquémico agudo en el brazo posterior derecho de la cápsula interna en un paciente varón de 36 años con EF (calcificaciones en los GB, cápsulas internas, tálamos, substancia blanca subcortical y cerebelosa profunda, y núcleos dentados), forma esporádica (11). También se ha publicado un caso clínico de SF (calcificaciones en los GB, tálamos y núcleos dentados) asociado a microinfartos subcorticales en paciente con epilepsia e HTA previas, con crisis epiléptica a la admisión, concluyendo que la pérdida de reactividad vascular podría haber jugado su papel (5).
Una forma menos habitual de presentación, fue el caso de una paciente mujer de 65 años con cefalea y hemiplejia izquierda debido a un infarto isquémico agudo y SF (calcificaciones en GB y hemisferios cerebelosos) con estudio metabólico normal (12).
Además, otro caso de un paciente varón de 57 años con germinoma hipofisario conocido, que presentó una amaurosis en el ojo derecho y hemiparesia izquierda de predominio crural. La TC reveló calcificaciones en GB y la RM craneal confirmó cambios isquémicos em región parietal superior derecha, obstrución de la arteria carótida interna derecha y colateralización de la ACM (13). También, una paciente mujer de 72 años con paraparesia espástica asimétrica de inicio agudo con infarto isquémico agudo en el córtex motor izquierdo con calcificaciones en los GB relacionadas con la EF (14). Asimismo, otro caso de un paciente varón de 56 años con ictus isquémico agudo localizado en los GB y regiones periventriculares portador de la mutación del gen SLC20A2, secundario a la CCFP (calcificaciones en los GB, núcleos caudados, tálamos, substancia blanca subcortical y cerebelo) (7). Otro caso de una paciente mujer de 53 años con ictus isquémico agudo del território parcial de la ACM izquierda con investigación etiológica negativa, excepto la asociación con EF (calcificaciones en los GB y tálamos) (15). Igualmente, una paciente mujer de 68 años com hemiparesia izquierda transitoria de 5 minutos, que al sexto día desarrolló un infarto cerebral y al décimo dia un infarto agudo de miocardio. Era portadora de HTA e hipoparatiroidismo iatrogénico con ictus isquémico en el hemisferio izquierdo e infarto de miocardio en el pasado. La TC reveló calcificaciones en núcleos subcorticales, hemisferios cerebelosos y cortex occipital características de SF y fue además diagnosticada de una estenosis del 90 % ACI derecha (16).
Asimismo, una paciente mujer de 76 años con HTA y hipercolesterolemia poligénica que a las 72 h. agravó su estado neurológico presentando disartria y hemiplejia derecha resultado de un infarto agudo en corona radiata y núcleo lenticular izquierdos con calcificaciones bilaterales en globo pálido y pulvinar en la TC, típicas de EF (17). Otro paciente varón de 51 años, con antecedentes de HTA, diabetes mellitus tipo 2 y epilepsia, que desarrolló crisis hipertensiva y una paresia facial central derecha con hemiparesia derecha de instalación súbita y posteriormente estado de mal convulsivo. La TC reveló un infarto temporal izquierdo y calcificaciones de SF, fue encontrada una hipocalcemia severa e hipovitaminosis D, el paciente fue tratado con anticoagulante, antiagregante, calcio, colecalciferol y levetiracetam con normalización del metabolismo fosfocálcico y recuperación de las crisis y del ictus (18).
Conclusión
Aunque la asociación entre ECV en el joven y el sindrome de Fahr no ha sido todavía determinada, la ocurrencia de estos casos nos lleva a sospechar que la ECV isquémica podría formar parte de la historia natural de esta entidad. Siendo la prevalencia del SF desconocida, alertamos a los clínicos para tener presente la ECV como forma de presentación de esta entidad.














