INTRODUCCIÓN
La epilepsia es una de las patologías neurológicas crónicas más frecuentes, con una incidencia de 50/100.000/año y una prevalencia entre 0,5 y 2% a nivel mundial(1)(2). Un tercio de estos pacientes son resistentes al tratamiento con fármacos antiepilépticos(3). La ILAE define a la epilepsia refractaria como “aquella en la cual se ha producido el fracaso a 2 ensayos de fármacos antiepilépticos (FAE), en monoterapia o en combinación, tolerados, apropiadamente elegidos y empleados de forma adecuada, para conseguir la ausencia mantenida de crisis” (4)(5).
La mayoría de estos pacientes sufren de epilepsias focales secundarias a lesiones epileptogénicas evidenciadas cada vez más en correlación directa con las nuevas técnicas de neuroimagen cerebral(6). La cirugía de la epilepsia es el único tratamiento que podría curar la epilepsia de los pacientes con epilepsia refractaria. Esta opción debe ser considerada tan pronto como la farmacorresistencia sea evidente, ya que varios estudios han demostrado que los pacientes con epilepsia activa tienen una mortalidad tres veces mayor que la población general(7). En pacientes bien seleccionados la cirugía de la epilepsia es altamente efectiva, obteniéndose resultados de libertad de crisis de hasta un 84%, en función de la experiencia de los cirujanos y de la tecnología que dispongan en sus centros(8). El objetivo de la cirugía de la epilepsia es remover la zona epileptogénica con preservación de las áreas elocuentes, y es aquí en que la experiencia quirúrgica y la tecnología de neuroimagen juegan un papel capital(9).
Imágenes en la evaluación preoperatoria de la epilepsia refractaria
Los protocolos básicos para la adquisición de imágenes en epilepsia fueron definidos por la Liga Internacional contra la Epilepsia (ILAE)(4). En los últimos 20 años ha existido un desarrollo tecnológico importante en el área de imagen en epilepsia, sobre todo en el campo de resonancia magnética nuclear, como son mejoras en los equipos de 3 teslas e incluso de 7 teslas, que han revolucionado el abordaje de estos pacientes encontrando lesiones que pasaban inadvertidas con equipos de 1,5 teslas(10). La resonancia magnética, tanto estructural como funcional, es la modalidad de imagen de elección para para determinar y delimitar la zona epileptogénica, así como para definir las estructuras aledañas.
Estos estudios obtenidos en formato DICOM permiten hacer el análisis de las imágenes en las estaciones de trabajo de los equipos de neuronavegación.
Neuronavegación
En las dos últimas décadas la evolución de las técnicas de neuroimagen, tanto estructural, como funcional y neuronavegación han demostrado su utilidad en la planificación prequirúrgica de la epilepsia refractaria(11). De forma concreta, la neuronavegación consiste en una sofisticada tecnología informática que tiene como soporte físico un potente ordenador que incluye un programa específico que procesa las imágenes neurorradiológicas digitalizadas en formato DICOM (proceso denominado planificación) y las interacciona y empareja punto por punto con las estructuras anatómicas reales del paciente obteniendo un mapa neuroanatómico en 3D a través de un proceso llamado registro. La precisión y la seguridad a la hora de localizar la lesión, la elección de la mejor ruta o trayectoria para abordarla sin dañar tejidos adyacentes, la reducción del tiempo de instrumentación quirúrgica y la extirpación radical de la lesión son algunas de las ventajas de esta técnica(11).
La localización estereotáctica es una técnica neuroquirúrgica capaz de lograr la localización y abordaje de cualquier punto o target intracraneal mediante un sistema de coordenadas x, y, z, a través de un dispositivo que va unido a la cabeza del paciente y guiado por imágenes de tomografía axial computariza (TAC), resonancia magnética nuclear (RMN), angiografía, o tomografía por emisión de positrones (PET).
La principal desventaja que presentan los sistemas de navegación es el conocido brain shift o movimiento cerebral que se produce por edema cerebral, secundaria a descompresión cerebral o posterior a drenaje de líquido cefalorraquídeo, lo que produce un error de cálculo debido a este desplazamiento, que puede ser corregido con la adquisición de imágenes intraoperatorias de Ecografía, TAC o de RMN, con sistemas que sean compatibles con los equipos de neuronavegación, lo que permitiría visualizar los cambios en tiempo real(12).
Para el uso intraoperatorio, los sistemas de neuronavegación deben relacionar la localización física de un paciente con los modelos preoperatorios mediante una transformación que relaciona los dos paradigmas a través de un mapeo de paciente a imagen(12). Los componentes principales de todo sistema de neuronavegación son: un dispositivo de localización el cual va a rastrear la posición del paciente y las herramientas quirúrgicas, una consola de computadora que va a presentar la información de las imágenes adquiridas y finalmente accesorios como sondas de navegación y marcos de referencia.
La utilización de la neuronavegación en la epilepsia refractaria lesional aún no ha sido adecuadamente estandarizada. El objetivo de este trabajo es demostrar la utilidad de la neuronavegación en la planificación prequirúrgica de la epilepsia refractaria en base a la experiencia adquirida en los cinco años de uso de la neuronavegación en pacientes epilépticos en nuestro centro.
MATERIALES Y MÉTODOS
Estudio descriptivo transversal y analítico que revisó los datos de los pacientes con epilepsia refractaria que fueron intervenidos en nuestro hospital con o sin neuronavegación.
Nuestro hospital es un centro pediátrico de referencia nacional ubicado en una ciudad con una población de 2.576.287 habitantes, y 723.073 habitantes menores de 15 años. Desde el año 2013 el hospital cuenta con un programa de cirugía de epilepsia y un comité multidisciplinario conformado por especialistas en neurología, neurocirugía, neurorradiología, neuropsicología, nutrición y neuroendocrinología. Durante las reuniones del comité se verificó el cumplimiento de los criterios de refractariedad, la frecuencia de las crisis, la afectación de la calidad de vida en relación con las crisis, la indicación del tipo de tratamiento médico y/o quirúrgico, curativo o paliativo. Así mismo los familiares fueron informados de las recomendaciones emitidas por el comité y se obtuvo el consentimiento informado.
Se incluyeron a todos los pacientes con epilepsia refractaria discutidos por el comité de epilepsia entre enero de 2013 y diciembre de 2016, en total 55 pacientes, que cumplían con los criterios de inclusión.
Se revisaron las planificaciones prequirúrgicas mediante neuronavegación, las historias clínicas y los protocolos operatorios de todos los casos.
Tecnología utilizada
Resonancia magnética cerebral
Estudio de resonancia magnética cerebral realizado con equipo de 3.0 teslas de marca Phillips (Medical Systems, DA Best, Holanda), que siguió un protocolo de epilepsia que incluía secuencias T1 volumétrica y T1 simple y contrastada contraste con cortes axiales, coronales y sagitales de hasta un mínimo de 0,4 mm de grosor, T2 y FLAIR; las imágenes por tensor de difusión se obtuvieron con un mínimo de 16 direcciones y se asignaron por convenio los colores rojo, verde y azul a las orientaciones derecha-izquierda, anterior-posterior y superior-inferior respectivamente; espectroscopía multivoxel; angioRM arterial y venosa en todos los casos. Las imágenes fueron adquiridas en formato DICOM y posteriormente transferidas a una estación de trabajo donde se realizó el análisis tridimensional del estudio, así como la planificación prequirúrgica de cada caso.
Neuronavegador
Utilizamos un neuronavegador conformado por:
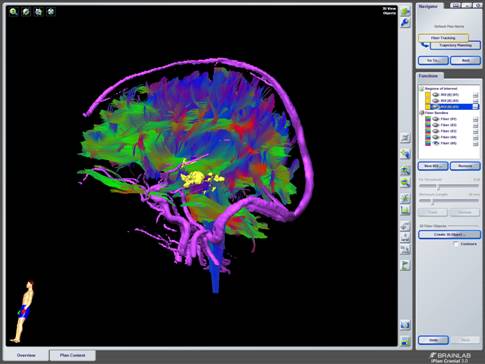
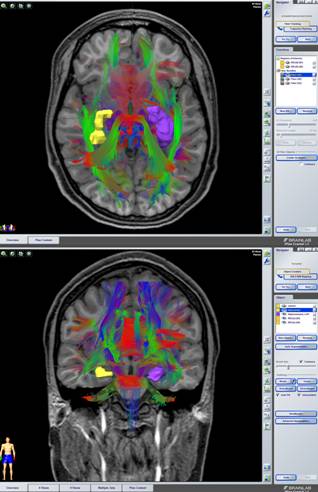
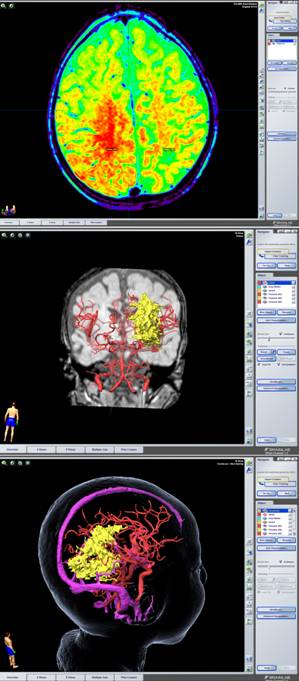
A) una estación de trabajo BrainLab Z800, con el programa iPlan versión 3.0.5 donde se cargaron las imágenes adquiridas en la resonancia magnética. Se planificaron las trayectorias que se iban a seguir durante la cirugía y se delimitaron tanto los trayectos de la apertura del colgajo cutáneo, como de la craneotomía y la durotomía. Se crearon objetos de las imágenes de interés, tanto lesionales como estructurales normales; se reconstruyó la vascularización mediante los estudios de angioRM, y la tractografía de los fascículos de interés particular.
B) En el análisis volumétrico utilizaremos la función denominada Segmentación Automática, que utiliza un enfoque de segmentación basado en el conocimiento que es capaz de identificar estructuras cerebrales comparando las imágenes del paciente con un conjunto de imágenes de un atlas incluido en el iPlan, que contiene estructuras anatómicas delimitadas. La aplicación encuentra la correspondencia directa entre el conjunto de imágenes del paciente y el conjunto de imágenes del atlas, y transfiere todas las estructuras delimitadas del atlas anatómico a las imágenes del paciente.
C) Para el estudio de la tractografía se utilizó una función denominada Fiber tracking del programa iPlan 3.0. Esta función se basa en la medida de anisotropía de difusión en el cerebro calculada a partir de imágenes del tensor de difusión (DTI) adquiridas en varias direcciones. La dirección de difusión del agua a lo largo de las potenciales fibras de la sustancia blanca se calculó para todo el volumen explorado.
D) Un sistema BrainLab Curve con pantalla dual, donde se transfirió la información de la planificación realizada en la estación de trabajo, y que permitió posteriormente registrar mediante una cámara de infrarrojos la anatomía facial y craneal del paciente ya anestesiado y fijado en el craneóstato (el de nuestro centro es un Mayfield Modified Skull), y aparejarla con las imágenes planificadas en la estación de trabajo.
Planificación quirúrgica
Una vez presentadas las imágenes en la pantalla de la estación de planificación del neuronavegador, se procedió a dibujar y colorear, sobre los cortes axiales, la lesión, zona epileptógena, cuerpo calloso, amígdala, hipocampo, así como estructuras elocuentes o vasculares de importancia. Seguidamente se realizó la reconstrucción tridimensional, así como, triplanar (secciones sagitales y coronales).
Sobre esta reconstrucción se dibujaron los puntos de entrada, diana, y trayectorias deseadas, visualizando de manera inmediata algunas de las estructuras elocuentes o vasculares cercanas a las trayectorias.
Registro intraoperatorio
Una vez en el quirófano, se colocó a los pacientes en posición quirúrgica, con fijación de la cabeza con un cabezal (craneostato) de 3 puntos de sujeción (en el hospital cuentan con el Mayfield Modified Skull). A continuación, se fijó una estrella de referencia (no estéril), a un lado u otro en función de la distribución del quirófano. La cámara de registro se ubicó habitualmente a los pies del paciente generalmente al lado derecho. La calibración se realizó moviendo las cámaras hasta observar las 3 esferas reflectantes de la estrella y las del puntero, mediante el uso del láser propio de la cámara. Y a continuación se procedió a realizar el registro de la superficie facial y/o cefálica del paciente.
El registro se realizó siempre en condiciones no estériles; la cara del paciente se colocó en lo posible en frente de la cámara. Mediante el puntero de reconocimiento facial se adquirieron múltiples puntos de zona malar, reborde orbitario, reborde superciliar, y nariz, al ser estas estructuras los menos móviles. De este modo se realizó un escaneo facial, que el sistema de neuronavegación utilizó para hacer el cálculo y obtención de un modelo tridimensional de la anatomía facial del paciente.
Después, este modelo, que representó la posición de la cabeza del paciente ya en el quirófano, se correlacionó con los datos radiológicos diagnósticos, y se completó el registro. Para comprobar el correcto registro se realizó el test de referencias anatómicas como control de la precisión del sistema. Se colocó el puntero sobre estructuras no desplazables como el nasion, punta de la nariz y trago.
Seguidamente, se procedió a localizar el punto de entrada, y delimitación de la superficie cutánea de la región a ser resecada, para definir los límites de la incisión quirúrgica y de la craneotomía. A continuación, se retiró la estrella no estéril, se realizó la asepsia y antisepsia, colocación de estrella estéril y de campos estériles. Y se continuó con el procedimiento quirúrgico, utilizando las puntas de registro o los instrumentos calibrados para ser reconocidos por el sistema de navegación
Fuente de obtención de datos
Para la evaluación de los casos se utilizaron datos de historias clínicas, así como los expedientes de consulta externa y hospitalización, además datos de los pacientes que fueron seleccionados por el comité de epilepsia, se tomaron en cuenta todos los estudios de imágenes que se encontraron en la base de datos del neuronavegador.
Instrumentos de recolección de datos
Se realizó fichas para recolección de datos creados con fines específicos para la investigación, se recabó datos de los archivos estadísticos, las historias clínicas y archivos fotográficos disponibles de los pacientes que se encontraban grabados en el Neuronavegador de pacientes con epilepsia refractaria que fueron discutidos en el comité de epilepsia del Hospital Pediátrico Baca Ortiz entre enero de 2013 y diciembre de 2016.
Análisis estadístico de los datos
Para describir el resultado de las variables del estudio se utilizaron métodos de estadística descriptiva: para variables numéricas se utilizó la media y la desviación estándar, para las variables categóricas se utilizaron porcentajes. Para el análisis de la relación entre variables se utilizó estadística no paramétrica, específicamente se realizó la comparación de medias dependientes de variables numéricas (frecuencia de crisis y puntuación de la escala de calidad de vida) mediante la prueba de Wilcoxon, y la comparación de variables categóricas mediante la prueba X2. El análisis de los datos se realizó con el programa SPSS (Statistical Package for the Social Sciences) versión 22,0 (SPSS, Inc., Chicago, IL, EE. UU.).
Aspectos éticos y legales
Dado que el presente es un estudio descriptivo y por lo tanto sin intervención, no requirió aprobación por un comité de bioética, aunque si fue aprobado por el Departamento de Docencia e Investigación del hospital. En la recolección de los datos se ha preservado la integridad física y emocional de cada paciente, así como su confidencialidad.
El presente trabajo no tiene conflictos de interés con la empresa BrainLab.
RESULTADOS
Durante los años 2013 - 2016, se presentaron 55 casos de pacientes con epilepsia refractaria en el “Comité multidisciplinario de Epilepsia”. Para el estudio se aplicaron criterios de inclusión y exclusión obteniendo una muestra de 47 casos (2 pacientes se excluyeron por presentar lesiones en áreas elocuentes y 6 solicitaron el alta voluntaria).
En la Tabla 1 se describen las variables del paciente y la etiología de la epilepsia. En la Tabla 2 aparecen los criterios de inclusión y de exclusión de los pacientes que participaron en este estudio. En la Tabla 3, Tabla 4 y Tabla 5 aparecen las cirugías y el tipo de procedimientos realizados en nuestro centro.
Tabla 1 Descripción de las variables en los pacientes estudiados. HBO 2013-2016.
| Variable | Resultado |
|---|---|
| Edad muestral | 9,93 años (SD 4,1). Rango 1 a 18 años |
| Sexo | Femenino: 24 (51%) Masculino: 23 (49%) |
| Etiología de la epilepsia | Noxa perinatal: 11 (23,4%) Malformación del desarrollo cortical: 12 (25,53%) Postinfecciosa: 8 (17,02%) Hamartoma hipotalámico: 2 (4,26%) Encefalitis de Rasmussen: 2 (4,26%) Postraumática: 1 (2,13%) Esclerosis hipocampal: 1 (2,13%) Tumores: 8 (17,02%) No identificada: 2 (4,26%) |
SD: Desviación típica
Tabla 2 Criterios
| Criterios de Inclusión Niños de 0 a 15 años, o mayores con aprobación del Ministerio de Salud Pública Pacientes con diagnóstico de epilepsia refractaria al tratamiento médico Pacientes que cuenten con todos los estudios de imágenes protocolizados en el comité de epilepsia. | Criterios de Exclusión Pacientes mayores de 15 años, (existen excepciones) Pacientes que tengan estudios de imágenes incompletos. Pacientes que, a pesar de tener epilepsia refractaria, tras la discusión no se consideran candidatos quirúrgicos. Pacientes con lesiones epileptogénicas sobre áreas elocuentes. Pacientes con algún tipo de proceso infeccioso (criterio relativo de exclusión) |
Tabla 3 Porcentaje de cirugías de epilepsia con el uso de neuronavegador. Servicio de Neurocirugía. Hospital Pediátrico Baca Ortiz ,2013 - 2016.
| Año | Total de cirugías de epilepsia | Cirugías de epilepsia con uso de neuronavegador | Porcentaje |
|---|---|---|---|
| 2013 | 2 | 1 | 50 |
| 2014 | 14 | 5 | 35.71 |
| 2105 | 14 | 11 | 78.57 |
| 2016 | 17 | 10 | 58.82 |
| TOTAL | 47 | 27 | 57.44 |
Fuente: Archivo estadístico e historias clínicas. Hospital Pediátrico Baca Ortiz
Tabla 4 Tipo de cirugía y uso de neuronavegador, en cirugías de epilepsia. Servicio de Neurocirugía. Hospital Pediátrico Baca Ortiz, 2013 - 2016.
| Tipo de Cirugía | Uso de Neuronavegación | Total | |
| Si | No | ||
| Resectivas | 8 | 4 | 12 |
| Paliativas | 17 | 15 | 32 |
| Diagnóstica | 2 | 1 | 3 |
| Total | 27 | 20 | 47 |
Fuente: Archivo estadístico e historias clínicas. Hospital Pediátrico Baca Ortiz
Tabla 5 Procedimientos quirúrgicos realizados con y sin el uso de neuronavegador, en cirugías de epilepsia. Servicio de Neurocirugía. Hospital Pediátrico Baca Ortiz, 2013 - 2016.
| Procedimiento Quirúrgico | Uso de Neuronavegación | Total | |
|---|---|---|---|
| Si | No | ||
| Callosotomía | 17 | 13 | 30 |
| Callosotomía + Exéresis de hamartoma | 0 | 1 | 1 |
| Resección Cortical | 1 | 0 | 1 |
| Hemisferectomía | 1 | 1 | 2 |
| Lobectomía temporal Estándar | 2 | 0 | 2 |
| Lobectomía Temporal Anterior | 1 | 1 | 2 |
| Exéresis Tumoral | 3 | 3 | 6 |
| Colocación de malla de electrodos | 0 | 1 | 1 |
| Biopsia | 2 | 0 | 2 |
| Total | 27 | 20 | 47 |
Fuente: Archivo estadístico e historias clínicas. Hospital Pediátrico Baca Ortiz
De los procedimientos quirúrgicos, 12 fueron de tipo resectivo, 32 de tipo paliativo, y 3 procedimientos diagnósticos (Figura 1, Figura 2, Figura 3)
De las 47 cirugías de epilepsia, 57.44% (n 27) fueron practicadas con el uso de neuronavegación (21 de ellas se realizaron en los dos últimos años - 77.78%).
Al comparar los resultados de tiempo quirúrgico, sangrado durante el procedimiento quirúrgico y días de hospitalización obtenidos de cirugías realizadas con y sin el uso de neuronavegación, observamos que con el uso del neuronavegador disminuyó el tiempo quirúrgico en 47,7 minutos (p = 0,022), el sangrado en 111,41 mililitros (p = 0,011) y los días de hospitalización en 6,68 días (p = 0,05) (Tabla 6).
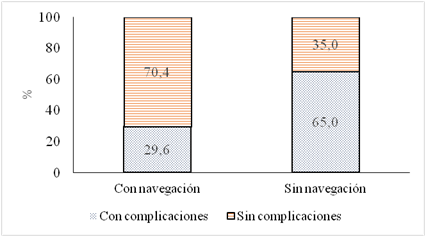
Las complicaciones en el grupo con neuronavegación fueron del 29,63% (ocho pacientes) en comparación con el 65% en el grupo intervenido sin neuronavegación (p = 0,034) (Tabla 7). Las complicaciones descritas fueron: infección de sitio quirúrgico, hemiplejía, hemiparesia transitoria. Sin el uso de la neuronavegación, 13 pacientes presentaron complicaciones (65%) Las complicaciones descritas fueron: déficits motores (hemiplejía, hemiparesia transitoria, mutismo) (Figura 4).
Tabla 6 Resultados postquirúrgicos según uso del neuronavegador en cirugías de epilepsia. Servicio de Neurocirugía. Hospital Pediátrico Baca Ortiz, 2013 - 2016.
| Años | Tiempo en | quirúrgico minutos | Sangrado | en mililitros | Días de | hospitalización |
|---|---|---|---|---|---|---|
| No | Si | No | Si | No | Si | |
| 2013 | 175 | 120 | 100 | 40 | 6 | 10 |
| 2014 | 258,89 | 186 | 316,89 | 170 | 15,67 | 7,6 |
| 2015 | 223,33 | 198,18 | 283,33 | 239,55 | 9 | 7,27 |
| 2016 | 247,86 | 212,5 | 407,14 | 303 | 17,29 | 9 |
| Total | 245,5 | 198,33 | 352,85 | 241,44 | 14,75 | 8,07 |
| p | 0,022 | 0,011 | 0,005 |
Fuente: Archivo estadístico e historias clínicas. Hospital Pediátrico Baca Ortiz
Tabla 7 Tipo de complicaciones postquirúrgicas con y sin el uso de neuronavegación. Servicio de Neurocirugía. Hospital Pediátrico Baca Ortiz ,2013 - 2016.
| Complicaciones Operatorias | Uso de Neuronavegación | Total | |
|---|---|---|---|
| Si | No | ||
| Infección local | 4 | 2 | 6 |
| Fístula de Líquido Cefalorraquídeo | 1 | 2 | 3 |
| Mutismo transitorio | 0 | 3 | 3 |
| Hemiparesia transitoria | 1 | 4 | 5 |
| Hemiplejía | 1 | 0 | 1 |
| Fallo Hipotalámico | 0 | 1 | 1 |
| Neumonía | 1 | 1 | 2 |
| Ninguna | 19 | 7 | 26 |
| Total | 27 | 20 | 47 |
Fuente: Archivo estadístico e historias clínicas. Hospital Pediátrico Baca Ortiz
La Tabla 8 describe la frecuencia absoluta de mortalidad en ambos grupos, siendo mayor en el grupo intervenido sin neuronavegador. Estas dos muertes no estuvieron relacionadas con el proceso de neuronavegación (una muerte por neumonía y otra por hiponatremia severa).
Tabla 8 Mortalidad con y sin el uso de neuronavegador, en cirugías de epilepsia. Servicio de Neurocirugía. Hospital Pediátrico Baca Ortiz, 2013 - 2016.
| Mortalidad | Uso de Neuronavegación | Total | |
|---|---|---|---|
| Si | No | ||
| Fallece | 0 | 2 | 2* |
| Vivo | 27 | 18 | 45 |
| Total | 27 | 20 | 47 |
Una muerte por neumonía y otra por hiponatremia
Fuente: Archivo estadístico e historias clínicas. Hospital Pediátrico Baca Ortiz
DISCUSION
Para la realización de cualquier procedimiento quirúrgico se requiere de un sentido de percepción espacial tridimensional de la anatomía de cada paciente; la localización intracraneal constituye un reto para todo neurocirujano ya que se enfrentan a variaciones anatómicas propias de cada paciente causadas por la distorsión ocasionada por la patología de base, por el limitado campo visual producto del tipo de abordaje, la misma localización de la lesión, la complejidad anatómica de las áreas más profundas del cerebro, las relaciones vasculares, la cercanía a áreas elocuentes, etc.
Los métodos de diagnóstico por imagen basados en un modelo tridimensional (3D), facilitaron en gran parte la localización espacial de todo tipo de lesiones sobre todo las que son más difíciles de acceder y delimitar por su localización o distribución. El principal vínculo entre los estudios de imagen y la anatomía de cada paciente se da por la integración que proporcionan los sistemas de navegación durante la cirugía.
Sin embargo, no todos los centros disponen de equipos de neuronavegación. En Argentina, en el año 2016, se reporta una serie de 43 cirugías sin uso de neuronavegación en 10 años (13). En nuestro centro, 20 pacientes fueron intervenidos sin navegador por procesos informáticos relacionados con el equipo.
En el año 2014 Valencia y col., realizaron 10 callosotomías asistidas con neuronavegación; en ningún caso se reportó complicaciones intraoperatorias, llegándose a la conclusión que la callosotomía guiada por neuronavegación sin marco es una técnica precisa y segura(11).
En Alemania, en una serie de 28 pacientes con epilepsia lesional, no lesional y epilepsia temporal fueron sometidos a cirugía, 11 de ellos (39.3%) utilizaron RMN intraoperatoria y neuronavegación; se obtuvieron mejores resultados en el grupo que utilizó neuronavegación como ayuda en el desarrollo de cirugía(14).
Si comparamos los estudios antes mencionados con nuestra investigación, en nuestra serie se realizó un número mayor de cirugías en menos tiempo (47 cirugías en 4 años), con un mayor porcentaje de utilización del neuronavegador (57.44% vs 39.3% reportado por Sommer) (14).
Amandeep Kumar, Sarat Chandra, y col. en el año 2014 hacen mención a que el uso de la neuronavegación multimodal (con resonancia funcional y tractografía) junto con el mapeo cerebral con estimulador cortical para la resección de lesiones sobre áreas corticales elocuentes (motoras, sensitivas, lenguaje) puede disminuir el riesgo de dejar al paciente con secuelas neurológicas permanentes y mejorando el porcentaje de resección del área afectada(15).
Björn Sommer, y col. en el año 2015 describen cómo el uso de resonancia funcional intraoperatoria y neuronavegación en exéresis de gangliogliomas (responsables de ocasionar epilepsia refractaria) mejora el porcentaje de resección del tumor, y por ende se disminuye de forma importante el número de crisis convulsivas(16).
En el año 2016 el mismo autor Björn Sommer, y col, describen cómo la resección basada en magnetoelectroencefalografía con el uso de neuronavegación y RMN intraoperatoria promete ser de gran utilidad en la resección completa de áreas epileptogénicas(17).
Karl Roessler y col. reportan en el año 2016 que la neuronavegación junto con la RMN intraoperatoria resultaron ser de mucha utilidad en la realización de cirugía de epilepsia ya que se asoció a una mejor resección de áreas corticales comprometidas, con menos complicaciones y con un mejor control de las crisis(18).
Una revisión sistemática realizada en Brasil en el año 2015 por Sovenso menciona que solo uno de los 28 estudios analizados reporta que no hubo diferencia significativa en cuanto al tiempo quirúrgico en comparación al uso o no de neuronavegación (239 vs 208 minutos). Otros cuatro estudios analizados solo describen los tiempos quirúrgicos medios con el uso de neuronavegación (212 min, 213.3 min, 243 min y 213 min) (19). Si comparamos nuestro estudio donde el promedio de tiempo quirúrgico fue 198 minutos para el grupo que utilizó neuronavegación, vemos que el tiempo de cirugía fue menor que los estudios analizados.
El Departamento de Neurocirugía de la Escuela de Medicina de la Universidad de Osaka Japón, Haruhiko Kishima y col. publicaron en el año 2017 la utilidad de la neuronavegación en la realización de amigdalohipocampectomía selectiva vía corteza infratemporal, con excelentes resultados en el control de crisis y en la preservación de la memoria porque mediante la guía del neuronavegador durante el procedimiento quirúrgico no se daña el lóbulo temporal(20).
En cuanto a las complicaciones postoperatorias, en la serie de Aberastury de 43 pacientes operados sin navegación, se reportan 19 pacientes con nuevos déficits neurológios posquirúrgicos de los cuales 14 fueron permanentes, 4 casos de hidrocefalia postquirúrgica, 7 casos de infecciones de sitio quirúrgico(13). En nuestra serie, con uso de neuronavegador, 9 pacientes presentaron déficits neurológicos, de los cuales 8 fueron transitorios, 4 infecciones del sitio quirúrgico, y no se reportó hidrocefalia.
Roessler, de Alemania, en su estudio basado en una serie de pacientes operados con el uso de neuronavegación no reporta fallecimientos, y un bajo porcentaje de hemiparesia y neumonías(18).
En Alemania, Delev y colaboradores estudiaron 40 pacientes en quienes el uso de neuronavegador fue utilizado en la planificación de pacientes con epilepsia aparentemente no lesional. Se demostró que con el uso correcto de las herramientas del neuronavegador se identificaron lesiones que en un inicio no se visualizan en la RMN, y su uso durante el procedimiento quirúrgico ayudó a realizar resecciones más amplias, con un mejor control de crisis(21).
CONCLUSIONES
La epilepsia refractaria en niños es una condición debilitante, que impacta aproximadamente al 20 o 30% de la población pediátrica que aqueja epilepsia. La cirugía de epilepsia mejora no sólo la calidad de vida con el control de las crisis, sino que se ha demostrado que mejora la cognición y el comportamiento en los pacientes sometidos a cirugía.
Podemos concluir que desde el año 2013 existe un incremento paulatino de cirugía para el control de epilepsia refractaria con el uso de neuronavegación como ayuda en el desarrollo de las cirugías; el uso de este recurso en el pre y trans quirúrgico es de utilidad ya que disminuye el riesgo de la presencia de complicaciones trans y posquirúrgicas asociadas al procedimiento, se disminuye el tiempo quirúrgico, la cantidad de sangrado e incluso los días de hospitalización. A pesar de que la realización de cirugía de epilepsia con el uso de neuronavegación se ha incrementado, continúa siendo subutilizada para el tratamiento de epilepsia refractaria.
RECOMENDACIONES
Es necesario realizar capacitaciones en el uso de neuronavegación para la planificación y desarrollo de cirugías para el control de epilepsia refractaria. Es imprescindible establecer protocolos de diagnóstico, evaluación y manejo de pacientes con epilepsia refractaria, así como diseñar un protocolo de uso de la neuronavegación en la planeación prequirúrgica y su uso durante el desarrollo de la cirugía de epilepsia. La cirugía con el uso de neuronavegación como tratamiento de epilepsia refractaria debería ser considerada dentro del manejo inicial para lograr un mejor control de las crisis epilépticas.