INTRODUCCIÓN
Los cambios en el estilo de vida, el sedentarismo, el aumento en los turnos de trabajos nocturnos y la contaminación visual durante la noche han condicionado un aumento en la prevalencia de los trastornos de sueño en las regiones urbanas de los países en vías de desarrollo. Sin embargo, es poco lo que se conoce acerca del impacto de este incremento en la salud de los habitantes de las zonas rurales de estos países, ya que la mayoría de las publicaciones carecen de consistencia en lo que respecta a metodología y diseño de estudio.(1) (2) (3) (4) Más aún, la gente que habita en estas regiones no suele buscar atención médica por trastornos de sueño.(5) El pobre conocimiento sobre estos trastornos en la población general puede ser uno de los factores que contribuye al aumento en la prevalencia de enfermedad cerebrovascular en nuestros pueblos.(6) Como parte del Proyecto Atahualpa, hemos desarrollado un protocolo específico para el estudio de trastornos de sueño, y sus correlaciones clínicas y con estudios de neuroimagen.(7)
Consideramos que los estudios que evalúen trastornos de sueño en comunidades rurales deben cumplir ciertos requisitos que no necesariamente se aplican en estudios realizados en naciones desarrolladas.(8) En primer lugar, las entrevistas deben ser directas (nunca por vía telefónica o correo) para poder obtener información adecuada. Los cuestionarios de campo - usualmente desarrollados en idioma Inglés - deben ser traducidos al español y validados en la misma población o en poblaciones similares, para asegurarnos de su confiabilidad. Hay que considerar, además, particularidades regionales. Por ejemplo, en Atahualpa, los turnos nocturnos de trabajo son escasos o nulos y la contaminación visual durante horas de la noche es escasa (Figura 1), lo cual favorece el sueño nocturno y reduce significativamente los trastornos de cronotipo. Atahualpa es un pueblo donde prácticamente toda la población son “alondras”, es decir, se encuentran despiertos desde las 6 o 7 de la mañana y se acuestan a dormir antes de las 12pm. Por otra parte, ciertos trastornos de sueño, como el síndrome de piernas inquietas (o enfermedad de Willis-Ekbom) han demostrado tener una prevalencia distinta en latitudes cercanas al Ecuador, donde existen 12 horas diarias de exposición solar durante todo el año.(9) (10) (11) Para el estudio de trastornos de respiración alterada durante el sueño - conocidos como apnea obstructiva del sueño (OSA por sus siglas en inglés, de Obstructive Sleep Apnea) - es factible la construcción de unidades de sueño (Figura 2), como la que tenemos en el Centro de Apoyo Comunitario del Proyecto Atahualpa, la cual cumple con los requisitos mínimos propuestos por la American Academy of Sleep Medicine, entre los que se incluye la interpretación de los estudios de polisomnografía por expertos certificados por dicha sociedad académica.

Figura 1 Fotografía de una calle céntrica de Atahualpa, mostrando la escasa contaminación visual en horas de la noche.
INSTRUMENTOS DE CAMPO
Para el estudio de trastornos de sueño hemos escogido aquellos cuestionarios (instrumentos de campo) que han demostrado ser prácticos, útiles y consistentes para la predicción de este tipo de desórdenes.(12) (13) (14) (15) (16) (17) (18) (19) (20) (21) (22) (23) (24) Estos incluyen versiones validadas al idioma español de la escala de Pittsburgh de calidad del sueño (Tabla 1), del cuestionario de Berlín (Tabla 2), de la escala de Epworth para el estudio de somnolencia diurna (Tabla 3), del índice de la severidad del insomnio (Tabla 4), y de los criterios mínimos para el estudio del síndrome de piernas inquietas o enfermedad de Willis-Ekbom (Tabla 5).
Escala de calidad de sueño de Pittsburgh
Esta escala diferencia básicamente la gente que “duerme bien” de aquellos que “duermen mal” y recoge información del mes previo a la toma de la información. Consiste en 18 preguntas agrupadas en 7 componentes, cada uno valorado en una escala de 0 a 3, para un puntaje máximo de 21. Se acepta que una puntuación ≥6 indica pobre calidad de sueño. Los componentes de la escala incluyen evaluación de la duración del sueño, de problemas al dormir, de la latencia de sueño, de problemas relacionados con somnolencia diurna, de la eficiencia del sueño, de la calidad global del sueño y del uso de medicamentos necesarios para poder dormir. Si bien la escala original incluye, además, cinco preguntas dirigidas a compañeros de habitación, dichas preguntas no fueron realizadas en nuestras encuestas ya que no han sido validadas al idioma español.
Cuestionario de Berlín
Este cuestionario principalmente evalúa la presencia de OSA, pero también es de utilidad para valorar somnolencia o fatiga al momento de despertar, así como la presencia de obesidad e hipertensión arterial. Consiste en 10 preguntas divididas en 3 categorías. Las primeras 5 preguntas conforman la categoría 1, las preguntas 6 a 8 conforman la categoría 2, y la pregunta 10 corresponde a la categoría 3 (la pregunta 9 se evalúa por separado). La respuesta positiva a dos de las preguntas de las dos primeras categorías, o a la pregunta 10, marca cada una de estas categorías como “positiva”, y la presencia de dos categorías positivas categoriza a una persona como de alto riesgo de tener OSA.
Escala de Epworth
Esta escala evalúa la cantidad de somnolencia diurna, basada en la posibilidad de somnolencia en ocho situaciones sedentarias diferentes, y se utiliza para valorar la presencia de somnolencia diurna excesiva. Cada pregunta se gradúa en una escala de 4 puntos, que va desde 0 (no probabilidad de quedarse dormido) a 3 (alta probabilidad de quedarse dormido), para un total máximo de 24 puntos. Se estima que un puntaje ≥10 se correlaciona con la presencia de OSA.
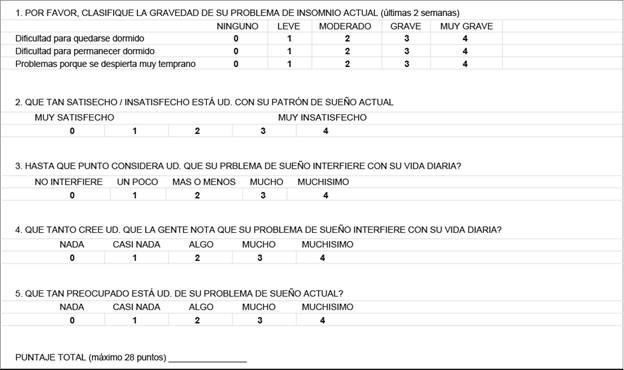
Índice de la severidad del insomnio
Este cuestionario consiste en 7 preguntas que evalúan las dificultades para el sueño nocturno, la pobre satisfacción con el sueño y el impacto del insomnio en la calidad de vida, y recoge información de las dos semanas previas a la toma de la información. Cada pregunta se gradúa en una escala de 0 a 4, para un total máximo de 28 puntos. Los puntajes de 0 a 7 significan no insomnio relevante, de 8 a 14 un insomnio leve, de 15 a 21 un insomnio moderado y de 22 a 28 un insomnio grave.
ESTUDIOS DE CALIDAD SEL SUEÑO
Además del estudio que se detalla en un artículo previo de este número de la Revista Ecuatoriana de Neurología, donde se documentó que una pobre calidad de sueño se asocia con algunos marcadores individuales de salud cardiovascular, incluyendo pobre actividad física (OR: 4.35; 95% C.I.: 2.05 - 9.25; p<0.001) y niveles de glucosa en ayunas (OR: 1.59; 95% C.I.: 1.09 - 2.31; p=0.015),(25) se han realizado otros estudios donde se evalúan correlatos clínicos y de imagen de una pobre calidad de sueño.
Consumo de cafeína y calidad de sueño
La cafeína, un antagonista de los receptores de adenosina, es el estimulante legal más utilizado en el mundo. El consumo de esta sustancia se ha asociado durante mucho tiempo con un mejor estado de alerta, así como con un mejor rendimiento motor y cognitivo.(26) (27) Estos beneficios podrían compensarse con un deterioro en la calidad del sueño. Sin embargo, diversos estudios han demostrado una amplia variabilidad individual en esta relación, relacionada con variables tales como tolerancia, diferencias en la biodisponibilidad de la cafeína (vida media prolongada), predisposición genética e incluso factores externos como la deprivación del sueño.(28) (29) (30) (31) (32) (33)
En un estudio del Proyecto Atahualpa, 716 residentes ≥ 40 años fueron entrevistaron con instrumentos de campo para evaluar la cantidad promedio de la ingesta diaria de cafeína y la calidad del sueño durante el mes anterior a la encuesta.(34) El efecto de la ingesta de cafeína sobre la calidad del sueño se evaluó mediante el uso de un modelo de exposición-efecto ajustado para variables demográficas y factores de riesgo cardiovasculares. Dicho modelo considera el efecto confusor de algunas variables sobre la exposición y otras sobre el efecto, y se construyó utilizando ponderación de probabilidad inversa aumentada. Un consumo de cafeína de menos de 100 mg/día de se registró en el 45% de participantes, de 100-200 mg/día en el 42% y de más de 200 mg/día en el 13%. La principal fuente de ingesta de cafeína fue el café, que se consumía más a menudo por la mañana y por la tarde. En segundo lugar en importancia estuvieron las bebidas energéticas que contienen cafeína (consumido por el 67% de la población) y el chocolate. El consumo de té negro y la ingesta de píldoras con cafeína (utilizadas como calmantes del dolor) fueron reportado por menos del 5% de la población y resultaron irrelevante para la cantidad promedio de consumo de cafeína en estos individuos. El puntaje promedio en la escala de Pittsburgh fue de 4.5 ± 2.2 puntos, con 203 (28%) individuos clasificados como con sueño pobre. El modelo de exposición-efecto no mostró ningún efecto de la ingesta de cafeína en la calidad de sueño (exposición- efecto promedio: 0.027, 95% C.I.: -0.284 - 0.338, p=0.866). Por otra parte, un estudio de márgenes predictivos de calidad de sueño de acuerdo con los niveles de cafeína ingeridos, no mostró diferencias significativas en dicha relación (Figura 3).
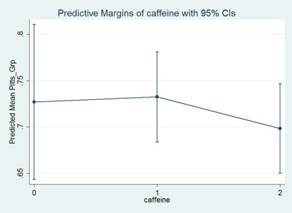
Figura 3 Gráfico que muestra la ausencia de diferencias significativas (sobreposición de intervalos de confidencia) en la relación entre los márgenes predictivos de calidad de sueño de acuerdo con los niveles de cafeína ingeridos (clasificados en 3 grupos).
La evaluación del efecto de la ingesta de cafeína sobre la calidad del sueño puede ser difícil ya que es posible que aquellos que piensan que son "sensibles al café" evitan esta sustancia por la noche. En el presente estudio, sin embargo, cuantificamos la cantidad total de la ingesta de cafeína de fuentes distintas del café. Una botella de 500 ml de Pepsi © o Coca-Cola © (los refrescos más comúnmente consumidos en el pueblo) contienen más de 40 mg de cafeína, que si se consumen en la cena, serían suficiente para mantener las concentraciones plasmáticas de cafeína durante la noche. Muchos de los entrevistados no fueron conscientes que al consumir esos productos estaban ingiriendo cafeína. Una limitación del estudio fue la falta de análisis de variaciones genéticas en los receptores de adenosina A2a que pueden explicar la "resistencia" de la ingesta de cafeína.(32) (33)
Fragilidad y calidad de sueño
La fragilidad (Frailty en idioma Inglés) es un estado geriátrico de reducción en la reserva funcional y vulnerabilidad que puede asociarse con deterioro cognitivo no necesariamente relacionado con enfermedades neurodegenerativas.(35) (36) Actualmente se considera a esta condición como un problema importante de salud pública en adultos mayores, sobre todo por su asociación con enfermedades sistémicas, así como con un mayor riesgo de hospitalización, institucionalización y mortalidad.(37) (38) Recientemente se ha demostrado un vínculo entre fragilidad y trastornos del sueño, ya que ambas condiciones están asociadas con una mayor expresión de biomarcadores inflamatorios, y el sueño alterado podría acelerar la sarcopenia (y la fragilidad) a través de la disfunción del eje hipotálamo-hipófisis-adrenocortical.(39) (40) (41)
Debido a que la fragilidad y los trastornos del sueño son comunes entre los adultos mayores, es importante comprender la contribución de la edad en esta relación. Utilizando un estudio en adultos mayores enrolados en el Proyecto Atahualpa, intentamos evaluar la magnitud del efecto de la edad en la asociación entre la fragilidad y la calidad del sueño en 311 individuos ≥60 años.(42)
La fragilidad se evaluó mediante el uso de la Escala de Edmonton,(43) la cual consta de 10 dominios con 11 ítems, incluyendo cognición (prueba de dibujo del reloj, 2 puntos), estado general de salud (número de hospitalizaciones durante el último año , 2 puntos), independencia funcional (investigada en ocho actividades independientes de la vida diaria, 2 puntos), apoyo social (contar con alguien que esté dispuesto y que sea capaz de satisfacer las necesidades del sujeto cuando éste requiere ayuda , 2 puntos), uso de medicamentos (cinco o más medicamentos recetados, 1 punto, y olvido para tomar medicamentos, 1 punto), nutrición (pérdida de peso no deseada, 1 punto), estado de ánimo (depresión, 1 punto), incontinencia (1 punto) y relación entre equilibrio y motilidad (2 puntos).
En nuestro estudio, la puntuación media en la escala de Pittsburgh fue de 5 ± 2 puntos, con 34% de individuos clasificados como con mala calidad de sueño. La puntuación media en la escala de Edmonton fue de 5 ± 3 puntos, con 46% de individuos clasificados como robustos (≤4 puntos), 23% como pre-frágiles (5-6 puntos) y 31% como frágiles (≥7 puntos), de acuerdo con valores de cortes previamente establecidos.(44) (45) Utilizando datos crudos, la presencia de fragilidad, la mala calidad del sueño y el aumento de la edad se encontraron superpuestos (Figura 4). De los 168 participantes pre-frágiles o frágiles, 109 (65%) tenían ≥69 años de edad y 76 (45%) tenían mala calidad del sueño. De los 242 individuos que eran pre-frágiles o frágiles, tenían una mala calidad de sueño o eran ≥69 años de edad, 80 (33%) tenían al menos dos de estas características, y 56 (23%) tenían las tres. En un modelo lineal generalizado, las puntuaciones más altas en la escala de Pittsburgh se asociaron significativamente con puntuaciones más altas en la escala de Edmonton (β: 0,23; IC del 95%: 0,11-0,35; p <0,0001). Las personas ≥69 años tuvieron más probabilidades de tener puntuaciones más altas en las escalas de Edmonton y de Pittsburgh, lo cual confirma la importancia de la edad como efecto en la asociación entre fragilidad y pobre calidad de sueño.
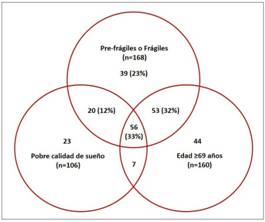
Figura 4 Diagrama de Venn, mostrando la sobre-posición entre fragilidad, mala calidad de sueño y edad avanzada. En total, el 33% de los individuos frágiles o pre-frágiles tenían pobre calidad de sueño y ≥69 años.
La relación entre calidad de sueño y fragilidad es probablemente bidireccional. De acuerdo con una secuencia propuesta de eventos, el sueño alterado reduce la hormona del crecimiento, el factor de crecimiento similar a la insulina-1 y la secreción de testosterona, que a su vez mejoran la proteólisis muscular, llevando a sarcopenia y fragilidad.(46) Por otro lado, las comorbilidades de la fragilidad, como la angustia psicológica, pueden tener un efecto negativo en los patrones de sueño normales al aumentar la inflamación y promover la exposición crónica a los corticoides debido a un desequilibrio en el eje somatotrófico.(47) (48)
Consumo de pescado y calidad de sueño
Las características del consumo de pescado oleoso en los residentes de Atahualpa han sido detalladas previamente en otro artículo de este número de la Revista Ecuatoriana de Neurología. A continuación describiremos los resultados de un estudio donde demostramos la relación entre la ingesta de pescado y la calidad de sueño en 677 individuos ≥40 años enrolados en el Proyecto Aahualpa.(49) En esta población, el consumo promedio de pescado graso fue de 9,1 ± 5,6 porciones por semana (rango 0 a 32). Una mala calidad del sueño se observó en 28% de los individuos. En general, la puntuación media en la escala de Pittsburgh fue 4,5 ± 2,2 puntos. Las raciones medias por semana de pescado graso fueron más altas en individuos con buena calidad de sueño que en aquellas con mala calidad de sueño (p=0.013). Por cada aumento de 10 porciones en la ingesta de pescado, la escala de Pittsburgh mejoró en 9,3%. Usando una regresión paramétrica, encontramos una asociación inversa entre el puntaje la escala de Pittsburgh y el número de porciones de pescado por semana (β = -0.040, 95% C.I..: -0.691 a -0.012, p = 0.007) (Figura 5). En un modelo lineal generalizado ajustado por factores demográficos y de riesgo cardiovascular, hubo una asociación significativa entre el puntaje del PSQI y el número de porciones de pescado graso por semana (β = -0.032, IC del 95%: -0.605 a -0.004, p = 0.025).
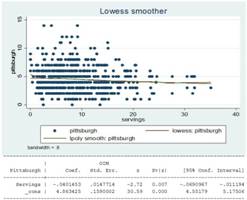
Figura 5 Gráfico LOWESS mostrando la relación entre el puntaje en la escala de Pittsburgh (eje vertical) y la cantidad de porciones de pescado oleoso consumidas por semana. Se observó una relación lineal inversa entre ambas variables. Por cada aumento de 10 porciones en la ingesta de pescado, la escala de Pittsburgh mejoró en 9,3%.
Incluso en las personas que consumían más de la cantidad recomendada de pescado graso por semana (una o dos porciones), este aumento se asoció con una mejora adicional en la calidad del sueño. Esto sugiere una relación lineal entre ambas variables, que no se limita a la cantidad actualmente recomendada. El problema en este caso podría ser el alto contenido de metilmercurio en algunos peces. Sin embargo, estos potenciales efectos deletéreos no se observaron en nuestro estudio, ya que la ingesta excesiva de pescado en la dieta (más de 20 porciones por semana) no se asoció con un decremento de la calidad del sueño.
Correlatos de neuroimagen de una pobre calidad de sueño
La relación entre la calidad de sueño y los marcadores de neuroimagen de enfermedad cerebral de pequeño vaso no había sido estudiada adecuadamente, con excepción de unos pocos estudios donde se había documentado asociación entre ciertos síntomas de sueño (no necesariamente la calidad de sueño valorada con la escala de Pittsburgh) y presencia de hiperintensidades de sustancia blanca de probable origen vascular o infartos lacunares.(50) (51) (52) (53) En un estudio de 237 personas ≥60 años libres de enfermedad cerebrovascular clínicamente evidente enroladas en el Proyecto Atahualpa, investigación la relación independiente entre la calidad de sueño y los tres principales marcadores de enfermedad de pequeño vaso, incluyendo hiperintensidades de sustancia blanca, infartos lacunares y micro-sangrados profundos.(54) En dicho estudio, el 33% de los participantes tuvieron mala calidad del sueño y la IRM reveló . La RM mostró hiperintensidades de sustancia blanca en 65% de personas, infartos lacunares silenciosos en 12% y micro-sangrados cerebrales profundos en el7%. La mala calidad del sueño se asoció con la presencia de hiperintensidades de sustancia blanca (OR: 2,44, IC del 95%: 1,26 - 4,71, p = 0,008) y su gravedad (coeficiente β: 0,77, SE: 0,37, p = 0,037), pero no con infartos lacunares silenciosos o micro-sangrados cerebrales profundos. Si bien el presente estudio fue de corte transversal y no se pudo evaluar causalidad, el hecho de que sólo las hiperintensidades de sustancia blanca asociaron con mala calidad del sueño podría sugerir que los síntomas del sueño son una consecuencia de un daño difuso subcortical y periventricular. Si la mala calidad del sueño hubiera sido la causa de la enfermedad de pequeño vaso, hubiéramos encontrado asociación con todos los marcadores silenciosos (infartos lacunares y micro-sangrados cerebrales profundos). Un estudio longitudinal proporciona apoyo adicional a esta hipótesis, ya que en pacientes hipertensos evaluados con IRM, la duración alterada del sueño se relacionó con eventos cerebrovasculares evidentes sólo en aquellas personas que ya tenían un evento cerebrovascular silente, pero no en aquellos que estaban libres de accidentes cerebrovasculares al inicio del seguimiento.(55) Esto sugiere que - en dicho estudio - los trastornos del sueño no se encontraron causalmente relacionados con la ocurrencia de eventos cerebrovasculares, pero que los pacientes que ya tenían este marcador silencioso fueron más propensos a desarrollar tanto eventos cerebrovasculares clínicamente evidentes como trastornos del sueño.
También realizamos, como parte del Proyecto Atahualpa, un estudio para investigar si la calidad de sueño se encuentra correlacionada con la severidad de atrofia cortical global en 290 personas ≥60 años. El 32% tuvieron mala calidad del sueño y el 49% tuvieron atrofia cortical global de acuerdo con la clasificación de Pasquier y colaboradores.(56) En un modelo de regresión logística (ajustado por variables demográficas, factores de riesgo cardiovascular, síntomas de depresión, puntuación en la escala cognitiva de Montreal (MoCA) y signos de neuroimagen del daño cerebrovascular), la mala calidad del sueño se asoció con la presencia de atrofia cortical global (OR: 0.09; 95% C.I.: 0.02 - 0.46; p=0.004). De igual manera, un modelo de probabilidad multivariado demostró que la atrofia cortical global de moderada a severa aumentó significativamente en individuos con mala calidad de sueño, siempre que éstos tengan ≥67 años. Este estudio proporciona evidencia de una asociación entre la mala calidad del sueño y la ACG en adultos mayores y la importante interacción de la edad en esta asociación.(57) La literatura revela pocos estudios que aborden la asociación entre la mala calidad del sueño y la atrofia cortical global. En uno de ellos, los autores encontraron una asociación directa, con la ventaja adicional de mostrar atrofia cortical progresiva en las personas con mala calidad de sueño en el seguimiento. Sin embargo, ese estudio puede que no haya representativo de la población en general.(58) Otros estudios han evaluado la relación de un síntoma único de sueño (por ejemplo, la cantidad de horas de sueño) con la presencia de atrofia cortical regional, proporcionando así información limitada sobre todo el espectro de síntomas relacionados con el sueño y daño cerebral estructural.(59) Ningún estudio poblacional había abordado el vínculo entre la mala calidad del sueño y la atrofia cortical global documentada por MRI y el efecto independiente de la edad en esta asociación.
ESTUDIOS DEL SÍNDROME DE PIERNAS INQUIETAS
El síndrome de piernas inquietas, también conocido como enfermedad de Willis-Ekbom, es un trastorno de etiología desconocida que se caracteriza por los cuatro criterios fundamentales descritos en la Tabla 5.(60) Este síndrome ha sido caracterizado como un trastorno del sueño y un trastorno del movimiento, y algunos incluso han propuesto que los síntomas pueden ser generados en el sistema nervioso periférico.(61) (62) (63) Tales controversias están parcialmente relacionadas con la falta de consenso sobre los mecanismos fisiopatológicos implicados en la génesis de la enfermedad de Willis-Ekbom. Las teorías que explican esta condición incluyen, entre otras, un desequilibrio entre las hormonas tiroideas y el sistema dopaminérgico,(64) aumento de la liberación talámica de glutamato,(65) alteración del control de la homeostasis del hierro(66) y mecanismos inmunológicos.(67) Independientemente de la diversidad de estas hipótesis, parece haber un papel central del sistema dopaminérgico en la patogénesis de la enfermedad de Willis-Ekbom que se confirma por la respuesta terapéutica a los agonistas de dopamina.(68) La prevalencia de esta condición puede estar relacionada con la latitud, un hecho que se ha corroborado en diversos estudios epidemiológicos que muestran que esta enfermedad es menos frecuente en regiones tropicales (Figura 6).(69) (70) (71) (72) (73) La raza o el grupo étnico al que pertenecen los participantes parecería ser un factor que influye en la prevalencia, aunque esto no ha sido investigado todavía en forma adecuada.
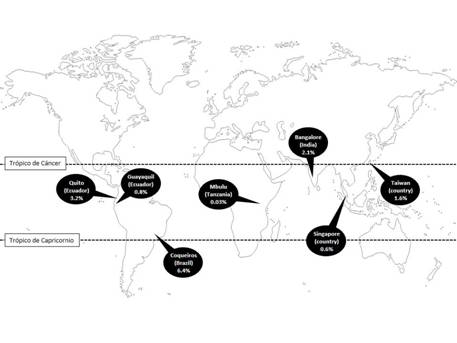
Figura 6 Mapa que muestra los estudios sobre prevalencia de enfermedad de Willis-Ekbom (síndrome de piernas inquietas) realizados en regiones tropicales. Destaca la baja prevalencia de esta entidad en dichas regiones.
En un estudio realizado en 665 residentes de Atahualpa ≥40 años, el cuestionario descrito en la Tabla 5 fue positivo en 94 personas (14%). El examen por neurólogos reveló solamente 40 de estas personas sospechosas tenían enfermedad de Willis-Ekbom. En dicho estudio, el examen neurológico de 188 personas no sospechosas no reveló otros casos de enfermedad de Willis-Ekbom. Estas cifras le dieron al cuestionario una sensibilidad del 100% (95% CI, 89% a 100%), una especificidad del 78% (95% CI, 72% al 83%), un valor predictivo positivo de 0,43 (95% CI, 0,33 a 0,53), y un valor predictivo negativo de 1 (95% CI, 0,98 a 1). La prevalencia de la enfermedad de Willis-Ekbom en habitantes de Atahualpa ≥40 años fue del 6%,(74) la cual fue muy similar a la encontrada en el estudio Brasileño (6.4%).(73) La mayoría de las personas afectadas en Atahualpa fueron mujeres y muchos tuvieron enfermedad leve a moderada según la escala de severidad del grupo internacional de estudio del síndrome de piernas inquietas.(75) El 20% de nuestros pacientes reportaron antecedentes familiares y el 20% de las mujeres describieron que su condición empeoraba durante los embarazos. Nuestro estudio confirma la escasa especificidad del instrumento de campo cuando se aplica a la población en general, y refuerza la necesidad de una segunda fase que debe incluir una entrevista de expertos y examen neurológico, con el fin de resolver la prevalencia real de WED en un pueblo dado.
En un estudio paralelo, realizado en la misma población, encontramos que los síntomas de angustia psicológica, incluyendo depresión, ansiedad y estrés, ocurren en alrededor de un tercio de los pacientes con enfermedad de Willis-Ekbom y son aproximadamente tres veces más prevalentes que en la población general.(76) A pesar de esto, la angustia psicológica no fue más común entre los pacientes con enfermedad de Willis-Ekbom severa que en aquellos con enfermedad leve a moderada. En este sentido, nuestros resultados son similares a los encontrados en un estudio realizado en la India, donde la depresión y la ansiedad eran comunes entre los pacientes con enfermedad de Willis-Ekbom, independientemente de su gravedad.(77) Por lo tanto, se puede sugerir que la depresión puede ser simplemente una comorbilidad de la enfermedad de Willis-Ekbom probablemente debido a los mecanismos patogénicos relacionados, es decir, la deficiencia dopaminérgica o alteraciones de la serotonina.(78) Sin embargo, en un estudio realizado en Turquía, los pacientes con enfermedad de Willis-Ekbom severa estuvieron más propensos a tener mayor ansiedad y depresión.(79) La relación entre la angustia psicológica y la enfermedad de Willis-Ekbom es probablemente bidireccional. Los antidepresivos pueden exacerbar los síntomas de la enfermedad de Willis-Ekbom, y los medicamentos usados para la enfermedad de Willis-Ekbom, es decir, fármacos dopaminérgicos, pueden tener un papel en el desarrollo de depresión y ansiedad. Nuestros pacientes no habían sido tratados con antidepresivos o fármacos dopaminérgicos, así que nuestros resultados no fueron influenciados por el uso de medicamentos. Se necesitan estudios longitudinales adicionales para determinar si la angustia psicológica precede a la enfermedad de Willis-Ekbom, si los síntomas de la enfermedad de Willis-Ekbom influyen en la aparición de depresión o ansiedad, o si ambas enfermedades comparten mecanismos patogenéticos
ESTUDIOS DE APNEA OBSTRUCTIVA DEL SUEÑO (OSA)
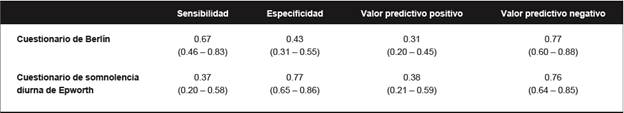
El aumento en la prevalencia de factores de riesgo cardiovasculares probablemente ha aumentado la prevalencia de OSA en zonas rurales de los países en desarrollo, pero su frecuencia real en dichas poblaciones es desconocida. El diagnóstico de OSA requiere la práctica de la polisomnografía, que no está disponible en estas regiones. Como parte del Proyecto Atahualpa, evaluamos la fiabilidad del cuestionario de Berlín y de la escala de somnolencia de Epworth para identificar candidatos para polisomnografía entre adultos mayores que viven en el pueblo.
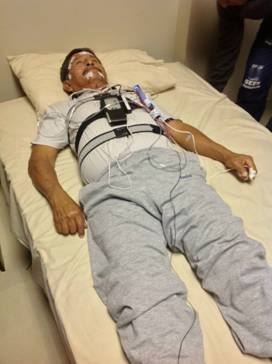
De un total de 104 individuos ≥60 años seleccionados aleatoriamente para la práctica de polisomnografía, 97 tuvieron registros adecuados (Figura 7) y fueron incluidos en el estudio.
Los participantes fueron entrevistados con el cuestionario de Berlín y el cuestionario de somnolencia diurna de Epworth (Tablas 2 y 3). Las polisomnografía se realizaron con un aparato portátil marca Embletta® X100™. El índice promedio de apnea/hipopnea fue de 13,8 ± 14,1 episodios por hora; 27 personas (28%) tenían >15 episodios por hora y se consideró que tenían OSA moderada a severa.(80) El cuestionario de Berlín fue positivo en el 60% de los participantes y el cuestionario de somnolencia diurna de Epworth en el 27%. Se evaluó la fiabilidad de estos instrumentos para reconocer los casos moderados a graves de OSA. Como se observa en la Tabla 6, la sensibilidad del cuestionario de Berlín fue mejor que la del cuestionario de somnolencia diurna de Epworth, pero su especificidad fue peor. Los valores predictivos negativos para ambos instrumentos fueron aceptables, pero los valores predictivos positivos fueron pobres. Nuestros resultados están en línea con los estudios realizados en otros grupos étnicos,(81) (82) y sugieren que los instrumentos de campo podrían no ser fiable para detectar candidatos a realizarse polisomnografía en esta población.
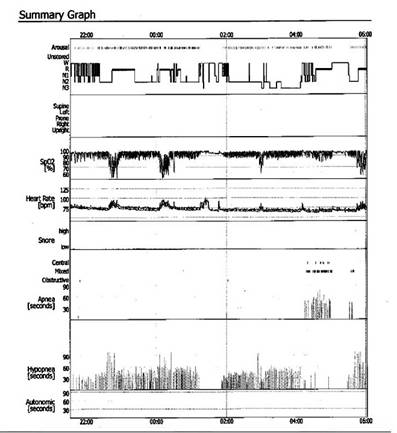
Figura 7 Reporte de polisomnografía de un residente de Atahualpa. En la parte inferior se observa la elevada prevalencia de episodios de apnea/hipopnea (56 x hora en este individuo en particular).
Tabla 6 Confiabilidad del cuestionario de Berlín y del cuestionario de somnolencia diurna de Epworth para detectar individuos con un índice de apnea/hipoxia >15 por hora en polisomnografía. Todos los valores incluyen intervalos de confianza del 95%
En el mismo grupo de 94 individuos, se investigó la relación entre la presencia de marcadores de neuroimagen de enfermedad de pequeños vasos cerebrales y OSA moderada a severa, en vista que la relevancia de la asociación entre OSA y dichos marcadores ha sido escasamente evaluada y los resultados han sido inconsistentes.(83) (84) (85) (86) (87) (88) (89) Como mencionamos previamente, en nuestro estudio el índice promedio de apnea/hipopnea fue de 13,8 ± 14,1 episodios por hora; 27 personas (28%) tenían >15 episodios por hora y se consideró que tenían OSA moderada a severa. Ninguno de estos individuos eran conscientes de su problema y ninguno había utilizado BiPAP u otros dispositivos para su condición. Las hiperintensidades de sustancia blanca moderadas a severas se observaron en el 25.8% de los casos, los infartos lacunares en el 22.7%, y los micro-sangrados profundos en el 12.4%. Los modelos de regresión logística demostraron que OSA moderada a severa se asoció independientemente con hiperintensidades de sustancia blanca moderadas a severas (OR: 3,94; 95% C.I.: 1,09 - 14,97; p=0,037), pero no con infartos lacunares silentes (OR: 2,07; 95% CI: 0,69 - 6,19, p=0,195) o micro-sangrados profundos (OR: 0,5; 95% C.I.: 0,09 - 2,55; p=0,405). Para confirmar aún más la asociación independiente entre OSA y hiperintensidades de sustancia blanca moderadas a severas, un modelo de regresión lineal se ajustó con el índice apnea/hipopnea como una variable continua. En este modelo, el índice apnea/hipopnea se asoció con la presencia de hiperintensidades de sustancia blanca moderadas a severas, independientemente de las variables demográficas y de los factores de riesgo cardiovasculares (β: -7,14; 95% C.I.: -13,6 a -0,69; p=0,031). Este estudio sugiere que OSA se asocia con daño difuso subcortical de origen vascular, pero no con lesiones focales.(90)
Como se mencionó previamente, la relevancia de la asociación entre OSA y dichos marcadores ha sido escasamente evaluada y los resultados han sido inconsistentes.
La relación entre OSA y enfermedad de pequeño vaso es compleja y probablemente bidireccional. Es posible que episodios recurrentes de hipoxia y alteración de la autorregulación cerebral sean los desencadenantes del daño subcortical difuso. Por otra parte, OSA puede aumentar algún factor de riesgo cardiovascular (hipertensión arterial), lo que puede favorecer el daño de pequeñas arterias intracraneales. Cabe también la posibilidad que OSA puede no ser la causa sino la consecuencia del daño subcortical difuso. En este sentido, la disrupción de las fibras periventriculares que forman parte de las vías de control de la respiración podrían ser los mediadores de los episodios apneicos.